Introducción
El diagnóstico diferencial de la EP incluye todas las entidades que pueden cursan con temblor o síndrome parkinsoniano, ya sea este un parkinsonismo secundario o un parkinsonismo asociado a otras enfermedades neurodegenerativas diferentes de la EP o a otras causas (Tabla I).

Como se ha comentado previamente, el diagnóstico de la EP es clínico, y es recomendable que el paciente sea remitido sin tratamiento antiparkinsoniano para su evaluación por parte de un especialista en trastornos del movimiento66 (NE-II).
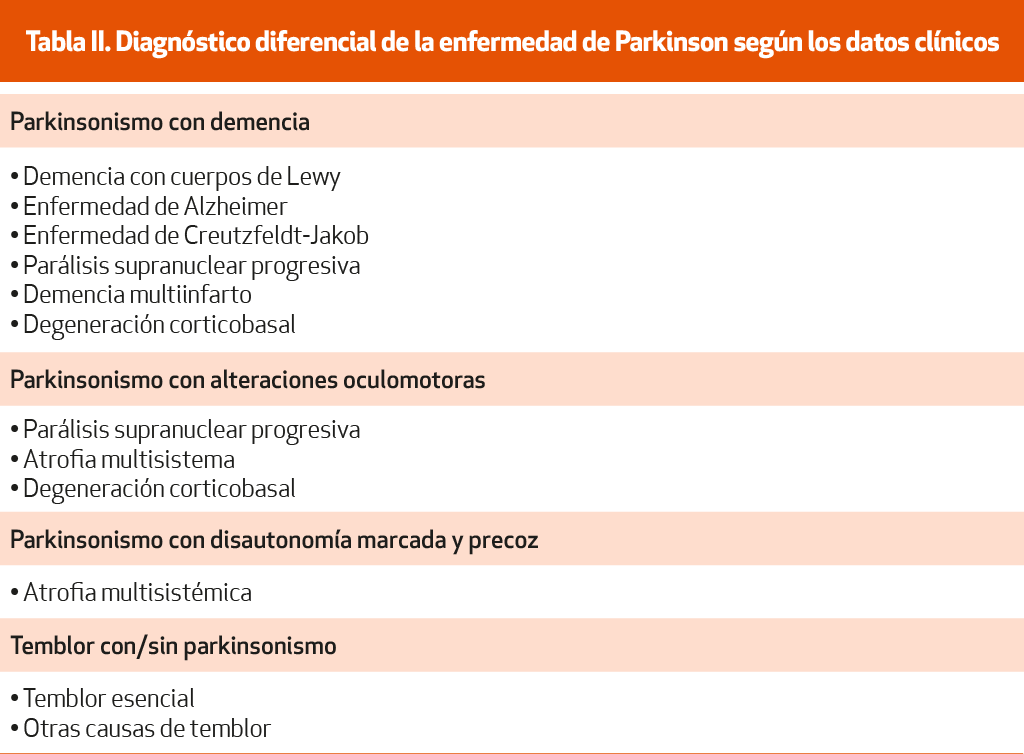
En el diagnóstico diferencial es fundamental comprobar que el paciente no presenta datos clínicos atípicos76 (NE-II), así como que existen datos de apoyo, como un curso progresivo, asimetría y respuesta a la terapia dopaminérgica (ver los criterios diagnósticos de la MDS). La presencia de caídas precoces, la falta de respuesta a la LD, la simetría de los síntomas al inicio, la rápida progresión llegando a un estadio III en la clasificación de Hoehn y Yahr en los 3 primeros años, la ausencia de temblor y la presencia de marcada disautonomía (urgencia o incontinencia urinaria o fecal, retención urinaria, disfunción eréctil o hipotensión ortostática sintomática) son datos clínicos sugestivos de otra causa de parkinsonismo diferente de la EP77 (NE-II). Dado que algunos datos atípicos no estarán presentes al inicio y pueden ir apareciendo a lo largo de la evolución, el diagnóstico debe ser revisado regularmente, reconsiderando siempre la posibilidad de un parkinsonismo atípico en aquellos pacientes que desarrollan signos de evolución atípica66 (NE-IV). La posibilidad de donación del cerebro por parte del paciente podría ser planteada por el clínico para poder hacer el diagnóstico definitivo post mortem66 (NE-IV). La Tabla II muestra diferentes entidades que se han de considerar en el diagnóstico diferencial de la EP teniendo en cuenta algunos aspectos clínicos.
No sería preciso realizar un estudio de neuroimagen estructural (tomografía computarizada [TC] o RM craneal) de forma rutinaria a todo paciente con sospecha de EP78 (NE-III). Sin embargo, sí sería recomendable realizar una TC craneal a todo paciente con sospecha de patología cerebral (tumor, hidrocefalia, etc.) que pueda estar causando o agravando el síndrome parkinsoniano68 (NE-IV), así como una RM craneal en caso de sospecha de enfermedad vascular cerebral subcortical causante de un parkinsonismo vascular o datos atípicos que sugieren un parkinsonismo atípico68 (NE-IV). Para revisar en profundidad la utilidad de las técnicas de imagen en el diagnóstico y diagnóstico diferencial de la EP, remitimos al lector al capítulo 2, donde se trata este tema de manera específica (pag. 57).
Además, en un paciente con sospecha de EP es recomendable una evaluación neuropsicológica que incluya una entrevista con el cuidador del paciente, evaluación de funciones cognitivas y cribado para trastorno de conducta del sueño REM, síntomas psicóticos y depresión67 (NE-I). No será necesario realizar estudios analíticos en el caso de una EP típica, pero serán útiles y necesarios determinados estudios (hormonas tiroideas, niveles séricos de ceruloplasmina, cobre en orina y suero, acantocitos en sangre periférica, creatina cinasa, estudio del hierro, estudios genéticos, etc.) en aquellos pacientes en los que los síntomas no estén tan claros y en los que se deban excluir otras entidades.

Parkinsonismos secundarios
Los parkinsonismos secundarios o sintomáticos son aquellos síndromes parkinsonianos producidos por una causa conocida y no por una enfermedad degenerativa. Representan entre el 25 y el 50% del total de los síndromes parkinsonianos.
Dentro de ellos, el parkinsonismo inducido por fármacos es el más frecuente. Los factores de riesgo para su desarrollo son la edad avanzada, el sexo femenino, una mayor potencia antidopaminérgica del fármaco, mayor dosis y tiempo de exposición y la presencia de un temblor de acción previo a la administración del fármaco. Será fundamental la prevención, evitando la administración de fármacos antidopaminérgicos, y en el caso de ser preciso su uso, intentar usar los que tienen un menor efecto parkinsonizante, administrarlos durante el menor tiempo y a la menor dosis posible. El parkinsonismo suele ser simétrico (aunque puede ser asimétrico) y asociar discinesias, que pueden desarrollarse tras 3 meses con el tratamiento responsable. En general, el parkinsonismo es reversible tras la supresión del fármaco causal y no se recomienda el uso de anticolinérgicos. En caso de no resolución después de 6 meses de haber retirado el fármaco, nos deberemos plantear si el paciente podría presentar una EP latente precipitada por el mismo, para lo que puede resultar útil realizar una prueba de neuroimagen funcional de la vía nigroestriada presináptica como una SPECT 3I-β-CIT (DaTSCAN®), que será normal en el caso de un parkinsonismo inducido por fármacos68,77 (NE-II).
En otras ocasiones, el parkinsonismo es ocasionado por tóxicos que dañan estructural y funcionalmente los ganglios basales, resultando muchas veces los síntomas irreversibles.
La Tabla III muestra los principales fármacos y tóxicos causantes de parkinsonismo.
Parkinsonismos heredodegenerativos
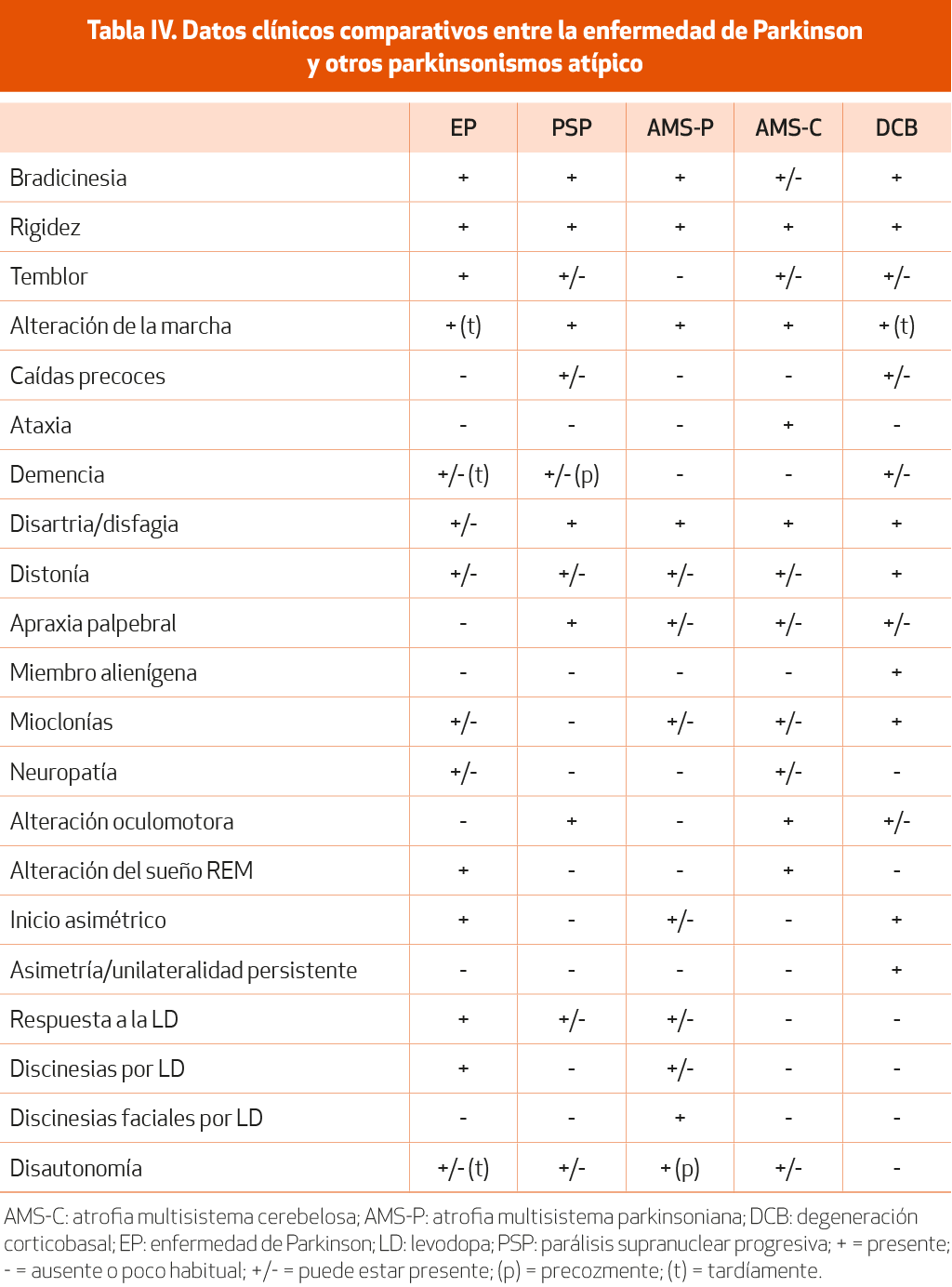
Los pacientes con parkinsonismos atípico (AMS, PSP y degeneración corticobasal [DCB]) plantean en ocasiones un reto diagnóstico, sobre todo en etapas tempranas de la enfermedad. Solo del 65 al 77% de los casos diagnosticados a finales de los años ochenta de EP idiopática cumplían criterios anatomopatológicos de EP1,3 (NE-II), el resto correspondían a otras enfermedades degenerativas que comprometían la vía nigroestriatal. Lo característico de los parkinsonismos atípicos es la nula o escasa y temporal respuesta a la LD y un peor pronóstico con una esperanza de vida reducida. En 2017 se publicaron los nuevos criterios de la PSP79 (NE-II) que, a diferencia de los previos, incluyen otras variantes además de la PSP richardsoniana. La variante PSP-parkinsonismo en concreto es la que más se asemeja a la EP, ya que los pacientes pueden presentar respuesta a la LD (habitualmente de forma temporal y baja-moderada) y un parkinsonismo simétrico o asimétrico que puede asociar temblor de reposo, que por tanto ha dejado de ser criterio de exclusión de PSP. La presencia de alteraciones oculomotoras en el plano vertical (enlentecimiento de los movimientos sacádicos o limitación de la infraversión de la mirada) sugieren el diagnóstico de PSP, pero pueden no estar presentes al inicio o incluso no estarlo en todo el transcurso de la enfermedad80 (NE-III). En cuanto a la AMS, los nuevos criterios se publicaron en 202281 (NE-II) e incluyen cuatro grados de certeza diagnóstica (definitiva, clínicamente definida, probable y posible prodrómica) y los dos fenotipos previamente conocidos (AMS-parkinsonismo y cerebelosa).
Los datos clínicos básicos comparativos vienen reflejados en la Tabla IV. Para cada uno de ellos existen criterios de certeza, y en todos los casos es necesaria la anatomía patológica para el diagnóstico definitivo.
En el capítulo 2 se revisa la utilidad de las pruebas de imagen en el diagnóstico de la EP y los parkinsonismos atípicos (pag. 57). Pruebas de olfacción como el Brief Smell Identification Test (BSIT), el University of Pennsylvania Smell Identification Test (UPSIT) o el San Diego Odor Identification Test (SDOIT) no se recomiendan en el diagnóstico diferencial de la EP con los otros parkinsonismos neurodegenerativos, porque no hay suficiente evidencia que lo apoye66 (NE-II). Los estudios de función autonómica (cardiovascular, urinaria, anorrectal y temperatura cutánea y sudoración) tampoco han demostrado ser beneficiosos67,77 (NE-IV).

Por último, el uso de SAA de α-sinucleína en LCR de forma aislada o en combinación con otros biomarcadores, como los niveles en LCR o en sangre de neurofilamentos o medidas de atrofia de mesencéfalo y protuberancia, se está mostrando de forma creciente en publicaciones como sensible y específico para diferenciar los parkinsonismos atípicos de la EP, si bien aún no están disponibles de forma ubicua para poder emplearse en la rutina clínica31,41,43,51 (NE-III). Un ejemplo de situación donde el SAA de α-sinucleína podría ser útil sería la diferenciación entre EP y PSP-P, aunque aún se dispone de evidencia limitada y la presencia de copatología podría en algunos casos justificar un SAA+, aun tratándose de una PSP; en este contexto, todavía es necesaria una metodología perfeccionada de SAA para proteína 4R-τ82 (NE-III).
Otras enfermedades neurodegenerativas que pueden cursar con parkinsonismo y que hay que tener en cuenta en el diagnóstico diferencial se reflejan en la Tabla II.
Temblor esencial y otras patologías a considerar en el diagnóstico diferencial
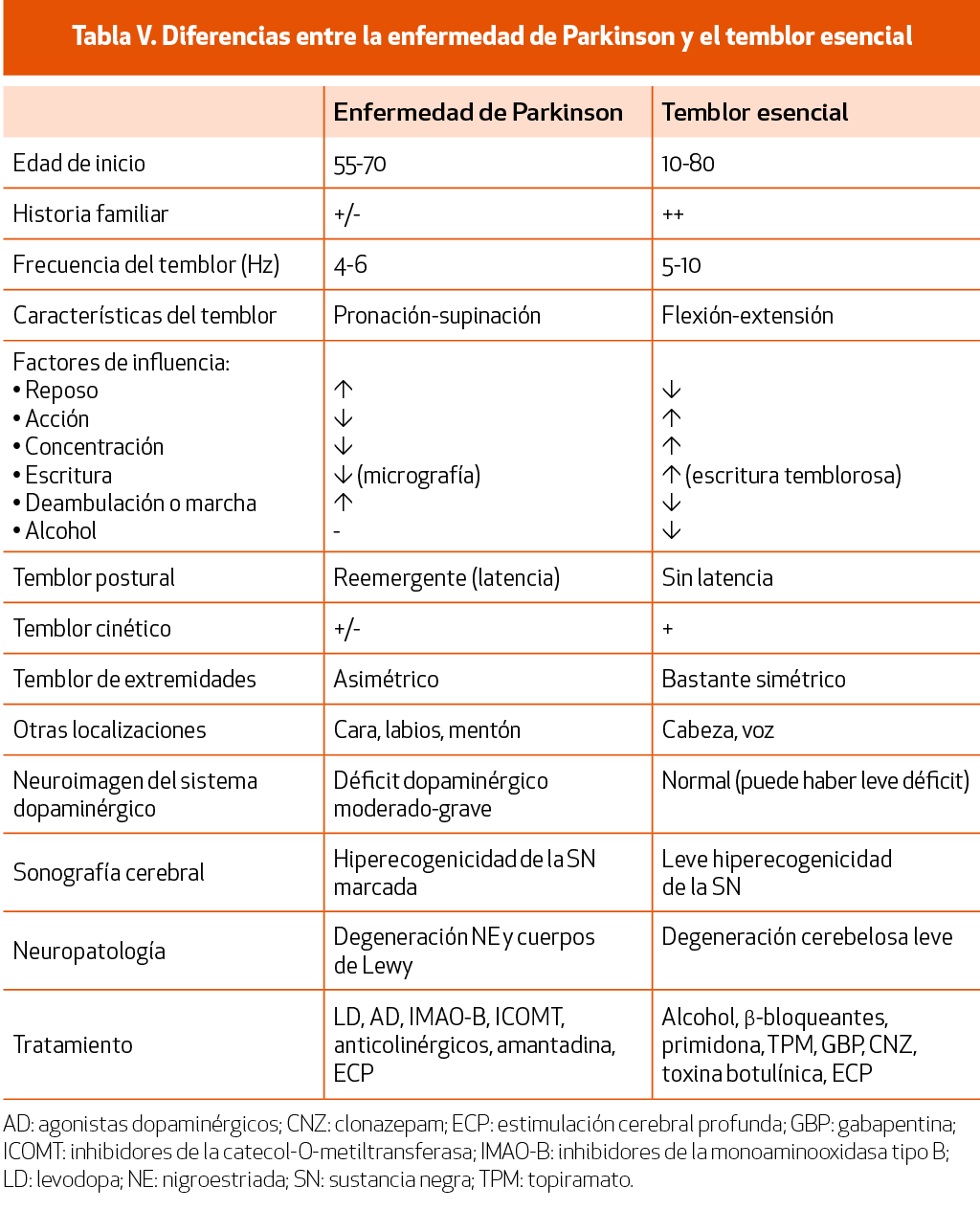
El temblor esencial (TE) es, posiblemente, la entidad con la que más frecuentemente se plantea el diagnóstico diferencial de la EP. Lo característico del TE (Tabla V) será la presencia de antecedentes familiares positivos de temblor, fundamentalmente postural de manos bilateral y relativamente simétrico, de cabeza y voz, y mejoría del temblor con el consumo de alcohol; no esperaríamos encontrar otros datos de parkinsonismo, aunque en ocasiones puede asociar temblor de reposo. En casos de duda, un DaTSCAN® podría ser de ayuda en el diagnóstico diferencial con la EP, que será normal en caso de TE67 (NICE 2006) (NE-III). Algunos estudios han observado que los pacientes con TE tienen más probabilidad de desarrollar EP83, por lo que se deberá tener en cuenta en su seguimiento evolutivo. El SAA de α-sinucleína negativo también puede añadirse al arsenal diagnóstico diferencial43 (NE-IV).
El parkinsonismo funcional es una causa poco frecuente. En ocasiones puede coexistir un parkinsonismo o EP con componente funcional asociado. La utilización combinada de la clínica, electrofisiología y neuroimagen funcional68,77,84 (NE-II) mejora la fiabilidad diagnóstica para distinguir entre formas de parkinsonismo funcional puras y combinadas. El parkinsonismo vascular típicamente es de predominio en extremidades inferiores, hay poca respuesta a la LD y daño vascular subcortical en los estudios de imagen craneal. Otras patologías que pueden simular un síndrome parkinsoniano y deben ser consideradas en el diagnóstico diferencial de la EP son por ejemplo un hipotiroidismo, la depresión o la patología osteoarticular.

Bibliografía
1. Rajput AH, Rozdilsky B, Rajput A. Accuracy of clinical diagnosis in parkinsonism: a prospective study. Can J Neurol Sci. 1991;18:275-8.
3. Hughes AJ, Daniel SE, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry. 1992;55:181-4. d
31. Fairfoul G, McGuire LI, Pal S, et al. Alpha-synuclein RT-QuIC in the CSF of patients with alpha-synucleinopathies. Ann Clin Transl Neurol. 2016;3(10):812-818.
41. Iranzo A, Fairfoul G, Ayudhaya ACN, et al. Detection of α-synuclein in CSF by RT-QuIC in patients with isolated rapid-eye-movement sleep behaviour disorder: a longitudinal observational study. Lancet Neurol. 2021 Mar;20(3):203-212.
43. Compta Y, Painous C, Soto M, et al. Combined CSF α-SYN RT-QuIC, CSF NFL and midbrain-pons planimetry in degenerative parkinsonisms: From bedside to bench, and back again. Parkinsonism Relat Disord. 2022 Jun;99:33-41.
51. Quadalti C, Calandra-Buonaura G, Baiardi S, et al. Neurofilament light chain and α-synuclein RT-QuIC as differential diagnostic biomarkers in parkinsonisms and related syndromes. NPJ Parkinsons Dis. 2021 Oct 11;7(1):93.
66. Parkinson’s disease in adults: diagnosis and management. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/ guidance/ng71/chapter/Update-information
67. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS [corrected] recommendations for the diagnosis of Parkinson›s disease. Eur J Neurol. 2013 Jan;20(1):16-34.
68. Scottish Intercollegiate Guidelines Network (SIGN). Diagnosis and pharmacological management of Parkinson’s disease. A national clinical guideline. En: Parkinson’s UK [Internet]. Disponible en: https://t.ly/UzriI
76. Gibb WR, Lees AJ. The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson’s disease. J Neurol Neurosurg Psychiatry. 1988;51:745-52.
77. Suchowersky O, Reich S, Perlmutter J, et al.; Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: diagnosis and prognosis of new onset Parkinson disease (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006;66(7):968-75.
78. NHS Quality Improvement Scotland. Diagnosis and pharmacological management of Parkinson’s disease. A national clinical guideline. Edimburgo: Scottish Intercollegiate Guidelines Network, EH7 5EA; 2010.
79. Höglinger GU, Respondek G, Stamelou M, et al.; Movement Disorder Society-endorsed PSP Study Group. Clinical diagnosis of progressive supranuclear palsy: The movement disorder society criteria. Mov Disord. 2017 Jun;32(6):853-864.
80. Williams DR, de Silva R, Paviour DC, et al. Characteristics of two distinct clinical phenotypes in pathologically proven progressive supranuclear palsy: Richardson›s syndrome and PSP-parkinsonism. Brain. 2005 Jun;128(Pt 6):124.
81. Wenning GK, Stankovic I, Vignatelli L, et al. The Movement Disorder Society Criteria for the Diagnosis of Multiple System Atrophy. Mov Disord. 2022 Jun;37(6):1131-1148. doi: 10.1002/mds.29005.
82. Saijo E, Metrick MA 2nd, Koga S, et al. 4-Repeat tau seeds and templating subtypes as brain and CSF biomarkers of frontotemporal lobar degeneration. Acta Neuropathol. 2020 Jan;139(1):63-77.
83. Benito-León J, Louis ED, Bermejo-Pareja F; Neurological Disorders in Central Spain Study Group. Risk of incident Parkinson’s disease and parkinsonism in essential tremor: a population based study. J Neurol Neurosurg Psychiatry. 2009;80(4):423-5.
84. Grimes D, Gordon J, Snelgrove B, et al. Canadian Guidelines on Parkinson’s disease. Can J Neurol Sci. 2012 Jul;39(4 Suppl 4):S1-30.



