


Con la progresión de la EP, los pacientes experimentan una pérdida progresiva de la eficacia sintomática del tratamiento dopaminérgico y la aparición de las complicaciones motoras, generalmente relacionadas con la LD: fluctuaciones y discinesias. Son las complicaciones más frecuentes del tratamiento con fármacos dopaminérgicos y siguen siendo el reto terapéutico más complejo. La probabilidad de sufrir dichas complicaciones es del 40% tras 4-6 años de tratamiento con LD1.
Los factores de riesgo para el desarrollo de complicaciones incluyen:
Gravedad de la enfermedad y tiempo de evolución.
Tratamiento crónico con LD: después de iniciar el tratamiento con LD desarrollan complicaciones motoras un 10% de pacientes por año. Influyen negativamente diferentes factores:
Dosis elevadas ( > 600 mg/día) de LD en etapas iniciales.
Forma de administración del fármaco: estimulación crónica pulsátil de los receptores dopaminérgicos postsinápticos frente a estimulación continua.
Edad de inicio de la EP (inicio joven).
Fenotipo clínico rígido-acinético y presencia de algunos síntomas no motores (depresión y ansiedad al inicio de la EP).
Factores farmacogenéticos: existen polimorfismos genéticos de los receptores dopaminérgicos que favorecen el desarrollo de complicaciones.
Mujeres y pacientes con bajo peso se han relacionado con mayor incidencia de discinesias.
En este capítulo abordaremos el tratamiento de las fluctuaciones motoras iniciales que ocurren tras esos primeros años de enfermedad con buena respuesta a fármacos o ya en fases no iniciales, pero con una intensidad leve-moderada, que se puede concretar en tiempos off < 2 horas o < 1 hora de discinesias incapacitantes si nos atenemos a los criterios 5-2-12 para identificar la EP ya más avanzada y que requería valorar la indicación de las terapias de segunda línea que se revisan en el capítulo 8 de este manual (pag. 179).
1. Ahlskog JE, Muenter MD. Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature. Mov Disord. 2001;16:448-58.
2. Malaty IA, Martínez-Martín P, Chaudhuri KR, et al. Does the 5–2-1 criteria identify patients with advanced Parkinson’s disease? Real-world screening accuracy and burden of 5–2-1-positive patients in 7 countries. BMC Neurol. 2022 Jan 24;22(1):35.
En la génesis de las complicaciones motoras participan numerosos factores:
Pérdida de neuronas dopaminérgicas de la SN compacta con la consiguiente denervación dopaminérgica y reducción de dopamina estriatal.
Factores farmacocinéticos centrales como:
Reducción de la síntesis de dopamina a partir de LD.
Conservación del metabolismo de dopamina por las enzimas MAO y COMT.
Disminución de la capacidad para almacenar dopamina presináptica.
Dependencia directa del aporte externo de LD.
Factores farmacodinámicos de la LD que provocan una estimulación anormal pulsátil de los receptores y cambios possinápticos. La vida media de los fármacos influye en la forma de estimulación de los receptores y se considera importante un mecanismo de estimulación dopaminérgica continuada.
Factores farmacocinéticos de la LD periféricos que modifican los niveles plasmáticos y su disponibilidad cerebral (absorción gastrointestinal).
En las discinesias, además de los mecanismos ya referidos, se debe considerar:
Hipersensibilidad de los receptores D1 por estimulación pulsátil postsináptica.
Mecanismos no dopaminérgicos serotoninérgicos que transforman la LD exógena a dopamina, pero sin mecanismos de control.
Respuesta anormal estriatal de las neuronas medianas espinosas gabaérgicas, con estimulación de la vía directa con hipoactividad del pálido interno y núcleo subtalámico y activación talamocortical.
Aumento de la actividad glutamatérgica al estriado desde el córtex cerebral.
Las fluctuaciones motoras se definen como la presencia de variaciones, falta de respuesta adecuada, poca duración del beneficio y en ocasiones respuesta clínica impredecible a una dosis de LD. El paciente presenta periodos con menor beneficio farmacológico a la LD y reaparición de los síntomas parkinsonianos, que son los denominados periodos off. Estos se suelen alternar con fases de mejoría de los síntomas después de la administración de una dosis de LD, descritos como estado on, y en los que se pueden presentar movimientos involuntarios denominados discinesias. Pueden asociarse a síntomas no motores (fluctuaciones no motoras)3.
La respuesta a la LD se suele dividir en tres franjas de tiempo: 1) inicio de beneficio de dosis (beginning of dose), que es cuando el paciente nota el primer beneficio y el paso a estado on; 2) pico de dosis (peak dose) o máximo beneficio de los síntomas, y 3) fin de dosis (end of dose), cuando reaparecen los síntomas parkinsonianos.
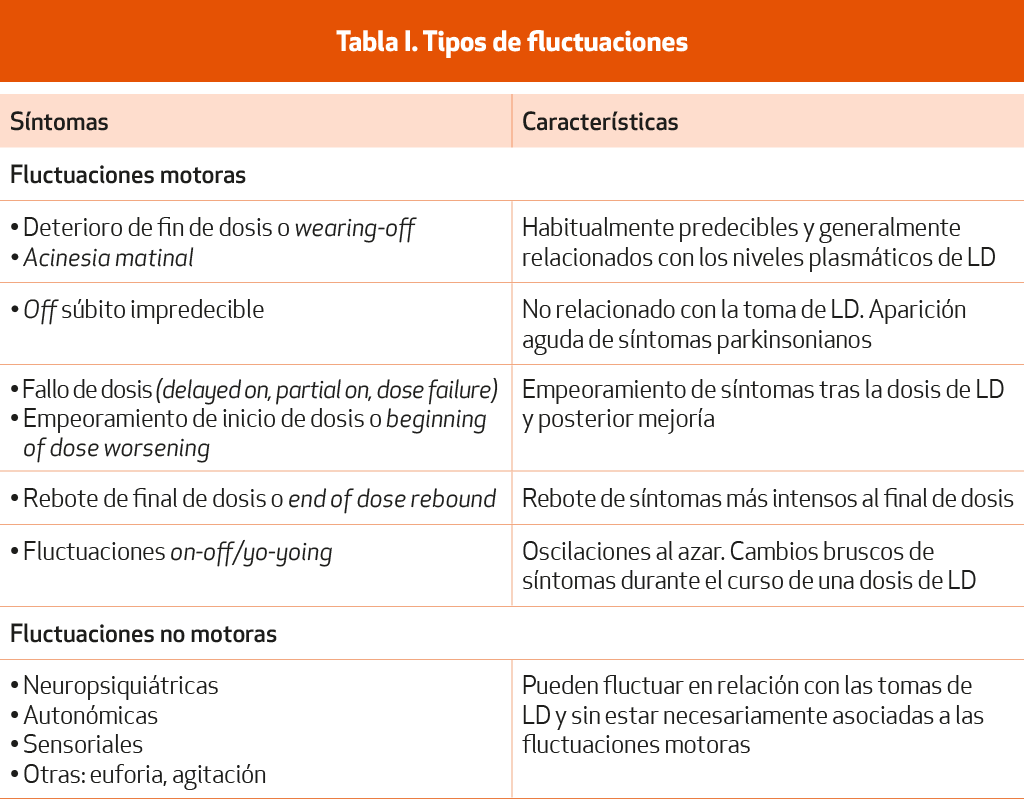
Los diferentes tipos de fluctuaciones motoras (Tabla I) son:
Deterioro de fin de dosis predecible (wearing-off): es la reaparición gradual de los síntomas parkinsonianos al final de cada dosis de LD. La duración del beneficio de la LD es igual o inferior a 4 horas y se produce un declive regular y previsible de su Cuanto más corto es el periodo de beneficio, más grave es el fenómeno de wearing-off. Se relaciona con los niveles plasmáticos de LD.
Acinesia matutina: presencia de los síntomas parkinsonianos, efecto de la última dosis del día anterior; suele ser la primera manifestación de fluctuación motora.
Off súbito impredecible: aparición aguda de los síntomas parkinsonianos, no relacionado con la toma de LD. Los síntomas suelen aparecer en pocos segundos (sudden off), son muy intensos y en forma de acinesia muy Se presenta en una fase más avanzada de la enfermedad.
Fallo de dosis, respuesta parcial o retrasada: una dosis de LD no consigue el beneficio esperado en un paciente que responde a la LD. El beneficio puede retrasarse minutos u horas (delayed on), no ser óptimo (partial on) o estar ausente (doce failure o no on). Esta falta de eficacia suele producirse por la tarde-noche y en pacientes con fluctuaciones graves que requieren gran número de tomas al día.
Empeoramiento de inicio de dosis (beginning of dose worsening): empeoramiento transitorio de los síntomas, principalmente del temblor, en los primeros minutos después de la dosis de LD, antes del inicio del beneficio.
Rebote de final de dosis (end of dose rebound): exacerbación o rebote de los síntomas parkinsonianos, que son más intensos que los del estado basal sin tratamiento y aparecen al final de la dosis. Es muy infrecuente.
Fluctuaciones on-off/yo-yoing: también denominadas oscilaciones al azar u on-off El término se utiliza para describir cambios rápidos u oscilaciones predecibles o impredecibles entre el estado on y el estado off durante el curso de una dosis de LD o a lo largo del día.
Son movimientos involuntarios debido al tratamiento crónico con agentes dopaminérgicos. Su expresión clínica más frecuente es la corea y la distonía y, más raros, el balismo y el mioclono.
Se deben considerar tres aspectos en el manejo de las discinesias:
Fenomenología del movimiento: tipo (corea, distonía o balismo) y distribución (piernas o parte superior del cuerpo).
Momento de aparición en relación con la dosis de LD (discinesias de dosis alta y discinesias de dosis baja).
Percepción de la discinesia por el paciente.
Los diferentes tipos se pueden clasificar en discinesias de dosis alta y discinesias de dosis baja (Tabla II):
Discinesias de pico de dosis y, con menor frecuencia, las discinesias en meseta a lo largo de todo el periodo on: se producen en el estado on, 1-2 horas después de la dosis de LD. Se manifiestan con movimientos coreicos, inicialmente en el cuello y la cara, que en fases posteriores se extienden al tronco y extremidades, junto con posturas distónicas de extremidades y cuello (distonía on). En casos más graves se pueden producir movimientos balísticos. Muchos pacientes solo las presentan en las tomas de la tarde o la noche, lo que se debe a la dosis de LD acumulada durante el día. Pueden mejorar reduciendo la dosis de los fármacos, aunque a veces a costa de disminuir su eficacia antiparkinsoniana. Muchos pacientes no las reconocen o no les molestan y, por tanto, no se recomienda reducir la medicación excepto cuando son molestas o se quiere evitar el empeoramiento.
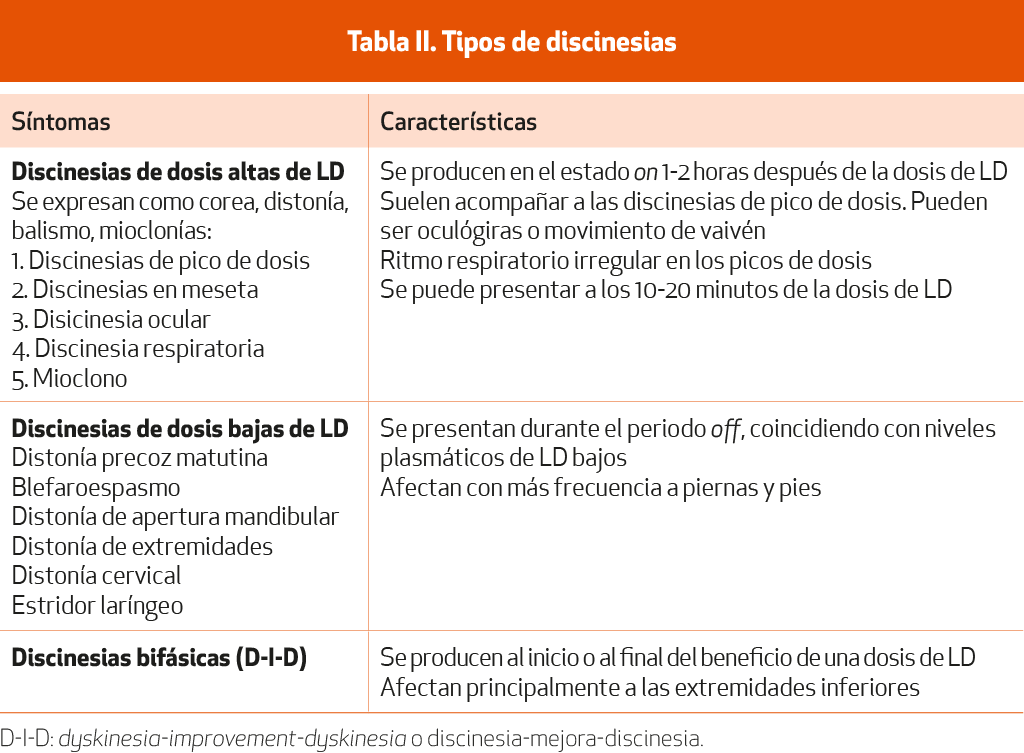
Discinesia ocular: suele acompañar a las discinesias de pico de Existen dos patrones: desviación de la mirada hacia arriba (crisis oculógiras) y movimientos lentos en vaivén.
Discinesia respiratoria: ritmo respiratorio irregular y profundo por afectación de la musculatura respiratoria en la discinesia de pico de
Mioclono: es poco frecuente, se suele producir en los primeros 10-20 minutos de la dosis de LD y desaparecer en el estado on Suele aparecer en pacientes con demencia.
Discinesias de dosis baja: son distonías off; la discinesia se produce durante el periodo off y wearing-off, es predominantemente distónica y tiende a afectar piernas y pies (inversión del tobillo y extensión o flexión del dedo gordo del pie). Puede ser dolorosa, provocar deformidad, dificulta la marcha y es molesta para el La forma más frecuente es la que se presenta por la mañana antes de la primera dosis de LD (distonía precoz matutina o early morning dystonia). Otras formas más raras de distonía off son: blefarospasmo, distonía de apertura mandibular, de la mano o pierna, cervical o estridor laríngeo. La distonía off se correlaciona con niveles plasmáticos bajos de LD.
Discinesia bifásica: también denominada fenómeno D-I-D o dyskinesia-improvement-dyskinesia. Se produce al inicio o al final del beneficio de una dosis, que corresponde respectivamente cuando los niveles plasmáticos de LD están aumentando o disminuyendo. Dura varios minutos y crea importante discapacidad al Tiende a afectar principalmente las piernas, se combinan movimientos distónicos y coreicos, manifestándose con movimientos lentos estereotipados, rápidos y alternando las piernas, y en ocasiones patadas balísticas.
Son fluctuaciones de síntomas no motores que pueden coincidir en ambos periodos on y off. Los síntomas pueden fluctuar en respuesta a la LD y, aunque son más frecuentes en off, pueden presentarse también en on, mejorando con un buen estado dopaminérgico. Pueden ser: neuropsiquiátricos (ansiedad, depresión, apatía, fatiga); autonómicos (disfagia, molestias abdominales) y sensoriales (dolor, parestesias, acatisia). En otros casos se presentan en la fase on como euforia, agitación o psicosis.
3. Aquino CC, Fox SH. Clinical spectrum of levodopa-induced complications. Mov Disorders. 2015;30:80-9.
Metodología: revisión de ensayos clínicos, preferentemente publicados en los últimos 5 años, pero también previos si el trabajo es de interés (Medline, Cochrane) así como guías terapéuticas, tanto de la American Academy of Neurology (AAN) como de la European Federation of Neurological Societies (EFNS).
Es el fármaco más importante en la EP avanzada. Es práctica común modificar la frecuencia y la dosis de LD para mejorar las fluctuaciones o discinesias. Sin embargo, no existen estudios de nivel I que evalúen estas estrategias.
En los periodos de fin de dosis es útil acortar el intervalo entre dosis de LD. En ocasiones es preciso también disminuir la cantidad de LD en cada toma, estrategia que también mejora las discinesias (NE-II). Al realizar estos ajustes hay que tener en cuenta que: 1) dosis frecuentes pueden empeorar las discinesias vespertinas, debido a los niveles mantenidos de LD, y 2) dosis bajas pueden inducir discinesias bifásicas.
Numerosos estudios han comparado la LD de liberación prolongada con la LD estándar. La reducción del off fue variable (20-70%) y se precisó un aumento de la dosis de LD (20%) con reducción del número de tomas de solo el 30%4 (NE-III).
Aunque los resultados de los ensayos clínicos no sean concluyentes parece que: 1) la LD de liberación prolongada permite un pequeño aumento del tiempo on (menos de 1 hora al día). 2) Puede ser útil cuando se utiliza en combinación con la LD estándar para el tratamiento de los episodios de fin de dosis. Esta combinación es especialmente útil con la primera dosis de la mañana si existe retraso en el on. 3) Una dosis nocturna de LD de liberación prolongada es útil para mejorar la acinesia nocturna y matutina (aunque hay dudas de que sea más eficaz que la LD estándar5 [NE-IV]).
Dado que la farmacocinética es poco predecible, existe riesgo de empeoramiento de las discinesias (especialmente vespertinas y bifásicas) (NE-II).
Se trata de una nueva formulación de LD oral, aun no disponible en nuestro medio, con una liberación dual inmediata y prolongada. No retrasa el inicio del efecto del fármaco y permite una mayor estabilidad en la concentración plasmática en sangre (NE-I). El tiempo off con IPX203 fue del 19,3% del día frente al 33,5% con LD de liberación inmediata, es decir hasta 2,3 horas menos de tiempo off con IPX203 que con LD convencional. Mientras que las concentraciones de LD de liberación inmediata se mantienen solo 1,5 horas por encima del 50% de la concentración máxima, en el caso de la nueva formulación se mantiene durante 4,6 horas6 (NE-I). Este perfil farmacocinético sugiere que la dosificación de tres veces al día es factible y puede conducir a una menor variabilidad en la clínica y mayor beneficio para el paciente, frente a tomas cada dos o tres horas de LD de liberación inmediata. Esto no conlleva un aumento de las discinesias de pico de dosis incapacitantes7 (NE-II). No presenta más efectos secundarios que la LD convencional (NE-II).
Estos preparados permiten una absorción más rápida de la LD y, por tanto, de su inicio de acción. En un estudio piloto con cuatro pacientes, la LD líquida demostró aumentar la duración del on sin aumentar las discinesias, permitiendo una respuesta más rápida a los periodos off8 (NE-III).
La melevodopa es una formulación líquida de LD. Un estudio evaluó su eficacia en acortar el inicio del on en la primera dosis de LD de la tarde. La melevodopa fue superior a la LD estándar, sin aumentar la duración del tiempo en on ni las discinesias. Otro estudio evaluó la eficacia de melevodopa frente a LD estándar en pacientes con fluctuaciones motoras y al menos 2 horas de off al día. No se encontraron diferencias en la reducción del tiempo en off (objetivo primario) ni en otras variables secundarias (NE-I).
Las soluciones de LD pueden ser de utilidad en pacientes con un retraso importante del on (vaciamiento gástrico enlentecido), ya que la LD líquida pasa más fácilmente el píloro y por tanto se facilita su absorción. Para ello basta con disolver la dosis de LD en agua y vitamina C. También puede utilizarse como dosis única para retrasos en el on puntuales (matutina, después de comer)9.
Los comprimidos solubles de LD consisten en un dispositivo dosificador de microtabletas de LD/carbidopa (5/1,25 mg) fácilmente dispersables en agua, para la individualización de tratamiento. La bioequivalencia de las microtabletas de LD/carbidopa es similar a las formulaciones convencionales. La ventaja de los comprimidos solubles de LD radica en que permiten un ajuste fino de dosis y por tanto una dosificación frecuente, obteniéndose unas concentraciones plasmáticas de LD más estables10 (NE-II). Están comercializados en los países escandinavos bajo la indicación de EP avanzada, en aquellos pacientes que desean posponer el inicio de tratamientos más invasivos, como perfusiones subcutáneas o gel intestinal. Permiten una administración sencilla y no invasiva, con dosis más individualizadas, ya que permiten incrementos de LD de 5 mg11,12 (NE-II).
Está indicada para el tratamiento intermitente de fluctuaciones motoras episódicas (episodios off) en pacientes con EP tratados con LD y un inhibidor de dopa-descarboxilasa13 (NE-I). Es eficaz en fenómenos off fin de dosis14-16 (NE-I), incluida la acinesia matutina17 (NE-II) y otras fluctuaciones más complejas o impredecibles18 (NE-IV). También permite mejorar la respuesta al tratamiento en pacientes con retraso del efecto de alguna toma o delayed on. Mejora tanto los síntomas motores como no motores asociados a los periodos off. La dosis indicada de LD inhalada es de dos cápsulas, en dos inhalaciones seguidas, no separadas más de 10 minutos (33 mg polvo para inhalación por cápsulas, 66 mg de LD por dosis, equivalente a 50 mg de LD que se absorbe por esta vía)19. Es segura y bien tolerada, siendo la tos el efecto adverso más frecuente, aunque no suele ser causa de abandono del tratamiento. El entrenamiento al paciente es un factor clave para la buena tolerancia y cumplimiento (NE-IV).
Los tratamientos con foslevodopa/foscarbidopa en perfusión subcutánea, levodopa/carbidopa y levodopa/carbidopa/entacapona en infusión intestinal están indicados una vez el paciente presenta complicaciones motoras moderadas. Estos tratamientos se tratan en el capítulo 8 de este manual (pag. 179), dedicado a terapias de segunda línea. Estas terapias están indicadas cuando otras opciones terapéuticas como las revisadas en este capítulo no han conseguido corregir los síntomas y las fluctuaciones de manera satisfactoria.
Los inhibidores de la ICOMT actualmente disponibles son la tolcapona, la entacapona y la opicapona. Estos inhibidores aumentan la biodisponibilidad de la LD un 40-80%, consiguiendo una reducción significativa del tiempo off frente a placebo (1,3-1,8 horas para entacapona, 2,3-3,2 horas para tolcapona y 1,2 a 2,0 horas para opicapona). La tolcapona presenta riesgo bajo de hepatotoxicidad fulminante, lo que restringe notablemente su uso.
Estudios con NE-I han demostrado que la tolcapona (frente a placebo) es eficaz reduciendo el tiempo off y es más potente que la entacapona20-22 (NE-I).
Antes del inicio del tratamiento con tolcapona se debe descartar que el paciente presente alguna hepatopatía. Generalmente es necesario reducir entre un 25-30% la dosis de LD para evitar discinesias. Es necesaria la monitorización de transaminasas (cada 2-4 semanas durante los primeros 6 meses y posteriormente según criterio médico).
Diversos estudios (NE-I) comparados con placebo han demostrado que la entacapona reduce el tiempo en off. La reducción del tiempo off es comparable a la obtenida con rasagilina. Esta mejoría se mantiene en el tiempo, tal y como demostró un metaanálisis de estudios con NE-I y sus extensiones abiertas. En cuanto a la dosis útil de entacapona un estudio no encontró diferencias entre 100 y 200 mg en cada toma20,23.
La entacapona, asociada a LD o en un mismo comprimido de LD-carbidopa-entacapona, es especialmente útil para el tratamiento del fenómeno de fin de dosis, sin necesidad de acortar el tiempo entre dosis24 (NE-IV). Un efecto adverso frecuente es el empeora- miento de las discinesias, que puede mejorar reduciendo la dosis de LD en cada toma.
La opicapona es el último inhibidor de la COMT aprobado por la Agencia Europea del Medicamento en junio del 2016. Se utiliza en el tratamiento de las fluctuaciones moto- ras en pacientes tratados con LD.
Estudios con NE-I han demostrado que la opicapona es eficaz en el control de las fluctuaciones motoras, produciendo una disminución del tiempo off y no inferioridad a entacapona.
El plan de desarrollo clínico de la opicapona se ha basado en diferentes estudios fase I, dos estudios de fase II con el objetivo de evaluar la farmacocinética y eficacia de diferentes dosis del fármaco25,26 (NE-II) y en dos estudios de fase III de eficacia y seguridad27,28 (NE-I). Estos ensayos han demostrado que opicapona es segura y bien tolerada a corto y largo plazo, incluso en pacientes mayores de 70 años29 (NE-II), y que reduce el tiempo off, incrementando el tiempo on sin discinesias molestas. La dosis de 50 mg una sola vez al día, produce prácticamente una hora de reducción del tiempo off respecto al placebo. La comparación con entacapona en el estudio BIPARK-I27 (NE-I) sugiere un efecto de mayor magnitud con el uso de la opicapona, pero estos resultados deberían ser replicados en un ensayo de comparación directa. La mejoría en la función motora también se observa en pacientes con LD y uso concomitante de agonistas dopaminérgicos o inhibidores de la MAO30 (NE-IV). En el caso de las fluctuaciones motoras tempranas, en el estudio ADOPTION se compara la adición de la opicapona con el aumento de 100 mg de LD a la dosis habitual en pacientes con fluctuaciones de menos de 2 años de inicio. La opicapona fue más eficaz que LD en reducir el tiempo off y tuvo un buen perfil de seguridad31,32 (NE-III). El efecto adverso más frecuente son discinesias, y no se ha observado asociación con disfunción hepática ni en el cambio de coloración de la orina.
Se recomienda tomar una cápsula de 50 mg día, una hora después de la última dosis del preparado de LD (LD/inhibidor de la dopa-descarboxilasa).
Actualmente existen tres IMAO-B comercializados en nuestro país, selegilina, rasagilina y safinamida. Con los IMAO se ha descrito el llamado efecto tiramina o efecto queso (IMAO-A y selegilina a dosis altas): hipertensión paroxística por ingesta de alimentos ricos en tiramina (queso, vino, cerveza). La asociación con inhibidores de la recaptación de serotonina (ISRS) puede producir un síndrome serotoninérgico.
Dos estudios con NE-I han demostrado que rasagilina es eficaz en disminuir el tiempo off en aproximadamente una hora. El estudio PRESTO comparó rasagilina (0,5 y 1 mg) con placebo33. Ambas dosis fueron superiores a placebo en la reducción del tiempo en off. La rasagilina 1 mg produjo discinesias molestas (no con 0,5 mg) y los efectos secundarios leves fueron más frecuentes. Sin embargo, no se encontraron diferencias en las tasas de abandono entre ambas dosis33,34. Otro estudio comparó la rasagilina (1 mg) con entacapona y placebo. Se encontró un aumento del tiempo on, sin aparición de discinesias molestas respecto a placebo34.
Es un fármaco de fácil administración y bien tolerado, exento del efecto tiramina. En algunos estudios se ha utilizado con antidepresivos ISRS sin que se haya descrito ningún efecto adverso. No obstante, en la ficha técnica se recomienda evitar el uso concomitante con fluoxetina o fluvoxamina y vigilancia con el resto de ISRS y otros antidepresivos. No se debe asociar a simpaticomiméticos (descongestionantes nasa- les). Más allá de su utilidad para las complicaciones motoras, la rasagilina también ha mostrado un efecto limitado en mejorar los episodios de congelación de la marcha.
Los estudios de corta duración (NE-I) no mostraron efecto consistente en la reducción del tiempo off. Una nueva formulación de selegilina bucodispersable ha mostrado resultados contradictorios en la reducción del tiempo en off20 (NE-IV).
La dosis recomendada de selegilina es 10 mg, en una o dos tomas. Con esta dosis no hay riesgo de efecto tiramina. No se recomienda su uso con antidepresivos ISRS, ISRS y noradrenalina, tricíclicos, otros IMAO (por ejemplo, el antibiótico linezolid), petidina ni simpaticomiméticos. Debido a sus metabolitos derivados (anfetamínicos) produce insomnio y no es recomendable adminístralo en dosis nocturna.
Presenta un mecanismo de acción dual: inhibidor reversible de la MAO-B y bloqueante de canales de sodio voltaje-sensitivos, actuando como modulador de la liberación excesiva de glutamato.
En un estudio de NE-I, la safinamida (50 y 100 mg) aumentó el tiempo on sin producir discinesias molestas (24 semanas de seguimiento). El aumento de tiempo en on con safinamida fue de 1,37 h, frente a 0,9 h en el grupo placebo. Del mismo modo, el tiempo en off se redujo aproximadamente una hora (1,42 h vs. 0,57 h, safinamida vs. placebo respectivamente)35. A largo plazo (24 meses), las discinesias no empeoraron y se observó una reducción de las discinesias moderadas-graves con 100 mg. La mejoría sobre la función motora, las actividades de la vida diaria, los síntomas depresivos, el estado clínico y la calidad de vida se mantuvieron a los 24 meses35 (NE-I).
Comparandado safinamida con rasagilina, se observa una mayor reducción del tiempo en off con safinamida (0,85 h vs. 0,27 h) y un aumento mayor del tiempo en on (0,4-0,6 h con safinamida vs. 0,39 h con rasagilina)33,35.
La safinamida fue bien tolerada y la frecuencia de efectos adversos fue similar a la del grupo placebo. Más recientemente, un estudio basado en población real que incluyó 1610 pacientes entre los que se incluyeron pacientes mayores de 75 años, con comorbilidades médicas y psiquiátricas previas, mostró un buen perfil de seguridad36. Un subanálisis de la población española de este estudio mostró resultados similares, siendo los efectos secundarios algo más frecuentes en pacientes con deterioro cognitivo37.
Con la safinamida no hay riesgo de efecto tiramina y su gran especificidad por la MAO-B hace posible que se pueda administrar junto con ISRS (fluoxetina y fluvoxatina a dosis bajas) sin riesgo de síndrome serotoninérgico.
Diversos estudios mostraron que el uso precoz de agonistas dopaminérgicos se asocia a una menor incidencia de complicaciones motoras en comparación con el inicio del tratamiento con LD38 (NE-I). Sin embargo, no estaba claro si el retraso en la aparición de complicaciones motoras se relacionaba con el inicio del tratamiento con un agonista dopaminérgico o, más bien, con la duración de la enfermedad y con dosis diarias más bajas de LD. Finalmente, Cilia et al.39 confirmaron que las complicaciones motoras están claramente condicionadas por la duración de la enfermedad y las dosis de LD. En este sentido, los agonistas dopaminérgicos juegan un papel como ahorradores de LD (NE-I).
Dados los efectos cardiopulmonares graves, como la fibrosis valvular, los agonistas dopaminérgicos ergóticos se usan solo en situaciones excepcionales.
Dentro de los agonistas dopaminérgicos no ergóticos orales, se manejan en nuestro medio el ropinirol y el pramipexol:
Ropinirol: en fases avanzadas de la enfermedad, asociado a tratamiento con LD, mejora las fluctuaciones motoras y permite reducir la dosis de LD40 (NE-II). Los estudios prospectivos, aleatorizados, doble ciego, apuntan al ropinirol como tratamiento eficaz en la EP avanzada reduciendo las fluctuaciones motoras.
Pramipexol: en la enfermedad avanzada es efectivo en el tratamiento de las fluctuaciones motoras, reduciendo el tiempo off. En un ensayo con 363 pacientes a 6 meses, comparado con placebo en tratamiento asociado a LD, la reducción del tiempo off al día fue de 2,5 horas con pramipexol frente a 10 minutos con placebo41 (NE-II). El pramipexol en EP avanzada es eficaz en la disminución de la aparición de fluctuaciones
Cuando empeoran las discinesias como efecto adverso al asociar un agonista dopaminérgico a LD, se recomienda primero reducir las dosis de LD.
Ropinirol: en pacientes con enfermedad de moderada a avanzada se ha visto una rápida mejoría incluso en las 2 primeras semanas, en probable relación con la más rápida y sencilla titulación de la formulación prolongada. En la enfermedad avanzada, en el tratamiento asociado a LD, se ha demostrado frente a placebo una reducción del tiempo en off y reducción de la dosis de LD mayor o igual al 20%. La última revisión centrada en la medicina basada en la evidencia concluye que ropinirol de liberación prolongada es eficaz en el tratamiento de las fluctuaciones motoras, pero no hay suficiente evidencia en el manejo de las discinesias20 (NE-IV).
Pramipexol: la última revisión centrada en la medicina basada en la evidencia concluye que para pramipexol de liberación prolongada no hay suficiente evidencia en el manejo de las complicaciones motoras20 (NE-IV).
Es el único agonista dopaminérgico transdérmico comercializado en nuestro medio. Respecto a las complicaciones motoras, en un ensayo clínico a 28 semanas frente a placebo con dos dosis de rotigotina de 8 y 12 mg/día, en 351 pacientes con fluctuaciones motoras y más de 2,5 horas de off al día, hubo una reducción del tiempo en off al día significativa (56%) en ambos brazos de rotigotina42 (NE-I). En otro estudio que comparaba rotigotina (dosis media 12,95 mg/día), pramipexol (media 3,1 mg/día) y placebo, en 506 pacientes con más de 2,5 horas de off al día, hubo una reducción significativa del tiempo off de 1,58 horas en el brazo de rotigotina, con un aumento del tiempo on sin discinesias problemáticas de +2,8 horas comparado con +1,4 horas en el brazo placebo40 (NE-I). Basándose en la evidencia de los estudios disponibles, la rotigotina es eficaz en el tratamiento de las fluctuaciones motoras.
Las inyecciones subcutáneas de apomorfina mediante un inyector de pluma permiten el tratamiento agudo de los episodios off. Su eficacia ha sido evaluada en tres estudios pivotales, con un diseño prospectivo, aleatorizado, controlado con placebo. Un estudio (APO202)44 (NE-I) fue realizado en pacientes que nunca habían recibido apomorfina y los otros dos en pacientes tratados como mínimo durante 3 meses antes de ser incluidos (APO301, APO302)45,46 (NE-I). En el estudio APO202 inicialmente se evaluaba al paciente ingresado y en un off inducido, al no recibir tratamiento antiparkinsoniano oral, con dosis progresivas de apomorfina o placebo. Esta fase iba seguida de 1 mes de tratamiento con apomorfina o placebo para tratar episodios off espontáneos según necesidad, en un máximo de 5 al día. En los estudios APO301 y APO302 se valoraba la respuesta a una dosis única de apomorfina o placebo, administrada al inicio de un episodio off espontáneo. En los tres ensayos, aproximadamente a los 20 minutos la mejoría en la puntuación media en la escala UPDRS respecto a la puntuación basal fue significativamente mejor con apomorfina que con placebo. La mejoría media también fue significativa respecto a placebo a los 10 (APO301 y APO302) y 60 minutos (APO302) pero no a los 90 minutos (APO302). En el estudio APO202, la apomorfina revertió con éxito el 90% de los off (en comparación al 23% con placebo) y redujo el número de horas off en 2 horas al día (en comparación con la no reducción del tiempo off con placebo). El tiempo en el que se alcanzaba la mejoría fue significativamente más corto con apomorfina que con placebo en los tres estudios. En los tres estudios los efectos secundarios experimentados con apomorfina fueron de intensidad leve e incluían bostezos, somnolencia, mareos, rinorrea y náuseas. Los problemas en el sitio de inyección como hematomas, dolor, reacciones cutáneas o nódulos fueron similares en ambas ramas de tratamiento.
La eficacia de la apomorfina subcutánea intermitente ha sido evaluada en otros dos pequeños estudios controlados con placebo47,48. En ambos hubo una reducción significativa del tiempo off y de su intensidad, respecto al placebo (NE-I).
Está indicada para el tratamiento intermitente de los episodios off en pacientes con EP, que no estén suficientemente controlados mediante la medicación antiparkinsoniana oral49 (NE-I). Fue aprobada por la AEMPS en diciembre de 2023. Se trata de una película sublingual, desarrollada para superar las limitaciones de la administración subcutánea, con diferentes dosis de 10, 15, 20, 25 y 30 mg. La dosis adecuada para cada paciente se determina mediante incrementos de la pauta posológica, que pueden realizarse en el domicilio tras testar la tolerabilidad de la primera dosis en el entorno controlado de un centro clínico especializado. En los ensayos pivotales se ha podido observar una respuesta clínica ya a los 15 minutos de la administración, la cual se mantiene a los 90 minutos50-52 (NE-I). Los efectos adversos son los característicos de la apomorfina, como somnolencia, náuseas e hipotensión, que pueden tratarse si fuera necesario con domperidona. Las reacciones locales en mucosa oral, como irritación o eritema se han observado con frecuencia, con una gravedad leve o moderada53,54.
La infusión continua de apomorfina subcutánea se trata en el capítulo 8 de este manual, dedicado a terapias de segunda línea (pag. 179).
Es un antagonista no selectivo de los receptores NMDA del glutamato, con propiedades antiparkinsonianas descritas en el año 1969. Posteriormente, en los años noventa, diversos estudios demostraron que era beneficioso en el tratamiento de las complicaciones motoras con disminución del tiempo en off y se demostró un efecto antidiscinético en ensayos clínicos aleatorizados, pero con pocos pacientes. No obstante, la duración de dicha eficacia está en debate.
Dos estudios aleatorizados, controlados con placebo, tipo wash-out, reportaron la eficacia del tratamiento con amantadina sobre las discinesias y que esta se mantenía a largo plazo. En un estudio55 (NE-II) se aleatorizaron 32 pacientes que estaban en tratamiento con amantadina para controlar las discinesias durante un mínimo de 1 año y con dosis promedio de 298 mg/día. Fueron aleatorizados de forma ciega, y un grupo continuó con el mismo tratamiento y en el otro grupo se cambió la amantadina por placebo, presentando un empeoramiento significativo de las discinesias a las 3 semanas y un aumento de las discinesias incapacitantes en tiempo on. El segundo estudio, AMANDYSK trial56 (NE-I), fue realizado con un diseño similar, pero con mayor seguimiento (3 meses). Se aleatorizaron 57 pacientes que recibían amantadina entre 6 meses y 3 años. Los resultados también mostraron que el grupo que cambió a placebo presentaba un empeoramiento de las discinesias. El efecto antidiscinético era significativamente superior en el grupo que continuaba con amantadina, el efecto se mantenía después de varios años de administración y la dosis media era 250 mg/día. Se demostró con un NE-II que la retirada de amantadina comportaba un empeoramiento significativo de las discinesias en 7 días.
La amantadina de liberación prolongada (ADS-5102), aun no comercializada en nuestro país, ha demostrado una reducción significativa de las discinesias y un aumento del tiempo on sin discinesias57 (NE-I). La reducción del tiempo off no llegó a ser significativa. Dicho beneficio es dependiente de dosis y con buena tolerancia. La dosis de 340 mg/día en una toma al acostarse ha demostrado el mejor equilibrio entre eficacia y seguridad.


4. Goetz CG, Koller WC, Poewe W. Management of Parkinson’s disease: an evidence-based review. Mov Disord 2002;17(Suppl 4):S1-S166.
5. Pahwa R, Lyons K, McGuire D, et al. Early morning akinesia in Parkinson’s disease: effect of standard carbidopa/levodopa and sustained-release carbidopa/levodopa. Neurology. 1996 Apr;46(4):1059-62.
6. Hauser RA, Espay AJ, Ellenbogen AL, et al. IPX203 vs Immediate-Release Carbidopa- Levodopa for the Treatment of Motor Fluctuations in Parkinson Disease: The RISE- PD Randomized Clinical Trial. JAMA Neurol. 2023 Oct 1;80(10):1062-1069.
7. Modi NB, Mittur A, Dinh P, et al. Pharmacodynamics, Efficacy, and Safety of IPX203 in Parkinson Disease Patients With Motor Fluctuations. Clin Neuropharmacol. 2019 Sep/ Oct;42(5):149-156.
8. Kurth MC, Tetrud JW, Irwin I, et al. Oral levodopa-carbidopa solution versus tablets in Parkinson’s patients with severe fluctuations A pilot study. Neurology. 1993;43:1036-9.
9. López Lozano JJ, Moreno Cano R. Preparación de una disolución de levodopa/carbidopa en ácido ascórbico (citrodopa) y valoración de su estabilidad durante 24 horas mediante cromatografía y detección electroquímica. Neurologia. 1995 Apr;10(4):155-8.
10. Senek M, Nyholm D, Nielsen EI. Population pharmacokinetics of levodopa/carbidopa microtablets in healthy subjects and Parkinson’s disease patients. Eur J Clin Pharmacol. 2018;74(10):1299-1307.
11. Johansson D, Ericsson A, Johansson A, et al. Individualization of levodopa treatment using a microtablet dispenser and ambulatory accelerometry. CNS Neurosci Ther. 2018;24(5):439-447.
12. Grétarsdóttir HM, Widman E, Johansson A, Nyholm D. Personalized Medicine Approach in Treating Parkinson’s Disease, Using Oral Administration of Levodopa/Carbidopa Microtablets in Clinical Practice. J Pers Med. 2021;11(8):720.
13. Inbrija 33 mg polvo para inhalación, cápsulas duras. En: CIMA-AEPMS [Internet]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1191390002/FT_1191390002.html
14. Lipp MM, Hickey AJ, Langer R, et al. A technology evaluation of CVT-301 (Inbrija): an inhalable therapy for treatment of Parkinson’s disease. Expert Opin Drug Deliv. 2021 Nov;18(11):1559-1569.
15. LeWitt PA, Hauser RA, Pahwa R, et al.; SPAN-PD Study Investigators. Safety and efficacy of CVT-301 (levodopa inhalation powder) on motor function during off periods in patients with Parkinson’s disease: a randomised,
16. Glenardi G, Handayani T, Barus J, et al. Inhaled Levodopa (CVT-301) for the Treatment of Parkinson Disease: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Neurol Clin Pract. 2022 Apr;12(2):139-148.
17. Hauser RA, Isaacson SH, Ellenbogen A, et al. Orally inhaled levodopa (CVT-301) for early morning OFF periods in Parkinson’s disease. Parkinsonism Relat Disord. 2019 Jul;64:175-180.
18. Saranza G, Lang AE. Inhaled Levodopa as a Potential Treatment for Diphasic Dyskinesia. Mov Disord. 2021 Jan;36(1):265-266.
19. Safirstein BE, Ellenbogen A, Zhao P, et al. Pharmacokinetics of Inhaled Levodopa Administered With Oral Carbidopa in the Fed State in Patients With Parkinson’s Disease. Clin Ther. 2020 Jun;42(6):1034-1046.
20. Fox SH, Katzenschlager R, Lim SY, et al. The Movement Disorder Society Evidence-Based Medicine Review Update: Treatment for the motor symptoms of Parkinson’s disease. Mov Disord. 2011;26(Suppl 3):S2-S41.
21. Baas H, Beiske AG, Ghika J, et al. Catechol-O-methyltransferase inhibition with tolcapone reduces the “wearing off” phenomenon and levodopa requirements in fluctuating parkinsonian patients. J Neurol Neurosurg Psychiatry. 1997;63(4):421-8.
22. Adler CH, Singer C, O’Brien C, et al. Randomized, placebo-controlled study of tolcapone in patients with fluctuating Parkinson disease treated with levodopa-carbidopa. Tolcapone Fluctuator Study Group III. Arch Neurol. 1998;55(8):1089-95.
23. Poewe WH, Deuschl G, Gordin A, et al.; Celomen Study Group. Efficacy and safety of entacapone in Parkinson’s disease patients with suboptimal levodopa response: a 6-month randomized placebo-controlled double-blind study in Germany and Austria (Celomen study). Acta Neurol Scand. 2002 ;105(4):245-55.
24. Hauser RA. Levodopa/carbidopa/entacapone (Stalevo). Neurology. 2004 Jan 13;62(1 Suppl 1):S64-71.
25. Rocha JF, Almeida L, Falcao A, et al. Opicapone: a short lived and very long acting novel catechol-O-methyltransferase inhibitor following multiple dose administration in healthy subjects. Br J Clin Pharmacol. 2013;76(5):763-75.
26. Ferreira JJ, Rocha JF, Falcão A, et al. Effect of opicapone on levodopa pharmacokinetics, catechol-O-methyltransferase activity and motor fluctuations in patients with Parkinson’s disease. Eur J Neurol. 2015;22(815-25):e56.
27. Ferreira JJ, Lees A, Rocha JF, et al. Opicapone as an adjunct to levodopa in patients with Parkinson’s disease and end-of-dose motor fluctuations: a randomised, double-blind, controlled trial. Lancet Neurol. 2015;15:154-65.
28. Lees AJ, Ferreira J, Rascol O, et al. Opicapone as adjunct to levodopa therapy in patients with parkinson disease and motor fluctuations: a randomized clinical trial. JAMA Neurol. 2016;74:197-206.
29. Ferreira JJ, Lees A, Rocha JF, et al. Efficacy and safety of opicapone in patients over 70 years with Parkinson’s disease and motor fluctuations. Mov Disord. 2015;30:S99.
30. Lopes N, Ferreira J, Lees A, et al. Exploratory efficacy of opicapone in combination with dopamine agonists or MAO-B inhibitors on the treatment of motor fluctuations inParkinson’s disease. Mov Disord. 2015;30:S10.
31. Lee JY, Ma HI, Ferreira JJ, et al. Opicapone to Treat Early Wearing-off in Parkinson’s Disease Patients: The Korean ADOPTION Trial. Mov Disord Clin Pract. 2024 Apr 9.
32. Ferreira JJ, Lee JY, Ma HI, Jeon B, Poewe W, Antonini A, et al.; ADOPTION study investigators. Opicapone for the treatment of early wearing-off in levodopa-treated Parkinson’s disease: pooled analysis of patient level data from two randomized open-label studies. J Neurol. 2024 Oct;271(10):6729-6738.
33. Parkinson Study Group. A randomized placebo-controlled trial of rasagiline in levodopa- treated patients with Parkinson disease and motor fluctuations: the PRESTO study. Arch Neurol. 2005;62:241-8.
34. Rascol O, Brooks DJ, Melamed E, et al.; LARGO study group. Rasagiline as an adjunct to levodopa in patients with Parkinson’s disease and motor fluctuations (LARGO), Lasting effect in Adjunct therapy with Rasagiline Given Once daily, study): a randomised, double- blind, parallel-group trial. Lancet. 2005;365:947-54.
35. Borgohain R, Szasz J, Stanzione P, et al. Randomized trial of safinamide add-on to levodopa in Parkinson’s disease with motor fluctuations. Mov Disord. 2014;29:229-37.
36. Abbruzzese G, Kulisevsky J, Bergmans B, Gomez-Esteban JC, Kägi G, Raw J, et al.; SYNAPSES Study Investigators Group. A European Observational Study to Evaluate the Safety and the Effectiveness of Safinamide in Routine Clinical Practice: The SYNAPSES Trial. J Parkinsons Dis. 2021;11(1):187-198.
37. Kulisevsky J, Esquivel A, Freire-Álvarez E, Gómez-Esteban JC, Legarda-Ramírez I, Avilés A, et al. SYNAPSES. Estudio observacional europeo para evaluar la seguridad y la efectividad de la safinamida en la práctica clínica habitual: análisis post hoc de la población española del estudio. Rev Neurol. 2023 Oct 15;77(s02):1-12.
38. Stowe RL, Ives NJ, Clarke C, et al. Dopamine agonist therapy in early Parkinson’s disease. Cochrane Database Syst Rev. 2008 Apr 16;(2):CD006564.
39. Cilia R, Akpalu A, Sarfo FS, et al. The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa. Brain. 2014 Oct;137(Pt 10):2731-42.
40. Rascol O, Lees AJ, Senard JM, et al. Ropinirole in the treatment of levodopa-induced motor fluctuations in patients with Parkinson’s disease. Clin Neuropharmacol. 1996;19(3):234-45.
41. Möller JC, Oertel WH, Köster J, et al. Long-term efficacy and safety of pramipexole in advanced Parkinson’s disease: results from a European multicenter trial. Mov Disord. 2005;20(5):602-10.
42. LeWitt PA, Lyons KE, Pahwa R; SP 650 Study Group. Advanced Parkinson disease treated with rotigotine transdermal system: PREFER Study. Neurology. 2007;68(16):1262-7.
44. Dewey Jr. RB, Hutton JT, LeWitt PA, et al. A randomized, double-blind, placebo-controlled trial of subcutaneously injected apomorphine for parkinsonian off-state events. Arch Neurol. 2001;58:1385-92.
45. Data on file. Vernalis Pharmaceuticals Inc. Study APO301.
46. Pfeiffer RF, Gutmann L, Hull Jr KL, et al.; and The APO302 Study Investigators. Continued efficacy and safety of subcutaneous apomorphine in patients with advanced Parkinson’s disease. Parkinsonism Relat Disord. 2007;13(2):93-100.
47. Van Laar T, Jansen EN, Essink AW, et al. A double-blind study of the efficacy of apomorphine and its assessment in ‘off’-periods in Parkinson’s disease. Clin Neurol Neurosurg. 1993;95:231-5.
48. Ostergaard L, Werdelin L, Odin P, et al. Pen injected apomorphine against off phenomena in late Parkinson’s disease: a double blind, placebo controlled study. J Neurol Neurosurg Psychiatry. 1995;58:681-7.
49. Kynmobi 10 mg + 15 mg + 20 mg + 25 mg + 30 mg película sublingual. En: CIMA-AEMPS [Internet]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/88979/FT_88979.html
50. Stocchi F, Rascol O, Poewe W, et al.; for the CTH-302 Study Investigators. Apomorphine Sublingual Film Compared with Subcutaneous Apomorphine for OFF Episodes in Parkinson’s Disease: An Open-Label, Randomized, Crossover Study. J Parkinsons Dis. 2023;13(8):1329-1342.
51. Olanow CW, Factor SA, Espay AJ, et al.; CTH-300 Study investigators. Apomorphine sublingual film for off episodes in Parkinson’s disease: a randomised, double-blind, placebo- controlled phase 3 study. Lancet Neurol. 2020 Feb;19(2):135-144.
52. Kassubek J, Stocchi F, Martínez EB, et al.; CTH-302 Study Investigators. Feasibility of home dose optimization of apomorphine sublingual film in Parkinson’s disease patients with OFF episodes: results from the dose-optimization phase of an open-label, randomized crossover study. Ther Adv Neurol Disord. 2023 Nov 9;16:17562864231209240.
53. Hui JS, Fox SH, Neeson W, et al.; CTH-300 Study Investigators. Open-label titration of apomorphine sublingual film in patients with Parkinson’s disease and “OFF” episodes. Parkinsonism Relat Disord. 2020 Oct;79:110-116.
54. Hauser RA, Ondo WG, Zhang Y, et al.; CTH-301 Study Investigators. Dose Optimization of Apomorphine Sublingual Film for OFF Episodes in Parkinson’s Disease: Is the Prophylactic Use of an Antiemetic Necessary? J Parkinsons Dis. 2023;13(3):403-414.
55. Wolf E, Seppi K, Katzenschlager R, et al. Long-term antidyskinetic efficacy of amantadine in Parkinson’s disease. Mov Disord. 2010;25:1357-63.
56. The AMANDYSK trial: Withdrawing amantadine in dyskinetic patients with Parkinson disease. Neurology. 2014;82:300-7.
57. Pahwa R, Tanner CM, Hauser RA, et al. Amantadine Extended Release for levodopa-induced dyskinesia in Parkinson’s disease (EASED Study). Mov Disord. 2015;30(6):788-95.
58. Rizos A, Sauerbier A, Antonini A, et al.; EUROPAR and the IPMDS Non-Motor-PD-Study Group. A European multicentre survey of impulse control behaviours in Parkinson’s disease patients treated with short- and long-acting dopamine agonists. Eur J Neurol. 2016 Aug;23(8):1255-61.
59. García-Ruiz PJ, Martínez Castrillo JC, Alonso-Canovas A, et al. Impulse control disorder in patients with Parkinson’s disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014 Aug;85(8):840-4.


