


Las cinco principales causas de hospitalización de los pacientes con EP reflejadas en revisiones sistemáticas y en un estudio multicéntrico internacional fueron la cirugía electiva, caídas o fracturas, infecciones, trastornos psiquiátricos y neumonía aspirativa1,2 (NE-IV). En general, una limitación destacable son los escasos estudios sobre estos aspectos en los que se haya especificado cuáles fueron los criterios diagnósticos de inclusión utilizados en relación con la EP3 (NE-III) y escasos los que analizan separadamente los sexos; otros se centran en pacientes jóvenes con la EP, incluyen aspectos de impacto económico o carecen del grupo control que permita diferenciar lo atribuible a la edad de lo propio de la EP. En el estudio COPPADIS se ha visto que las caídas son un factor independiente predictor de ingreso hospitalario urgente4 (NE-II).
En los estudios con pacientes con EP y controles se observa un patrón de mayor frecuentación de los servicios de Urgencias, estimándose que el 16-45% de estos enfermos acuden al menos una vez al año3 (NE-III). También se observa un incremento de admisiones hospitalarias, en un rango de frecuencia de hospitalización entre el 7% y el 28% por año, entre 1,2 a 1,45 veces por encima de los controles. Por último, en la población de EP de edad avanzada se aprecia una prolongación de días de estancia, que se estima en torno a 2-14 días más de estancia, o unas 1,19-1,20 veces más que los controles3,5 (NE-III), reseñándose que los pacientes con EP tienen casi el doble de probabilidades de permanecer en el hospital más de tres meses (ratio 1,90; IC 95: 1,83, 1,97). Sin embargo, otros estudios no han mostrado diferencias entre las estancias hospitalarias6,7 (NE-III-IV) y discrepan entre las tasas de mortalidad7 (NE-IV). Las comorbilidades no agudas parecen contribuir a estas cifras; las causas más comúnmente implicadas son la patología de ojos y oídos (89%), psiquiátricas (68%), musculoesqueléticas (64%), gastrointestinales bajas (62%), respiratorias (60,5%), gastrointestinales altas (59,2%) y genitourinarias (53,9%). Respecto a la polifarmacia, hay una relación entre frecuentación de Urgencias y pacientes con EP mayores de 65 años consumidores de más de cinco fármacos5-7.
Este perfil de utilización de servicios sanitarios es multifactorial: se debe a factores propios de la enfermedad, a la comorbilidad o a los efectos directos del tratamiento antipsicótico y de la medicación dopaminérgica. Pero también por la falta de familiaridad con la EP entre el personal sanitario de Urgencias y en las salas de hospitalización no neurológica, o por los problemas relacionados con la medicación, que acontecen entre el 39 y el 89,9% de los pacientes con EP, fundamentalmente en los 2 primeros días1,2. En el área de Urgencias-Hospitalización se ha descrito tanto la interrupción de la medicación (5%) como cambios en la medicación parkinsoniana (29%), fallos en su administración (34%) que suponen que los pacientes no lleguen a recibir el 10% de las dosis prescritas1 (NE-IV), o un 3% de autoadministración; carencia de stock en Farmacia; horarios de prescripción alterados (61-79%), así como altas tasas de prescripción (7-40%) y administración (21-23%) de medicamentos antidopaminérgicos3,8 (NE-III), lo que supone el principal factor de riesgo para el deterioro de la función motora y la causa de la prolongación de las estancias hospitalarias.
Durante la primera visita al servicio de Urgencias o la primera hospitalización entre el 5% y el 21% de los pacientes con EP fueron diagnosticados como tales. Pero en el 80% de los casos el motivo de admisión al servicio de Urgencias no fue originado por el cuadro motor/no motor primario, sino por una comorbilidad no específica de la enfermedad6 (NE-III), aunque la psicosis sí fue la principal razón para las repetidas readmisiones1 (NE-IV). En relación con el género, en ambos sexos eran más frecuentes las infecciones, principalmente respiratorias, mientras que el traumatismo era significativamente mayor en varones6. En relación con la edad, en los pacientes menores de 40 años los motivos de admisión no diferían de los recogidos en los de edad avanzada, observándose también en este subgrupo que tanto la duración de la hospitalización como el número de diagnósticos al alta fueron mayores que en los controles. La mitad de los pacientes presentaron una complicación y un tercio más de una durante su ingreso, principalmente confusión seguida de infecciones. En cuanto a las especialidades más consultadas, fueron Cirugía (24%), Medicina Interna (22%), Traumatología (15%), Urología (13%) y Cardiología (11%)8 (NE-III).
Las comorbilidades agudas no específicas de la enfermedad representan el 80% de las causas de ingreso6. Entre ellas destacan:
Infecciones pulmonares y genitourinarias. La neumonía representa entre el 6 y el 14% de las causas de admisión y es la principal causa de muerte en pacientes con EP; se trata generalmente, salvo en pacientes institucionalizados previamente, de una neumonía de la Las infecciones pulmonares se ven favorecidas por la alteración de los mecanismos de la tos y por la enfermedad restrictiva pulmonar, condicionadas por la rigidez muscular y en ocasiones por alteraciones posturales, la medicación y la progresión de la propia enfermedad. También la disfunción orofaríngea y la laríngea incrementan el riesgo de neumonía aspirativa, que se produce entre el 2,4% y el 3,6% de los pacientes con EP frente al 1,0% de los controles, aconsejándose para prevenirlas medidas activas de fisioterapia pulmonar. Las infecciones genitourinarias originan entre el 9% y el 33% de las causas de admisión y muy frecuentemente se acompañan de delirio. Si se añaden otros problemas urológicos como hiperreflexia del detrusor, presente en el 70-90% de los pacientes, irritabilidad y obstrucción vesical, con prevalencia del 27-39%, o prostatitis, originan hasta el 20% de las admisiones en hombres6 (NE-III). Algunos pacientes perciben que los antibióticos en general pueden empeorar su movilidad, pero ninguno en particular ha sido específicamente implicado.
Síndrome confusional, delirio y encefalopatía. Se han descrito como motivo para la hospitalización la encefalopatía (7%) y el delirio (5-7%), aunque estas cifras varían según la ubicación geográfica de los centros, ya que en un estudio multinacional eran notificadas en el 6% de los centros estadounidenses frente al 38% en otros países1 (NE-IV). También la presencia de agitación, confusión e hipertermia fue observada en un 28% de los casos durante la hospitalización, interpretándose que era originada entre otras razones por la propia hospitalización, la infección intercurrente, los cambios de tratamiento, los efectos de la anestesia o en el contexto de una demencia preexistente. Los cuadros de encefalopatía en el contexto de un parkinsonismo hiperpirexia y el síndrome discinesia hiperpirexia se revisan en secciones posteriores de este capítulo.
Síncope e hipotensión. Representan el 4% de las causas de admisión, mientras que la hipotensión ortostática, que es muy común en la EP, se observa en aproximadamente el 11% de los pacientes durante la hospitalización5 (NE-IV).
Alteraciones gastrointestinales. Originan entre el 11 y el 15% de las razones de ingreso, destacando la oclusión intestinal (11%) sobre otras causas como disfagia (6%), hemorragia digestiva alta (3%), diarrea o vómitos (2%) o estreñimiento (2%)5 (NE-IV).
Urgencias cardiovasculares. Se han descrito como causa de ingreso en el 12% y son fundamentalmente por angina (6%), insuficiencia cardiaca (6%) e infarto de miocardio (2%), ictus o isquemia cerebral transitoria (2-4%), arritmia cardiaca (2%) y trombosis venosa profunda (1%)5 (NE-IV).
Comorbilidades relacionadas directamente con la EP. Solo representan entre el 15 y el 25% de las causas de ingreso3 (NE-III), y no solo corresponden a las complicaciones motoras, sino también a los síntomas psiquiátricos y sensoriales, disfunción autonómica, trastornos del sueño y efectos secundarios de los fármacos antiparkinsonianos. En general son debidas a complicaciones de las últimas etapas de la EP o a los propios tratamientos. Durante la hospitalización, entre una quinta parte y el 38% de todos los pacientes experimentan deterioro de síntomas motores de la EP, y se observa un empeoramiento de la rigidez (12%), temblor (9%), problemas de equilibrio (3%), bradicinesia (3%) y discinesias (8%), de tal forma que se ha descrito que al alta la función motora puede ser peor hasta en el 28% de los pacientes, con un incremento medio de más de 5 puntos en la UPDRS-III8 (NE-III). Dos de las grandes causas de ingreso relacionadas directamente con la EP son los trastornos neuropsiquiátricos y las caídas. De los trastornos neuropsiquiátricos cabe destacar que los cuadros psicóticos son el origen de ingreso en el 8-23% de los pacientes, aumentando hasta el 25% en pacientes jóvenes7 (NE-IV). La depresión, con una prevalencia del 30 al 40% en la EP, o la ansiedad, del 40%, pueden también requerir hospitalización. Todos los trastornos psíquicos descritos contribuyen a los síntomas motores de la EP, a las complicaciones motoras, a las dificultades de la marcha, a los episodios de congelación, a las fluctuaciones on-off, al deterioro cognitivo y a la discapacidad. En cuanto a las caídas, el 61% (35-90%) de pacientes incluidos en una revisión sistemática reciente sufrían al menos una caída, siendo recurrentes en al menos un 39% (18-65%). Las caídas representan en las distintas series un 13-14% de los motivos de consulta en Urgencias, mientras que la fractura de cadera es motivo de ingreso (aproximadamente el 4%) y se presenta con una frecuencia cuatro veces superior a lo esperable, particularmente en el estadio III de la clasificación de Hoehn y Yahr. El riesgo de caídas está aumentado en comparación con los controles debido a la inestabilidad postural, festinación de la marcha, freezing, debilidad de la musculatura de las piernas, alteración cognitiva e hipotensión ortostática8 (NE-III). Mientras que en las mujeres con EP la fractura es la principal causa de hospitalización, en los hombres, frente a controles, solo lo es el trauma en Las dos principales complicaciones a las que se enfrentan además estos pacientes durante la hospitalización son la neumonía y el delirio.
Uso de medicación concomitante en Urgencias. Con cierta frecuencia en los servicios de Urgencias se emplean fármacos que pueden empeorar el parkinsonismo. En general se trata de fármacos antidopaminérgicos que tienen otras indicaciones, como vómitos (metoclopramida) o vértigo (sulpirida), y cuyo uso debe evitarse al máximo en estos pacientes.

1. Chou KL, Zamudio J, Schmidt P, et al. Hospitalization in Parkinson disease: a survey of National Parkinson Foundation Centers. Parkinsonism Relat Disord. 2011;17:440-5.
2. Skelly R, Brown L, Fakis A, et al. Hospitalization in Parkinson’s disease: a survey of UK neurologists, geriatricians and Parkinson’s disease nurse specialists. Parkinsonism Relat Disord. 2015; 21(3):277-81.
3. Oliver HH, Gerlach OH, Winogrodzka A, et al. Clinical problems in the hospitalized Parkinson’s disease patient: systematic review. Mov Disord. 2011;26:197-208.
4. Santos García D, de Deus Fonticoba T, Cores C, et al.; COPPADIS Study Group. Falls Predict Acute Hospitalization in Parkinson’s Disease. J Parkinsons Dis. 2023;13:105-124.
5. Woodford H, Walker R. Emergency hospital admissions in idiopathic Parkinson’s disease. Mov Disord. 2005;20:1104-8.
6. Braga M, Pederzoli M, Antonini A, et al. Reasons for hospitalization in Parkinson’s disease: a case-control study. Parkinsonism Relat Disord. 2014;20:488-92.
7. Aminoff MJ, Christine CW, Friedman JH, et al. Management of the hospitalized patient with Parkinson’s disease: Current state of the field and need for guidelines. Parkinsonism Relat Disord 2011;17:139-45.
8. Gerlach OH, Broen MP, van Domburg PH, et al. Deterioration of Parkinson’s disease during hospitalization: survey of 684 patients. BMC Neurol. 2012;12:13.
La principal causa de parkinsonismo de rápida instauración es la exposición a fármacos bloqueantes dopaminérgicos. La situación más extrema tras la exposición a los mismos es el síndrome neuroléptico maligno (SNM), pero también han de tenerse en cuenta otros síndromes importantes inducidos por fármacos como el síndrome parkinsonismo-hiperpirexia, el síndrome discinesia-hiperpirexia, el síndrome serotoninérgico y otras causas de parkinsonismo agudo9,10 (NE-IV).
El SNM es una complicación grave del tratamiento con neurolépticos que puede surgir hasta en el 0,2% de los pacientes que los toman, independientemente de la dosis usada, ya que se trata de un problema idiosincrásico11,12 (NE-IV). Aunque la mayoría de los casos son provocados por neurolépticos, también se ha descrito con el uso de otros fármacos bloqueantes o deplecionadores dopaminérgicos (metoclopramida, prometazina).
Los factores de riesgo para su aparición son deshidratación, cansancio o agotamiento, agitación, escalado abrupto de la dosis del fármaco causante, uso de formulaciones depot, sexo masculino, pacientes jóvenes, uso concomitante de litio e inhibidores de la recaptación de serotonina (ISRS), altas temperaturas, presencia de síndromes parkinsonianos y el haber tenido previamente SNM. Puede prevenirse su aparición instaurando los tratamientos antidopaminérgicos de forma paulatina, con incrementos de dosis escalonados11,12.
Suele iniciarse en torno a la semana (3-10 días) de haber instaurado o incrementado la dosis del fármaco causal, la clínica se desarrolla en horas, con un incremento en la gravedad a lo largo de los 2-3 primeros días y permanece durante 1-2 semanas. El cuadro clínico consiste en fiebre, rigidez, alteración del estado mental, disfunción autonómica y otros trastornos del movimiento como temblor, distonía y mioclonías. Además, se acompaña de alteraciones de laboratorio que incluyen leucocitosis, aumento de creatina cinasa (CK), alteración de las pruebas de función hepática y renal y de la coagulación, acidosis metabólica y alteraciones electrolíticas; por otra parte, los reactantes de fase aguda pueden estar disminuidos11,12 (NE-IV).
El cuadro clínico puede verse complicado, a veces de forma irreversible, con la presencia de fracaso renal debido a la rabdomiólisis, el fallo respiratorio o la neumonía por aspiración, así como por otras complicaciones secundarias a la inmovilidad, como la trombosis venosa profunda, el tromboembolismo pulmonar o las úlceras por presión. Todo ello condiciona una situación de gravedad con una mortalidad que puede llegar al 20-30%11,12 (NE-IV).
Existen unos criterios diagnósticos mayores (fiebre, rigidez y aumento de CK) y unos menores (taquicardia, presión arterial anómala, taquipnea, alteración del nivel de consciencia, diaforesis y leucocitosis). La presencia de los tres criterios mayores, o dos mayores y cuatro menores permite establecer con una alta probabilidad el diagnóstico de SNM en el contexto clínico apropiado11,12 (NE-IV). El diagnóstico diferencial más importante debe realizarse con el síndrome serotoninérgico, la hipertermia maligna y la catatonía11,12 (NE-IV).
No existen ensayos clínicos prospectivos aleatorizados respecto al tratamiento del SNM. El tratamiento consiste en la supresión inmediata del agente causal, el uso de medidas de soporte vital, fármacos dopaminérgicos y relajantes musculares, así como el manejo de las complicaciones. Clásicamente se ha usado bromocriptina (habitualmente 2,5 mg/8 horas, máximo 60 mg/día), si bien cualquier agente dopaminérgico puede ser eficaz. Por otra parte, el dantroleno (entre 2-3 mg/kg/8 horas hasta un máximo de 10 mg/kg/día), un relajante muscular inespecífico, puede usarse para disminuir la rigidez muscular y minimizar la rabdomiólisis en los casos más graves o que no respondan bien al agente dopaminérgico. Este tratamiento debe mantenerse al menos 7-10 días, teniendo en cuenta la vida media del agente causal, y debe esperarse al menos 2 semanas desde la resolución del cuadro para reintroducir, siempre de forma lenta, el tratamiento neuroléptico11,12 (NE-IV).
Se trata de un síndrome prácticamente indistinguible del SNM, salvo por que ocurre en pacientes ya diagnosticados de parkinsonismo. Tiene lugar cuando a estos pacientes se les retira o reduce de forma abrupta la medicación dopaminérgica. Clásicamente ocurría cuando se realizaban vacaciones de LD, y si bien actualmente esta situación ya no se da, sí se puede observar este síndrome en el contexto de cambios terapéuticos agresivos en relación con cirugía de estimulación cerebral profunda (ECP) en pacientes con EP, en caso de falta de cumplimiento terapéutico o en relación con ingresos hospitalarios por otras patologías cuando no se respeta la pauta dopaminérgica previa. Igualmente se han comunicado casos tras disfunción de estimuladores cerebrales profundos o agotamientos de la batería de estos. Es posible que el SNM, el parkinsonismo-hiperpirexia y la crisis acinética y la acinesia aguda sean el espectro de un mismo síndrome13 (NE-IV).
Puede verse precipitado por la presencia de factores como deshidratación, infecciones y alteraciones metabólicas. Cursa con hipertermia, disautonomía, alteración del nivel de consciencia, rigidez intensa y aumento de CK, y puede complicarse con los mismos procesos que el SNM (trombosis venosa, tromboembolismo pulmonar, neumonía por aspiración, fallo renal)13 (NE-IV).
El tratamiento consiste en medidas de soporte; es fundamental la hidratación, junto con la restitución del tratamiento dopaminérgico. Puede usarse dantroleno en caso necesario. En un pequeño ensayo aleatorizado encontraron que el uso de dosis altas de metilprednisolona intravenosa era eficaz como tratamiento complementario para reducir el tiempo de recuperación9 (NE-IV).
Se caracteriza por la aparición de discinesias graves que llevan al agotamiento muscular, rabdomiólisis, hipertermia y confusión mental en pacientes parkinsonianos9,10 (NE-IV).
Comparte ciertas características con el síndrome parkinsonismo-hiperpirexia, salvo que predominan las discinesias frente a la rigidez y el tratamiento consiste en la reducción cautelosa de fármacos dopaminérgicos en vez del aumento necesario en el síndrome parkinsonismo-hiperpirexia. Este cuadro puede favorecerse por las altas temperaturas y hay algún reporte anecdótico de su prevención con estimulación dopaminérgica continua14 (NE-IV).
Se trata de un síndrome ocasionado por un incremento rápido en la actividad biológica de la serotonina, usualmente causado por cualquier fármaco que incremente la transmisión serotoninérgica. Actualmente aparece en pacientes que toman dos o más fármacos con esta acción (Tabla I), habitualmente a dosis terapéuticas. El síndrome serotoninérgico se debe a una toxicidad farmacológica, no es un fenómeno idiosincrásico12,15 (NE-IV).
Muchas de sus manifestaciones clínicas se solapan con las del SNM; sin embargo, el síndrome serotoninérgico presenta como características clínicas diferenciales mioclonías, hiperreflexia, crisis y alteraciones del estado de ánimo en forma de inquietud o ánimo exaltado. El inicio del cuadro suele ser agudo, tras la introducción o aumento del agente causal, aunque a veces hay casos de curso insidioso o recurrentes, con aparición de cambios sutiles en el rendimiento cognitivo, trastornos de conducta y temblor que duran de días a semanas antes de la aparición del cuadro florido.

Diferenciar entre síndrome serotoninérgico y SNM puede resultar dificultoso: aunque a priori los agentes causales son diferentes, en la práctica clínica los pacientes con frecuencia pueden estar en tratamiento con ambas familias de fármacos. Los hallazgos clínicos más importantes para realizar esta diferenciación son la hiperreflexia, frecuentemente en forma de clonías de predominio en miembros inferiores, el clono ocular y el temblor en el síndrome serotoninérgico, mientras que en el SNM el hallazgo es la presencia de un síndrome bradicinético-rígido con hiporreflexia12,15 (NE-IV).
El tratamiento consiste en la supresión del agente causal, medidas de soporte y, en casos graves, ciproheptadina. La ciproheptadina es un antihistamínico y un antagonista de la serotonina que debe pautarse en dosis divididas hasta un máximo de 32 mg/ día. Por otra parte, es necesario tratar algunas manifestaciones clínicas y complicaciones (crisis, arritmias, coagulopatía, hipertermia, etc.). El pronóstico puede ir desde una resolución rápida y completa hasta ser potencialmente fatal (rango de mortalidad entre el 2,4% y el 12%)12,15 (NE-IV).
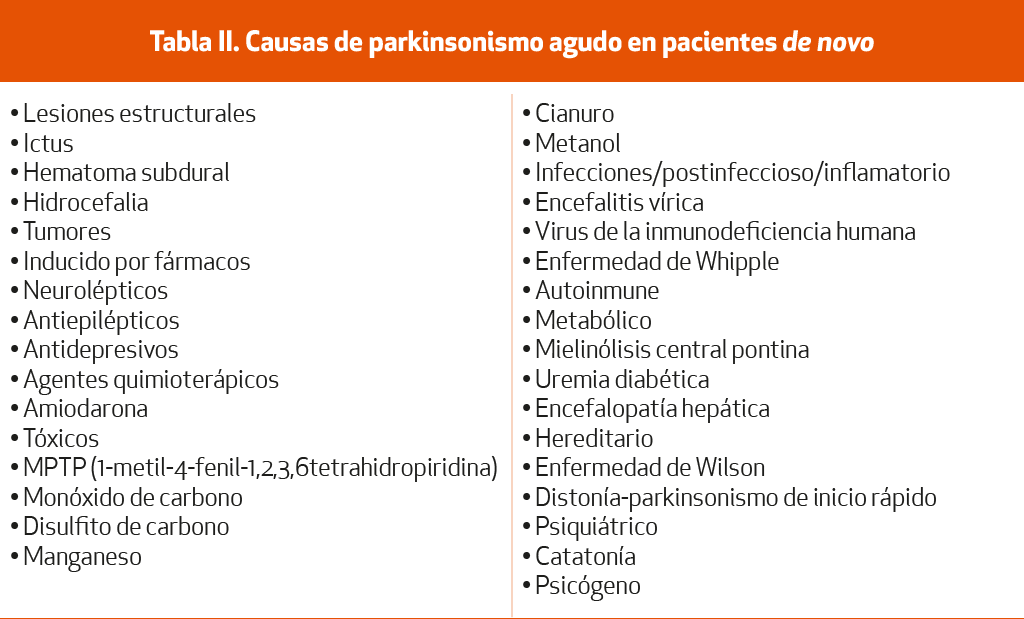
La aparición de forma aguda o subaguda de un cuadro parkinsoniano entraña un amplio diagnóstico diferencial (Tabla II)9,10 (NE-IV). Cuando este se desarrolla en cuestión de días o incluso semanas siempre debe considerarse la posibilidad de una causa secundaria, entre las que merece especial atención la lista de fármacos.
El empeoramiento agudo de los síntomas motores en la EP no relacionado con la progresión de la enfermedad habitualmente tiene lugar por una enfermedad intercurrente, típicamente una infección del tracto urinario o respiratorio, o por alteraciones metabólicas o neurológicas añadidas.
El tratamiento debe ir encaminado a la causa responsable. En todo caso los agentes dopaminérgicos son de elección, y en caso de alteración de la deglución se usarán vías alternativas a la oral como la transdérmica (rotigotina) o subcutánea (apomorfina)9,10 (NE-IV). Existe algún reporte anecdótico del uso de perfusiones intravenosas de fármacos dopaminérgicos para pacientes que no pueden tolerar medicación oral16 (NE-IV).
9. Robottom BJ, Weiner WJ, Factor SA. Movement disorders emergencies. Part 1: Hypokinetic disorders. Arch Neurol. 2011;68:567-72.
10. Munhoz RP, Scorr LM, Factor SA. Movement disorders emergencies. Curr Opin Neurol. 2015;28:406-12.
11. Tse L, Barr AM, Scarapicchia V, et al. Neuroleptic Malignant Syndrome: A review from clinically oriented perspective. Curr Neuropharmacol. 2015;13:395-406.
12. Perry PJ, Wilborn CA. Serotonin syndrome vs neuroleptic malignant syndrome: a contrast of causes, diagnosis, and management. Ann Clin Psychiatry. 2012;24:155-62.
13. Onofrj M, Thomas A. Acute akinesia in Parkinson disease. Neurology. 2005;64:1162-9.
14. Herreros-Rodríguez J, Sánchez-Ferro Á. Summertime Dyskinesia-Hyperpyrexia Syndrome: The “Dual Heat” Hypothesis. Clin Neuropharmacol. 2016;39(4):210-1.
15. Boyer EW, Shannon M. The serotonin syndrome. N Engl J Med. 2005 Mar 17;352(11):1112- 20. Erratum in: N Engl J Med. 2007 Jun 7;356(23):2437. Erratum in: N Engl J Med. 2009 Oct 22;361(17):1714.
16. Mizuno J, Kato S, Watada M, Morita S. [Perioperative management of a patient with Parkinson’s disease with intravenous infusion of levodopa]. Masui. 2009;58(10):1286-9.
Hemorragias (intraventricular, subdural, epidural, subaracnoidea, intracerebral). La frecuencia es del 0,6-3,3%. Se deben al daño de vasos sanguíneos por el microrregistro (MER) o por los electrodos El diagnóstico se realiza mediante TC craneal. En cuanto al tratamiento, requiere el ingreso en la UCI y medidas conservadoras de soporte vital en la mayoría de los casos17 (NE-IV).
Infarto venoso. Debido al daño de venas corticales en el contexto de edema y hemorragia que condiciona estasis venosa e hipertensión17 (NE-IV).
Edema perielectrodo de características idiopáticas. Puede ocurrir en 1 o en los 2 electrodos, e interferir en los efectos de la estimulación, modificando el volumen de activación, sobre todo en los primeros días tras el encendido del generador de pulsos. En ocasiones, sobre todo cuando es sintomático, requiere la administración de corticoides intravenosos u orales y, habitualmente, se retrasa el inicio de la terapia17 (NE-IV).
Tormenta discinética. Ocurre sobre todo en pacientes con graves discinesias en el periodo Se debe al MER, la localización de la cánula o la localización del electrodo en la porción sensitivo-motora del núcleo subtalámico (NST). Su aparición indica buen pronóstico. Solo en casos muy extremos con presencia de discinesias y rabdomiólisis puede requerir sedación con propofol intravenoso17 (NE-IV).
Alteración comportamental y trastornos cognitivos en el posoperatorio precoz. La incidencia de confusión es del 5%. Estas urgencias están relacionadas sobre todo con la cirugía del núcleo subtalámico, el tratamiento con anticolinérgicos (para la EP o la incontinencia urinaria) y la edad. Se debe siempre hacer un cribado de las posibles causas tratables (infección del tracto urinario, hemorragia, fármacos). La alteración cursa con alucinaciones y delirios. Se debe manejar como una emergencia, con cribado de las posibles causas orgánicas (TC craneal, bioquímica completa) y el tratamiento será el de la causa responsable y/o neurolépticos atípicos (quetiapina/clozapina)17,18 (NE-IV).
Intento de suicidio. No queda del todo claro si la ECP aumenta el riesgo de suicidio o este es equivalente al que presentan los pacientes con EP. Se ha visto asociado a la existencia de intentos de suicidio previos, presencia de trastornos del control de impulsos, desregulación dopaminérgica, depresión y apatía posoperatorias y pacientes Por tanto, es muy importante la evaluación neuropsicológica y psiquiátrica preoperatoria. Los pacientes deben ser ingresados para recibir un abordaje multidisciplinar (terapia cognitivo-conductual, terapia psicológica, ajuste del estimulador y tratamiento médico)17 (NE-IV).
Infarto agudo de miocardio. Es importante la revisión preoperatoria de la comorbilidad médica. Los pacientes en tratamiento con antidepresivos tricíclicos tienen mayor riesgo con la anestesia general. La incidencia de angina y arritmias tras la ECP es del 0,3%17,18 (NE-IV).
Embolismo aéreo. Su incidencia es del 3%. Se debe a la entrada de aire al sistema venoso; por ello deben cubrirse con cera los bordes del trépano e irrigarse bien el campo quirúrgico durante todo el procedimiento17,18 (NE-IV).
Infección. La incidencia de infección y erosión es del 0,15-2%. El tratamiento puede requerir la retirada urgente del sistema y el cultivo del aspirado del bolsillo del generador de impulsos Es muy importante la prevención prequirúrgica y posquirúrgica con tratamiento antibiótico. También se puede realizar instilación local con tratamiento antibiótico antiestafilocócico (neomicina o polimixina) sobre la herida quirúrgica. Según la afectación, se valorará el tratamiento conservador frente a la retirada del hardware, y dependiendo de si el electrodo está afectado o no se procederá a la retirada parcial (solo el generador) o total (generador, extensión y electrodo). Habrá que esperar 6-8 semanas como mínimo para valorar el reimplante17-20 (NE-IV).
Malfuncionamiento. La pérdida repentina de funcionamiento puede ser debida a fractura de electrodo, rotura de la extensión, fallo del generador o manipulación del generador por parte del paciente. Se debe hacer una medición de impedancias y examinar el sistema mediante imagen de cráneo y cuello en dos proyecciones, y de no encontrar solución de continuidad se han de medir impedancias en el quirófano17 (NE-IV).
Migración del electrodo. Se debe al malfuncionamiento de los dispositivos de anclaje, al crecimiento del cráneo o a movimientos vigorosos cefálicos. Ante la sospecha de migración del electrodo se ha de realizar una prueba de imagen, probar a cambiar los contactos activos y revisión quirúrgica si precisa. Se debe tener cuidado con la posibilidad de extensión de la corriente a áreas vecinas y los consiguientes posibles efectos secundarios, que en algunos casos pueden mejorar con el ajuste de la programación de modo temporal18 (NE-IV).
Mala localización del electrodo. Se debe al fallo del sistema que asegura el electrodo, el desplazamiento cerebral intraoperatorio (por pérdida de líquido cefalorraquídeo) o error en la planificación. Ante una baja relación efecto terapéutico/ efectos adversos se ha de realizar prueba de imagen posoperatoria para verificar la localización del electrodo17 (NE-IV).
Síntomas motores. Pueden aparecer discinesias, corea, balismo, trastorno de la marcha, disartria e hipofonía. La mayoría mejoran con estrategias de reprogramación21 (NE-IV).
Síntomas no motores. Incluyen parestesias, alteración del comportamiento, problemas cognitivos, síntomas pseudobulbares, depresión y manía. Se deben a la irradiación de corriente a áreas asociativas y límbicas. Requieren estrategias de reprogramación o ajustes de medicación. En casos graves (sobre todo ante depresión y manía) pueden requerir ingreso hospitalario con verificación de la localización del electrodo, reprogramación o ajuste de la medicación. Siempre se debe adoptar un abordaje multidisciplinar22 (NE-IV).
Apagado accidental del sistema. Puede ocurrir en presencia de determinados detonantes ambientales (congelador magnético, cajas fuertes muy potentes). Con el propio controlador del paciente se puede revisar la condición de estimulación y revertir a modo on. Se deben evitar campos magnéticos potentes21 (NE-IV).
Rebote de sintomatología preoperatoria o síndrome de retirada de la estimulación. Puede ocurrir al finalizar la batería del generador. La posibilidad de que ocurra rebote es mayor cuanto más beneficiosa haya sido la terapia, mayor la edad del paciente y los años de evolución de la enfermedad. Se puede producir rebote o empeoramiento rápido de síntomas motores y no motores. Son muy importantes las revisiones periódicas del generador así como el recambio de este previo a su completa finalización, ya que puede llegar a suponer en algunos casos una urgencia vital, al no responder a dosis mayores de LD21,22 (NE-IV).
Se suele desencadenar por infecciones, traumatismos o intervenciones quirúrgicas. La primera medida es el tratamiento oral (pimozida, risperidona, olanzapina, haloperidol, tetrabenacina, trihexifenidilo). De no ser eficaz, se debe pasar a formulación intravenosa, intratecal y sedación (midazolam, propofol)21 (NE-IV).
El paciente ha de ser ingresado en la UCI para vigilar el compromiso respiratorio, la hipertermia, la deshidratación, la rabdomiólisis y la insuficiencia renal. De no conseguir mejoría sintomática con las medidas anteriores, se ha de considerar la cirugía mediante ECP del globo pálido interno tras la persistencia de los síntomas durante semanas o meses21-24 (NE-IV).
El nivel de evidencia científica disponible relacionado con las urgencias relacionadas con el procedimiento quirúrgico es NE-IV, siendo por tanto D el grado de recomendación ofrecida.
17. Morishita T, Foote KD, Burdick AP, et al. Identification and management of deep brain stimulation intra and postoperative urgencies and emergencies. Parkinsonism Relat Disord. 2010;16:153-62.
18. Bronstein JM, Tagliati M, Alterman RL, et al. Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues. Arch Neurol. 2011;68:165-71.
19. Sillay KA, Larson PS, Starr PA. Deep brain stimulator hardware-related infections: incidence and management in a large series. Neurosurgery. 2008;62:360-6; discussion: 366-7.
20. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
21. Grimaldi S, Eusebio A, Carron R, et al. Deep Brain Stimulation-Withdrawal Syndrome in Parkinson’s Disease: Risk Factors and Pathophysiological Hypotheses of a Life-Threatening Emergency. Neuromodulation. 2023;26(2):424–34.
22. Simonet C, Tolosa E, Camara A, et al. Emergencies and critical issues in Parkinson’s disease. Pract Neurol. 2020;20(1):15-25.
23. Cossu G, Sensi M. Deep Brain Stimulation Emergencies: How the New Technologies Could Modify the Current Scenario. Curr Neurol Neurosci Rep. 2017;17(7):51.
24. Allen NM, Lin JP, Lynch T, et al. Status dystonicus: a practice guide. Develop Med Child Neurol. 2014;56:105-12.
El porcentaje de complicaciones por el tratamiento con perfusión intestinal de LD (LD / carbidopa o LD / carbidopa / entacapona intestinal en gel) es alto en las distintas series22,25-27 (NE-I), aunque la mayoría de las complicaciones son leves y tienen una incidencia especialmente alta la primera semana tras el inicio del tratamiento. Además, la mayoría de las complicaciones y las más graves están relacionadas fundamentalmente con el procedimiento endoscópico.
El tratamiento con perfusión intestinal de LD conlleva la realización de gastrostomía endoscópica percutánea para la colocación de una sonda interna a nivel duodenal y una sonda externa que conecte con la bomba de perfusión. Dicho procedimiento es el que ocasiona las complicaciones y por tanto los motivos de consulta a Urgencias más graves relacionados con este tipo de terapia. Entre ellos cabe destacar neumoperitoneo (7%), peritonitis (1%) y neumonía aspirativa (2%)25-27 (NE-I). En general, se suelen solventar con medidas conservadoras y antibioterapia y rara vez suelen conllevar la retirada del dispositivo.
Otras complicaciones dentro de este grupo más banales y que no suelen ser motivo frecuente de consulta en Urgencias son el dolor abdominal, dolor orofaríngeo, estreñimiento, flatulencia y enrojecimiento a nivel del estoma. Aunque tienen una alta incidencia en las distintas series26,27 (NE-I), suelen ser leves y autolimitadas.
Los motivos de urgencias vinculados al propio sistema de perfusión suelen incluir la obstrucción de la sonda interna (9%), la migración de la misma, especialmente hacia el estómago (17%), la rotura de las conexiones o de la propia sonda interna (5%) y el fallo en la bomba de perfusión (6%). Si alguna de estas complicaciones sucede es aconsejable parar la bomba de perfusión y reintroducir tratamiento dopaminérgico oral a la espera de poder resolverse26,27 (NE-I).
Uno de los motivos más frecuentes de consulta urgente en pacientes con perfusión intestinal de LD lo constituyen las infecciones periestomales, las cuales suelen ser locales y leves y rara vez provocan celulitis extensa o abscesos a nivel de la pared abdominal28 (NE-II). Ante la sospecha de infección periestomal, debe tratarse de entrada con antibioterapia empírica, realizándose cultivo y antibiograma del exudado simultáneamente para conocer el germen patógeno responsable y la adecuada sensibilidad del mismo a los distintos antibióticos. De esta manera se garantiza la resolución de la infección o se modifica la pauta antibiótica de inicio si fuera necesario. Dado que esta terapia conlleva de forma permanente la colocación de una sonda externa, no es infrecuente la colonización e infección del sistema por Pseudomonas28(NE-II). Para la prevención de infecciones periestomales es fundamental la adecuada higiene y limpieza de la piel y de la estoma.
También los granulomas a nivel del estoma suponen un motivo de consulta en Urgencias28, dado que suelen sangrar espontáneamente o con el roce, y esto constituye un motivo de alarma para los pacientes. No obstante, los granulomas a nivel del estoma no suponen una urgencia en sí misma y deben tratarse con la aplicación de nitrato de plata una vez al día hasta su resolución. Es frecuente la recidiva (NE-IV).
Este grupo de urgencias son las propias de cualquier paciente con EP que se encuentre en tratamiento con LD. Aunque la forma de administración de la LD a través de la perfusión intestinal continua a modo de gel aumenta claramente la biodisponibilidad del fármaco, la incidencia de este tipo de complicaciones es similar a la observada en pacientes que se encuentran en tratamiento con LD oral22,25 (NE-II).
Dentro de los motivos de consulta a Urgencias en este grupo cabe destacar los siguientes: discinesias, psicosis, alucinaciones e hipotensión ortostática20,23. Este tipo de complicaciones suelen conllevar el ajuste individualizado del tratamiento dopaminérgico. Se han documentado casos esporádicos de polineuropatía aguda en pacientes en tratamiento con perfusión intestinal de LD, aunque se desconoce el posible papel del tratamiento en la fisiopatología del cuadro clínico28 (NE-II).
Los motivos de consulta a Urgencias en pacientes con EP en tratamiento con perfusión subcutánea de apomorfina están relacionados especialmente con los efectos secundarios que pueda ocasionar el fármaco en sí mismo y no con la vía de administración22,29 (NE-IV). Dentro de estos se incluirían los siguientes:
Hipotensión, que suele ser leve y rara vez constituye motivo de consulta a Urgencias. Suele ser manejada con medidas no farmacológicas, tales como aumento en la ingesta de sal y líquidos, medias compresivas, etc. En ocasiones es necesario ajustes de otras terapias como antihipertensivos, controlar la dosis del fármaco o incluso utilizar medicaciones que ayuden a elevar la tensión arterial como la midodrina, la piridostigmina o la fludrocortisona, entre otras.
Los síntomas neuropsiquiátricos como psicosis, alucinaciones o confusión suelen ser leves e infrecuentes, pero hasta en un 10% de los casos pueden ser graves y por tanto constituir motivo de consulta a Urgencias29(NE-IV). Otros síntomas neuropsiquiátricos como el trastorno del control de impulsos, el punding o el síndrome de desregulación dopaminérgica pueden ocurrir como con cualquier otro agonista dopaminérgico.
Las náuseas intensas que constituyan un motivo de consulta a Urgencias son infrecuentes y puede controlarse con domperidona o trimetobenzamida antes del inicio del tratamiento con perfusión subcutánea de apomorfina29.
La anemia hemolítica constituye un proceso potencialmente grave e idiosincrático en pacientes en tratamiento con Aunque su incidencia es baja, menor al 1%, es preciso conocerlo por su gravedad29 (NE-IV).
El síndrome eosinofílico es también una complicación muy infrecuente y rara vez suele ocasionar manifestaciones graves como daño hepático o cardiaco. Su aparición conlleva la retirada del tratamiento con apomorfina29 (NE-IV).
Dentro de las complicaciones propias de la vía de administración de la apomorfina, se encuentra la aparición de nódulos subcutáneos en los puntos de perfusión. Esta complicación no suele constituir un motivo de consulta a Urgencias, a pesar de tener alta incidencia en pacientes en tratamiento con perfusión de apomorfina. Su manejo y resolución representan la clave para poder mantener el tratamiento a largo plazo. Es fundamental prevenir su aparición con medidas conservadoras, tales como rotación en el punto de perfusión, adecuada higiene de la piel, uso de parches de silicona, agujas de Teflon®, etc. Una vez que aparecen los nódulos, la aplicación de ultrasonidos constituye el único tratamiento efectivo29 (NE-IV). Los nódulos subcutáneos no van a ser una causa de visita a urgencias, sin embargo, sí puede serlo la celulitis, que podría requerir un tratamiento antibiótico urgente.
Las perfusiones de pLD/pCD se han introducido recientemente y la experiencia es limitada. Ambos compuestos de la solución se trasforman en LD y carbidopa respectivamente, los efectos adversos están relacionados con los propios de la LD, y no es esperable que los pacientes acudan a Urgencias. Las salvedades serían los síndromes confusionales y trastornos neuropsiquiátricos, ya comentados anteriormente. El manejo sería rebajar las dosis de LD perfundida, ajustar las horas de perfusión, o ambas. Es imprescindible que lo realice un neurólogo experto30 (NE-IV).
La otra posible complicación, al igual que con la perfusión de apomorfina, la aparición de nódulos subcutáneos hasta en un cuarto de los pacientes. El manejo sería el mismo que para la apomorfina30 (NE-IV).
20. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
22. Simonet C, Tolosa E, Camara A, et al. Emergencies and critical issues in Parkinson’s disease. Pract Neurol. 2020;20(1):15-25.
23. Cossu G, Sensi M. Deep Brain Stimulation Emergencies: How the New Technologies Could Modify the Current Scenario. Curr Neurol Neurosci Rep. 2017;17(7):51.
24. Allen NM, Lin JP, Lynch T, et al. Status dystonicus: a practice guide. Develop Med Child Neurol. 2014;56:105-12.
25. Slevin JT, Fernández HH, Zadikoff C, et al. Long-term safety and maintenance of blind pivotal study in advanced Parkinson’s disease patients. J Parkinsons Dis. 2015;5:165-74.
26. Olanow CW, Kieburtz K, Odin P, et al. Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson’s disease: a randomised, controlled, double-blind, doble-dummy study. Lancet Neurol. 2014;13:141-9.
27. Fernández HH, Standaert DG, Hauser RA, et al. Levodopa-Carbidopa intestinal gel in advanced Parkinson’s disease: final 12 month, open-label results. Mov Disord. 2015;30:500-9.
28. Nyholm D. Duodopa treatment for advanced Parkinson’s disease: a review of efficacy and safety. Parkinsonism Relat Dis. 2012;18:916-29.
29. Trenkwalder C, Chaudhuri KR, García Ruiz PJ, et al. Expert consensus group report on the use of apomorphine in the treatment of Parkinson´s disease Clinical practice recommendations. Parkinsonism Relat Dis. 2015;21:1023-30.
30. Fung VSC, Aldred J, Arroyo MP, et al. Continuous subcutaneous foslevodopa/foscarbidopa infusion for the treatment of motor fluctuations in Parkinson’s disease: Considerations for initiation and maintenance. Clin Park Relat Disord. 2024;10:100239.
Se debe destacar en primer lugar que los pacientes con EP deben ser sometidos a cirugía si está indicada. Esta aseveración se da por sentada en casos de cirugía urgente, pero también debe ser evidente en las cirugías electivas. Sin embargo, es frecuente que en diferentes ámbitos quirúrgicos se rechace a los candidatos con EP, porque pese más el temor a las posibles complicaciones que la obtención de beneficio del paciente. Es innegable que la EP es compleja y su abordaje perioperatorio debe tener en cuenta todos sus síntomas, motores y no motores, así como las posibles interacciones farmacológicas. Con una planificación adecuada y un abordaje multidisciplinar (equipos de Cirugía, Neurología, Enfermería, Nutrición y Fisioterapia) se pueden anticipar las complicaciones, prevenir la morbimortalidad nosocomial, disminuir los tiempos de ingreso y mejorar la tasa de éxito quirúrgico. El objetivo de este apartado es dar unas pautas claras para el manejo del paciente con EP antes, durante y después de la cirugía31.
Si el paciente estuviera tomando un IMAO-B como selegilina, rasagilina o safinamida, este se debe suspender 2-3 semanas antes de la intervención por su posible interacción con algunos opioides31 (NE-IV).
Si el paciente está tomando un anticolinérgico (trihexifenidilo), también se debe suspender por su posible interacción con otros fármacos y precipitación de un síndrome confusional31 (NE-IV).
Si el paciente presenta sialorrea, se puede infiltrar con toxina botulínica en las glándulas parótidas para disminuir la salivación y así reducir el riesgo de broncoaspiración perioperatoria32 (NE-IV).
Desde el momento del ingreso se debe continuar con la medicación habitual (salvo el IMAO suspendido) según el régimen que el paciente tomaba en Esta directriz, aparentemente tan sencilla, es muy difícil de cumplir en el ambiente hospitalario. En los estudios de manejo prequirúrgico, los errores de tratamiento reportados oscilan entre el 30% y el 71%33 (NE-I). Los errores más frecuentes son de prescripción (por ejemplo, cambio de horario), el retraso de las tomas e incluso la omisión de alguna. Se debe concienciar a todo el equipo médico y de enfermería de la importancia del seguimiento estricto del tratamiento pautado, respetando su horario, ya que se ha demostrado que los errores de tratamiento prolongan de forma significativa la estancia hospitalaria33. Por tanto, la recomendación es realizar todas las tomas de medicación, hasta las 6 horas habituales de ayunas antes de la cirugía. Si el paciente está en tratamiento con LD (vida media de 1,5 horas), dependiendo de la gravedad de su enfermedad se pueden administrar 100-250 mg de LD (con una cucharada de agua o gelatina) con la premedicación 1 hora antes de la cirugía (NE-IV).
Si el paciente tiene una enfermedad muy avanzada y requiere tomas de LD frecuentes o va a estar a dieta absoluta durante más de 12-24 horas, se deben considerar tratamientos alternativos a la vía No solo porque el cese abrupto del tratamiento antiparkinsoniano durante más de 24 horas puede ser potencialmente mortal, ya que se puede desencadenar un síndrome de parkinsonismo-hiperpirexia, como se ha descrito previamente (sus síntomas principales son fiebre, disautonomía, alteración del nivel de consciencia o confusión, acinesia, rigidez y elevación de CK), sino para permitir la mejor movilidad y comodidad del paciente. Si el paciente tiene una enfermedad leve-moderada, la mejor opción es la rotigotina, un agonista dopaminérgico que tiene un formato de parche transdérmico de 24 horas de duración. Se debe calcular la dosis que precisa el paciente según las equivalencias conocidas33 (ver calculadora de equivalentes de LD en Pág. 375). Se debe vigilar la aparición de efectos secundarios frecuentes como el eccema cutáneo en la región del parche, náuseas y somnolencia33 (NE-IV).
Si el paciente tiene una enfermedad más avanzada, requiere altas dosis de LD (más de 1000 mg) o va a precisar dieta absoluta de forma prolongada, se puede considerar un tratamiento alternativo con apomorfina en perfusión continua. Este agonista dopaminérgico tiene un perfil de actividad similar a la LD (actúa sobre los receptores D1/D2) y puede pautarse en forma de perfusión subcutánea calculando las dosis (ver calculadora de equivalentes de LD en Pág. 375). Este cambio se debe prever con tiempo, ya que la apomorfina puede causar náuseas y vómitos que son evitables con premedicación (domperidona a dosis de 10 mg en desayuno, comida y cena desde 3 días antes). Se debe hacer el cambio de la medicación oral a la perfusión subcutánea la semana previa a la cirugía para optimizar el control de los síntomas y vigilar la posible aparición de hipotensión, somnolencia o ataques de sueño33 (NE-IV).
El propofol es el fármaco de elección. Puede mejorar el parkinsonismo, pero también inducir discinesias.
Se debe evitar la ketamina porque puede provocar una respuesta simpática Se debe evitar el tiopental porque puede reducir la liberación de dopamina a nivel estriatal.
Se debe evitar el halotano porque puede interaccionar con la LD y aumentar la sensibilidad cardiaca a las catecolaminas.
Los relajantes musculares no despolarizantes son seguros y el rocuronio es de elección.
Se deben evitar fármacos con efectos serotoninérgicos en pacientes que toman IMAO (si no se han podido suspender en las semanas previas), ya que la interacción puede producir agitación, rigidez, diaforesis, hiperpirexia e incluso un síndrome serotoninérgico y de manera infrecuente la Algunos opioides con actividad inhibitoria sobre la recaptación de serotonina son la meperidina y en menor medida el tramadol, la metadona, el dextrometorfano y el propoxifeno. Los opioides más seguros son la morfina a dosis bajas, la codeína, la oxicodona y la buprenorfina. A su vez, los IMAO inhiben el metabolismo hepático de los narcóticos, por lo cual se debe ajustar la dosis.
En el manejo del dolor, los opioides, y en particular el fentanilo, pueden empeorar la Si el origen del dolor es la rigidez parkinsoniana el mejor tratamiento será el propio de la enfermedad.
Los neurolépticos como las fenotiacinas, las butirofenonas y la metoclopramida pueden empeorar la EP y por tanto no deben emplearse nunca en estos pacientes.
La indicación de intubación es más frecuente en pacientes con EP que en la población de edad similar porque la disfagia y la bradicinesia de la musculatura respiratoria les hace especialmente vulnerables a sufrir neumonías por broncoaspiración.
Si el paciente fuera portador de un neuroestimulador, es recomendable apagar el estimulador durante el procedimiento quirúrgico porque puede interferir con el bisturí eléctrico. Si se debe electrocauterizar, se recomienda la cauterización bipolar.
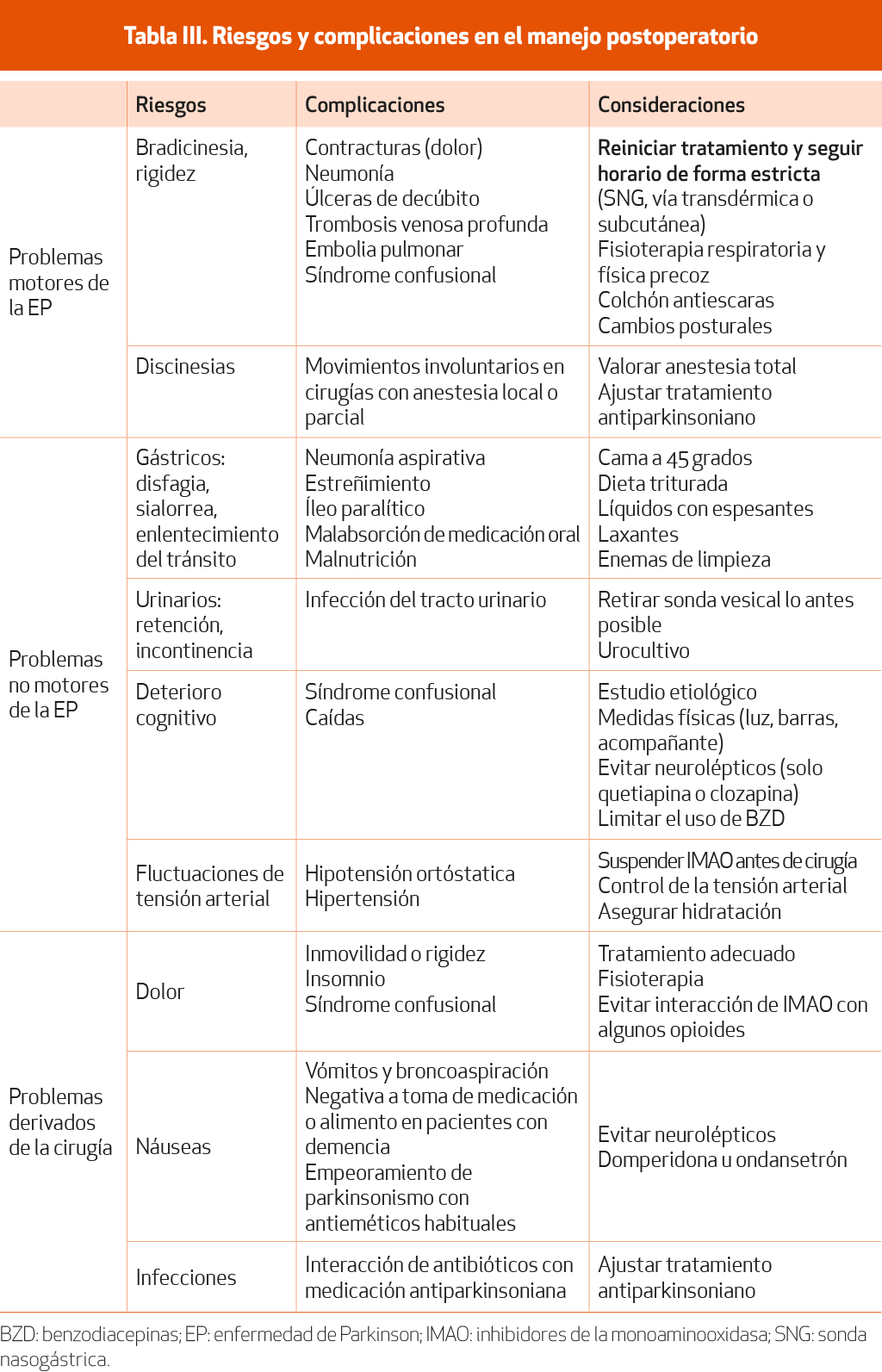
La mayoría de las complicaciones perioperatorias de los pacientes con EP ocurren durante el posoperatorio. Por su enfermedad basal, estos pacientes tienen mayor riesgo de presentar alteraciones motoras, disautonómicas y cognitivas. Los problemas posquirúrgicos más frecuentes son las infecciones (del tracto urinario, de la herida quirúrgica o pulmonares), el síndrome confusional, la hipotensión, las caídas y el mal control de la EP. Se deben anticipar estas complicaciones y considerar aspectos particulares del enfermo parkinsoniano para su mejor manejo (Tabla III)32 (NE-IV).
Como se ha señalado con anterioridad, es prioritario que el paciente reciba su medicación antiparkinsoniana lo antes posible tras la cirugía. Para ello, se debe evaluar periódicamente su nivel de consciencia y su capacidad de ingesta oral. Si la vía oral no es posible en las primeras horas del posoperatorio, se debe valorar el poner una sonda nasogástrica para medicación o administrar la medicación antiparkinsoniana por vía transdérmica o subcutánea31 (NE-IV).
Se debe comenzar la fisioterapia respiratoria de forma precoz para evitar infecciones respiratorias, la inmovilidad, las contracturas, las trombosis y el estreñimiento31 (NE-IV).
El síndrome confusional es frecuente, incluso en pacientes sin deterioro cognitivo previo, y puede ocurrir de forma diferida tras 36 horas de la cirugía en hasta un 70% de los pacientes33. Generalmente se trata de un cuadro de alteración del ritmo sueño-vigilia, acompañado de alucinaciones o delirio y agitación. Como en todo paciente, se debe hacer un estudio para detectar la posible causa (alteraciones metabólicas, infecciones intercurrentes o interacciones medicamentosas). En su manejo son importantes las medidas no farmacológicas (entrada de luz natural, reloj visible, acompañamiento de familiares) y se deben evitar los neurolépticos típicos (haloperidol) y la mayoría de los atípicos (risperidona, olanzapina, aripriprazol, ziprasidona). El uso de estos fármacos empeora el pronóstico de estos pacientes30. En la práctica general, el neuroléptico más utilizado es la quetiapina, porque tiene poco efecto sobre el receptor D2 y por tanto no agrava el parkinsonismo y no precisa monitorización. Sin embargo, si pese a dosis altas (200 mg) no se controla el cuadro confusional, se debe recurrir a la clozapina, ya que es el único fármaco que verdaderamente ha demostrado eficacia en el control de los síntomas psicóticos34 (NE-IV). La agranulocitosis como posible efecto secundario es muy poco frecuente (0,38%) y en el contexto hospitalario la realización de hemogramas seriados semanales las primeras 18 semanas y mensuales después es relativamente En el uso de ambos fármacos se deben tener en cuenta sus posibles efectos secundarios, fundamentalmente la hipotensión y la somnolencia. Se pueden utilizar benzodiacepinas para el insomnio a dosis bajas teniendo en cuenta la posibilidad de depresión respiratoria secundaria31 (NE-IV).

30. Fung VSC, Aldred J, Arroyo MP, et al. Continuous subcutaneous foslevodopa/foscarbidopa infusion for the treatment of motor fluctuations in Parkinson’s disease: Considerations for initiation and maintenance. Clin Park Relat Disord. 2024;10:100239.
31. Mariscal A, Medrano IH, Alonso-Cánovas A, et al. Manejo perioperatorio de la enfermedad de Parkinson. Neurologia. 2012;27:46-50.
32. Katus L, Shtilbans A. Perioperative management of patients with Parkinson’s disease. Am J Med. 2014;127:275-80.
33. Gerlach OH, Winogrodzka A, Weber WE. Clinical problems in the hospitalized Parkinson’s disease patient: systematic review. Mov Disord. 2011;26:197-208.
34. Seppi K, Weintraub D, Coelho M, et al. The Movement Disorder Society Evidence-Based Medicine Review Update: Treatments for the non-motor symptoms of Parkinson’s disease. Mov Disord. 2011;26 Suppl 3:S42-80.


