


Los síntomas no motores de la EP son una parte importante de su clínica, y llegan a ser tan incapacitantes como los signos motores. Se incluyen, entre otros, los síntomas neuropsiquiátricos como depresión, apatía, ansiedad, trastorno del control de impulsos, síntomas psicóticos, déficits cognitivos y demencia, y también las alteraciones del sueño, hiposmia, trastornos autonómicos y sensitivos. Afectan a la calidad de vida del paciente y de sus cuidadores, incluso cuando el control motor es bueno.
Los trastornos del sueño incluyen la somnolencia diurna excesiva (SDE), las alteraciones del sueño nocturno con el insomnio y el trastorno de conducta durante el sueño REM (TCSR) (Tabla I). Estos trastornos del sueño son especialmente frecuentes en la EP avanzada, probablemente debido a la combinación de diversos factores, como por ejemplo el incremento en el tratamiento dopaminérgico y el uso de otros fármacos, el empeoramiento de los síntomas motores de la enfermedad y, quizás, la neurodegeneración de las áreas encefálicas que regulan la vigilia y el sueño. Una excepción sería el TCSR, que con frecuencia antecede a los síntomas motores de la enfermedad o puede estar ya presente en el momento del diagnóstico de la EP.
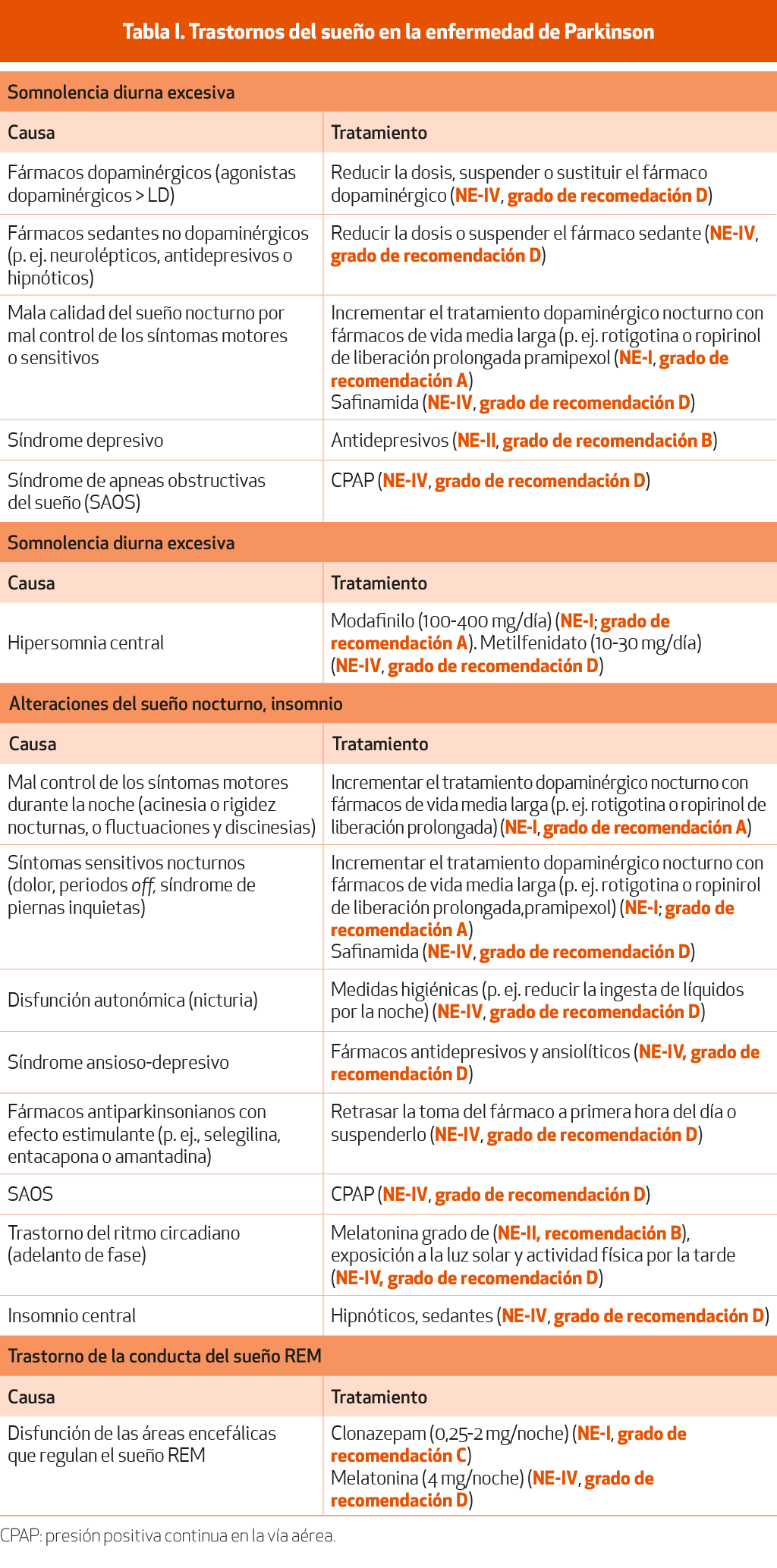
Puede afectar a entre un 12 y un 84% de los pacientes. En un 0,5-20% de ellos, la SDE se puede presentar en la forma de episodios súbitos de sueño irresistible o ataques de sueño1.
Las causas de somnolencia en la EP pueden ser diversas. La SDE puede ser un efecto secundario de los fármacos dopaminérgicos, incluyendo la LD, pero en especial de todos los agonistas dopaminérgicos. En algunos pacientes la relación entre la SDE y los fármacos dopaminérgicos es clara, pues la somnolencia aparece al introducir o incrementar la dosis del fármaco. Otra causa de SDE en la EP puede ser la administración como consecuencia de comorbilidades neuropsiquiátricas de otros fármacos con efecto sedante, como por ejemplo neurolépticos, antidepresivos o hipnóticos. Un insomnio y un sueño nocturno insuficiente por los problemas asociados a un mal control de los síntomas motores o sensitivos por la noche también pueden dar lugar a SDE. La SDE en la EP también puede estar en relación con la presencia de una depresión, otro síntoma no motor frecuente en la EP. Si bien el SAOS no ocurre con más frecuencia en la EP que en la población general, un SAOS coincidental también puede ser la causa de una SDE en un paciente con EP. Finalmente, la SDE puede ser un síntoma propio de la EP, causado por la degeneración de las estructuras encefálicas que promueven la vigilia, incluyendo el hipotálamo y estructuras del tronco como el locus coeruleus, el área dopaminérgica ventral-tegmental mesencefálica, el núcleo pedunculopontino o los núcleos del rafe. Así pues, el tratamiento de la somnolencia en la EP dependerá de la causa, y es importante considerar que en un mismo paciente pueden coexistir varias de ellas.
En cuanto al tratamiento, el primer paso será alertar al paciente sobre la peligrosidad de conducir o realizar otras actividades de riesgo hasta que la somnolencia no se resuelva. El siguiente paso será evaluar si la somnolencia puede tener una causa farmacológica. Si está en relación con algún fármaco dopaminérgico, se puede considerar reducir la dosis o incluso suspender el fármaco, o bien cambiar a otro medicamento dopaminérgico2,3 (NE-IV), si bien todo ello puede comportar un empeoramiento de los síntomas motores. Si existe alguna medicación no dopaminérgica sedante, se debe valorar la posibilidad de suprimirla o disminuir la dosis4 (NE-IV). Si no existe una causa farmacológica, se deberá considerar si hay un mal control de los síntomas motores o sensitivos nocturnos que puedan causar un sueño nocturno insuficiente, y si es preciso optimizar el tratamiento antiparkinsoniano por la noche evitando dosis elevadas antes de dormir y usar formulaciones retard, aunque hay resultados contradictorios5 (NE-IV). Si existe una depresión, se deberá tratar adecuadamente6 (NE-I). Por otro lado, se debe preguntar, sobre todo al cónyuge o al cuidador del paciente, por la presencia de ronquidos y apneas, y si se sospecha un SAOS, realizar un polisomnograma. Si se confirma un índice elevado de apneas obstructivas, estará indicado realizar una prueba terapéutica con presión positiva continua en la vía aérea (CPAP)7 (NE-IV). Cuando no exista ninguna causa evidente y se considere que la SDE puede ser un síntoma propio de la EP, se puede valorar realizar una prueba con fármacos estimulantes como el modafinilo (entre 100 y 400 mg al día) (existen tres estudios con NE-I: en dos se sugiere que es un tratamiento eficaz para la somnolencia en la EP y en el otro que es ineficaz)8-10.
Hasta un 55% de los pacientes con EP presentan sueño fragmentado y despertar precoz, que son los tipos de insomnio más frecuentes11. El insomnio en la EP también puede tener diferentes causas, pudiendo estar en relación con los síntomas motores y no motores de la enfermedad u otros factores. Un mal control de los síntomas motores durante la noche, como la presencia de acinesia o rigidez, así como de fluctuaciones o discinesias, podría despertar al paciente y causar un sueño fragmentado. Por otro lado, la existencia de síntomas sensitivos nocturnos, como dolor por la rigidez, por la imposibilidad de cambiar de postura, o dolor en relación con los periodos off, o bien la presencia de un síndrome de piernas inquietas, también pueden fragmentar el sueño. Una disfunción autonómica como la nicturia, la depresión o la ansiedad son otras causas de una mala calidad y fragmentación del sueño. Además, fármacos antiparkinsonianos como la selegilina, la amantadina o la entacapona pueden alertar excesivamente al paciente durante la noche12 (NE-IV).
Otros fármacos también utilizados en el tratamiento de estos pacientes, como anticolinesterásicos, ISRS o venlafaxina también pueden aumentar el insomnio12. Por otro lado, en los pacientes con EP pueden coexistir otros trastornos del sueño que son frecuentes en las personas de edad avanzada y que pueden fragmentar el sueño y causar un despertar precoz, como serían el SAOS o un trastorno del ritmo circadiano en la forma de un adelanto de fase. Finalmente, el insomnio también podría ser un síntoma propio de la EP, causado por la degeneración de las estructuras encefálicas que regulan la vigilia y el sueño. Establecer cuál de todos estos factores es el responsable de la alteración del sueño nocturno en un paciente con EP puede ser difícil.
Medidas específicas (dependerá de las causas) para tratar el insomnio en la EP incluyen la supresión de la selegilina o la amantadina cuando se administran por la tarde o por la noche13 (NE-II) o, cuando hay síntomas motores o sensitivos nocturnos significativos, optimizar el tratamiento antiparkinsoniano con la administración de agentes dopaminérgicos de vida media larga o de liberación sostenida como la rotigotina o el ropirinol de liberación prologada, que pueden ser útiles para evitar los periodos off durante la noche14-15 (NE-I). Si el paciente presenta un síndrome de piernas inquietas asociado, el uso de agentes dopaminérgicos de larga duración o, en su caso, fármacos como la gabapentina podría ser de utilidad16 (NE-II). En el caso de existir una depresión o un síndrome ansioso, deben ser tratados de forma correcta17 (NE-IV).
Otros fármacos, como la safinamida, han mostrado un efecto beneficioso en el sueño nocturno y sobre la somnolencia diurna18-20 (NE-IV).
La estimulación cerebral profunda del núcleo subtalámico y los tratamientos de perfusión como la apomorfina subcutánea y LD/carbidopa intestinal mejoran la calidad del sueño, aunque no están indicadas con este objetivo21 (NE-III).
Caracterizado por la presencia de pesadillas y conductas violentas durante el sueño REM, está presente entre un 23 y un 58% de los pacientes con EP22. La fisiopatología de esta parasomnia en la EP está en relación con la degeneración de las áreas del tronco encefálico que modulan el sueño REM. El clonazepam es el fármaco más utilizado en dosis única de 0,5 a 2 mg antes de acostarse, con una alta tasa de respuesta en distintas series23 (NE-I).
Cuando el clonazepam no es eficaz, una posible alternativa sería la melatonina 4 mg 2 horas antes de acostarse24 (NE-IV). Siempre es importante considerar la posibilidad de otro trastorno de sueño diferente al TCSR como la causa de las conductas anormales durante el sueño, como por ejemplo un SAOS, sobre todo si el clonazepam se muestra ineficaz y agrava las conductas anormales, y en especial si hay antecedentes de ronquidos y apneas observadas. En tal caso estaría indicado realizar un videopolisomnograma para confirmar el diagnóstico de un TCSR o descartar un SAOS, que por otro lado podría ser agravado por el tratamiento con clonazepam.
1. Ondo WG, Dat Vuong K, Khan H, et al. Daytime sleepiness and other sleep disorders in Parkinson’s disease. Neurology. 2001;57:1392-1396.
2. Razmy A, Lang AE, Shapiro CM. Predictors of impaired daytime sleep and wakefulness in patients with Parkinson disease treated with older (ergot) vs newer (nonergot) dopamine agonists. Arch Neurol. 2004;61:97-102.
3. Pal S, Bhattacharya KF, Agapito C, et al. A study of excessive daytime sleepiness and its clinical significance in three groups of Parkinson’s disease patients taking pramipexole, cabergoline and levodopa mono and combination therapy. J Neural Transm 2001;108:71–77.
4. Martins Rodrigues T, Castro Caldas A, Ferreira JJ. Pharmacological interventions for daytime sleepiness and sleep disorders in Parkinson’s disease: systematic review and meta-analysis. Parkinsonism Relat Disord. 2016;27:25-34.
5. Chahine LM, Daley J, Horn S, et al. Association between dopaminergic medications and nocturnal sleep in early-stage Parkinson’s disease. Parkinsonism Relat Disord. 2013 Oct;19(10):859-63.
6. Menza M, Dobkin RD, Marín H, et al. A controlled trial of antidepressants in patients with Parkinson disease and depression. Neurology. 2009 Mar 10;72(10):886-92.
7. Neikrug AB, Liu L, Avanzino JA, et al. Continuous positive airway pressure improves sleep and daytime sleepiness in patients with Parkinson disease and sleep apnea. Sleep. 2014;37(1):177-185.
8. Adler CH, Caviness JN, Hentz JG, et al. Randomized trial of modafinil for treating subjective daytime sleepiness in patients with Parkinson’s disease. Mov Disord. 2003;18:287-93.
9. Högl B, Saletu M, Brandauer E, et al. Modafinil for the treatment of daytime sleepiness in Parkinson’s disease: a double-blind, randomized, crossover, placebo-controlled polygraphic trial. Sleep. 2002;25:905-9.
10. Ondo WG, Fayle R, Atassi F, et al. Modafinil for daytime somnolence in Parkinson’s disease: double blind, placebo controlled parallel trial. J Neurol Neurosurg Psychiatry. 2005;76:1636-9.
11. Dodet P, Houot M, Leu-Semenescu S, et al. Sleep disorders in Parkinson’s disease, an early and multiple problem. NPJ Parkinsons Dis. 2024 Feb 29;10(1):46.
12. Taximaimaiti R, Luo X, Wang XP. Pharmacological and non-pharmacological treatments of sleep disorders in Parkinson’s disease. Curr Neuropharmacol. 2021;19(12):2233-49.
13. Fahn S, Isgreen WP. Long-term evaluation of amantadine and levodopa combination in parkinsonism by double-blind corssover analyses. Neurology. 1975 Aug;25(8):695-700.
14. Pahwa R, Stacy MA, Factor SA, et al. Ropinirole 24-hour prolonged release: randomized, controlled study in advanced Parkinson disease. Neurology. 2007;68:1108-15.
15. Trenkwalder C, Kies B, Rudzinska M, et al. Rotigotine effects on early morning motor function and sleep in Parkinson’s disease: a double-blind, randomized, placebo-controlled study (RECOVER). Mov Disord. 2011;26:90-9.
16. García-Borreguero D, Larrosa O, de la Llave Y, et al. Treatment of restless legs syndrome with gabapentin: a double-blind, cross-over study. Neurology. 2002 Nov 26;59(10):1573-9.
17. Kay DB, Tanner JJ, Bowers D. Sleep disturbances and depression severity in patients with Parkinson’s disease. Brain Behav. 2018 Jun;8(6):e00967.
18. Santos García D, Cabo López I, Labandeira Guerra C, et al. Safinamide improves sleep and daytime sleepiness in Parkinson’s disease: results fromthe SAFINONMOTOR study. Neurol Sci. 2022;43(4):2537-44.
19. Bianchi MLE, Riboldazzi G, Mauri M, et al. Efficacy of safinamide on non-motor symptoms in a cohort of patients affected by idiopathic Parkinson’s disease. Neurol Sci. 2019;40(2):275-279.
20. Liguori C, Stefani A, Runi R, et al. Safinamide effect on sleep disturbances and daytime sleepiness in motor fluctuating Parkinson’s disease patients: A validated questionnaires- controlled study. Park Relat Disord. 2018;57:80-81.
21. Zibetti M, Romagnolo A, Merola A, et al. A polysomnographic study in parkinsonian patients treated with intestinal levodopa infusion. J Neurol. 2017 Jun;264(6):1085-1090.
22. Zhang J, Xu CY, Liu J. (2017). Meta-analysis on the prevalence of REM sleep behavior disorder symptoms in Parkinson’s disease. BMC Neurol. 2017;17(1):23.
23. Shin C, Park H, Lee WW, et al. Clonazepam for probable REM sleep behavior disorder in Parkinson’s disease: A randomized placebo-controlled trial. J Neurol Sci. 2019 Jun 15;401:81-86.
24. Byun JI, Shin YY, Seong YA, et al. Comparative efficacy of prolonged-release melatonin versus clonazepam for isolated rapid eye movement sleep behavior disorder. Sleep Breath. 2023 Mar;27(1):309-318.
Los trastornos afectivos son frecuentes desde las fases iniciales de la EP. Dentro de ellos debe diferenciarse la presencia de depresión, ansiedad y apatía. Si bien coexisten con frecuencia en un mismo paciente, su diferenciación implica el uso de fármacos específicos para cada problema. El desarrollo de apatía sin depresión, además, se asocia con un mayor riesgo de progresión hacia la demencia. Debe tenerse en cuenta que los trastornos de ansiedad representan el síntoma afectivo más frecuente, y se manifiestan desde fases muy iniciales de la enfermedad25,26 (NE-IV). La depresión y la ansiedad también son frecuentes en los periodos off, que ocurren en el 35% de los pacientes como parte de fluctuaciones no motoras. Las fluctuaciones no motoras pueden ser psiquiátricas, cognitivas, autonómicos o sensoriales, y pueden variar durante el transcurso del día. Distinguir los síntomas afectivos persistentes de los que ocurren en el contexto de periodos off no siempre es sencillo y algunos pacientes pueden tener ambos26 (NE-IV).
Se basa fundamentalmente en una entrevista adecuada, que reconozca los síntomas propios de cada problema. Los pacientes con trastorno depresivo manifiestan síntomas apáticos, mientras que aquellos con apatía aislada o predominante (15-25%) solo manifiestan síntomas de desmotivación. Ciertos síntomas como la anhedonia, la anergia y el enlentecimiento psicomotor son comunes a la apatía y la depresión27 (NE-IV). La ansiedad se manifiesta mediante trastorno por ansiedad generalizada, crisis de pánico e irritabilidad, fobia social o agorafobia. Hasta en el 80% coexiste con la depresión.
Una dificultad añadida en el diagnóstico de la depresión en la EP es la limitación para utilizar los criterios diagnósticos de depresión del Manual diagnóstico y estadístico de los trastornos mentales (Diagnostic and Statistical Manual of Mental Disorders [DSM]), dado el solapamiento entre síntomas físicos y cognitivos presentes tanto en la depresión primaria como en la EP28 (NE-IV). Como alternativa, varios estudios han intentado describir las notas de corte de escalas de depresión aceptadas para su uso en la EP. Teniendo en cuenta la limitación que supone que aún no se haya diseñado ninguna escala de depresión específica para la EP, el grupo de trabajo de la MDS Task Force para el diagnóstico de depresión en la EP determinó qué escalas son las más útiles en esta enfermedad29 (NE-IV). Entre las escalas aconsejadas destacan la Escala de Depresión de Montgomery-Asberg (Montgomery-Asberg Depression Rating Scale [MADRS]) y la Escala de Depresión Geriátrica (Geriatric Depression Scale [GDS]), útiles tanto para el cribado como para el seguimiento de la clínica depresiva; la subescala para la depresión de la Escala de Ansiedad y Depresión Hospitalaria (Hospital Anxiety and Depression Scale [HADS-D]) es útil para el cribado de la depresión. Las notas de corte para el diagnóstico de depresión con estas tres escalas son: MADRS ≥ 15, GDS-15 ≥ 6 y HADS-D ≥ 11. La Escala de Depresión de Hamilton (Hamilton Rating Scale for Depression [HAM-D]) y el Inventario de Depresión de Beck (Beck Depression Inventory [BDI]) son escalas muy bien validadas en la depresión primaria, pero incluyen muchos ítems somáticos que se solapan con la EP 29. Aun así, se han establecido notas de corte para el cribado de la depresión en poblaciones de EP (HAM-D ≥ 16; BDI ≥ 14), y varios estudios las han utilizado también para el seguimiento y la respuesta terapéutica 30.
Para el diagnóstico de la apatía, tres escalas han mostrado una buena validez de constructo y han sido validadas para su uso en la EP31 (NE-IV). La Escala de Apatía (Apathy Scale [AS]), con nota de corte ≥ 14, y la Escala de Apatía de Lille (Lille Apathy Rating Scale [LARS]), con nota de corte ≥ 17, son útiles para el cribado, seguimiento y respuesta al tratamiento, mientras que el ítem 7 del Inventario Neuropsiquiátrico (Neuropsychiatric Inventory [NPI]), con nota de corte ≥ 4, puede ser útil para el cribado, pero no para el seguimiento ni la valoración de cambio del síntoma en el tiempo.
Hasta el momento actual, la mayoría de los estudios que han evaluado la ansiedad en la EP han utilizado la subescala para la ansiedad de la HADS (HADS-A), la Escala de Ansiedad de Hamilton (Hamilton Anxiety Rating Scale [HAM-A]) o el Inventario de Ansiedad de Beck (Beck Anxiety Inventory [BAI]). Para estas escalas, sin embargo, no hay notas de corte para la EP y tampoco se han evaluado todas sus propiedades psicométricas en esta enfermedad32. Mejor comportamiento en la EP parece tener el Inventario de Ansiedad Geriátrica (Geriatric Anxiety Inventory [GAI]), y recientemente se ha diseñado una escala específica, la Escala de Ansiedad en Parkinson (Parkinson’s Anxiety Scale [PAS]), que parece tener mayor validez de constructo y presenta buenas propiedades psicométricas33 (NE-IV).
Múltiples estudios abiertos, cruzados o doble ciego comparados con placebo han intentado comprobar cuáles son los mejores fármacos para el tratamiento de la depresión en la EP. El solapamiento con síntomas propios de la enfermedad, los factores psicosociales que acompañan a un paciente con una enfermedad degenerativa crónica y el desarrollo de depresión en diferentes momentos evolutivos de la EP dificultan dar una respuesta unívoca a esta pregunta. Basándonos en la evidencia aportada por ensayos a doble ciego, aleatorizados y comparados con placebo, así como en revisiones, guías y metaanálisis recientes26,34-36 (NE-I), los fármacos antidepresivos con mayor respaldo de la literatura científica son citalopram 10-20 mg/día, paroxetina 10-20 mg/día, venlafaxina 75-150 mg/día, nortriptilina 50 mg/día y desipramina 50-75 mg/día (NE-I). En la práctica clínica habitual, los inhibidores selectivos de la recaptación de serotonina (sertralina 50-100 mg/día, escitalopram 10-15 mg/día) y los inhibidores duales de la recaptación de serotonina y noradrenalina (duloxetina 60 mg/día) y venlafaxina (75-150 mg) son los fármacos antidepresivos más utilizados (NE-I)36.
Fármacos recientes como la vortioxetina (5-20 mg) han demostrado su utilidad en estudios prospectivos abiertos (NE-IV).
Un ensayo doble ciego y controlado con placebo también demostró la eficacia del pramipexol (2,1 mg/día) para el tratamiento de la depresión en la EP 37 (NE-I).
Los IMAO-B, como la safinamida, también han mostrado beneficios sobre los síntomas depresivos en estudios recientes38-39 (NE-IV).
Tratamientos no farmacológicos como la terapia cognitiva conductual, la estimulación magnética transcraneal sobre la corteza prefrontal dorsolateral izquierda o la terapia electroconvulsiva han demostrado su eficacia en pacientes con enfermedad de Parkinson40-43 (NE-I).
Menor evidencia existe para el tratamiento de la apatía. Este síntoma depende de diferentes sustratos neuroquímicos (déficits colinérgico y dopaminérgico). En pacientes con mayor deterioro cognitivo, el déficit colinérgico parece de mayor relevancia, mientras que, en pacientes sin demencia, el déficit dopaminérgico a nivel del estriado ventral aparece como el factor causal más importante. Aun así, y en función de los estudios publicados, la rivastigmina a 9,5 mg/día se ha mostrado igualmente eficaz para la mejoría de la clínica apática en pacientes con y sin demencia44 (NE-I) . En un estudio a doble ciego controlado con placebo, el uso de piribedil ha mostrado mejorías estadísticamente significativas45 (NE-II), y en series abiertas de pacientes el uso de pramipexol, rotigotina y safinamida también ha mostrado mejorías en la puntuación de las escalas de apatía46,47 (NE-IV).
No existen estudios específicos para el tratamiento de la ansiedad en la EP y las opciones terapéuticas aconsejadas se basan en la eficacia demostrada de las benzodiacepinas en pacientes de edad avanzada con ansiedad primaria o asociada a otras enfermedades degenerativas48. Se considera preferible el uso de benzodiacepinas de vida corta, como el alprazolam, y benzodiacepinas que se metabolicen más fácilmente, como el lorazepam48,49 (NE-III). Para el manejo a largo plazo de la ansiedad generalizada es aconsejable el uso de antidepresivos ISRS e ISRNS49 (NE-IV). Sin duda, se requieren estudios bien dirigidos y diseñados para determinar el tratamiento de la ansiedad en la EP.
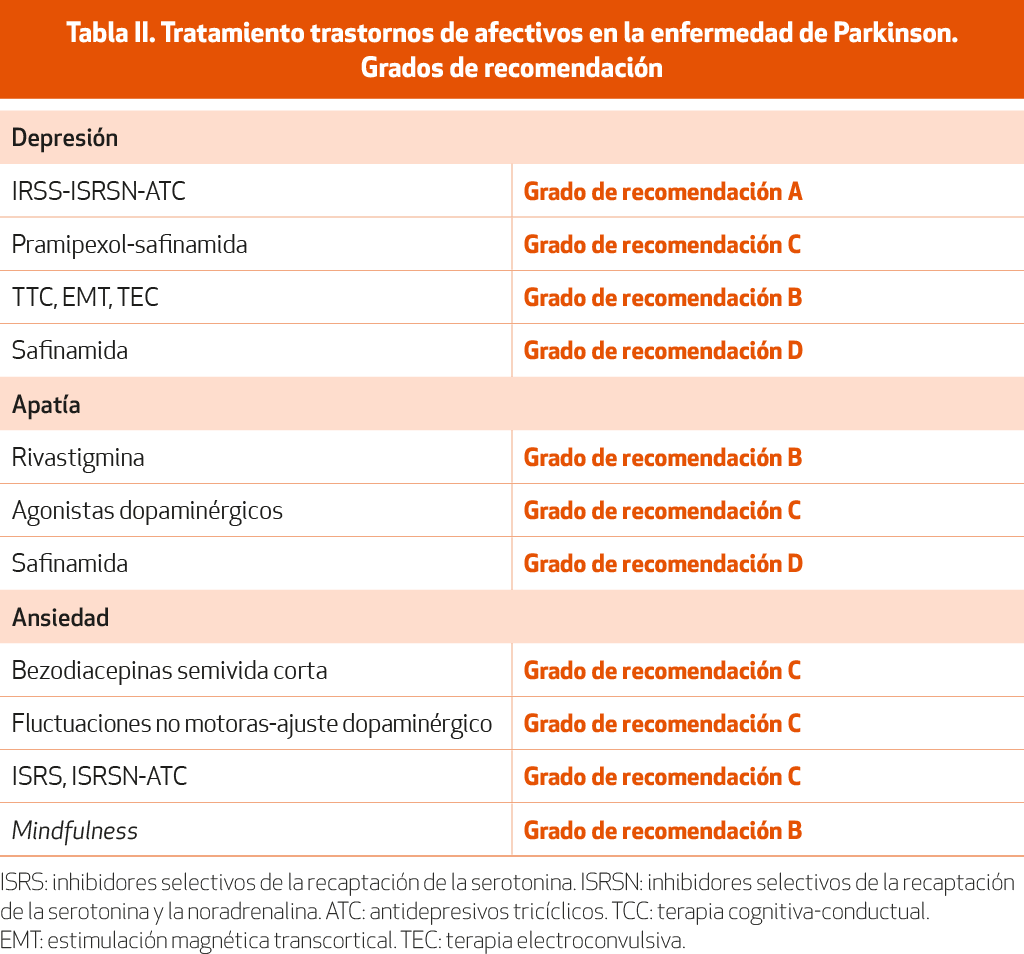
Los síntomas de ansiedad, si aparecen como fluctuaciones no motoras, se manejarán primero con ajustes en los tratamientos dopaminérgicos26,34,49 (NE-III). Se ha demostrado recientemente que el uso de la safinamida también podría tener un efecto en los trastornos del ánimo y, entre ellos, en la apatía en los pacientes con EP. El beneficio se obtenía tanto con dosis de 50 mg como con 100 mg19,47 (NE-IV).
Otros tratamientos no farmacológicos, como el mindfulness, pueden ser útiles en tratar la ansiedad y depresión en la enfermedad de Parkinson50 (NE-I) (ver capítulo 15 sobre terapias alternativas en la enfermedad de Parkinson (pag. 345).
19. Bianchi MLE, Riboldazzi G, Mauri M, et al. Efficacy of safinamide on non-motor symptoms in a cohort of patients affected by idiopathic Parkinson’s disease. Neurol Sci. 2019;40(2):275-279.
25. Aarsland D, Marsh L, Schrag A. Neuropsychiatric symptoms in Parkinson’s disease. Mov Disord. 2009;24:2175-86.
26. Weintraub D, Aarsland D, Chaudhuri KR, et al. The neuropsychiatry of Parkinson’s disease: advances and challenges. Lancet Neurol. 2022;21(1):89-102.
27. Pagonabarraga J, Kulisevsky J, Strafella AP, et al. Apathy in Parkinson’s disease: clinical features, neural substrates, diagnosis, and treatment. Lancet Neurol. 2015;14:51831.
28. Marsh L, McDonald WM, Cummings J, et al.; NINDS/NIMH Work Group on Depression and Parkinson’s Disease. Provisional diagnostic criteria for depression in Parkinson’s disease: report of an NINDS/NIMH Work Group. Mov Disord. 2006;21(2):14858.
29. Schrag A, Barone P, Brown RG, et al. Depression rating scales in Parkinson’s disease: critique and recommendations. Mov Disord. 2007;22(8):1077-92.
30. Leentjens AF, Verhey FR, Lousberg R, et al. The validity of the Hamilton and Montgomery- Asberg depression rating scales as screening and diagnostic tools for depression in Parkinson’s disease. Int J Geriatr Psychiatry. 2000 Jul;15(7):644-9.
31. Leentjens AF, Dujardin K, Marsh L, et al. Apathy and anhedonia rating scales in Parkinson’s disease: critique and recommendations. Mov Disord. 2008;23:2004-14.
32. Leentjens AF, Dujardin K, Marsh L, et al. Anxiety rating scales in Parkinson’s disease: a validation study of the Hamilton anxiety rating scale, the Beck anxiety inventory, and the hospital anxiety and depression scale. Mov Disord. 2011 Feb 15;26(3):407-15.
33. Dissanayaka NN, Torbey E, Pachana NA. Anxiety rating scales in Parkinson’s disease: a critical review updating recent literature. Int Psychogeriatr. 2015;27:1777-84.
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
36. Mills KA, Greene MC, Dezube R, et al. Efficacy and tolerability of antidepressants in Parkinson’s disease: a systematic review and network meta-analysis. Int J Geriatr Psychiatry. 2018;33(4):642-51.
37. Barone P, Poewe W, Albrecht S, et al. Pramipexole for the treatment of depressive symptoms in patients with Parkinson’s disease: a randomised, double-blind, placebo- controlled trial. Lancet Neurol. 2010;9:573-80.
38. De Masi C, Liguori C, Spanetta M, et al. Non-motor symptoms burden in motor-fluctuating patients with Parkinson’s disease may be alleviated by safinamide: the VALE-SAFI study. J Neural Transm (Vienna). 2022;129(11):1331-1338.
39. Stocchi F, Antonini A, Berg D, et al. Safinamide in the treatment pathway of Parkinson’s Disease: a European Delphi Consensus. NPJ Parkinsons Dis. 2022;8(1):17.
40. Dobkin RD, Mann SL, Gara MA, et al. Telephone-based cognitive behavioral therapy for depression in Parkinson disease: a randomized controlled trial. Neurology. 2020;94(16):e1764-e1773.
41. Dobkin RD, Mann SL, Weintraub D, et al. Innovating Parkinson’s care: a randomized controlled trial of telemedicine depression treatment. Mov Disord. 2021;36(11):2549-58.
42. Li S, Jiao R, Zhou X, et al. Motor recovery and antidepressant effects of repetitive transcranial magnetic stimulation on Parkinson disease: a PRISMA-compliant meta- analysis. Medicine (Baltimore). 2020;99(18):e19642.
43. Takamiya A, Seki M, Kudo S, et al. Electroconvulsive therapy for Parkinson’s disease: a systematic review and meta-analysis. Mov Disord. 2021;36(1):50-8.
44. Devos D, Moreau C, Maltête D, et al. Rivastigmine in apathetic but dementia and depression- free patients with Parkinson’s disease: a double-blind, placebo-controlled, randomised clinical trial. J Neurol Neurosurg Psychiatry. 2014;85(6):668-74.
45. Thobois S, Lhommée E, Klinger H, et al. Parkinsonian apathy responds to dopaminergic stimulation of D2/D3 receptors with piribedil. Brain. 2013;136(Pt 5):1568-77.
46. Mele B, Van S, Holroyd-Leduc J, et al. Diagnosis, treatment and management of apathy in Parkinson’s disease: a scoping review. BMJ Open. 2020;10(9):e037632.
47. Labandeira CM, Alonso Losada MG, Yáñez Baña R, et al. Effectiveness of Safinamide over Mood in Parkinson’s Disease Patients: Secondary Analysis of the Open-label Study SAFINONMOTOR. Adv Ther. 2021;38(10):5398-5411.
48. Baldwin DS, Anderson IM, Nutt DJ, et al. Evidence-based guidelines for the pharmacological treatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. J Psychopharmacol. 2005;6:567-96.
49. Weintraub D. Management of psychiatric disorders in Parkinson’s disease: Neurotherapeutics. 2020;17(4):1511-24.
50. Lin HW, Tam KW, Kuan YC. Mindfulness or meditation therapy for Parkinson’s disease: A systematic review and meta-analysis of randomized controlled trials. Eur J Neurol. 2023;30(8):2250-2260.
Las conductas impulsivas y compulsivas (CIC) comprenden los trastornos del control de impulsos (TCI), el trastorno por dependencia de fármacos dopaminérgicos o síndrome de desregulación dopaminérgica (SDD) y distintos trastornos compulsivos. Se trata de trastornos complejos de la conducta, caracterizados por un incremento de la impulsividad, con respuestas rápidas, repetitivas y poco planificadas ante estímulos internos y externos, desinhibidas y con poca valoración de las consecuencias negativas tanto para el propio sujeto como para los demás51 (NE-IV). Entre los trastornos compulsivos, el punding, por ejemplo, se caracteriza por conductas repetitivas y estereotipadas con detrimento de la normal actividad diaria (por ejemplo, limpiar, ordenar cosas, etc.), el hobbysmo es un punding más elaborado (como tocar un instrumento musical, escribir, etc.), el walkabout consiste en vagar sin rumbo en exceso y el hoarding es un acaparamiento excesivo que conlleva el acopio de gran número de elementos de poco o ningún valor objetivo. El SDD se caracteriza por un uso compulsivo de la medicación dopaminérgica, asemejándose a la adicción a drogas de recreo. Entre los TCI, los más frecuentemente observados en la EP son la ludopatía, la ingesta impulsiva, la compra compulsiva y la hipersexualidad, si bien se han descrito casos de piromanía y cleptomanía. Estos trastornos agravan de forma marcada el deterioro funcional de la EP y dañan la calidad de vida del paciente y de sus familiares y cuidadores.
Las CIC se caracterizan por ser una comorbilidad sorprendentemente frecuente tanto en la EP sin tratar como en controles sanos51 (NE-IV) y se observan en un 13-35% de los pacientes tratados51, aunque solo lo manifiesten espontáneamente un 12%. Su prevalencia oscila entre un 13% de los primeros estudios usando como criterio diagnóstico el DSM-IV52,53 (NE-III) y el 40% de las últimas series, cuando el criterio diagnóstico empleado es el Cuestionario para Trastornos Impulsivos-Compulsivos en la Enfermedad de Parkinson (Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease Rating Scale [QUIP-RS])54 (NE-III).
El principal factor de riesgo es el uso de agonistas dopaminérgicos. Otros factores de riesgo que contribuyen a su aparición son la vulnerabilidad psicobiológica personal (antecedentes impulsividad, ansiedad y personalidad con búsqueda de novedad), los antecedentes familiares de trastornos psiquiátricos (depresión, trastorno bipolar, adicciones), el sexo masculino, la edad de inicio precoz de la EP y una mayor duración de la enfermedad. Entre los diferentes subtipos de TCI, el juego patológico y la hipersexualidad encuentran mayor relación con el sexo masculino, y la ingesta y la compra compulsivas con el sexo femenino. Existen también factores socioculturales; en nuestro medio son más frecuentes la hipersexualidad y la ingesta compulsiva55 (NE-IV).
Aunque todavía no está aclarada su fisiopatología en la EP, están implicados los circuitos mesolímbicos, el estriado ventral y el córtex prefrontal entre otras estructuras56 (NE-IV).
No existen guías ni método establecido basado en la evidencia sobre el tratamiento y corrección de estos trastornos. Una revisión reciente sobre el manejo clínico de las CIC57 (NE-IV) resume las principales acciones que se han de considerar en estos pacientes. La mayoría de las recomendaciones que se realizan en guías están basadas en opinión de expertos o datos empíricos26,34,35 (NE-III).
Típicamente, la primera estrategia es la disminución de la dosis o retirada del agonista dopaminérgico, que suele ser una medida efectiva para solucionar el problema57-59 en un 75% de los casos aproximadamente (NE-IV). Sin embargo, en un importante número de casos, conlleva el agravamiento de los signos motores de la enfermedad y las fluctuaciones motoras, que puede ser compensado con un aumento de dosis de LD (a veces con agravamiento de discinesias) o adición de ICOMT. La asociación de IMAO-B es más controvertida, puesto que, en algunos estudios, la rasagilina se ha asociado con la presencia de TCI53 (NE-III). Otros tratamientos complejos, como la ECP o la infusión de gel intestinal de LD-carbidopa (GILC), que pueden permitir la supresión de agonistas dopaminérgicos, se han mostrado eficaces en casos concretos. Aunque, la ECP tradicionalmente se había asociado al desarrollo de CIC, un estudio reciente prospectivo a largo plazo ha demostrado que la ECP en el núcleo subtalámico bilateral reduce los CIC60 (NE-II). A pesar de ello, revisiones de expertos recientes indican que se necesita más evidencia de calidad para hacer recomendaciones respecto a la ECP en el manejo de las CIC57 (NE-IV). Recientemente, tres estudios abiertos prospectivos de 6 meses61, 3 años62 y 8 años63 de seguimiento, informan de un manejo satisfactorio de las CIC con el tratamiento de infusión de GILC (NE-III).
El segundo problema secundario a la supresión de agonistas dopaminérgicos es el síndrome de retirada de agonistas dopaminérgicos, que puede ocurrir en un 15-20% o hasta en un tercio de estos pacientes. Este síndrome consiste en depresión e incluso ideación suicida, angustia, fatiga, dolor y necesidad de tomar el agonista (craving). No existe ningún tratamiento eficaz del síndrome, no se resuelve con un aumento de dosis de LD, puede mejorar con el trascurso del tiempo o bien puede persistir y necesitar la reintroducción del agonista, aunque a dosis mínima o su retirada más gradual64 (NE-IV).
Aunque se han usado varios tratamientos farmacológicos y psicológicos para controlar las CIC, en la actualidad ninguno ha resultado eficaz de forma suficientemente contrastada.
Un estudio con naltrexona (NE-I)65 mostró resultados positivos en la escala Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease (QUIP), aunque no mejoró la impresión clínica global, si bien no existen más datos al respecto, como para hacer una recomendación. Estudios con amantadina (NE-II)66, atomoxetina (NE-II)67 y terapia cognitiva conductual (NE-I)68 mostraron resultados positivos. Sin embargo, estudios retrospectivos abiertos con un elevado número de pacientes han mostrado una asociación del uso de amantadina con TCI52,53 (NE-III). En estudios aislados y abiertos con pocos casos, la zonisamida69 (NE-IV), el topiramato70 (NE-IV), el valproato71 (NE-II), la clozapina y la finasterida han mostrado una cierta eficacia en reducir la gravedad de los TCI refractarios a la disminución de dosis de los agonistas dopaminérgicos (NE-IV)70.
Un estudio con naltrexona (NE-I)65 mostró resultados positivos en la escala Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease (QUIP), aunque no mejoró la impresión clínica global, si bien no existen más datos al respecto, como para hacer una recomendación. Estudios con amantadina (NE-II)66, atomoxetina (NE-II)67 y terapia cognitiva conductual (NE-I)68 mostraron resultados positivos. Sin embargo, estudios retrospectivos abiertos con un elevado número de pacientes han mostrado una asociación del uso de amantadina con TCI52,53 (NE-III). En estudios aislados y abiertos con pocos casos, la zonisamida69 (NE-IV), el topiramato70 (NE-IV), el valproato71 (NE-II), la clozapina y la finasterida han mostrado una cierta eficacia en reducir la gravedad de los TCI refractarios a la disminución de dosis de los agonistas dopaminérgicos (NE-IV)70.
En el manejo del SDD, que conlleva una paulatina disminución de LD, el valproato ha sido particularmente útil (NE-II)71.
No parece indicado el tratamiento con otros neurolépticos, por su limitada evidencia en eficacia y su asociación con el deterioro del parkinsonismo motor57 (NE-IV).
El trabajo conjunto con médicos especialistas en conductas adictivas puede ser necesario en muchos casos. En este sentido, el uso de antidepresivos y ansiolíticos puede ser útil para el manejo de la comorbilidad psiquiátrica que estos pacientes presentan con frecuencia.
26. Weintraub D, Aarsland D, Chaudhuri KR, et al. The neuropsychiatry of Parkinson’s disease: advances and challenges. Lancet Neurol. 2022;21(1):89-102.
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
51. Augustine A, Winstanley CA, Krishnan V. Impulse control disorders in Parkinson’s disease: from bench to bedside. Front Neurosci. 2021;15:654238.
52. Lee JY, Jeon BS. Maladaptive reward-learning and impulse control disorders in patients with Parkinson’s disease: a clinical overview and pathophysiology update. J Mov Disord. 2014;7(2):67-76.
53. Weintraub D, Koester J, Potenza MN, et al. Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients. Arch Neurol. 2010;67(5):589-95.
54. García-Ruiz PJ, Martínez Castrillo JC, Alonso-Cánovas A, et al. Impulse control disorder in patients with Parkinson’s disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014;85(8):840-4.
55. Sáez-Francàs N, Martí Andrés G, Ramírez N, et al. Clinical and psychopathological factors associated with impulse control disorders in Parkinson’s disease. Neurologia. 2015 Jun 18. pii: S0213-4853(15)00113-9.
56. Jiménez-Urbieta H, Gago B, de la Riva P, et al. Dyskinesias and impulse control disorders in Parkinson’s disease: From pathogenesis to potential therapeutic approaches. Neurosci Biobehav Rev. 2015;56:294-314.
57. Debove I, Paschen S, Amstutz D, et al. Management of Impulse Control and Related Disorders in Parkinson’s Disease: An Expert Consensus. Mov Disord. 2024;39(2):235-248.
58. Mamikonyan E, Siderowf AD, Duda JE, et al. Long-term follow-up of impulse control disorders in Parkinson’s disease. Mov Disord. 2008;23:75-80.
59. Bastiaens J, Dorfman BJ, Christos PJ, et al. Prospective cohort study of impulse control disorders in Parkinson’s disease. Mov Disord. 2013;28(3):327-33.
60. Abbes M, Lhommée E, Thobois S, et al. Subthalamic stimulation and neuropsychiatric symptoms in Parkinson’s disease: results from a long-term follow-up cohort study. J Neurol Neurosurg Psychiatry 2018;89(8):836-843.
61. Catalán MJ, De Pablo-Fernández E, Villanueva C, et al. Levodopa infusion improves impulsivity and dopamine dysregulation syndrome in Parkinson’s disease. Mov Disord. 2013;28(14):2007-10.
62. Todorova A, Ray Chaudhuri K. Subcutaneous apomorphine and non-motor symptoms in Parkinson’s disease. Parkinsonism Relat Disord. 2013;19(12):1073-8.
63. De Fabregues O, Dot Bach J, Abu-Suboh Abadia M, et al. Eight years’ experience with continuous intraduodenal levodopa infusion in Parkinson’s disease. 19th International Congress of Parkinson’s disease and Movement Disorders. San Diego, EEUU, 14-18 Jun 2015. Poster. Mov Disord. 2015;30 Suppl 1:S78-19.
64. Rabinak CA, Nirenberg MJ. Dopamine agonist withdrawal syndrome in Parkinson disease. Arch Neurol. 2010 Jan;67(1):58-63.
65. Papay K, Xie SX, Stern M, et al. Naltrexone for impulse control disorders in Parkinson disease: a placebo-controlled study. Neurology. 2014;83(9):826-33.
66. Thomas A, Bonanni L, Gambi F, et al. Pathological gambling in Parkinson disease is reduced by amantadine. Ann Neurol. 2010;68:400-4.
67. Kehagia AA, Housden CR, Regenthal R, et al. Targeting impulsivity in Parkinson’s disease using atomoxetine. Brain. 2014;137(Pt 7):1986-97.
68. Okai D, Askey-Jones S, Samuel M, et al. Trial of CBT for impulse control behaviors affecting Parkinson patients and their caregivers. Neurology. 2013;80:792-9.
69. Bermejo PE, Ruiz-Huete C, Anciones B. Zonisamide in managing impulse control disorders in Parkinson’s disease. J Neurol. 2010;257(10):1682-5.
70. Zhang JF, Wang XX, Feng Y, et al. Impulse control disorders in Parkinson’s disease: epidemiology, pathogenesis and therapeutic strategies. Front Psychiatry. 2021;12:635494.
71. Sriram A, Ward HE, Hassan A, et al. Valproate as a treatment for dopamine dysregulation syndrome (DDS) in Parkinson’s disease. J Neurol. 2013;260:521-7.
La psicosis, con una prevalencia de más del 50%, es una de las principales causas de ingreso de los pacientes con EP en centros asistidos. El principal factor de riesgo es la demencia asociada a la enfermedad, seguido por edad avanzada, larga evolución, clínica motora grave, trastornos del sueño, trastorno autonómico y depresión.
El diagnóstico se basa en la presencia de al menos uno de los siguientes síntomas: alucinaciones, delirio, ilusiones o sensaciones falsas de presencia, que deben aparecer sin alteración del nivel de conciencia y con curso crónico (al menos 1 mes), de forma continua o recurrente72 (NE-IV).
Las alucinaciones son el síntoma psicótico más frecuente. Suelen aparecer por la noche, cuando disminuyen los estímulos ambientales externos. En los primeros años de la enfermedad, son típicas las alucinaciones menores (alucinaciones minor), que son breves y con autocrítica conservada. Incluyen tres fenómenos: alucinaciones visuales transitorias o de pasaje (el paciente ve sombras en la periferia de su campo visual, que desaparecen cuando se gira para verlas), alucinaciones de presencia (el paciente siente que hay alguien detrás pero no lo ve) e ilusiones ópticas (objetos reales que se trasforman en otros; por ejemplo, flores que parecen caras, bocas de riego que parecen perros, etc.).
Con el tiempo, las alucinaciones se vuelven más complejas: visión de personas, animales, partes del cuerpo aisladas u objetos móviles. No generan miedo ni preocupación, por lo que el paciente no suele darles importancia y no lo cuenta, pudiendo pasar fácilmente inadvertidas en la anamnesis. En fases más avanzadas las alucinaciones son más estructuradas, se pierde la autocrítica y el paciente presenta ante ellas irritación, agitación e incluso agresividad. Pueden asociar delirio, que suele ser paranoide o de celotipia. Con menos frecuencia se han descrito también alucinaciones auditivas, táctiles, olfatorias o gustativas73 (NE-IV).
La fisiopatología de la psicosis en la EP no está clara. Se cree debida a una interacción complicada entre fenómenos fisiopatológicos intrínsecos y variables extrínsecas74 (NE-IV). Los procesos intrínsecos incluyen cambios neuroquímicos que afectan a la dopamina, la serotonina y la acetilcolina, patrones de activación aberrantes en corteza y tronco, daño visual primario y alteración atencional, cognitiva y visuoespacial. Entre las variables extrínsecas, el uso de fármacos dopaminérgicos y anticolinérgicos es el más habitual75 (NE-I).
El tratamiento de la psicosis y las alucinaciones en la EP supone un reto complicado, ya que la mejoría de la clínica neuropsiquiátrica suele conllevar un empeoramiento del control motor, lo que no siempre es bien aceptado por el paciente y sus cuidadores.
En primer lugar, debemos descartar otras causas posibles del cuadro, sobre todo cuando el comienzo es brusco y agudo, entre otras: delirio, infecciones, urgencias como el síndrome neuroléptico maligno u otras (ver capítulo 11, pag. 283) y trastornos toxicometabólicos. El siguiente paso consistirá en suspender la medicación no antiparkinsoniana que no sea imprescindible para el paciente y que pueda contribuir a la aparición de psicosis como: antidepresivos tricíclicos, benzodiacepinas, anticolinérgicos y opioides. En tercer lugar, hay que disminuir o incluso suspender la medicación antiparkinsoniana. Primero los IMAO-B (selegilina, rasagilina), luego la amantadina, después los agonistas dopaminérgicos (pramipexol, ropinirol y rotigotina), después los ICOMT (tolcapona, entacapona opicapona) y finalmente, si es necesario, se reducirá la dosis de LD34,35 (NE-I).
Si con estos pasos no conseguimos una respuesta adecuada, debemos considerar añadir al tratamiento fármacos antipsicóticos, como neurolépticos o inhibidores de la acetilcolinesterasa. Los neurolépticos típicos producen un agravamiento del parkinsonismo e incluso un síndrome neuroléptico maligno, por lo que están contraindicados en la EP, usándose solo los atípicos, que tienen menor riesgo de estas complicaciones. La Food and Drug Administration (FDA) advierte de que diversos estudios han demostrado un aumento del riesgo de morbimortalidad por patología cerebrovascular en pacientes mayores de 75 años tratados con neurolépticos, sobre todo si se asocia deterioro cognitivo. En la actualidad, no hay ningún fármaco con indicación aprobada por la FDA para psicosis en la EP, los utilizamos fuera de guía y por uso compasivo.
Los neurolépticos atípicos más utilizados para tratar las alucinaciones y la psicosis en general en la EP son la clozapina y la quetiapina34,35,74,75 (NE-IV).
Es el más eficaz en el tratamiento de la psicosis sin empeorar la clínica motora76 (NE-I).
Se ha descrito, asociado a su uso, un riesgo menor del 1% de producir agranulocitosis, no relacionado con la dosis del fármaco, por lo que debe monitorizarse el tratamiento con un hemograma semanal durante las primeras 18 semanas de tratamiento y al menos una vez cada 4 semanas durante el tiempo que continúe el tratamiento. La dosis indicada varía según los casos (6,25-50 mg/día). Otros efectos secundarios descritos de la clozapina son somnolencia, sedación, hipotensión ortostática y sialorrea74,75 (NE-I).
Un metaanálisis reciente concluye que, aunque inferior a la clozapina, la quetiapina era superior al placebo, con una adecuada seguridad76 (NE-I). Su uso es seguro, el manejo sencillo y no se necesita realizar monitorización del hemograma durante el tratamiento, por eso es el más utilizado en la práctica clínica diaria. La dosis media suele variar entre 50 y 150 mg/día. Los efectos secundarios incluyen somnolencia, sedación e hipotensión ortostática.
Una revisión sistemática concluye que la ziprasidona es tan eficaz como la clozapina y que el perfil de seguridad, efectos secundarios y eficacia es similar al de otros antipsicóticos usados en los síntomas psicóticos en la enfermedad de Parkinson77 (NE-II). Produce menos hipotensión ortostática neurogénica, al bloquear poco los receptores α-1-adrenérgicos; sin embargo, puede alargar el QT, lo que puede provocar arritmias.
Entre los inhibidores de la acetilcolinesterasa, la rivastigmina y el donepezilo se han valorado como tratamiento crónico de síntomas psicóticos leves-moderados en la EP. No se han realizado estudios largos, doble ciego, controlados frente a placebo, con psicosis en EP como objetivo primario, pero varios pequeños estudios de series de casos abiertos han visto de forma secundaria cómo mejoran las alucinaciones y el delirio74 (NE-IV). En un estudio contralado con rivastigmina con deterioro cognitivo como objetivo primario, se observó reducción de alucinaciones visuales frente a placebo78 (NE-I).
Estudios recientes sugieren que la pimavanserina es una prometedora opción de tratamiento de la psicosis asociada a la EP79 (NE-I). Actúa como agonista inverso de los receptores 5-HT2A sin que tenga efecto antidopaminérgico. Es un fármaco seguro que controla los síntomas psicóticos con dosis 100 veces menores que la dosis que produce efectos secundarios, por lo que es bien tolerado y tiene un perfil de seguridad similar al placebo. Dos metaanálisis recientes encontraron que la pimavanserina era un fármaco seguro y efectivo para el tratamiento de los trastornos psicóticos en la enfermedad de Parkinson75-79 (NE-I). Está aprobado por la FDA, pero no está disponible en Europa en la fecha de edición de este manual.
72. Ravina B, Marder K, Fernández HH, et al. Diagnostic criteria for psychosis in Parkinson’s disease: Report of an NINDS, NIMH Work Group. Mov Disord. 2007;22:1061-68.
73. Feneleon G, Mahieux F, Huon R, et al. Hallucinations in Parkinson´s disease. Prevalence, phenomenology and risk factors. Brain. 2000;123:733-45.
74. Friedman JH. Parkinson disease psychosis: Update. Behav Neurol. 2013;27(4):46977.
75. Zhang H, Wang L, Fan Y, et al. Atypical antipsychotics for Parkinson’s disease psychosis: a systematic review and meta-analysis. Neuropsychiatr Dis Treat. 2019;15:2137-49.
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
74. Friedman JH. Parkinson disease psychosis: Update. Behav Neurol. 2013;27(4):46977.
75. Zhang H, Wang L, Fan Y, et al. Atypical antipsychotics for Parkinson’s disease psychosis: a systematic review and meta-analysis. Neuropsychiatr Dis Treat. 2019;15:2137-49.
76. Iketani R, Furushima D, Imai S, et al. Efficacy and safety of atypical antipsychotics for psychosis in Parkinson’s disease: a systematic review and Bayesian network meta- analysis. Parkinsonism Relat Disord. 2020;78:82-90.
77. Younce JR, Davis AA, Black KJ. A systematic review and case series of ziprasidone for psychosis in Parkinson’s disease. J Parkinsons Dis. 2019;9(1):63-71.
78. Emre M, Aarsland D, Albanese A, et al. Rivastigmine for dementia associated with Parkinson’s disease. N Engl J Med. 2004;351(24):2509-2518.
79. Mansuri Z, Reddy A, Vadukapuram R, et al. Pimavanserin in the treatment of Parkinson’s disease psychosis: meta-analysis and meta-regression of randomized clinical trials. Innov Clin Neurosci.2022;19(1-3):46-51.
El babeo, en la EP, se produce por la acumulación de saliva y alteración de su manejo dentro de la boca, producida por las dificultades de deglución que aparecen en el curso de la enfermedad, conduciendo a su caída o aspiración80.
No disponemos de criterios diagnósticos, aunque sí de múltiples herramientas que pre- tenden observarlo (UPDRS-II, SCOPA-AUT, PD-NMSQuest), por lo que en diferentes estudios la prevalencia varía entre el 10% y el 84%81.
En cuanto al tratamiento, se aconseja retirar todos los fármacos que puedan aumentarlo, como los inhibidores de la acetilcolinesterasa o los antipsicóticos, y corregir el tratamiento dopaminérgico a criterio del clínico.
Se han realizado estudios con atropina, bromuro de ipratropio, tropicamida y glicopirrolato, siendo este último el único que demostró, en un estudio aleatorizado, a doble ciego y cruzado (1 mg oral tres veces al día), un efecto beneficioso82 (NE-I), si bien no se dispone de evidencia para tratamientos de más de 1 semana de duración. El glicopirrolato oral no está disponible en nuestro país, pudiendo obtenerse para fórmulas magistrales.
La infiltración de toxina botulínica en las glándulas salivares es una medida eficaz en el tratamiento de la sialorrea83 (NE-I). Concretamente la incobotulinumtoxina A, en un estudio fase III ha demostrado ser útil infiltrando 100 u distribuidas entre parótidas y submandibulares84 (NE-I).
Otros tratamientos sin evidencia suficiente, como el colirio oftálmico de atropina al 1% sublingual, también se utilizan85 (NE-IV).
Se define como la reducción en la presión arterial sistólica en más de 20 mmHg o diastólica en más de 10 mmHg tras pasar del decúbito a la bipedestación durante 3 minutos. Es, probablemente, consecuencia de la denervación simpática vascular a la que pueden contribuir otros factores como los fármacos antihipertensivos o antipsicóticos concomitantes, en su caso, o la amantadina y agonistas dopaminérgicos, así como del efecto vasodilatador, diurético e inotrópico negativo de la dopamina secundaria a la metabolización periférica de la LD. Puede estar presente en más del 52% de los pacientes con EP y con mayor frecuencia en otros parkinsonismos34 (NE-I).
Los síntomas que produce son sincopes y presíncopes al ponerse de pie, y en ocasiones sensación de dolor de cuello y hombros y fatiga.
Su manejo precisa de una primera fase en la que se reduzcan y controlen los posibles precipitantes: fragmentación de las comidas evitando las ingestas copiosas de carbohidratos, aumento del consumo de agua y sal (> 8 g/día), uso de calcetines de presión o maniobras para recuperar la tensión ante los primeros síntomas, como ponerse en cuclillas, inclinarse hacia delante o cruzar las piernas haciendo presión en los muslos y pantorrillas34-35 (NE-IV).
Cuando estas maniobras no son suficientes, se pueden emplear fármacos. No disponemos de evidencia suficiente de la eficacia de la fludrocortisona86 ni de la domperidona 10 mg/8 horas (NE-IV).
La droxidopa está aprobada por la FDA a dosis de 100-300 mg/8 horas, tiene mayor nivel de evidencia, mejorando los síntomas y el impacto de los síntomas en las actividades de la vida diaria, pero no está disponible en España87 (NE-I). Por su parte, la midodrina, un agonista de los adrenorreceptores α1 en dosis de 2,5-10 mg tres veces al día está aprobada en Europa y América88 (NE-I) y otros, como la yohimbina (antagonista adrenérgico α2) están aún bajo estudio en fase III en Estados Unidos. Un estudio parece sugerir que aumenta su acción con la administración combinada de atomoxetina, un inhibidor del transportador de norepinefrina (yohimbina 5,4 mg y atomoxetina 18,0 mg)89 (NE-IV). La piridostigmina, que aumenta la acetilcolina ganglionar en la vía eferente simpática, parece ser inferior a la fludrocortisona para el control de síntomas de hipotensión ortostática en pacientes con EP90 (NE-III).
Hay que tener cuidado y evitar la administración de estos fármacos en dosis nocturna (después de las 17:00 horas), especialmente la midodrina, ya que pueden agravar la hipertensión arterial en decúbito que presentan frecuentemente estos pacientes, que se puede tratar con medidas no farmacológicas (elevar el cabecero o tomar un pequeño snack nocturno rico en carbohidratos) o farmacológicas con IECA de vida media corta como captopril a 25 mg o ARA-II como losartán a 25-50 mg91 (NE-IV).
Se manifiesta clínicamente en forma de urgencia miccional, aumento de la frecuencia con más de siete micciones al día, nicturia, con más de 3-4 micciones por la noche, o urge-incontinencia. En la mayor parte de los casos, se relaciona con la hiperactividad del músculo detrusor secundaria a la alteración de los mecanismos reguladores dopaminérgicos y noradrenérgicos del SNC, así como en los centros pontinos de la micción, implicados en la inhibición parasimpática de dicho músculo. Está presente en un 30-60% de los pacientes con EP, y puede verse potenciada por otros factores como la edad.
A pesar de la frecuencia del síntoma, no disponemos de estudios cuyo diseño establezca evidencia de los tratamientos aplicados, por lo que el tratamiento92 (NE-IV) se enfoca atendiendo a los conocimientos generales. Los pacientes con disfunción vesical deben someterse a una valoración urológica antes de plantear la mejor opción terapéutica. No es infrecuente la asociación en pacientes varones de hiperplasia benigna de próstata, que facilita la hiperactividad del detrusor y cuyo tratamiento quirúrgico se asocia con mayor frecuencia que en la población general a incontinencia posterior. Se recomienda la cateterización intermitente en los pacientes con residuo miccional superior a los 100 ml. En caso de hipertonía del detrusor sin presentar residuo, puede plantearse el uso de los anticolinérgicos, preferiblemente los selectivos de los receptores muscarínicos M3, responsables de la contracción del detrusor, para reducir el riesgo de efectos secundarios cognitivos y el estreñimiento34,35,85 (NE-I). Entre ellos, la solifenacina (NE-I), la oxibutinina, que también existe en parches transdérmicos, la tolterodina, la propiverina, la fesoterodina o el cloruro de trospio (NE-III) pueden utilizarse34,35,85.
Los agonistas adrenérgicos β3 como el mirabegrón relajan el detrusor durante el llenado vesical y podrían plantearse como una opción en estos pacientes93 (NE-I). También los antagonistas α1 (tamsulosina, doxazosina) relajan el cuello vesical y facilitan la micción94 (NE-IV). Existen sugerencias de que algunos pacientes pueden mejorar tras el tratamiento con ECP. En la actualidad, la toxina botulínica se considera el tratamiento de elección en los pacientes que no responden a los tratamientos orales95 (NE-I).
La safinamida en un estudio retrospectivo ha demostrado que podría mejorar los síntomas urinarios96 (NE-II). En el estudio Surinpark se achaca el beneficio tanto al efecto dopaminérgico como al no dopaminérgico del fármaco96.
Es más frecuente en la EP que en la población general, aunque no es fácil establecer hasta qué punto está relacionada directa y exclusivamente con la fisiopatología o clínica de la enfermedad ya que, al menos en hombres, su frecuencia es similar a otras enfermedades crónicas no neurológicas. La disfunción eréctil, en más del 60% de los pacientes, y la dificultad para eyacular y conseguir un orgasmo son frecuentes en varones, mientras la tensión vaginal, falta de lubricación, incontinencia urinaria, ansiedad e inhibición son predominantes en las mujeres. Los pacientes varones, pero no las mujeres, parecen mejorar la percepción de su vida sexual tras la ECP. Puede estar implicada la comorbilidad en forma de depresión, disautonomía o hipotestosteronemia, así como los fármacos hipotensores o antidepresivos97 (NE-IV).
La disfunción eréctil es el único aspecto de la disfunción sexual en la EP que tiene un tratamiento farmacológico basado en la evidencia, los inhibidores de la fosfodiesterasa 5 (PDE5-inh). El sildenafilo dispone de un NE-IV para su utilización en pacientes con EP98, y el vardenafilo y el tadalafilo pueden considerarse probablemente efectivos en base a los estudios disponibles99. Los PDE5-inh están contraindicados en pacientes con hipotensiones previas (90 mmHg/50 mmHg documentadas), en tratamiento con vasodilatadores derivados de la nitroglicerina (podría plantearse el cambio a su cardiólogo), con retinitis pigmentaria o historia de priapismo. En pacientes con EP, debe hacerse un mayor control de la aparición de hipotensión ortostática en pacientes que no la presentaran previamente. Con frecuencia debe recurrirse a dosis máximas (50-100 mg en sildenafilo, 20 mg en vardenafilo y tadalafilo), y el inicio del efecto puede retrasarse por los problemas de absorción, lo que debería avisarse al inicio del tratamiento.
En los casos en que no se obtuviera respuesta satisfactoria, podrían plantearse otras opciones de tratamiento, como los parches transdérmicos de testosterona, la apomorfina sublingual en dosis de 2-4 mg (inicio: 10-15 minutos)95,97 (NE-IV). La formulación referida de apomorfina sublingual es difícil de conseguir en España y habrá que ver si con las formulaciones que se comercializarán proximamente, de 10 a 30 mg, tienen evidencia para usarla en esta indicación. También se pueden considerar las las inyecciones intracavernosas de prostaglandina E1 (alprostadil), o los dispositivos de vacío tras la valoración urológica, pero no se dispone de resultados específicos de estos dos últimos tratamientos en pacientes con EP. En casos refractarios o que deseen una solución permanente, se puede optar por una prótesis quirúrgica, que tiene unos altos índices de eficacia en la población general no específicamente afecta de EP (entre el 92-100%)95 (NE-IV).
El estreñimiento en la EP es secundario a la neurodegeneración en los plexos mientéricos y centros autonómicos, pero también a la disinergia del suelo pélvico, indicación esta última para la que se utiliza la toxina botulínica en el músculo puborrectal o en el esfínter anal externo han mostrado eficacia100 (NE-IV).
Es el trastorno autonómico más frecuente entre los pacientes EP, afectando hasta al 80% de ellos. Puede preceder en años la aparición de los síntomas motores. El tratamiento debe empezar con medidas dietéticas, ejercicio físico, beber abundante agua34,35-75 (NE-IV). El macrogol, un laxante osmótico, resultó eficaz en un estudio doble ciego, aleatorizado, controlado con placebo y de grupos paralelos en el que no se describieron efectos secundarios101 (NE-I). Aunque no hay estudios específicos en la EP, se utilizan con frecuencia reguladores del tránsito intestinal, sobre todo aumentadores del volumen del bolo como metilcelulosa o Plantago ovata.
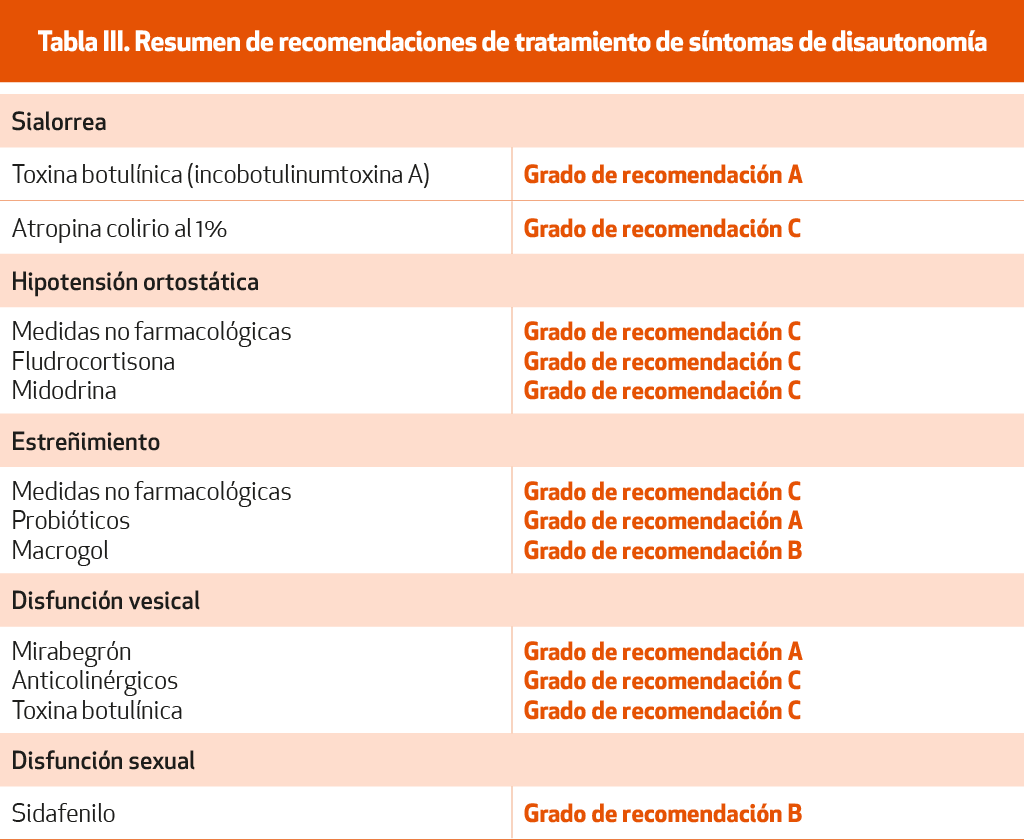
La utilización de probióticos se ha demostrado eficaz en estudios recientes102-104 (NE-I).
Los pacientes con EP pueden presentar tanto aumento como descenso o normalidad de la sudoración. La hiperhidrosis en forma de crisis de sudoración excesiva suele presentarse durante el off y con menos frecuencia durante el on, en el contexto de las fluctuaciones motoras, pero también puede ser una fluctuación no motora. En este caso se deberá manejar con ajuste del tratamiento para la EP. Medicamentos orales como dosis bajas de clonidina, antidepresivos tricíclicos con efectos secundarios anticolinérgicos y betabloqueantes, se han probado, pero faltan pruebas sólidas de su eficacia y justifican precaución con respecto a los efectos adversos95 (NE-I).
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
80. Srivanitchapoom P, Pandey S, Hallet M. Drooling in Parkinson’s disease: A review. Parkinsonism Relat Disord. 2014;20:1109-18.
81. Kalf JG, de Swart BJ, Borm GF, et al. Prevalence and definition of drooling in Parkinson’s disease: A systematic review J Neurol. 2009;256:1391-6.
82. Arbow ME, Moving KI, Koopmann M, et al. Glycopirrolate for sialorrhea in Parkinson disease: a randomized, double-blind, crossover trial. Neurology. 2010;74:1203-7.
83. Yang CL, Huang JP, Tan YC, et al. The effectiveness and safety of botulinum toxin injections for the treatment of sialorrhea with Parkinson’s disease: a systematic review and meta-analysis. BMC Pharmacol Toxicol. 2023 Oct 12;24(1):52.
84. Jost WH, Friedman A, Michel O, et al. SIAXI: Placebo-controlled, randomized, double-blind study of incobotulinumtoxinA for sialorrhea. Neurology. 2019;92(17):e1982-e1991.
85. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf- 1837629189061
86. Veazie S, Peterson K, Ansari Y, et al. Fludrocortisone for orthostatic hypotension. Cochrane Database Syst Rev. 2021 May 17;5(5):CD012868.
87. Kaufmann H, Freeman R, Biaggioni I, et al.; NOH301 Investigators (2014). Droxidopa for neurogenic orthostatic hypotension: a randomized, placebo-controlled, phase 3 trial. Neurology. 2014 Jul 22;83(4):328-35.
88. Smith W, Wan H, Much D, et al. Clinical benefit of midodrine hydrochloride in symptomatic orthostatic hypotension: a phase 4, double-blind, placebo-controlled, randomized, tilt-table study. Clin Auton Res. 2016;26:269–277.
89. Schrag A, Sauerbier A, Chaudhuri KR. New clinical trials for non-motor manifestations of Parkinson’s disease. Mov Disord. 2015;30(11):1490-504.
90. Schreglmann SR, Büchele F, Sommerauer M, et al. Pyridostigmine bromide versus fludrocortisone in the treatment of orthostatic hypotension in Parkinson’s disease - a randomized controlled trial. Eur J Neurol. 2017 Apr;24(4):545-551.
91. Isaacson SH, Dashtipour K, Mehdirad AA, et al. Management Strategies for Comorbid Supine Hypertension in Patients with Neurogenic Orthostatic Hypotension. Curr Neurol Neurosci Rep. 2021 Mar 9;21(4):18.
92. Sakakibara R, Panicker J, Finazzi-Agro E, et al.; and The Parkinson’s Disease Subcommittee, The Neurourology Promotion Committee in The International Continence Society. A guideline for the management of bladder dysfunction in Parkinson’s disease and other gait disorders. Neurourol Uradyn. 2015;35(5):551-63.
93. Moussa M, Chakra MA, Dabboucy B, et al. The safety and effectiveness of mirabegron in Parkinson’s disease patients with overactive bladder: a randomized controlled trial. Scand J Urol. 2022;56(1):66-72.
94. Jia C, Cui X, Ou T. Efficacy of medication for overactive bladder symptoms in 70 patients with Parkinson’s disease. Transl Androl Urol. 2024 Jan 31;13(1):64-71.
95. Udow S, Fox S. Autonomic dysfunction. En: Grimes D, Fitzpatrick M, Gordon J, et al. Canadian guideline for Parkinson disease. CMAJ. 2019;191(36):E989-1004.
96. Gómez-López A, Sánchez-Sánchez A, Natera-Villalba E, et al. SURINPARK: Safinamide for Urinary Symptoms in Parkinson’s Disease. Brain Sci. 2021;11(1):57.
97. Palma JA, Kaufmann H. Treatment of autonomic dysfunction in Parkinson disease and other synucleinopathies.Mov Disord. 2018;33(3):372-90.
98. Bernard BA, Verhagen Metman L, Levine L, et al. Sildenafil in the treatment of erectile dysfunction in Parkinson’s disease. Mov Disord Clin Pract. 2016;4(3):412–415.
99. Lombardi G, Nelli F, Celso M, et al. Treating erectile dysfunction and central neurological diseases with oral phosphodiesterase type 5 inhibitors. Review of the literature. J Sex Med. 2012 Apr;9(4):970-85.
100. Albanese A, Brisinda G, Bentivoglio AR, María G. Treatment of outlet obstruction constipation in Parkinson’s disease with botulinum neurotoxin A. Am J Gastroenterol. 2003;98(6):1439-40.
101. Zangaglia R, Martignoni E, Glorioso M, et al. Macrogol for the treatment of constipation in Parkinson’s disease. A randomized placebo-controlled study. Mov Disord. 2007; 22(9):1239-1244.
102. Du Y, Li Y, Xu X, et al. Probiotics for constipation and gut microbiota in Parkinson’s disease. Parkinsonism Relat Disord. 2022;103:92-97.
103. Ibrahim A, Ali RAR, Manaf MRA, et al. Multi-strain probiotics (Hexbio) containing MCP BCMC strains improved constipation and gut motility in Parkinson’s disease: a randomised controlled trial. PLoS One. 2020;15(12):e0244680.
104. Tan AH, Lim SY, Chong KK, et al. Probiotics for constipation in Parkinson disease: a randomized placebo-controlled study. Neurology. 2021;96(5):e772-e782.
La fatiga en la EP se caracteriza por falta de energía o necesidad de aumentar el esfuerzo de manera desproporcionada para realizar las actividades básicas de la vida diaria, que no mejora con el descanso y que aparece impredeciblemente, sin relación con un esfuerzo excesivo o desproporcionado y se mantiene crónicamente105 (NE-IV). En ocasiones está relacionada con depresión o somnolencia diurna, y en otras es un síntoma independiente.
La fatiga es un síntoma común, que presentan alrededor del 50% de los pacientes que sufren EP, aunque a menudo es un síntoma poco reconocido. Debe identificarse si existe depresión, somnolencia u otras causas y tratarlas adecuadamente34 (NE-I). Cuando no está relacionada con ninguno de estos factores, su tratamiento es más difícil.
Existen 11 estudios aleatorizados y controlados, 9 de ellos evalúan fármacos, controlados con placebo y los otros dos evalúan el efecto del ejercicio. Los fármacos que se han evaluado son LD-carbidopa, memantina, rasagilina, cafeína, metilfenidato, modafinilo y doxepina. De todos estos fármacos, el único que ha mostrado una reducción significativa de la fatiga es la rasagilina106 (NE-II). De los dos estudios que evalúan el efecto del ejercicio, ninguno ha demostrado eficacia en reducir la intensidad de la fatiga ni su impacto en la calidad de vida.
Estudios abiertos con terapias avanzadas no evalúan el efecto sobre la fatiga sino en subdominios de escalas globales como el dominio sueño/fatiga o en el total de síntomas no motores. La LD intrayeyunal107 (NE-III) y la ECP108 (NE-II) mejoraron los síntomas no motores en conjunto y el dominio sueño/fatiga.
En resumen, actualmente no existe evidencia suficiente para recomendar un tratamiento para la fatiga en la EP. Serían necesarios más estudios que evalúen la fatiga como variable principal.
Dolor y otros trastornos sensitivos
Durante tiempo el dolor se ha considerado como parte de la reaparición de los síntomas motores (rigidez, sobre todo) en los periodos off, pero se ha visto que puede aparecer en cualquier momento de la evolución de la enfermedad, tanto precediendo al diagnóstico de la EP como asociado a complicaciones motoras en fases avanzadas, ya sea en los periodos on como off o independientemente de estas fluctuaciones. El dolor en la EP se presenta en una variedad de localizaciones y tipos (musculoesquelético, central, visceral, neuropático, etc.).
Se ha atribuido tanto a causas centrales en el procesamiento del dolor, como periféricas, relacionadas con el sistema dopaminérgico y con otros sistemas de neurotransmisión109 (NE-IV).
Se han publicado pocos estudios específicos sobre el dolor en la EP, con lo que el conocimiento de la fisiopatología y de los efectos de los diversos tratamientos aplicados en la clínica es escaso. En su tratamiento, en primer lugar, hay que identificar si el dolor se debe a otra patología concomitante, la cual debe ser tratada de modo independiente. Si el dolor está relacionado con fluctuaciones motoras o no motoras, lo primordial será optimizar el tratamiento dopaminérgico. En el análisis post-hoc del estudio RECOVER se sugiere que la rotigotina reduce significativamente el dolor110 (NE-III). La ECP también ha mostrado en varios estudios ser efectiva en aumentar el umbral del dolor en la EP y que el efecto es mantenido a 8 años111 (NE-II). Los estudios realizados con infusión enteral de LD107 y apomorfina107, que evalúan la mejoría en los síntomas no motores, no estudian el dolor por separado sino dentro del dominio miscelánea (NE-IV).
La safinamida se ha mostrado útil en dos ensayos, uno prospectivo abierto112 (NE-II) y otros analisis post-hoc113 en dosis de 100 mg en mejorar el dolor de manera mantenida. Concretamente, los pacientes mejoraron en dolor musculoesquelético, dolor relacionado con las fluctuaciones, dolor nocturno y síntomas como decoloración, edema o hinchazón y dolor radicular (NE-II).
En cuanto al tratamiento del dolor crónicono relacionado con las fluctuaciones motoras ni con las no motoras propiamente, solo existe un estudio específico de fase II aleatorizado y controlado114, que evalúa el efecto de la naloxona-oxicodona de liberación prolongada. En este estudio el objetivo principal, que era demostrar la mejoría del dolor en una escala a la semana 16, no se alcanza, pero el análisis por protocolo sí demuestra que la oxicodona prolongada es más eficaz que el placebo (NE-I). De manera empírica se han utilizado neuromoduladores y opiáceos. En este momento no existe estudios con evidencia de clase I en el manejo del dolor en la EP.
Los pacientes con EP pueden presentar otros trastornos sensoriales como alteraciones visuales, disfunción olfatoria y del gusto, parestesias, calambres, sensación de quemazón, dolor genital o sensación de boca quemante, que pueden llevar a intervenciones agresivas innecesarias. La mayoría de estos síntomas se relacionan también con las fluctuaciones motoras. No existen ensayos aleatorizados que evalúen el efecto de otros tratamientos en estos síntomas.
Los pacientes con EP muestran un índice de masa corporal menor que la población general. Las causas son multifactoriales. El inicio de la pérdida de peso no se relaciona con el estadio de la enfermedad y puede incluso aparecer tanto en la fase premotora como en fases avanzadas. No existen ensayos que evalúen el tratamiento de la pérdida de peso en la EP. En ocasiones es necesario usar suplementos nutricionales115 (NE-IV).
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
105. Kluger BM, Herlofson K, Chou KL, et al. Parkinson’s disease-related fatigue: A case definition and recommendations for clinical research. Mov Disord. 2016;31(5):625-31.
106. Lim TT, Kluger BM, Rodríguez RL, et al. Rasagiline for the symptomatic treatment of fatigue in Parkinson’s disease. Mov Disord. 2015;30(13):1825-30.
107. Honig H, Antonini A, Martínez-Martín P, et al. Intrajejunal levodopa infusion in Parkinson’s disease: a pilot multicenter study of effects on non-motor symptoms and quality of life. Mov Disord. 2009;24(10):1468-74.
108. Dafsari HS, Reddy P, Herchenbach C, et al.; IPMDS Non-Motor Symptoms Study Group. Beneficial effects of bilateral subthalamic stimulation on non-motor symptoms in Parkinson’s disease. Brain Stimul. 2016;9(1):78-85.
109. Wasner G, Deuschl G. Pains in Parkinson disease: many syndromes under one umbrella. Nat Rev Neurol. 2012;8:284-94.
110. Kassubek J, Chaudhuri KR, Zesiewicz T, et al. Rotigotine transdermal system and evaluation of pain in patients with Parkinson’s disease: a post hoc analysis of the RECOVER study. BMC Neurol. 2014;14:42.
111. Jung YJ, Kim HJ, Jeon BS, et al. An 8-year follow-up on the effect of subthalamic nucleus deep brain stimulation on pain in Parkinson disease. JAMA Neurol. 2015;72(5):504-10.
112. Santos García D, Yáñez Baña R, Labandeira Guerra C, et al. Pain Improvement in Parkinson’s Disease Patients Treated with Safinamide: Results from the SAFINONMOTOR Study. J Pers Med. 2021;11(8):798.
113. Cattaneo C, Kulisevsky J, Tubazio V, et al. Long-term Efficacy of Safinamide on Parkinson’s Disease Chronic Pain. Adv Ther. 2018;35(4):515-522.
114. Trenkwalder C, Chaudhuri KR, Martínez-Martín P, et al. Prolonged-release oxycodone– naloxone for treatment of severe pain in patients with Parkinson’s disease (PANDA): a double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2015;(14)1161-70.
115. Ma K, Xiong N, Shen Y, et al. Weight Loss and Malnutrition in Patients with Parkinson’s Disease: Current Knowledge and Future Prospects. Front Aging Neurosci. 2018 Jan 19;10:1.
Los trastornos cognitivos en la EP son frecuentes y ocasionan un fuerte impacto en pacientes y cuidadores, por lo que su detección, diagnóstico y tratamiento es esencial para un buen manejo de la enfermedad. Actualmente existen dos entidades nosológicas en referencia a los trastornos cognitivos asociados a la EP: la demencia (D-EP) y el deterioro cognitivo leve (DCL-EP).
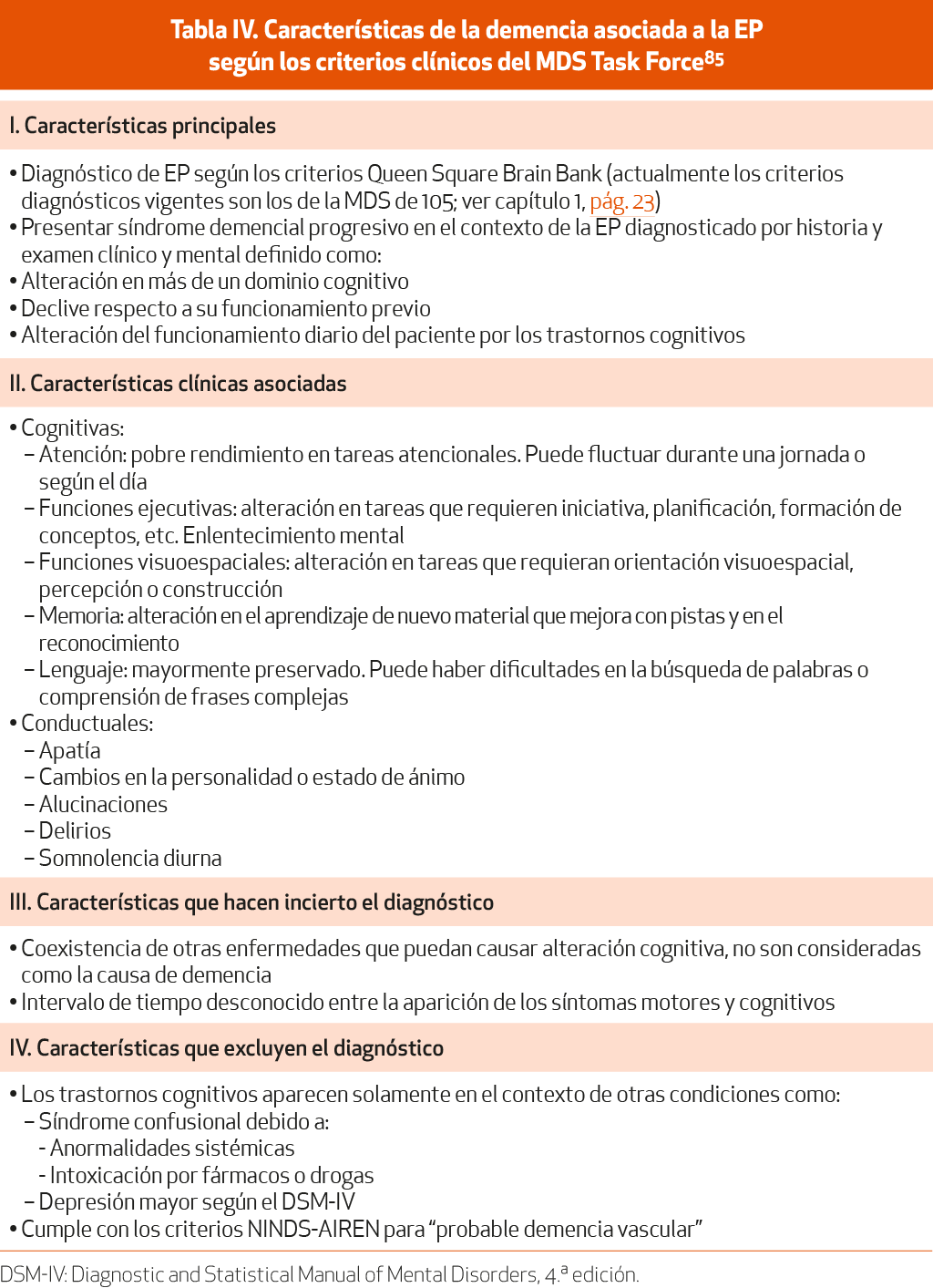
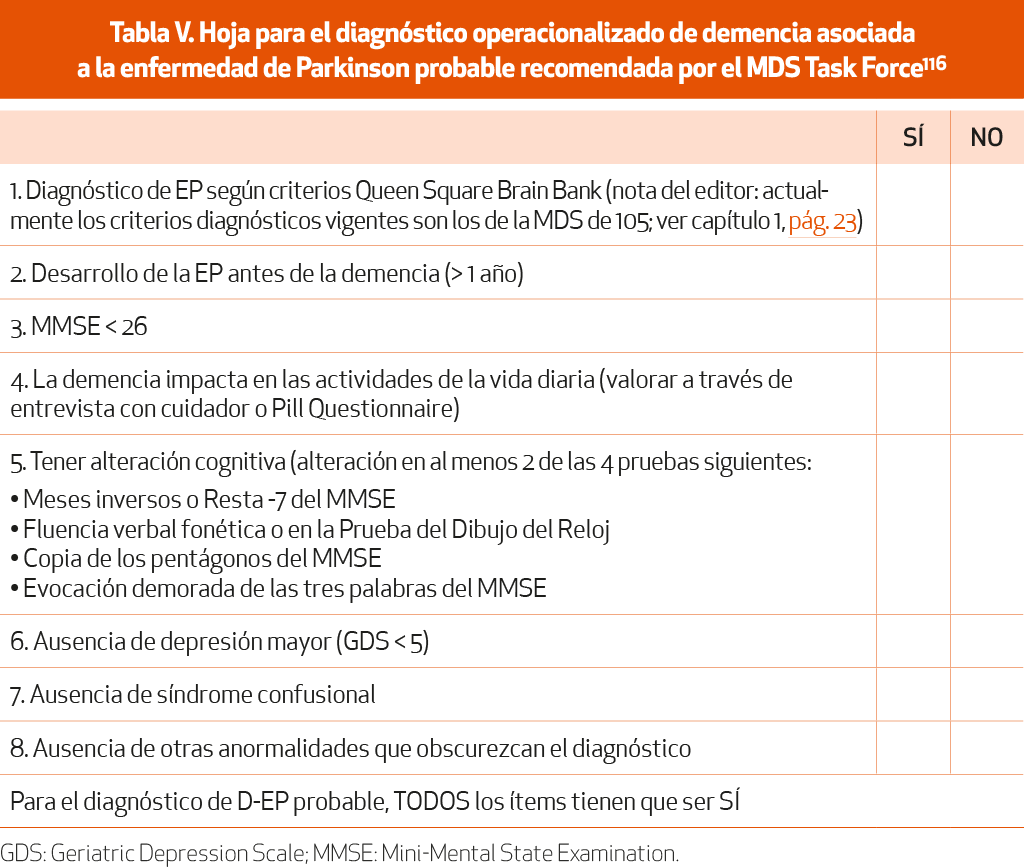
Se define como una alteración cognitiva progresiva, en más de un dominio, que se desarrolla en el contexto de una EP establecida y que se asocia a ella, y que es lo suficientemente grave como para producir alteraciones funcionales en las actividades instrumentales de la vida diaria de forma significativa. Existen unos criterios específicos116 (NE-IV) y una guía sistematizada para su diagnóstico117 (NE-IV) (Tablas IV y V).
Su prevalencia es de aproximadamente un 30% y su incidencia es cercana al 10% al año. La prevalencia acumulativa es muy alta, alcanzando el 75-80% a los 10-20 años de enfermedad. El riesgo de demencia en la EP es 4-6 veces superior al de la población general, aunque puede ser inferior en los primeros años de la enfermedad. Los factores de riesgo para el desarrollo de demencia asociada a la EP más consistentes son la edad, la presencia de deterioro cognitivo leve (DCL) o alucinaciones visuales, y parkinsonismo grave, especialmente si se presenta inestabilidad postural y trastorno de la marcha. Los estudios clínico-patológicos asocian la D-EP con la acumulación de cuerpos de Lewy en el neocórtex y el sistema límbico. Aunque frecuentemente coexiste patología de tipo Alzheimer, normalmente no alcanza suficiente gravedad como para hacer un diagnóstico de ambas enfermedades. Por otra parte, hay una fuerte evidencia de disfunción colinérgica en los trastornos cognitivos asociados a la EP.
A nivel farmacológico, la rivastigmina, en varias revisiones sistemáticas y metaanálisis, ha evidenciado la eficacia en la mejoría, además de la cognición, de los síntomas conductuales, alucinaciones, las actividades de la vida diaria, la carga del cuidador y la impresión global118,119 (NE-I). La rivastigmina es asimismo un fármaco seguro. Dos estudios que han analizado el efecto de la memantina en la EP con demencia no han encontrado mejorías en la función cognitiva global ni en los dominios cognitivos más específicos120,121 (NE-II). El tratamiento con donepezilo, mantenido durante 52 semanas, mostró una mejoría modesta, aunque significativa en el Mini-Examen del Estado Mental (Mini-Mental S tate E xamination [MMSE]), el NPI y las fluctuaciones de la cognición122 (NE-II).
Distintas guías proponen la memantina si los inhibidores de la acetilcolinesterasa no son bien tolerados, están contraindicados o falta de eficacia de los mismos35,85 (NE-III).
Se define como un declive del rendimiento cognitivo que aparece en el contexto de una EP establecida y que se asocia a ella, pero que no es suficientemente grave como para interferir de forma significativa en el desarrollo de las actividades instrumentales de la vida diaria. Los estudios sugieren que el DCL-EP es un factor de riesgo para el desarrollo de demencia y puede representar un estadio intermedio entre la normalidad y la demencia, por lo que detectar el DCL en la EP podría tener múltiples ventajas con relación al manejo clínico y pronóstico de los pacientes. Es por ello por lo que se están realizando esfuerzos para caracterizar el DCL-EP y desarrollar estrategias terapéuticas. En 2012 se publicaron los criterios específicos de DCL-EP123 (NE-IV), que han permitido avanzar mucho en este sentido (Tabla VI). Sin embargo, cabe señalar que los criterios diagnósticos de DCL-EP están todavía pendientes de una validación completa. Los datos actuales indican que los trastornos cognitivos en la EP son heterogéneos y los estudios longitudinales en marcha intentan caracterizar la existencia de perfiles de riesgo acorde a los subdominios afectados. Un estudio longitudinal ha mostrado cómo los déficits de características frontosubcorticales pueden permanecer durante años estables mientras que las alteraciones más corticales posteriores (déficits en memoria, fluencia verbal semántica, funciones visuoespaciales y visuoconstructivas) sí se han relacionado con un mayor riesgo de desarrollar D-EP124 (NE-II).
Algunos estudios muestran la dificultad de definir subgrupos de riesgo acorde a los criterios de subdominios afectados, ya que la mayoría de los pacientes con DCL-EP presentan una afectación de múltiples dominios124 (NE-II).
La prevalencia de DCL-EP en estudios transversales se sitúa alrededor de un 30% de los pacientes. Un estudio longitudinal reciente mostró que la mayoría de los pacientes diagnosticados de DCL-EP progresaron hacia D-EP en 6 años124 (NE-II).
Con relación al tratamiento farmacológico, a pesar de que en los últimos años se han llevado a cabo diversos estudios con agentes colinérgicos, dopaminérgicos y noradrenérgicos, no hay una evidencia clara de beneficio de ninguno de los tratamientos ensayados125. Los IMAO, como la rasagilina o la safinamida, los agonistas dopaminérgicos o la LD, pueden mejorar las funciones ejecutivas y la atención125 (NE-I). Un estudio controlado doble ciego reciente, con rivastigmina en parches de 9,5 mg/día, administrados durante 24 semanas, no ha mostrado cambios significativos126 (NE-I). Puesto que las alteraciones en el estado de ánimo afectan el rendimiento cognitivo, deberá valorarse individualmente el posible uso de antidepresivos y ansiolíticos.
Con relación a las terapias no farmacológicas, actualmente todavía existen pocos estudios de calidad que evalúen la eficacia de dichas intervenciones en los trastornos cognitivos asociados a la EP. Sin embargo, varias terapias se han mostrado prometedoras y existe evidencia creciente de su efecto positivo en la cognición de personas afectadas por la EP. Los datos actuales indican que el ejercicio físico (ver capítulo 12 sobre ejercicio físico en la enfermedad de Parkinson, pag. 307), especialmente el aeróbico, es un gran inductor de neuroplasticidad y tiene efectos beneficiosos en el funcionamiento cerebral y sobre la cognición127-132 (NE-I). Existen todavía pocos ensayos aleatorizados que demuestren una mejora de la cognición en personas con EP132 (NE-I). Un metaanálisis reciente ha mostrado que las intervenciones con ejercicio físico aeróbico tienen un efecto positivo en la función cognitiva de pacientes con demencia, independientemente del diagnóstico clínico y la frecuencia de la intervención127 (NE-I).

Respecto a las intervenciones mediante entrenamiento cognitivo basadas en la repetición de unas tareas estandarizadas133 (NE-I), un metaanálisis ha concluido que, aunque todavía hay pocos ensayos controlados y aleatorizados, el entrenamiento cognitivo es seguro y moderadamente efectivo para mejorar la cognición de pacientes con EP leve y moderada134 (NE-I).
Un estudio exploratorio reciente de baja calidad evaluó la capacidad cognitiva con rehabilitación para mejorar el deterioro cognitivo en pacientes con EP que recibieron entrenamiento cognitivo por ordenador. Se observaron algunos efectos significativos. Debido al carácter exploratorio del estudio y al pequeño tamaño de la muestra, no se pueden hacer recomendaciones a este respecto135 (NE-IV).
También recientemente se ha publicado un estudio con estimulación transcraneal de corriente directa (t-DCS) en la corteza prefrontal dorsolateral izquierda versus t-DCS simulada con el objetivo de evaluar el posible beneficio en el deterioro cognitivo leve en la EP en pacientes que reciben entrenamiento cognitivo por ordenador136,137 (NE-I). Aunque tuvo efectos positivos, al ser un estudio de baja calidad no se pueden obtener conclusiones para recomendaciones.

35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
85. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf- 1837629189061
116. Emre M, Aarsland D, Brown R, et al. Clinical diagnostic criteria for dementia associated with Parkinson’s disease. Mov Disord. 2007;22(12):1689-707.
117. Dubois B, Burn D, Goetz C, et al. Diagnostic procedures for Parkinson’s disease dementia: recommendations from the movement disorder society task force. Mov Disord. 2007;22(16):2314-24.
118. Pagano G, Rengo G, Pasqualetti G, et al. Cholinesterase inhibitors for Parkinson’s disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry.2015;86(7):767-73.
119. Wang HF, Yu JT, Tang SW, et al. Efficacy and safety of cholinesterase inhibitors and memantine in cognitive impairment in Parkinson’s disease, Parkinson’s disease dementia, and dementia with Lewy bodies: systematic review with meta-analysis and trial sequential analysis. J Neurol Neurosurg Psychiatry. 2015;86(2):135-43.
120. Stubendorff K, Larsson V, Ballard C, et al. Treatment effect of memantine on survival in dementia with Lewy bodies and Parkinson’s disease with dementia: a prospective study. BMJ Open. 2014;4(7):e005158.
121. Wesnes KA, Aarsland D, Ballard C, et al. Memantine improves attention and episodic memory in Parkinson’s disease dementia and dementia with Lewy bodies. Int J Geriatr Psychiatry. 2015;30(1):46-54.
122. Ikeda M, Mori E, Kosaka K, et al.; Donepezil-DLB Study Investigators. Long-term safety and efficacy of donepezil in patients with dementia with Lewy bodies: results from a 52-week, open-label, multicenter extension study. Dement Geriatr Cogn Disord. 2013;36(3-4):229-41.
123. Litvan I, Goldman JG, Tröster AI, et al. Diagnostic criteria for mild cognitive impairment in Parkinson’s disease: Movement Disorder Society Task Force guidelines. Mov Disord. 2012;27(3):349-56.
124. Williams-Gray CH, Evans JR, Goris A, et al. The distinct cognitive syndromes of Parkinson’s disease: 5 year follow-up of the CamPaIGN cohort. Brain. 2009;132(Pt 11):2958-69.
125. Pigott K, Rick J, Xie SX, et al. Longitudinal study of normal cognition in Parkinson disease. Neurology. 2015;85(15):1276-82.
126. Frakey L, Friedman J. The effects of rasagiline on cognition in mild to moderate stage Parkinson’s disease, a double-blind placebo controlled study. Arch Clin Neuropsychol. 2014;6:514.
127. Mamikonyan E, Xie SX, Melvin E, et al. Rivastigmine for mild cognitive impairment in Parkinson disease: a placebo-controlled study. Mov Disord. 2015;30:912-8.
128. Groot C, Hooghiemstra AM, Raijmakers PG, et al. The effect of physical activity on cognitive function in patients with dementia: A meta-analysis of randomized control trials. Ageing Res Rev. 2016;25:13-23.
129. Szuhany KL, Bugatti M, Otto MW. A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor. J Psychiatr Res. 2015;60:56-64.
130. Wang C, Yu JT, Wang HF, et al. Non-pharmacological interventions for patients with mild cognitive impairment: a meta-analysis of randomized controlled trials of cognition-based and exercise interventions. J Alzheimers Dis. 2014;42(2):663-78.
131. Erickson KI, Leckie RL, Weinstein AM. Physical activity, fitness, and gray matter volume. Neurobiol Aging. 2014;35 Suppl 2:S20-8.
132. Kelly ME, Loughrey D, Lawlor BA, et al. The impact of exercise on the cognitive functioning of healthy older adults: a systematic review and meta-analysis. Ageing Res Rev. 2014;16:12-31.
133. Kalron A, Zeilig G. Efficacy of exercise intervention programs on cognition in people suffering from multiple sclerosis, stroke and Parkinson’s disease: A systematic review and meta-analysis of current evidence. NeuroRehabilitation. 2015;37(2):273-89.
134. Peña J, Ibarretxe-Bilbao N, García-Gorostiaga I, et al. Improving functional disability and cognition in Parkinson disease: randomized controlled trial. Neurology. 2014;83(23):2167-74.
135. Leung IH, Walton CC, Hallock H, et al. Cognitive training in Parkinson disease: A systematic review and meta-analysis. Neurology. 2015;85(21):1843-51.
136. Cerasa A, Gioia MC, Salsone M, et al. Neurofunctional correlates of attention rehabilitation in Parkinson’s disease: an explorative study. Neurological Sci 2014;35:1173-1180
137. Biundo R, Weis L, Fiorenzato E, et al. Double-blind randomized trial of tDCS versus sham in Parkinson patients with mild cognitive impairment receiving cognitive training. Brain Stim 2015;8:1223-1225.


