


Como veíamos en el anterior capítulo, el diagnóstico de la EP es clínico, y resulta relativamente fácil cuando el paciente presenta los principales signos cardinales (temblor de reposo, bradicinesia y rigidez y una respuesta a la LD mantenida).
Sin embargo, en los estadios iniciales de la enfermedad, realizar un diagnóstico correcto y ser capaz de diferenciarlo de otros parkinsonismos puede resultar un auténtico reto diagnóstico para el neurólogo1. Con el fin de poder establecer el diagnóstico de EP, diferenciarlo de los parkinsonismos plus y parkinsonismos secundarios y poder monitorizar la progresión de la enfermedad, se ha considerado que la neuroimagen podría ser una herramienta de gran relevancia. No cabe duda de que un mejor diagnóstico permite poder tratar más adecuadamente a nuestros pacientes y ayuda a establecer un pronóstico más fiable
1. Beach TG, Adler CH. Importance of low diagnostic accuracy for early Parkinson’s disease. Mov Disord. 2018;33(10):1551-1554.
En la EP, los cambios observados en la RM cerebral están principalmente relacionados con la degeneración de las neuronas dopaminérgicas, localizadas a nivel de la sustancia negra (SN) del mesencéfalo y del incremento de depósito de hierro en estas regiones. La correcta visualización de estos cambios dependerá de la potencia de campo utilizado en la RM y las diferentes secuencias que, aunque cada vez su uso esté más extendido, no se disponen de protocolos estandarizados en la práctica clínica.
El papel de la RM estructural de 1,5 teslas (T) en pacientes con EP idiopática es controvertido, debido a la falta de signos específicos de la enfermedad y, de acuerdo con las guías del National Institute for Health and Care Excellence (NICE), no se debe utilizar para realizar el diagnóstico de la EP2 (NE-I). Sin embargo, en la práctica clínica, la imagen cerebral y en particular la RM suele realizarse al menos una vez durante el curso de la enfermedad, con el objetivo de detectar la presencia de lesiones estructurales que causen o contribuyan al parkinsonismo, poder identificar la magnitud y extensión de la enfermedad y ayudar a diferenciar la EP de otros parkinsonismos atípicos.
Los signos radiológicos que facilitan el diagnóstico de la EP y de los parkinsonismos atípicos son (Figuras 1-4):
En la EP, existen depósitos de hierro en la SN, visibles en secuencias T2 en la RM cerebral. Diferentes autores han publicado que este depósito de hierro puede incluso ayudarnos a diferenciar la PSP de la EP, ya que en la PSP existen depósitos de hierro mayores a nivel del tálamo, globo pálido y núcleo rojo. En cambio, en la AMS, a diferencia de la PSP y la EP, el depósito de hierro mayor está en el putamen3(NE-II).
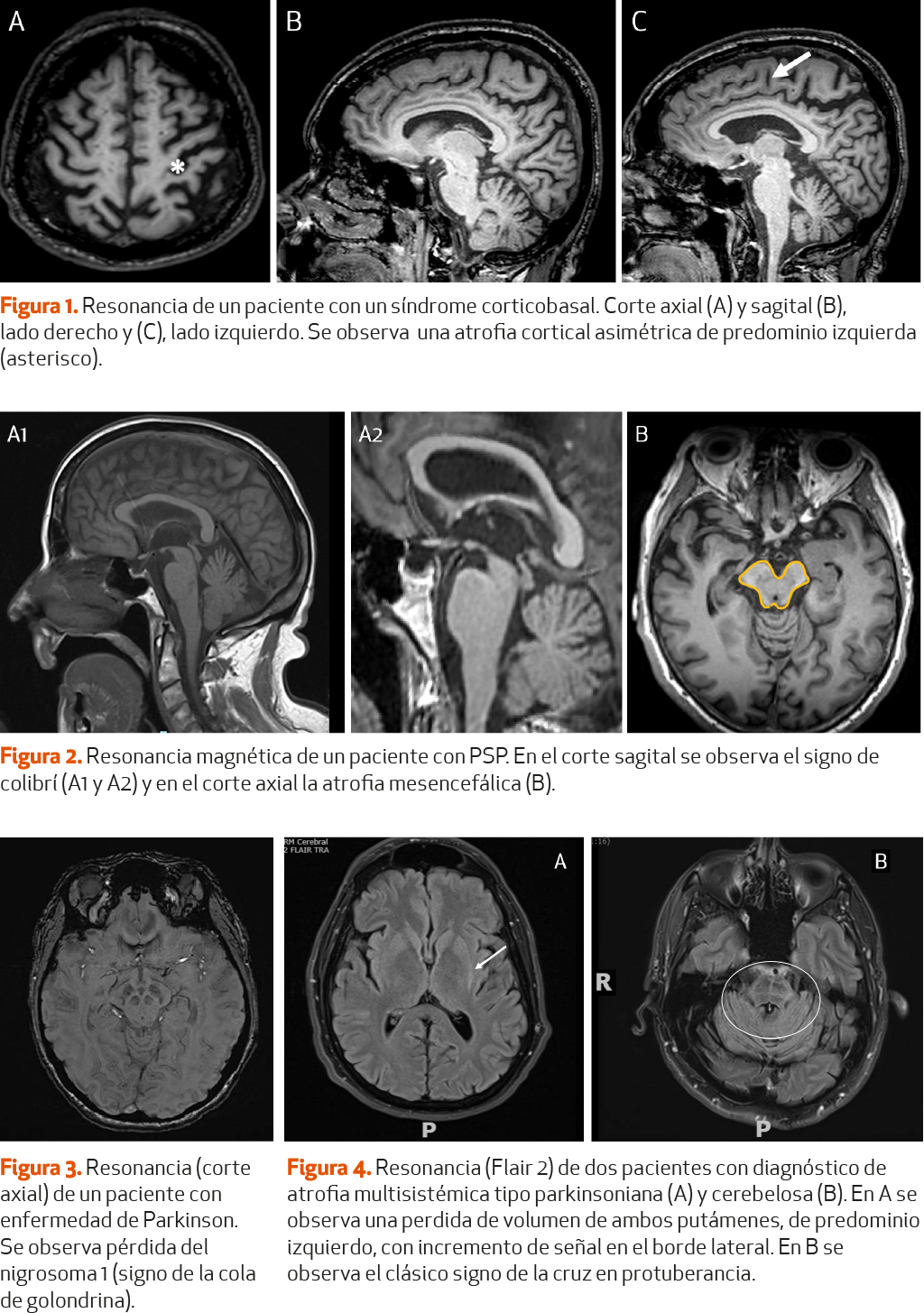
En la PSP existe una atrofia a nivel del mesencéfalo (tegmento y tubérculos cuadrigéminos superiores), junto con la conservación relativa de la morfología de la protuberancia, que permite observar en plano sagital el signo del colibrí (hummingbird sign) y en el plano axial, el signo de Mickey Mouse4. Determinados estudios han demostrado que estos hallazgos tienen una alta especificidad, del 99,5 y el 97,7% respectivamente para cada signo, pero una baja sensibilidad, del 51,6 y 38,6%5(NE-II) para el diagnóstico de PSP.
En la AMS-P, podemos encontrar una atrofia bilateral putaminal, con el signo del ribete o hiperintensidad en T2 del borde dorsolateral del putamen (putaminal rim sign) e hipointenso en T1. En la AMS-C destaca la atrofia del pedúnculo cerebeloso medio, cerebelo y puente del troncoencéfalo. En las formas cerebelosas de la AMS puede observarse el signo de la cruz (hot cross bun sign)4(NE-II) producido por una degeneración de las fibras pontocerebelosas que puede causar una hiperintensidad en el pedúnculo cerebral medio y protuberancia6,7(NE-II).
Estas anomalías en la neuroimagen son altamente específicas, pero su sensibilidad es relativamente baja, limitando su uso como biomarcador diferencial de parkinsonismos.
Como ya se ha explicado previamente, en la EP existen cambios degenerativos a nivel de la SN. Esta puede dividirse en la pars reticularis (SNpr) y la pars compacta (SNpc); esta última es la que alberga la mayoría de las neuronas dopaminérgicas. Aunque la composición estructural de estos elementos es sumamente compleja, se han identificado subregiones adicionales dentro de la SNpc conocidas como nigrosomas. Estas áreas se caracterizan por una densidad especialmente alta de neuronas dopaminérgicas y una concentración de hierro proporcionalmente baja. De los cinco nigrosomas totales, el nigrosoma-1 es el más grande y se ubica en la sección dorsal de la SNpc. Con las nuevas técnicas de alto campo de RM de 3 T o superiores y con las secuencias de alta resolución sensibles al hierro, como las secuencias ponderadas en T2* o las secuencias ponderadas en susceptibilidad (SWI), es posible visualizar estas estructuras en la RM. El nigrosoma-1 se visualiza como una estructura hiperintensa y ovalada en el segmento dorsolateral de la SNpc en estas secuencias, un signo radiológico conocido como cola de golondrina. En la EP existe una disminución en la concentración de neuronas dopaminérgicas y un aumento en los depósitos del hierro, siendo el nigrosoma-1 el más afecto, produciéndose una pérdida de la hiperintensidad (ausencia de cola de golondrina). Este signo radiológico ha demostrado en diversos estudios de metaanálisis una alta sensibilidad y especificidad en el diagnóstico de EP en estadios iniciales8 (NE-I). Sin embargo, no es signo patognomónico de la EP y la falta de protocolos estandarizados limita su uso en la práctica clínica.
La RM por volumetría permite cuantificar la atrofia cerebral. Se realiza de una forma semicuantitativa, definiendo a priori regiones de interés (ROI). Para poder diferenciar los diferentes síndromes parkinsonianos se han creado diferentes ROI, y ello ha permitido calcular las ratios de protuberancia, mesencéfalo y pedúnculos cerebelosos medio/superior, originando los índices de parkinsonismo en la RM9 (NE-II), muy útiles para el diagnóstico de PSP. Otros autores han destacado una pérdida de volumen pontocerebelar en la AMS10 (NE-II). En cambio, los volúmenes regionales suelen estar respetados en la EP.
La atrofia cerebral puede ser también evaluada a nivel global. La morfometría basada en vóxeles (VBM) es una técnica totalmente automatizada, independiente del evaluador, que no precisa una delimitación a priori de ROI. Usando esta técnica (VBM), en la EP diferentes autores han descrito una atrofia cortical sobre todo en áreas asociativas temporales, límbica, paralímbica, frontal y parietal11 (NE-II). Recientes estudios de VBM han descrito los siguientes hallazgos: en la EP se identifica una clara atrofia a nivel de los ganglios basales12 (NE-II) (debido a la degeneración nigroestriatal y la disfunción del circuito tálamo-cortical de los ganglios basales), lóbulo frontal y, de manera no específica, en el hipocampo derecho, circunvoluciones cinguladas anteriores izquierdas y giros temporales superiores. En pacientes con EP con disfunción respiratoria, se ha descrito un adelgazamiento cortical en la formación parahipocampal izquierda, giro fusiforme derecho, corteza cerebelosa derecha, y giros poscentrales izquierdos en comparación con los pacientes con EP con funciones pulmonares normales13 (NE-II). Por otro lado, en sujetos con EP avanzada, se descrito que la atrofia de la sustancia gris a nivel de las estructuras subcorticales es más pronunciada con respecto a los sujetos en etapas tempranas de la EP14 (NE-III), sirviendo de marcador de progresión de la enfermedad.
En la AMS se ha descrito una pérdida de volumen putaminal en comparación con la EP, siendo capaz de diferenciar la AMS/AMS-P de la EP con alta especificidad (92%), pero con una sensibilidad bastante baja (44%)15 (NE-II). Con respecto al diagnóstico diferencial entre los subtipos de AMS, recientes estudios han observado que tanto los pacientes con AMS-P como los de AMS-C pueden mostrar atrofia putaminal e infratentorial con considerable superposición. Sin embargo, la atrofia putaminal/ supratentorial ha demostrado ser más predominante en el subtipo AMS-P, mientras que la atrofia infratentorial lo es en el subtipo AMS-C16 (NE-III).
En cambio, en la PSP han encontrado una reducción de la sustancia blanca en protuberancia, mesencéfalo y adyacente a los ganglios basales, y reducción de la sustancia gris en tálamo, mesencéfalo, ganglios basales, corteza frontal e insular. En la PSP, la atrofia predominante a nivel del mesencéfalo se ha incorporado como una característica de imagen de apoyo en los criterios diagnósticos de la MDS17. Los autores han encontrado que las relaciones entre el área de la protuberancia y del mesencéfalo (P/M) y entre el grosor del pedúnculo cerebeloso medio y el pedúnculo cerebeloso superior (MCP/SCP) son mayores en la PSP que en la EP, AMS-P y controles. Utilizando estas relaciones, se calculó un índice como [(P/M) × (MCP/SCP)], denominado índice de parkinsonismo de RM, que demostró ser altamente sensible y específico para distinguir la PSP de la EP, AMS-P y los controles18 (NE-II). Se ha propuesto una versión revisada que incorpora el ancho del tercer ventrículo [índice de parkinsonismo de RM × (ancho del tercer ventrículo) / (ancho de los cuernos frontales)], que mostró una mayor sensibilidad (100%) y especificidad (94,3%) en la diferenciación de pacientes con parkinsonismo por PSP con lentitud de sacadas verticales de los de EP19 (NE-II).
La RM por difusión supone una técnica novedosa que permite valorar la integridad del cerebro a nivel microestructural, al medir el movimiento de las moléculas de agua, lo que posibilita medir la indemnidad de las fibras de la sustancia blanca. En general, en las enfermedades neurodegenerativas se produce un daño axonal y pérdida de neuronas asociado a un incremento en el movimiento de moléculas y por tanto el coeficiente de difusión. La imagen del tensor de difusión proporciona además información sobre la difusión media en un vóxel y la dirección de difusión (anisotropía fraccional). En general, la RM por difusión, a diferencia de la RM estructural, puede objetivar cambios más precoces estructurales que no son observados en la RM estructural normal.
Diferentes estudios han objetivado que la topografía del coeficiente de difusión, la difusión media y los cambios de anisotropía fraccional en los parkinsonismos atípicos muestran una alta correlación con los hallazgos histopatológicos. En este sentido, se ha observado un aumento regional de coeficiente de difusión en el pedúnculo cerebral medio que diferencia la AMS de la EP con una sensibilidad y especificidad del 84-100%20 (NE-III). Los pacientes con AMS-P presentan un aumento medio de la difusión en el putamen comparado con los pacientes con EP y PSP21 (NE-III). En cambio, los pacientes con PSP presentan una elevación del coeficiente de difusión regional en el mesencéfalo y globo pálido a diferencia de los pacientes con EP y AMS, y un aumento del coeficiente de difusión en el pedúnculo cerebeloso superior y núcleo caudado comparado con los pacientes con AMS22,23 (NE-III).
La secuencia de susceptibilidad magnética (SWI, susceptibility weighted imaging) se basa en una secuencia T2-3D con alta resolución espacial, que utiliza el artefacto de susceptibilidad de la sangre en los vasos como si fuera contraste intrínseco. Esto va a
permitir diferenciar y detectar sustancias ferromagnéticas, diamagnéticas, como las calcificaciones y los depósitos de minerales, y las sustancias paramagnéticas, que son los productos de degradación de la sangre, hemosiderina y desoxihemoglobina24 (NE-I).
Esta secuencia tiene especial interés en el estudio de pacientes con EP por el estudio de los depósitos anómalos de hierro a nivel cerebral, principalmente en la SN. En personas sanas, el mayor porcentaje de depósito de hierro se encuentra a nivel del putamen, el globo pálido y el núcleo caudado y, en menor proporción, a nivel de la SN y el locus coeruleus. Sin embargo, la presencia de depósitos anómalos del hierro generalmente se encuentra en enfermedades neurodegenerativas, como la enfermedad de Alzheimer y la EP. Existen diferentes estudios publicados que comparan la concentración de depósitos de hierro a nivel de la SN entre sujetos sanos y pacientes con EP, las diferencias son estadísticamente significativas desde estadios iniciales de la enfermedad, haciendo posible el diagnóstico25 (NE-III). Existe una nueva técnica de RM conocida con mapeo cuantitativo de susceptibilidad (siglas en inglés QSM), con una resolución mayor, pero su uso no está extendido en la práctica clínica habitual26 (NE-III).
Recientes estudios27 (NE-III) abogan por el uso de forma conjunta de la secuencia SWI, QSM y secuencias específicas de neuromelanina en RM de 3T, con el objetivo de estudiar de forma cualitativa y cuantitativa los depósitos anómalos de hierro, principalmente a nivel de la SN. Este estudio multiparamétrico permitiría el diagnóstico de EP en estadios precoces, pero también evaluar el grado de progresión de la enfermedad.
La espectroscopia protónica por RM permite la valoración de ciertas moléculas implicadas en la bioenergía cerebral y en integridad neuronal. Particularmente, la ratio de N-acetil aspartato (NAA), como un marcador de integridad neuronal, y la creatina (Cr), como un marcador de metabolismo energético, son los pilares donde se han centrado diferentes estudios realizados en síndromes parkinsonianos. Concretamente en pacientes con EP y deterioro cognitivo, se ha descrito una disminución regional de NAA/Cr28,29 (NE-III). No obstante, el principal factor limitante es que los hallazgos pueden ser equívocos en estadios iniciales de la EP.
Esta técnica de RM evalúa la energía transferida entre protones que se unen fuertemente a estructuras como la mielina con protones con alta movilidad en el agua. Por tanto, la magnitud de ratio de transferencia de la magnetización es altamente dependiente de la mielinización axonal. Esta técnica puede observar alteraciones que se producen en la desmielinización en enfermedades neurodegenerativas. En este sentido, se ha observado reducción de la ratio de transferencia de la magnetización en el núcleo caudado, putamen, tálamo y en la sustancia blanca periventricular, frontal y parietal en los síndromes parkinsonianos, pero todavía no se tiene la suficiente experiencia como para poder diferenciar los diferentes síndromes parkinsonianos.
La RM de 7 teslas (RM 7T) permite visualizar la anatomía de la SN. Usando esta técnica se ha observado una hiperintensidad en secuencias T2 de la SN en sujetos normales, y su ausencia en pacientes con EP debido a una pérdida de neuronas con melanina (nigrosomas) en la parte reticulada de la SN, y mayor depósito de hierro. La precisión diagnóstica de la RM 7 T para visualizar los nigrosomas tiene una sensibilidad del 100%, una especificidad del 87-100%, un valor predictivo positivo del 91-100% y un valor predictivo negativo del 100%, con un acuerdo intra e interevaluador alto. No obstante, las principales limitaciones que tiene todavía son la transmisión de campos no homogéneos, altos artefactos por movilidad y la alta intensidad de la señal depositada30 (NE-IV).
La neuromelanina (NM) es un pigmento que se produce durante la oxidación de la dopamina, y se encuentra principalmente a nivel de la SN y el locus coeruleus. Desde la introducción de secuencias de RM sensibles a la NM31, esta técnica ha adquirido una gran importancia en estudios de investigación con el objetivo de realizar un diagnóstico precoz de la EP y la diferenciación entre la EP, el temblor esencial (ET) y los parkinsonismos atípicos. Numerosos estudios han demostrado la existencia de niveles disminuidos de NM a nivel de la SN en fases precoces de la EP32 (NE-III). Actualmente esta técnica se utiliza en el campo de la investigación.


1. Beach TG, Adler CH. Importance of low diagnostic accuracy for early Parkinson’s disease. Mov Disord. 2018;33(10):1551-1554.
2. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf 1837629189061
3. Han YH, Lee JH, Kang BM, et al. Topographical differences of brain iron deposition between progressive supranuclear palsy and parkinsonian variant multiple system atrophy. J Neurol Sci. 2013;325(1-2):29-35.
4. Saeed U, Compagnone J, Aviv RI, et al. Imaging biomarkers in Parkinson’s disease and Parkinsonian syndromes. Current and emerging concepts. Transl Neurodegener. 2017;6:8.
5. Mueller C, Hussl A, Krismer F, et al. The diagnostic accuracy of the hummingbird and morning glory sign in patients with neurodegenerative parkinsonism. Parkinsonism Relat Disord. 2018;54:90-94
6. Wenning GK, Colosimo C, Geser F, et al. Multiple system atrophy. Lancet Neurol. 2004;3(2):93-103. 7. Schwarz J, Weis S, Kraft E, et al. Signal changes on MRI and increases in reactive microgliosis, astrogliosis, and iron in the putamen of two patients with multiple system atrophy. J Neurol Neurosurg Psychiatry. 1996;60(1):98-101.
7. Schwarz J, Weis S, Kraft E, et al. Signal changes on MRI and increases in reactive microgliosis, astrogliosis, and iron in the putamen of two patients with multiple system atrophy. J Neurol Neurosurg Psychiatry. 1996;60(1):98-101.
8. Mahlknecht P, Krismer F, Poewe W, et al. Meta-analysis of dorsolateral nigral hyperintensity on magnetic resonance imaging as a marker for Parkinson’s disease. Mov Disord. 2017;32(4):619-623.
9. Quattrone A, Nicoletti G, Messina D, et al. MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology. 2008;246(1):214-21.
10. Paviour DC, Price SL, Jahanshahi M, et al. Regional brain volumes distinguish PSP, MSA-P, and PD: MRI-based clinico-radiological correlations. Mov Disord. 2006;21(7):989-96.
11. Pereira JB, Ibarretxe-Bilbao N, Marti MJ, et al. Assessment of cortical degeneration in patients with Parkinson’s disease by voxel-based morphometry, cortical folding, and cortical thickness. Hum Brain Mapp. 2012;33(11):2521-34.
12. Xu X, Han Q, Lin J, et al. Grey matter abnormalities in Parkinson’s disease: a voxel-wise meta-analysis. Eur J Neurol. 2019; 27:653-9.
13. Lee SY, Chen MH, Chiang PL, et al. Reduced gray matter volume and respiratory dysfunction in Parkinson’s disease: a voxel-based morphometry study. BMC Neurol. 2018;18:73.
14. Blair JC, Barrett MJ, Patrie J, et al. Brain MRI reveals ascending atrophy in Parkinson’s disease across severity. Front Neurol. 2019;10:1329.
15. Massey LA, Micallef C, Paviour DC, et al. Conventional magnetic resonance imaging in confirmed progressive supranuclear palsy and multiple system atrophy. Mov Disord. 2012;27:1754-62.
16. Krismer F, Seppi K, Göbel G, et al. Morphometric MRI profiles of multiple system atrophy variants and implications for differential diagnosis. Mov Disord 2019;34:1041-8.
17. Höglinger GU, Respondek G, Stamelou M, et al. Clinical diagnosis of progressive supranuclear palsy: the movement disorder society criteria. Mov Disord. 2017;32:853-64.
18. Quattrone A, Nicoletti G, Messina D, et al. MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology. 2008;246:214-21.
19. Lee W. Conventional Magnetic Resonance Imaging in the Diagnosis of Parkinsonian Disorders: A Meta-Analysis. Mov Disord Clin Pract. 2020;8(2):217-223.
20. Nicoletti G, Lodi R, Condino F, et al. Apparent diffusion coefficient measurements of the middle cerebellar peduncle differentiate the Parkinson variant of MSA from Parkinson’s disease and progressive supranuclear palsy. Brain. 2006;129(Pt 10):2679-87.
21. Baudrexel S, Seifried C, Penndorf B, et al. The value of putaminal diffusion imaging versus 18-fluorodeoxyglucose positron emission tomography for the differential diagnosis of the Parkinson variant of multiple system atrophy. Mov Disord. 2014;29(3):380-7.
22. Tsukamoto K, Matsusue E, Kanasaki Y, et al. Significance of apparent diffusion coefficient measurement for the differential diagnosis of multiple system atrophy, progressive supranuclear palsy, and Parkinson’s disease: evaluation by 3.0-T MR imaging. Neuroradiology. 2012;54(9):947-55.
23. Erbetta A, Mandelli ML, Savoiardo M, et al. Diffusion tensor imaging shows different topographic involvement of the thalamus in progressive supranuclear palsy and corticobasal degeneration. AJNR. 2009;30(8):1482-7.
24. Bajaj S, Krismer F, Palma JA, et al. Diffusion-weighted MRI distinguishes Parkinson disease from the parkinsonian variant of multiple system atrophy: A systematic review and meta-analysis. PLoS One. 2017;12(12):e0189897.
25. Martín-Bastida A, Lao-Kaim NP, Loane C, et al. Motor associations of iron accumulation in deep grey matter nuclei in Parkinson’s disease. A crosssectional study of iron-related magnetic resonance imaging susceptibility. Eur J Neurol. 2017;24:357-365.
26. Langkammer C, Pirpamer L, Seiler S, et al. Quantitative Susceptibility Mapping in Parkinson’s Disease. PLoS One. 2016; 11(9):e0162460.
27. Cao Q, Huang J, Tang D, et al. Application value of multiparametric MRI for evaluating iron deposition in the substantia nigra in Parkinson’s disease. Front Neurol. 2023;13:1096966.
28. Wang Y, Butros SR, Shuai X, et al. Different iron-deposition patterns of multiple system atrophy with predominant parkinsonism and idiopathetic Parkinson diseases demonstrated by phase-corrected susceptibility-weighted imaging. AJNR. 2012;33(2): 266-73.
29. Lewis SJ, Shine JM, Duffy S, et al. Anterior cingulate integrity: executive and neuropsychiatric features in Parkinson’s disease. Mov Disord. 2012;27(10):1262-7.
30. Lehericy S, Bardinet E, Poupon C, et al. 7 Tesla magnetic resonance imaging: a closer look at substantia nigra anatomy in Parkinson’s disease. Mov Disord. 2014;29(13):1574-81.
31. Sasaki M, Shibata E, Tohyama K, et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson’s disease. Neuroreport. 2006;17:1215-1218.
32. Jin L, Wang J, Wang C, et al. Combined visualization of nigrosome-1 and neuromelanin in the substantia nigra using 3T MRI for the differential diagnosis of essential tremor and de novo Parkinson’s disease. Front Neurol. 2019;10:100
La neurosonografía es una técnica no invasiva, de bajo coste y de ejecución rápida y cómoda para el sujeto de estudio, lo que ha facilitado que el volumen de sujetos estudiados sea elevado, favoreciendo la calidad y cantidad de la evidencia científica acumulada33 (NE-III).
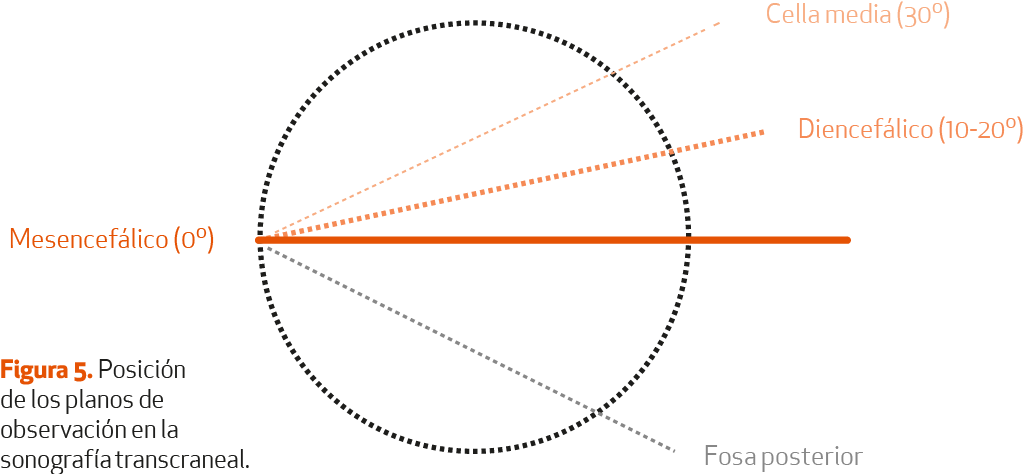
La sonografía transcraneal (STC) del parénquima o mesencefálica debe ser realizada por exploradores experimentados de acuerdo con una sistemática estandarizada (Tabla I). Se trata de una ecografía en modo dúplex, que se realiza con el paciente en decúbito supino, con el cabecero elevado unos 30 grados. La sonda se coloca sobre la escama temporal, en la línea orbitomeatal en ambos lados, con una inclinación variable en los planos de observación mesencefálico (SN, rafe y núcleo rojo) y diencefálico (ventrículos laterales, tercer ventrículo, ganglios basales) (Figura 5).

La ausencia de una ventana temporal suficiente puede limitar su aplicación en un 5-15% de los sujetos, en especial mujeres de edad avanzada y sujetos asiáticos (15-60%). Se requiere un entrenamiento específico, asistido por expertos, y experiencia documentada suficiente34 (NE-IV). Bajo estas condiciones, la reproducibilidad y la concordancia intra e interobservador son elevadas.
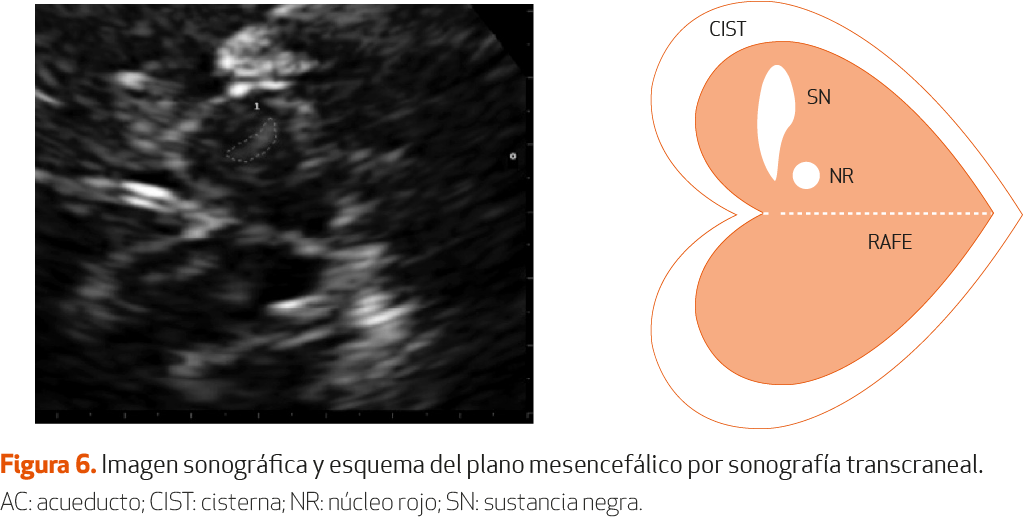
En el plano axial mesencefálico (Figura 6) se visualiza el mesencéfalo en forma de mariposa delimitada por la hiperecogenicidad de las cisternas basales. En la región anterior ipsilateral se observan unas señales hiperecogénicas confluentes: corresponden a la SN mesencefálica, el principal biomarcador detectado por STC. El área de ecogenicidad de la SN sigue una distribución normal en la población, considerándose la SN hiperecogénica (hiperecogenicidad marcada, SN+) cuando su área supera el percentil 90 (P90) de una muestra de sujetos control. No se han observado variaciones significativas en la ecogenicidad de la SN según la raza, aunque sí entre ecógrafos de distintos fabricantes. Para los equipos de última generación el punto de corte de hiperecogenicidad marcada está en torno a 0,25-0,30 cm2, mientras que está en torno a 0,20 cm2 para los más antiguos34 (NE-IV).
La hiperecogenicidad de la SN en pacientes con EP fue descrita por primera vez en el año 199533. A día de hoy, el mecanismo exacto por el que se produce este fenómeno no es del todo conocido, pero sí se sabe que intervienen diferentes procesos, como son la alteración en el depósito de hierro a nivel del mesencéfalo (principalmente debido a la alteración en el metabolismo del hierro)35 y los procesos de neuroinflamación que incluyen la activación de la microglía y la presencia de gliosis36 (NE-II). Por otra parte, hay que saber que estos cambios también han sido descritos en pacientes con parkinsonismos atípicos, como PSP y AMS, pero la incidencia en la EP es mayor. En recientes metaanálisis se estima una prevalencia de hiperecogeneidad en EP idiopática en torno al 84%37, con una sensibilidad en torno al 80-95% y una especificidad que varía entre el 60 y el 96%37 (NE-I). La hiperecogenicidad de la SN en pacientes con EPI suele ser unilateral o bilateral asimétrica, sin correlacionarse con la gravedad o duración de la enfermedad39 (NE-IV). Además, se ha observado una mayor hiperecogeneidad en EP de subtipo no tremórico y su ausencia en sujetos con EP podría predecir una peor respuesta al tratamiento dopaminérgico40 (NE-IV).
¿Cómo interpretar la hiperecogenicidad de la SN en sujetos control? La mayoría de estos individuos (en torno al 80%) no desarrollará nunca una EPI, pero su riesgo relativo es de 17,37 veces el de la población con SN normal, y de hasta 48,39 si se combina con anosmia o signos motores sutiles41 (NE-IV). Diversos autores han comunicado la conversión clínica a EPI de sujetos controles con hiperecogenicidad de la SN. La frecuencia de hiperecogenicidad de la SN es mayor del 10% en sujetos control con factores de riesgo para EPI, como el sexo masculino, la edad avanzada y los antecedentes familiares de EP, y mayor aún en presencia de hiposmia, trastorno del sueño REM y depresión.
La hiperecogenicidad de la SN se encuentra presente también en pacientes con EP monogénicas (PARK-SCNA, PARK-parkin, PARK-PINK1, PARK-DJ1, PARK-LRRK2)42
(NE-IV), con la excepción de la enfermedad de Kufor-Rakeb (PARK-ATP13A2). La hiperecogenicidad también está presente en la EP asociada a mutaciones en el gen de la glucocerebrosidasa (PARK-GBA o enfermedad de Gaucher) y en portadores asintomáticos de mutaciones en este gen43 (NE-IV). La hiperecogenicidad bilateral simétrica es más frecuente en pacientes con deterioro cognitivo asociado a EP. Varios autores han observado áreas de ecogenicidad mayores en el lado contralateral al hemicuerpo más afecto. La hipoecogenicidad del rafe se ha asociado a depresión y disfunción urinaria, la dilatación de ventrículos laterales con el deterioro cognitivo, y la hiperecogenicidad del caudado con psicosis dopaminérgica44 (NE-IV).
Diversos estudios han demostrado que la STC es útil para el diagnóstico diferencial de la EPI con el temblor esencial, en el que la SN es normal por definición. No obstante, la frecuencia de SN+ puede ser algo superior a la población normal, probablemente a expensas de aquellos pacientes en los que el temblor esencial es prodrómico de una EPI45 (NE-I). Recientes estudios de metaanálisis describen una sensibilidad entre el 69-85% (IC 95) y una especificidad entre el 77-91% (IC 95) en el diagnóstico diferencial entre EPI y temblor esencial con el uso de ecografía de la SN37 (NE-I). También se ha observado que pacientes con temblor esencial e hiperecogeneidad en la SN tienen un riesgo mayor de desarrollar EP en los próximos 5 años, que es mayor si además asocian alteraciones en la fase REM del sueño46 (NE-II).
En el caso de la entidad conocida como escáner sin evidencia de degeneración dopaminérgica (scans without evidence of dopaminergic deficiency [SWEDD]) y el parkinsonismo vascular, la proporción de SN+ es similar a la población control46 (NE-IV).
Respecto al parkinsonismo inducido por fármacos con SN+, lo que probablemente ocurra es que el uso de fármacos ha desenmascarado la EP47 (NE-IV). Estudios prospectivos recientes indican que la ecogenicidad normal de la SN se asocia con una alta probabilidad de reversibilidad de los síntomas en estos pacientes, con elevado valor predictivo negativo para descartar EPI subyacente desenmascarada (96%)48 (NE-I).
En el caso de los parkinsonismos atípicos AMS, PSP, DCB y DCL, la STC tiene especial interés, ya que no solo la frecuencia de SN+ es menor que en la EPI (AMS 20% y PSP 30-39%), sino que hay otras alteraciones sonográficas más específicas que apoyan el diagnóstico de forma positiva (Figura 7). En este sentido, destacan la hiperecogenicidad del núcleo lenticular (LN+), la ampliación del tercer ventrículo (IIIV+) y la simetría en la hiperecogenicidad de la SN49 (NE-III). La combinación de SN normal y LN+ tiene una buena rentabilidad diagnóstica para discriminar parkinsonismo atípico frente a EPI (especificidad y valor predictivo positivo cercano al 100%, sensibilidad del 59%), mientras que la de SN+ y lenticular normal diagnostica EPI frente a parkinsonismo atípico con valores predictivos sobre el 90% (positivo 91%, negativo 96%)50,51 (NE-I).

Recientes estudios de metaanálisis37,38 concluyen que la ecografía de la SN permite el diagnóstico diferencial entre EP y otros parkinsonismos (AMS-P, PSP y DCB principalmente), observándose una sensibilidad del 65-93% (IC 95) y una especificidad del 70% (IC 95) entre EPI y AMS (NE-I); una sensibilidad del 83% (IC 95) y especificidad del 71% (IC 95) entre la EPI y PSP (NE-I). En el caso del diagnóstico diferencial entre PSP y DCB (NE-II), es importante valorar de forma conjunta SN, ecogenicidad lenticular y tamaño del tercer ventrículo. Estudios más recientes de práctica clínica real muestran una utilidad diagnóstica más baja si únicamente se considera la hiperecogenicidad de la SN como variable ultrasonográfica (Tabla II)40 (NE-IV).


33. Becker G, Seufert J, Bogdahn U, et al. Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography. Neurology. 1995;45(1):182-4.
34. Walter U. How to measure substantia nigra hyperechogenicity in Parkinson disease:detailed guide with video. J Ultrasound Med. 2013;32(10):1837-43.
35. Behnke S, Berg D, Naumann M, et al. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry.2005;76(3):423-5.
36. Berg D, Godau J, Riederer P, et al. Microglia activation is related to substantia nigraechogenicity. J Neural Transm (Vienna). 2010;117(11):1287-92.
37. Shafieesabet A, Fereshtehnejad SM, Shafieesabet A, et al. Hyperechogenicity of substantia nigra for differential diagnosis of Parkinson’s disease: A meta-analysis. Parkinsonism Relat Disord. 2017;42:1-11.
38. Mei YL, Yang J, Wu ZR, et al. Transcranial Sonography of the Substantia Nigra for the Differential Diagnosis of Parkinson’s Disease and Other Movement Disorders: A Meta-Analysis. Parkinsons Dis. 2021;2021:8891874.
39. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain. 2007;130(Pt 7):1799-807.
40. Fernández Moreno C, Arjona Padillo A. Neuroimagen estructural: tomografía axial computarizada, resonancia magnética y ecografía craneal. En: Escamilla Sevilla F, González
41. Berg D, Seppi K, Liepelt I, et al. Enlarged hyperechogenic substantia nigra is related to motor performance and olfaction in the elderly. Mov Disord. 2010;25(10):1464-9.
42. Brockmann K, Groger A, Di Santo A, et al. Clinical and brain imaging characteristics in leucine-rich repeat kinase 2-associated PD and asymptomatic mutation carriers. Mov Disord. 2011; 26(13): 2335-42.
43. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS [corrected] recommendations for the diagnosis of Parkinson’s disease. Eur J Neurol. 2013 Jan;20(1): 16-34. Erratum in: Eur J Neurol. 2013 Feb;20(2):406.
44. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain. 2007;130(Pt 7):1799-807.
45. Lauckaite K, Rastenyte D, Surkiene D, et al. Ultrasonographic (TCS) and clinical findings in overlapping phenotype of essential tremor and Parkinson’s disease (ET-PD). BMC Neurol. 2014;14(54):54.
46. Heim B, Peball M, Hammermeister J, et al. Differentiating Parkinson’s Disease from Essential Tremor Using Transcranial Sonography: A Systematic Review and Meta-Analysis. J Parkinsons Dis. 2022;12(4):1115-1123.
47. Skidmore F, Anderson K, Fram D, Weiner W. Psychogenic camptocormia. Mov Disord. 2007;22(13):1974-5.
48. López-Sendón Moreno JL, Alonso-Cánovas A, Buisán Catevilla J, et al. Substantia nigra echogenicity predicts response to drug withdrawal in suspected drug-induced parkinsonism. Mov Disord Clin Pract. 2016;3:268-74.
49. Behnke S, Berg D, Naumann M, et al. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry. 2005;76(3):423-5.
50. Alonso-Canovas A, Tembl Ferrairó JI, Martínez-Torres I, et al. Transcranial sonography in atypical parkinsonism: How reliable is it in real clinical practice? A multicentre comprehensive study. Parkinsonism Relat Disord. 2019 Nov;68:40-45.
51. Tao A, Chen G, Deng Y, et al. Accuracy of Transcranial Sonography of the Substantia Nigra for Detection of Parkinson’s Disease: A Systematic Review and Meta-analysis. Ultrasound Med Biol. 2019 Mar;45(3):628-641.
Las técnicas de imagen de Medicina Nuclear requieren la administración de un radiofármaco que nos permitirá la evaluación del parámetro molecular de interés, y la adquisición de las imágenes. Estas pueden ser planares (gammagrafía) o por SPECT o PET, dependiendo del tipo de emisión radiactiva del radiofármaco empleado.
Los radiofármacos son medicamentos que contienen una dosis traza de una molécula (no tiene efecto terapéutico), que se une a un isotopo radiactivo. Los isotopos se pueden dividir en emisores gamma (99mtecnecio, 123iodo) con un periodo de semidesintegración radiactivo de varias horas, o emisores de positrones (generalmente 18flúor y excepcionalmente 11carbono) con un periodo de semidesintegración radiactivo corto (110 minutos en el caso del 18flúor, o 10 minutos en el caso del 11carbono).
Los equipos de tomográficos son actualmente equipos multimodalidad que incluyen una tomografía computarizada (SPECT/CT o PET/CT) o una RM (PET/RM) y mejoran la visualización de las estructuras cerebrales y la corrección de la atenuación. Asimismo, los equipos digitales de última generación tanto de SPECT como de PET han optimizado las prestaciones de tiempos de realización de las imágenes como parámetros de calidad de imagen como la sensibilidad y resolución espacial.
La imagen dopaminérgica mediante técnicas de medicina nuclear permite evaluar tanto la vía presináptica (nigroestriatal) como la postsináptica (unión a receptores dopaminérgico D2).
Este tipo de imágenes muestran la degeneración de la sustancia nigra mediante la evaluación de las terminales dopaminérgicas que proyectan al estriado.
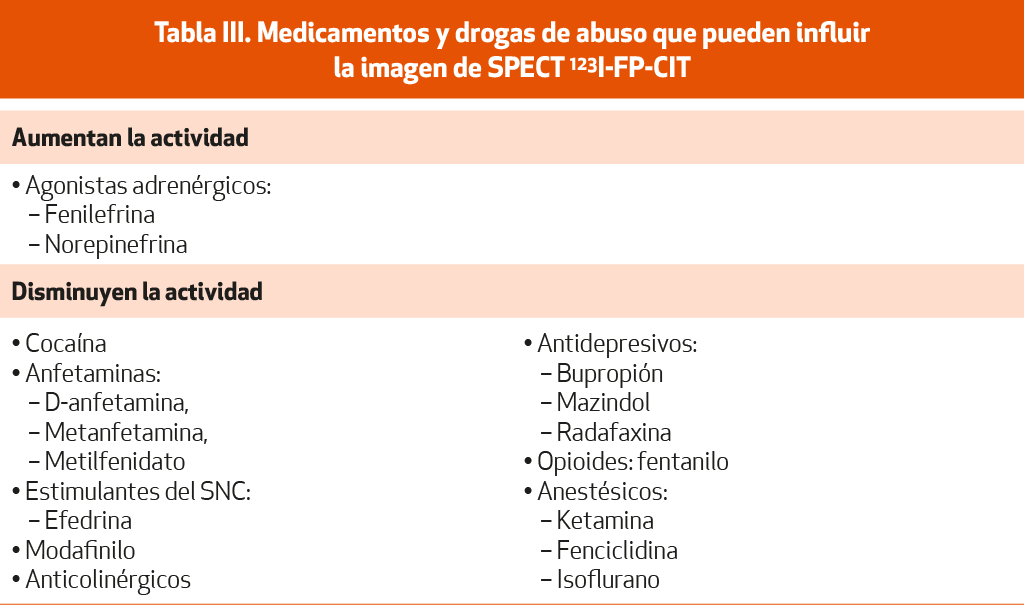
El radiofármaco de SPECT que más se emplea en clínica es el ioflupano o N-3-fluo- ropropil-2b-carbometoxi-3b-(4-iodofenil) nortropano marcado con 123I (123I-FP-CIT o DaTSCAN©). Este radiofármaco se une al transportador activo de dopamina (DAT, de sus siglas en ingles) en las terminales del neoestriado reflejando la densidad del mismo. Para la realización del estudio, es necesario reducir la exposición de la tiroides a la radiación del 123I libre mediante una dosis única de solución oral de yoduro de potasio o solución de Lugol (equivalente a 100 mg de yoduro) o tableta de yoduro de potasio, perclorato de potasio (400 mg) o perclorato de sodio (600 mg). Según la ficha técnica del producto, hay que tener en cuenta los medicamentos y drogas de abuso con afinidad por los trasportadores monoaminérgicos que pueden influir en el análisis visual o cuantitativo del (123I-FP-CIT) (Tabla III)52. Otros medicamentos que también pueden influir en el resultado de la SPECT son los antagonistas del canal del calcio, la digoxina y la amiodarona. La toma de LD y agonistas dopaminérgicos (AD) no interfiere con la unión al DAT52.
Tras la administración del 123I-FP-CIT o DaTSCAN©, deben transcurrir entre 3 y 6 horas antes de realizar las imágenes de SPECT. La unión normal del radiotrazador en los estriados se visualizan como dos regiones simétricas brillantes en forma de coma, que indican una actividad intensa en el núcleo caudado y putamen. Cualquier cambio en esta morfología indica la presencia de una lesión presináptica nigroestriatal(Figura 8). La evaluación visual de las imágenes suele ser suficiente para evaluar la simetría estriatal izquierda/derecha y las subregiones estriatales. No obstante, los equipos de SPECT/CT vienen provistos de estaciones de trabajo con programas informáticos que proporcionan un análisis cuantitativo de la actividad de las diferentes estructuras estriatales respecto a la corteza occipital ya que no recibe a penas terminales dopaminérgicas (índice estriado/occipital). Los valores de este índice se deberán comparar con una base de datos de normalidad ajustada por edad ya que el 123I-FP-CIT experimenta una disminución de la unión al DAT con la edad52.
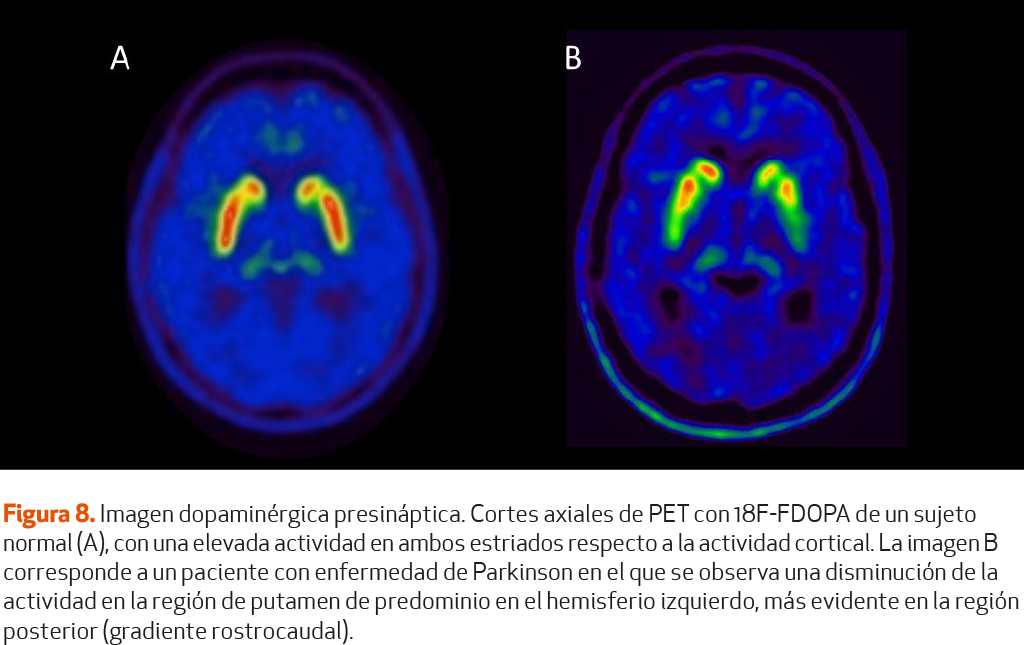
Para los estudios de PET se dispone actualmente en España de 3,4-dihydroxy-6-[18F] fluoro-L-phenylalanine (18F-FDOPA) (Figura 8). La PET con 18F-FDOPA se ha utilizado históricamente para la evaluación de síndromes parkinsonianos en entornos de investigación53. Sin embargo, con el incremento de disponibilidad de equipos PET y la comercialización de la 18F-FDOPA, esta técnica se ha integrado a la práctica clínica como herramienta de diagnóstico clínico. La PET con 18F-FDOPA refleja el transporte de la dopamina en el terminal presináptico, la metabolización de la dopamina por la dopa-descarboxilasa (cataliza la conversión del 18F-dopa en 18F-dopamina), y la capacidad de almacenamiento de la dopamina. De la misma forma que en el tratamiento con LD, es necesario administrar un inhibidor periférico de la dopadecarboxilasa sistémico que no atraviesa la barrera hematoencefálica (generalmente 150 mg de carbidopa una hora antes de la administración de 18F-FDOPA). Además, se deberá suprimir la toma de LD en las 12 horas anteriores y los agonistas dopaminérgicos 24 horas. La mayor resolución espacial de la PET facilita la valoración visual de las diferentes estructuras estriatales (caudado, putamen anterior y posterior). Al igual que con el 123I-FP-CIT, se obtienen valores de captación de las áreas del estriado respecto a la captación occipital como complemento a la interpretación visual. No obstante, la PET con 18F-FDOPA permite además cuantificar la constante de descarboxilación (Ki).
Existen otros radiofármacos PET que se emplean en la valoración de la actividad dopaminérgica presináptica como la dihidrotetrabenazina marcada con 11carbono o 18flúor (11C-DTBZ, 18F-FP-DTBZ) que mide la actividad del transportador vesicular de DA (VMAT2). No obstante, estos estudios se realizan en el ámbito de la investigación.
Los nuevos radiofármacos de unión a DAT para PET ofrecen numerosas ventajas respecto al 123I-FP-CIT de SPECT. El más desarrollado es el N-(3-iodoprop-2E-enyl)- 2β-carbo[18F]fluoroethoxy-3β-(4-methylphenyl)-nortropane (18F-FE-PE2I). Muestra una cinética más rápida, reduciendo el tiempo entre inyección y adquisición a 15-20 minutos, una elevada afinidad (KD = 12nM), mayor selectividad DAT/SERT (ratio de 29,4 frente a 2,78 con 123I-FP-CIT), y no requiere bloqueo del tiroides54 (NE-II). Es muy probable que este radiofármaco llegue a comercializarse en breve para su uso clínico.
Los radiotrazadores más utilizados para obtener imágenes de receptores tipo D2 con SPECT han sido 123I-IBZM y para PET el 11C-raclopride. Estos derivados antagonistas del receptor de dopamina no son radiofármacos selectivos para el receptor D2, ya que también se unen al receptor D3. Sin embargo, la gran mayoría de los receptores tipo D2 en el cuerpo estriado son receptores D2. El uso clínico de los trazadores SPECT o PET para la obtención de imágenes dopaminérgicas postsinápticas está actualmente limitado por no estar disponibles en varios países y se ha sugerido que la PET con 18F-FDG supera a las imágenes SPECT D2 para el diagnóstico diferencial de los parkinsonismos como describimos en el siguiente apartado.
La actividad sináptica neuronal se puede evaluar mediante la PET con 2-[18F] fluoro- 2-desoxi-D-glucosa (18F-FDG) o, en su defecto, mediante la SPECT de perfusión con hexametilpropilenoamina oxima marcada con 99mtecnecio (99mTc-HMPAO).
El metabolismo de glucosa cerebral medido mediante la 18F-FDG se correlaciona estrechamente con la actividad e integridad sináptica55. La disfunción sináptica observada en los estudios PET con 18F-FDG antecede a la neurodegeneración por lo que permite su empleo en estadios relativamente tempranos de la enfermedad, antes de que la muerte neuronal sea apreciable por técnicas de imagen basadas en la estructura o anatomía (por ejemplo, secuencias estructurales en RMN cerebral o la TC cerebral).
El análisis de las imágenes en la práctica clínica se realiza visualmente de acuerdo con patrones establecidos para cada entidad. Sin embargo, actualmente las estaciones de trabajo de los equipos PET vienen provistos de programas de análisis cuantitativo basado en vóxeles, que permiten comparar las imágenes de un individuo respecto a una base de datos de normalidad ajustada por edad, mostrando las áreas de aumento o disminución de la actividad sináptica que sirven como complemento al análisis visual que disminuye la variabilidad inter- e intraevaluador.
La imagen de inervación simpática miocárdica se realiza mediante la gammagrafía con 123I-metayodobencilguanidina marcado con 123I (123I-MIBG). La 123I-MIBG es un análogo de noradrenalina que es transportado a los gránulos de noradrenalina de las terminales nerviosas simpáticas y visualiza la integridad de la inervación simpática cardiaca.
Existen una serie de fármacos que prolongan o reducen la captación de 123I-MIBG (Tabla IV) y que deben interrumpirse antes de la administración de 123I-MIBG, generalmente durante cuatro vidas medias biológicas que son necesarias para su completa eliminación. Al igual que con el 123I-FP-CIT, es necesario bloquear la actividad tiroidea.

La valoración visual se encuentra limitada por la heterogeneidad de la captación miocárdica, por lo que se utilizan el índice de captación corazón/ mediastino y la tasa de lavado.
En la EP, los estudios se centran principalmente en la valoración de la vía dopaminérgica nigro-estriatal.
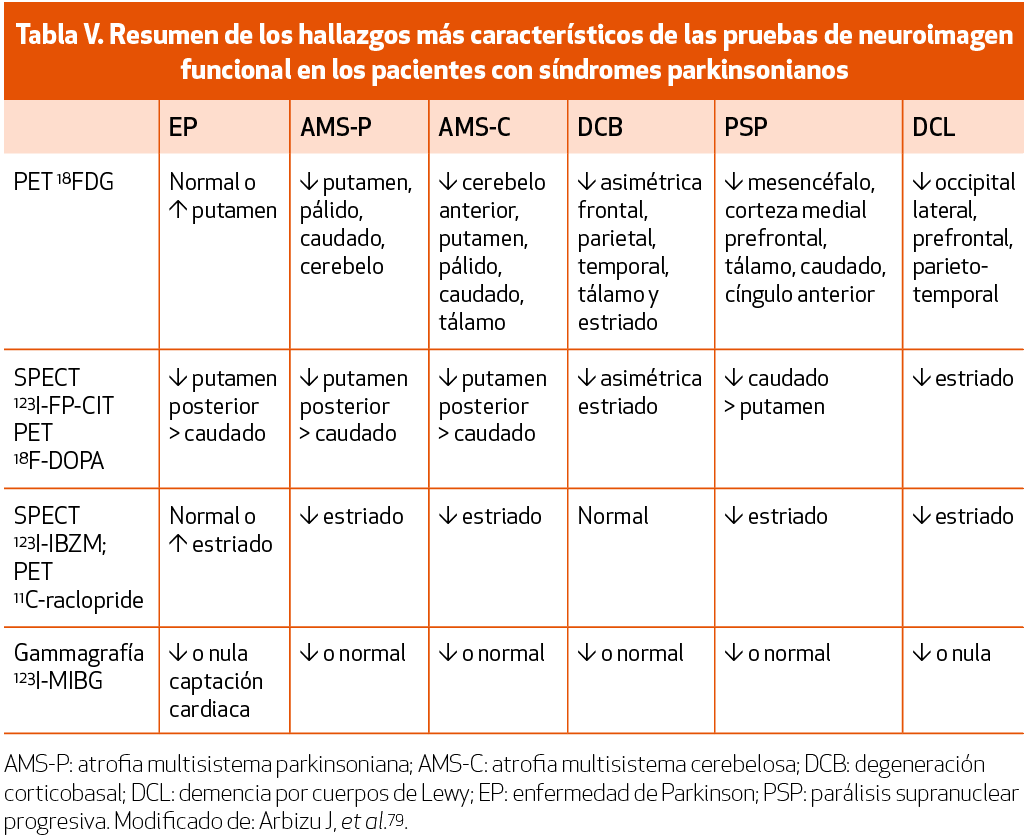
Los estudios de imagen dopaminérgica presináptica tanto con SPECT como PET muestran una actividad normal en sujetos sanos, temblor esencial y en parkinsonismo inducido por fármacos o en trastornos funcionales56 (NE-II). En la EP, el putamen posterior presenta una reducción progresiva en la actividad más temprana y grave en comparación con el putamen anterior o el núcleo caudado, que se correlaciona bien con la degeneración neuronal, como lo demuestran los estudios patológicos57 (NE-III). La denervación observada suele ser asimétrica, más pronunciada en el hemisferio contralateral a la sintomatología parkinsoniana, mientras puede aparecer simétrica en casos con déficits motores simétricos58 (NE-II) o en estados más avanzados (Tabla V). La afectación en el estriado observada con SPECT 123I-FP-CIT y PET 18F-FDOPA se ha demostrado que correlaciona con la gravedad de la EP y el deterioro motor59 (NE-III).
Tanto la SPECT con 123I-FP-CIT como la PET con 18F-FDOPA han demostrado ser las técnicas de imagen más precisas para demostrar la presencia de denervación dopaminérgica presináptica en pacientes con EP, aumentando la confianza en el diagnóstico y cambios en el manejo clínico en un 72% de los pacientes60-63 (NE-I). En los estudios comparativos con la valoración de la integridad estructural del nigrosoma 1 en las secuencias SWI de RM, la PET con 18F-FDOPA es más precisa para diferenciar síndromes parkinsonianos de trastornos no parkinsonianos64 (NE-III). Se han descrito algunos falsos positivos de la SPECT con 123I-FP-CIT relacionados con interferencias farmacológicas o artefactos metodológicos, ya que la SPECT tiene una menor resolución espacial. Si bien no es indispensable, la imagen dopaminérgica presináptica está incluida en los criterios diagnósticos de EP; un estudio normal es un criterio de exclusión absoluto para la EP52. No obstante, los ensayos clínicos han demostrado la presencia de un 10-15% de los pacientes con criterios clínicos de EP que presentan estudios normales con 18F-DOPA o 123I-FP-CIT (SWEDD: sujetos sin evidencia de degeneración dopaminérgica)65 (NE-II).
En los pacientes con EP inicial se han descrito efectos compensatorios de regulación de la L-aminoácido aromático descarboxilasa y la recaptación de DA en las neuronas dopaminérgicas presinápticas remanentes. Sin embargo, dichos efectos no se han traducido en una diferencia de sensibilidad en la detección de la denervación dopaminérgica entre la SPECT con 123I-FP-CIT y la PET con 18F-FDOPA66 (NE-II).
Los estudios de imagen dopaminérgica presináptica han puesto de manifiesto la presencia de denervación dopaminérgica presináptica en sujetos asintomáticos desde el punto de vista motor, tanto en pacientes con mutaciones asociadas a EP como en personas con trastornos del comportamiento del sueño REM (TCSREM), que posteriormente han desarrollado una EP (fase prodrómica)67 (NE-II).
En la EP existe una degeneración posganglionar del sistema nervioso autónomo a nivel cardiaco desde estadios relativamente tempranos de la enfermedad (Tabla V). Los estudios preliminares en poblaciones seleccionadas mostraron una alta sensibilidad (89%) de la gammagrafía con 123I-MIBG, con una especificidad en torno al 77%68 (NE-I). No obstante, existen múltiples factores de confusión que pueden alterar los resultados y deben tenerse en cuenta en la interpretación de los resultados, como por ejemplo la presencia de una cardiopatía isquémica o cardiomiopatía, una polineuropatía periférica por otra causa, diabetes o ciertos fármacos. Además, su rendimiento en estadios precoces de la enfermedad disminuye a expensas de un descenso en la sensibilidad (73,3% en la EP con menos de 3 años de evolución). Por ello, su precisión diagnóstica a nivel individual y aplicación en la práctica clínica es limitada69(NE-II).
En el modelo de desarrollo de EP de inicio en el cerebro (brain-first) por el que los pacientes inicialmente acumulan α-sinucleína en un hemisferio, generando un perfil asimétrico de neurodegeneración en el cerebro y aparición tardía de disfunción autonómica, la denervación dopaminérgica presináptica es asimétrica, pero la denervación simpática cardiaca no suele estar presente. Sin embargo, el modelo de inicio sistémico (body-first) predice una afectación temprana del sistema nervioso autónomo periférico con denervación simpática cardiaca en el estudio de 123I-MIBG, y afectación de las estructuras inferiores del tronco del encéfalo70 (NE-III).
El estudio PET de metabolismo cerebral de 18F-FDG de los pacientes con EP muestra un patrón de hipermetabolismo en el núcleo lenticular (que incluye el putamen y el globo pálido), tálamo, cortex motor y el cerebelo (vermis), además de junto a un hipometabolismo variable en áreas de asociación parietooccipital y en la corteza prefrontal dorsolateral (fundamentalmente en pacientes de largo tiempo de enfermedad o con síntomas cognitivos) (Tabla V)71 (NE-III).
En la fase prodrómica de la EP, los sujetos con TCSREM muestran un patrón característico muy similar al que presentan en la fase sintomática. La presencia de este patrón predice el desarrollo de la EP con una elevada sensibilidad del 87%, especificidad del 72% (hazard ratio: 7,42, IC 95: 2,6-21,4)72 (NE-II).
No obstante, los criterios actuales de diagnóstico clínico de EP no incluyen la PET-FDG entre las pruebas de soporte. Esto ha motivado el desarrollo de diferentes estudios, entre los que destaca el metaanálisis realizado sobre 2323 pacientes con EP y 1767 sujetos control con estudios de imagen de RM estructural, secuencias DTI y PET-FDG. En este estudio se pone de manifiesto la superioridad de la PET FDG frente a las otras técnicas en la identificación de un patrón metabólico consistente en la EP73 (NE-I).
En los parkinsonismos no degenerativos, la imagen dopaminérgica presináptica permanece intacta y, por lo tanto, permite el diagnóstico diferencial con los parkinsonismos degenerativos. En los pacientes con un cuadro tremórico de origen incierto, la imagen dopaminérgica presináptica permite diferenciar aquellos con EP (denervación generalmente asimétrica con gradiente rostro-caudal) de los que padecen un temblor esencial (sin evidencia de denervación)74 (NE-I). Probablemente una de las aplicaciones más relevantes de la imagen dopaminérgica presináptica en la práctica clínica es el diagnóstico diferencial entre la EP y el parkinsonismo inducido por fármacos. El parkinsonismo farmacológico es la segunda causa de parkinsonismo en pacientes ancianos y la lista de medicamentos involucrados es muy amplia. Las técnicas de imagen de la vía dopaminérgica presináptica no muestran alteraciones de la vía nigroestriatal en más del 90% de los pacientes con parkinsonismo farmacológico, mostrando una sensibilidad y especificidad por encima del 90%75 (NE-I).
En la evaluación del parkinsonismo de origen vascular es importante realizar una fusión entre las imágenes de SPECT o PET con las estructurales de TC o RM. De esta manera se puede evaluar con precisión la colocalización de las alteraciones vasculares (microinfartos o dilataciones de espacios vasculares) con los déficits de captación focales en las imágenes de actividad dopaminérgica presináptica64. Por tanto, los patrones pueden ser muy diversos, pero en general no se aprecia una denervación dopaminérigica presináptica en el parkinsonismo vascular. En un estudio diseñado para definir la precisión de la SPECT con 123I-FP-CIT en el parkinsonismo vascular se describe una sensibilidad del 83,7% y una especificidad del 99,4%76 (NE-III).
La imagen dopaminérgica presináptica resulta muy útil para demostrar el carácter neurodegenerativo del cuadro parkinsoniano. Se han descrito patrones diferentes relacionados con entidades concretas, como por ejemplo la denervación asimétrica con gradiente rostro-caudal en la EP, o la denervación bilateral y homogénea (mayor afectación de caudado) en la PSP (Tabla V). Sin embargo, la imagen dopaminérgica presináptica tanto mediante SPECT 123I-FP CIT como PET con 18F-FDOPA tienen un valor muy limitado para discriminar entre los parkinsonismos degenerativos (Tabla V)61,62 (NE-II).
La imagen dopaminérgica postsináptica (SPECT con 123I-iodobenzamida (IBZM) o PET con 11C-raclopride), en general no muestra alteraciones en los pacientes con diagnóstico de EP hasta estadios avanzados de la enfermedad Tabla IV. Esta técnica fue considerada de gran utilidad en el diagnóstico diferencial entre EP y los parkinsonismos atípicos, aunque en los estudios de precisión diagnóstica tan solo se alcanza una sensibilidad de entre el 60-80%, con una tasa elevada de falsos negativos77 (NE-II). La SPECT 123I-IBZM resulta inespecífica en la AMS y se solapa con la PSP y la DCB (Tabla IV). En este sentido, la PET 18FDG ha demostrado ser superior a la SPECT 123I-IBZM en el diagnóstico diferencial de los parkinsonismos atípicos78 (NE-III).
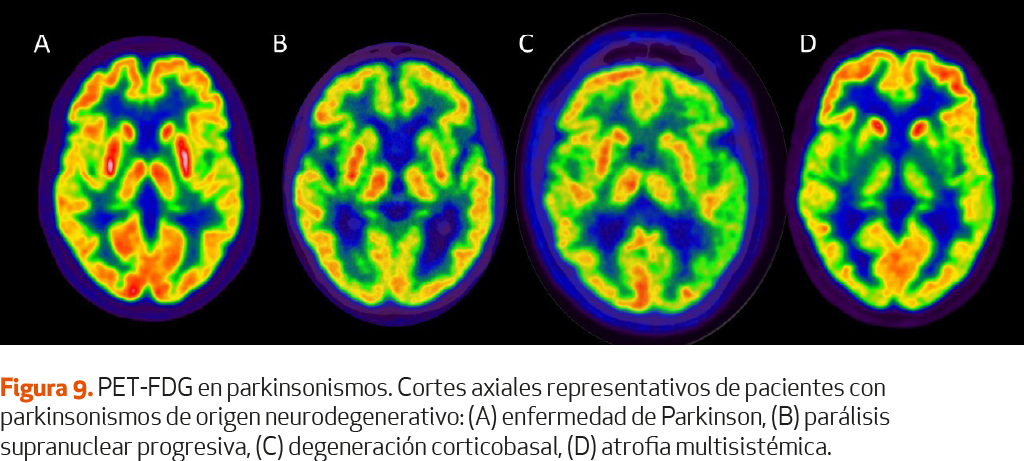
Se ha propuesto en el diagnóstico diferencial de los parkinsonismos neurodegenerativos por la elevada sensibilidad y especificidad (superior al 90% en los metaanálisis) (Tabla V, Figura 9)79,80 (NE-I). El patrón más característico es el de la PSP, y consiste en un hipometabolismo en la corteza frontal y frontoinsular, en el mesencéfalo, ganglios basales incluido caudado, tálamo, e hipermetabolismo en el cerebelo y cortezas sensoriomotoras81 (NE-III). Las variantes de PSP comparten este patrón con mayor o menor extensión, aunque la afectación resulta ser más asimétrica en la PSP variante parkinsoniana. La precisión diagnóstica de este patrón de PET 18F-FDG es muy elevada, con una sensibilidad de 80-88%, tanto para diferenciar entre pacientes con PSP y controles como entre PSP y EP, con una especificidad varía entre 90% (PSP respecto a EP) y 97% (PSP respecto a controles)78,81,82 (NE-II). El estudio de imagen PET con 18F-FDG está incluido dentro de los criterios actuales de diagnóstico clínico de PSP como soporte.
El patrón de hipometabolismo en pacientes con síndrome corticobasal difiere dependiendo de la etiología del mismo83 (NE-II). Así, los pacientes con degeneración corticobasal muestran un hipometabolismo frontoparietal marcadamente asimétrico con afectación de la corteza motora, ganglios basales y tálamo. Dicho patrón alcanza una especificidad el 92%, aunque se solapa con la PSP en un 24% de los casos84 (NE-III). En los estudios de imagen dopaminérgica presináptica se observa una denervación asimétrica a nivel del estriado lentamente progresiva, precedida en meses o años por los déficits de metabolismo en la PET con 18F-FDG85,86(NE-III).
En los pacientes con AMS, las alteraciones en PET 18FDG difieren entre la variante parkinsoniana (hipometabolismo de estriado con gradiente rostro-caudal generalmente asimétrico, contralateral al hemicuerpo clínicamente más afecto), de la cerebelosa (hipometabolismo cerebeloso bilateral y de protuberancia con afectación variable a nivel cortical). No obstante, en la práctica clínica se presentan con frecuencia patrones mixtos de combinación de ambos87 (NE-III). La presencia de un patrón AMS parkinsoniana (AMS-P) tiene una sensibilidad cercana al 95% y una especificidad del 100%. El patrón de la AMS cerebelosa permite el diagnóstico diferencial con las ataxias espinocerebelosas y otras enfermedades que cursan con ataxia y síntomas rígido-acinéticos. El valor predictivo positivo para la AMS-P es del 88% en los primeros 2 años de enfermedad y del 100% a los 5 años82, 88 (NE-III).
A diferencia de la EP, la inervación cardiaca posganglionar del sistema nervioso autónomo está preservada en la AMS, lo que facilitaría la diferenciación entre estas dos entidades. La mayoría de los parkinsonismos atípicos muestran una 123I-MIBG sin alteraciones significativas, aunque puede ser patológica hasta en un 30% de los casos (especialmente en la AMS-P). En un estudio prospectivo la 123I-MIBG mostró una precisión diagnóstica limitada del 73% (sensibilidad del 88%; especificidad del 65%; valor predictivo positivo [VPP] del 58%; valor predictivo negativo [VPN] del 91%88 (NE-III).

52. Morbelli S, Esposito G, Arbizu J, et al. EANM practice guideline/SNMMI procedure standard for dopaminergic imaging in Parkinsonian syndromes 1.0. Eur J Nucl Med Mol Imaging. 2020 Jul;47(8):1885-1912.
53. Heiss WD, Hilker R. The sensitivity of 18-fluorodopa positron emission tomography and magnetic resonance imaging in Parkinson’s disease. Eur J Neurol. 2004;11(1):5-12.
54. Jakobson Mo S, Axelsson J, Jonasson L, et al. Dopamine transporter imaging with [18F] FE-PE2I PET and [123I]FP-CIT SPECT-a clinical comparison. EJNMMI Res. 2018;8(1):100.
55. Attwell D, Laughlin SB. An energy budget for signaling in the grey matter of the brain. J Cereb Blood Flow Metab. 2001;21(10):1133-45.
56. Leenders KL, Salmon EP, Tyrrell P, et al. The nigrostriatal dopaminergic system assessed in vivo by positron emission tomography in healthy volunteer subjects and patients with Parkinson’s disease. Arch Neurol. 1990;47(12):1290-8.
57. Snow BJ, Tooyama I, McGeer EG, et al. Human positron emission tomographic [18F] fluorodopa studies correlate with dopamine cell counts and levels. Ann Neurol. 1993;34(3):324-30.
58. Vingerhoets FJ, Schulzer M, Calne DB, et al. Which clinical sign of Parkinson’s disease best reflects the nigrostriatal lesion? Ann Neurol. 1997;41(1):58-64.
59. Im JH, Chung SJ, Kim JS, et al. Differential patterns of dopamine transporter loss in the basal ganglia of progressive supranuclear palsy and Parkinson’s disease: analysis with [(123) I]IPT single photon emission computed tomography. J Neurol Sci. 2006;244(1-2):103-9.
60. Suwijn SR, van Boheemen CJM, de Haan RJ, et al. The diagnostic accuracy of dopamine transporter SPECT imaging to detect nigrostriatal cell loss in patients with Parkinson’s disease or clinically uncertain parkinsonism: A systematic review. EJNMMI Res. 2015;5(1):1-8.
61. Ba F, Martin WR. Dopamine transporter imaging as a diagnostic tool for parkinsonism and related disorders in clinical practice. Parkinsonism Relat Disord. 2015 Feb;21(2):87-94.
62. Puñal-Riobóo J, Serena-Puig A, Varela-Lema L, et al. Clinical utility of (18)F-DOPA-PET in movement disorders. A systematic review. Rev Esp Med Nucl. 2009 May-Jun;28(3):106-13.
63. Dhawan V, Niethammer MH, Lesser ML, et al. Prospective F-18 FDOPA PET Imaging Study in Human PD. Nucl Med Mol Imaging. 2022 Jun;56(3):147-157.
64. Michler E, Kaiser D, Eleftheriadou K, et al. Comparison of 6-[18F]FDOPA PET with Nigrosome 1 detection in patients with parkinsonism. EJNMMI Res. 2021;11(1):16.
65. Marshall VL, Reininger CB, Marquardt M, et al. Parkinson’s disease is overdiagnosed clinically at baseline in diagnostically uncertain cases: a 3-year European multicenter study with repeat [123I]FP-CIT SPECT. Mov Disord. 2009;24(4):500-8.
66. Rinne OJ, Nurmi E, Ruottinen HM, et al. [(18)F]FDOPA and [(18)F]CFT are both sensitive PET markers to detect presynaptic dopaminergic hypofunction in early Parkinson’s disease. Synapse. 2001;40(3):193-200.
67. Iranzo A, Santamaria J, Valldeoriola F, et al. Dopamine transporter imaging deficit predicts early transition to synucleinopathy in idiopathic rapid eye movement sleep behavior disorder. Ann Neurol. 2017;82(3):419-428.
68. Treglia G, Stefanelli A, Cason E, et al. Diagnostic performance of iodine-123-metaiodobenzylguanidine scintigraphy in differential diagnosis between Parkinson’s disease and multiple-system atrophy: A systematic review and a meta-analysis. Clin. Neurol. Neurosurg. 2011;113(10):823-829.
69. Skowronek C, Zange L, Lipp A. Cardiac 123I-MIBG Scintigraphy in Neurodegenerative Parkinson Syndromes: Performance and Pitfalls in Clinical Practice. Front Neurol. 2019;10:152.
70. Horsager J, Borghammer P. Brain-first vs. body-first Parkinson’s disease: An update on recent evidence. Parkinsonism Relat Disord. 2024;122:106101
71. Meles SK, Renken RJ, Pagani M, et al. Abnormal pattern of brain glucose metabolism in Parkinson’s disease: replication in three European cohorts. Eur J Nucl Med Mol. Imaging 2020;47(2):437-450.
72. Mattioli P, Orso B, Liguori C, et al. Derivation and Validation of a Phenoconversion-Related Pattern in Idiopathic Rapid Eye Movement Behavior Disorder. Mov Disord. 2023;38(1):57-67.
73. Albrecht F, Ballarini T, Neumann J, et al. FDG-PET hypometabolism is more sensitive than MRI atrophy in Parkinson’s disease: a whole-brain multimodal imaging meta-analysis. Neuroimage Clin. 2019;21:101594.
74. Benamer HTS, Patterson J, Grosset DG, et al. Accurate differentiation of parkinsonism and essential tremor using visual assessment of [123I]-FP-CIT SPECT imaging: The [123I]-FP-CIT study group. Mov Disord. 2000;15(3):503-510.
75. Rissardo JP, Caprara ALF. Neuroimaging Techniques in Differentiating Parkinson’s Disease from Drug-Induced Parkinsonism: A Comprehensive Review. Clin Pract. 2023;13(6):1427-1448.
76. Benítez-Rivero S, Marín-Oyaga VA, García-Solís D, et al. Clinical features and 123I-FPCIT SPECT imaging in vascular parkinsonism and Parkinson’s disease. J Neurol Neurosurg Psychiatry. 2013;84(2):122-9.
77. Vlaar AM, de Nijs T, Kessels AG, et al. Diagnostic value of 123I-ioflupane and 123I-iodobenzamide SPECT scans in 248 patients with parkinsonian syndromes. Eur Neurol. 2008;59(5):258-66.
78. Hellwig S, Amtage F, Kreft A, et al. [(1)(8)F]FDG-PET is superior to [(1)(2)(3)I]IBZMSPECT for the differential diagnosis of parkinsonism. Neurology. 2012;79(13):1314-22.
79. Arbizu J, Luquin MR, Abella J, et al. Functional neuroimaging in the diagnosis of patients with Parkinsonism: Update and recommendations for clinical use. Rev Esp Med Nucl Imagen Mol. 2014;33(4):215-26.
80. Meyer PT, Frings L, Rücker G, et al. 18F-FDG PET in Parkinsonism: Differential Diagnosis and Evaluation of Cognitive Impairment. J Nucl Med. 2017;58(12):1888-1898.
81. Martí-Andrés G, van Bommel L, Meles SK, et al. Multicenter Validation of Metabolic Abnormalities Related to PSP According to the MDS-PSP Criteria. Mov Disord. 2020;35(11):2009-2018.
82. Tang CC, Poston KL, Eckert T, et al. Differential diagnosis of parkinsonism: a metabolic imaging study using pattern analysis. Lancet Neurol. 2010;9(2):149-58.
83. Pardini M, Huey ED, Spina S, et al. FDG-PET patterns associated with underlying pathology in corticobasal syndrome. Neurology. 2019;92(10):e1121-e1135.
84. Niethammer M, Tang CC, Feigin A, et al. A disease-specific metabolic brain network associated with corticobasal degeneration. Brain. 2014;137(Pt 11):3036-46.
85. Pirker S, Perju-Dumbrava L, Kovacs GG, et al. Progressive Dopamine Transporter Binding Loss in Autopsy-Confirmed Corticobasal Degeneration. J Parkinsons Dis. 2015;5(4):907-12.
86. Ceravolo R, Rossi C, Cilia R, et al. Evidence of delayed nigrostriatal dysfunction in corticobasal syndrome: a SPECT follow-up study. Parkinsonism Relat Disord. 2013;19(5):557-9.
87. Grimaldi S, Boucekine M, Witjas T, et al. Multiple System Atrophy: Phenotypic spectrum approach coupled with brain 18-FDG PET. Parkinsonism Relat Disord. 2019;67:3-9.
88. Südmeyer M, Antke C, Zizek T, et al. Diagnostic accuracy of combined FP-CIT, IBZM, and MIBG scintigraphy in the differential diagnosis of degenerative parkinsonism: a multidimensional statistical approach. J Nucl Med. 2011;52(5):733-40.


