


Este capítulo se centra en ciertas manifestaciones de la EP que no suelen tener una respuesta tan predecible a los tratamientos habituales. Revisaremos en primer lugar, por su importancia, las alteraciones del equilibrio y de la marcha. Prestaremos especial atención a los bloqueos en la misma. Después evaluaremos la evidencia sobre los tratamientos para las alteraciones posturales, finalizando con manifestaciones con mucho impacto en la calidad de vida y en otros ámbitos del paciente, como son la disartria y la disfagia.
Los bloqueos en la marcha (FOG, freezing of gait) son uno de los retos terapéuticos más importantes en la EP.
Los bloqueos en la marcha se definen como episodios repentinos de breve duración de incapacidad para dar pasos hacia delante de forma efectiva, a pesar de la intención de caminar1. Aparecen típicamente al inicio de la marcha o en los giros, aunque pueden desencadenarse por estrés, distracciones o espacios estrechos. La aparición de FOG se asocia a trastorno de la marcha, caídas y disfunción ejecutiva frontal en estadios avanzados de la enfermedad2. Puede aparecer con menos frecuencia en fases iniciales, pero cuando es uno de los síntomas de presentación, debe descartarse un parkinsonismo atípico como la PSP (ver capítulo 1, pag. 23).
Cuando se utilizan cuestionarios específicos para FOG, la prevalencia ponderada global es del 50,6% de los pacientes con EP, es del 37,9% en pacientes iniciales (≤ 5 años) y del 64,6% en estadios avanzados (≥ 9 años)3.
Ante la naturaleza impredecible del FOG, se han desarrollado instrumentos que facilitan su identificación objetiva y cuantificación4. La puntuación visual del paciente por evaluadores independientes se considera el gold standard para valorar la gravedad del FOG. Se han utilizado maniobras de provocación de FOG como giros de 360°, tareas duales, caminar con obstáculos o realidad virtual que facilitan la observación del FOG en un entorno controlado, pero al ser tareas dirigidas y menos automáticas, pueden ser menos sensibles al FOG. El FOG-Score es una herramienta clínica que puntúa el FOG en 4 tareas de provocación: inicio de la marcha, giros en sentido horario y antihorario y cruce de una puerta. Este método, que mide de forma objetiva la grave- dad, aunque no la duración del FOG, es sensible a los estados on y off medicación y se correlaciona con la autoevaluación del FOG por el paciente. El Time Up-Go Test se puede utilizar para cuantificar el tiempo de FOG con una elevada fiabilidad interobservador, aunque no valora la situación del paciente fuera del entorno hospitalario y no es un test específico para FOG. Para una cuantificación más objetiva, se han desarrollado índices basados en datos de acelerómetros, laboratorios de marcha, EMG, dispositivos inteligentes o combinación de varios, así como dispositivos portátiles en domicilio. Los cuestionarios específicos más comúnmente utilizados son el Freezing of Gait Questionnaire (FOG-Q) y el New Freezing of Gait Questionnaire (NFOG-Q), que incluye un vídeo demostrativo para facilitar el reconocimiento del FOG. Ambos son cuestionarios autoadministrados, fáciles de usar y que evalúan el FOG en distintos entornos, pero pueden no detectar un efecto de pequeño tamaño, y no se correlacionan con la frecuencia o la duración del FOG observado2,5 (NE-IV).
Los bloqueos pueden aparecer en off y responder al tratamiento dopaminérgico, pueden ser parcial o totalmente resistentes a la terapia dopaminérgica y también pueden ser originados por el tratamiento, tanto médico como quirúrgico, de la EP. En la Tabla I se revisan diferentes estrategias para tratar los bloqueos de la marcha en función del contexto en el cual aparecen. Los estudios no incluidos en alguna de las categorías no han diferenciado entre tipos de bloqueos.
Los IMAO, tanto la rasagilina como la selegilina, redujeron el riesgo de padecer bloqueos en la marcha en dos ensayos clínicos2. Este beneficio se observó tanto en pacientes sin tratamiento como en pacientes tratados con fármacos dopaminérgicos, si bien en ninguno de los estudios era el objetivo principal, por lo que no puede descartarse que se trate de un hallazgo incidental (NE-II).
La LD oral ha mostrado una reducción en el riesgo de aparición de FOG respecto a los agonistas dopaminérgicos en un ensayo clínico que comparó eficacia de la LD oral con ropinirol en monoterapia2. Se trata de un hallazgo incidental, que algunos autores relacionan con el hecho de que los pacientes con agonistas dopaminérgicos estaban posiblemente tratados de forma subóptima dado que la potencia de la LD como antiparkinsoniano es mayor que la del ropinirol2 (NE-II).
Finalmente, un estudio abierto, multicéntrico, aleatorizado, en 52 pacientes con FOG y depresión que fueron tratados con dosis de paroxetina de 20-25 mg, escitalopram 10 mg o duloxetina 40 mg, mostró mejoría del FOG medido por FOG-Q, así como de la depresión, a las 3 y 6 semanas de tratamiento5 (NE-IV).
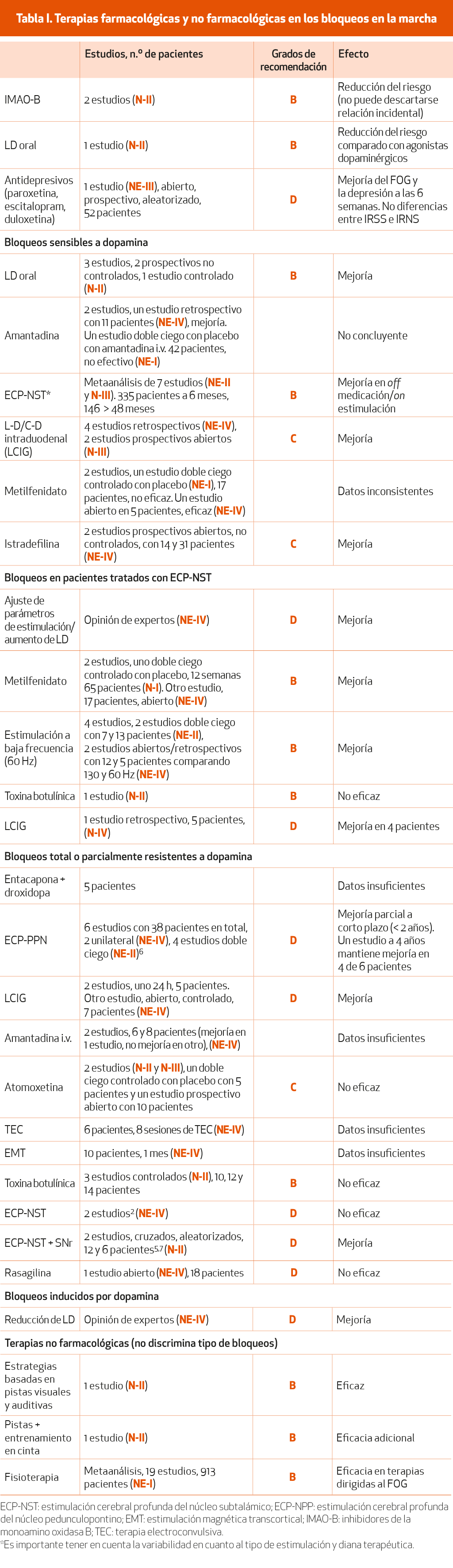
Es el tipo de bloqueos más frecuente. Suelen ser más intensos y prolongados en off. El tratamiento de elección es la LD.
Los agonistas dopaminérgicos pueden mejorar todos los síntomas parkinsonianos, incluyendo el FOG. No obstante, en opinión de algunos expertos2 (NE-IV), los agonistas pueden inducir bloqueos en la marcha que no tienen por qué reaparecer cuando se introduce en su lugar la LD.
Por lo tanto, ante un paciente parkinsoniano en fases iniciales tratado con agonistas dopaminérgicos que comienza con FOG, la primera recomendación sería aumentar la dosis de LD o añadirla si no la estaba tomando previamente, pero se puede valorar también aumentar la dosis de agonistas dopaminérgicos si esta es baja2. Si, a pesar de la mejoría de las fluctuaciones motoras, persiste el FOG, debe valorarse reducir o suspender el agonista2 (NE-IV).
Algunos estudios indican que en algunos pacientes el FOG puede ser un síntoma más resistente al tratamiento con LD que otros síntomas parkinsonianos8 (NE-I). Se puede dar la situación de que encontremos a un paciente en aparente on y persistencia del FOG, condición que puede ser interpretada como FOG resistente o FOG en on y que se ha denominado también pseudo on-FOG. El FOG resistente es indiferente a los cambios en la medicación dopaminérgica mientras que el pseudo on-FOG se observa durante un estado on aparentemente óptimo, pero que, sin embargo, mejora con una estimulación dopaminérgica más intensa9. Ambos son diferentes del on-FOG, que como se ha comentado anteriormente, es inducido por la medicación dopaminérgica. En los pacientes con pseudo on-FOG puede ser necesario aumentar la dosis de medicación dopaminérgica para que el FOG remita por completo, aun a expensas de producir discinesias.
Hay que considerar que en algunos casos los pacientes pueden presentar más FOG cuando aumentan las discinesias por LD. En estos casos la recomendación es reducir la dosis de LD2 (NE-IV).
Los resultados de la amantadina no son concluyentes. Un estudio mostró menor riesgo de bloqueos en la marcha en pacientes tratados crónicamente con amantadina, a diferencia de los pacientes tratados con agonistas dopaminérgicos, que presenta- ban mayor riesgo10 (NE-II), mientras que en otras series de pacientes no se observó el mismo efecto. En un estudio retrospectivo en 11 pacientes tratados con amantadina por bloqueos en la marcha se observó un efecto beneficioso, pero en algunos pacientes transitorio2,5 (NE-IV). Un estudio doble ciego con amantadina i.v., en el que se incluyeron pacientes con FOG en on y en off, no fue efectivo5 (NE-IV).
La infusión intraduodenal de LD/carbidopa (LCIG) ha demostrado mejorías significativas del FOG5 en 4 estudios retrospectivos y 4 estudios prospectivos (NE-III). Un estudio retrospectivo que incluyó 65 pacientes con EP avanzada mostró una incidencia de FOG del 22% a 1 año de seguimiento respecto al 46% pretratamiento2. Otro estudio retrospectivo con 91 pacientes mostró mejoría de los trastornos de la marcha (FOG, festinación, inestabilidad postural) en el 61,4% de los pacientes a 18 meses de trata- miento2. Dos estudios prospectivos han demostrado mejoría del FOG medido por la escala FOGQ en 17 pacientes a 2 años de tratamiento, y en 25 pacientes a los 6 meses5 (NE-III). Dos estudios piloto, con escaso número de pacientes, han mostrado también mejorías de los bloqueos parcialmente resistentes a LD (NE-IV) (Tabla I).
No hay estudios con apomorfina en infusión continua.
El tratamiento con ECP-STN ha demostrado mejorías consistentes hasta 4 años en los bloqueos en la marcha sensibles a LD en la situación de off-medicación/on-estimulación11 (NE-I). Un metaanálisis sobre 6 estudios que estudiaron específicamente el efecto de la ECP-NST sobre los bloqueos en la marcha ha mostrado un efecto beneficioso y persistente de la estimulación en la condición de off-medicación/on-estimulación respecto a la situación precirugía. El estudio recoge los resultados en 335 pacientes seguidos 6-15 meses, y 146 pacientes seguidos 48 meses11. No se observaron mejorías en la condición de on-estimulación/on-medicación.
Una situación particular es la de los bloqueos que aparecen en pacientes tratados ECP-NST. En este subgrupo de pacientes, la administración de metilfenidato a dosis de 1 mg/kg/ día ha mostrado efectos beneficiosos en un estudio controlado doble ciego (NE-I)12. No obstante, el metilfenidato no es efectivo para los bloqueos en la marcha en pacientes parkinsonianos no tratados con ECP-NST, basándose en un estudio doble ciego controlado con placebo en 23 pacientes8 (NE-I).
En los bloqueos en pacientes tratados con ECP-NST se recomienda ajustar los parámetros de estimulación: reducir voltajes, reducir frecuencia a 60 Hz, minimizar las diferencias izquierda-derecha en los electrodos, o aumentar la dosis de LD13 (NE-IV).
Un primer estudio doble ciego realizado en 2008 en 13 pacientes parkinsonianos tratados con ECP-NSTque desarrollaron bloqueos 2,5 años después de la cirugía, mostró que la frecuencia baja de 60 Hz producía menos bloqueos en la marcha13. En el seguimiento a 8 meses, 11 pacientes mantenían la mejoría, aunque precisaron aumentar la dosis de LD, y dos pacientes volvieron a la frecuencia de 130 Hz por incapacidad para controlar los síntomas segmentarios a pesar del incremento de LD. Un estudio posterior realizado en 11 pacientes con una frecuencia de 80 Hz mostró una mejoría inmediata de la marcha por la prueba de Sit-Walk-Sit (SWS), que se perdió en el seguimiento a los 1, 5 y 15 meses; tres pacientes volvieron a los parámetros de 130 Hz por mal control de los síntomas motores13 (NE-IV).
En un estudio reciente, doble ciego, realizado en siete pacientes parkinsonianos tratados con ECP-NST a baja frecuencia que presentaban síntomas axiales y bloqueos en la marcha, estos mejoraron significativamente en la escala de FOG y en SWS respecto a la estimulación con 130 Hz y a la situación de desconexión del estimulador13 (NE-I). La mejoría se mantuvo en el seguimiento a 3-8 semanas en todos los pacientes excepto en uno, que volvió a la frecuencia anterior por aumento del temblor. La estimulación a baja frecuencia parece ser efectiva en los bloqueos asociados a ECP-NST, si bien son necesarios más estudios para evaluar la respuesta a largo plazo y sopesar el efecto de la estimulación a baja frecuencia sobre los restantes síntomas parkinsonianos.
Un estudio retrospectivo en 5 pacientes tratados con ECP que desarrollaron FOG resistente, ha mostrado mejorías en 4 pacientes, a los 12 meses de instaurar tratamiento con LCIG5 (NE-IV).
No hay estudios aleatorizados ni metaanálisis sobre tratamientos no dopaminérgicos en bloqueos parcial o totalmente resistentes a LD.
Se ha utilizado la combinación de droxidopa y entacapona para intentar corregir el déficit en los circuitos adrenérgicos que interviene en los síntomas parkinsonianos2 (NE-IV). En un pequeño estudio realizado en cinco pacientes, la administración de droxidopa junto con entacapona mejoró los bloqueos resistentes a LD2 (NE-IV).
La estimulación cerebral profunda del núcleo pedunculopontino (ECP-PPN) se ha utilizado en los últimos años para tratamiento de síntomas axiales, principalmente FOG resistente y caídas6. La evidencia derivada de 6 estudios con 5 a 8 pacientes cada uno indica que puede ser útil para el tratamiento del FOG resistente en off y en on medicación, si bien con limitaciones por el escaso número de pacientes y por las diferencias metodológicas entre los estudios. La estimulación se ha realizado sobre la zona rostral del PPN en 2 estudios y en la caudal en 4 estudios. El diseño ha sido doble ciego en 4 estudios (NE-II), uno de ellos con estimulación combinada con NST. Las mejorías del FOG han variado entre un 30% en el ítem 14 de la UPDRS-II, 39% en on medicación y 64,6% en off medicación en un análisis de marcha6. En resumen, la ECP-PPN mejoral, pero no elimina el FOG. Hay que considerar que la ECP-PPN no mejora la acinesia, la rigidez ni el temblor, por lo que no se reduce la dosis de medicación antiparkinsoniana. Los pacientes pueden necesitar otras terapias, incluida ECP-NST, para mejorar de forma global los síntomas parkinsonianos.
Dos estudios aleatorizados, cruzados, con 12 y 6 pacientes (NE-II) han demostrado mejorías del FOG resistente con la estimulación dual del NST y la substancia nigra pars reticulata (SNr) respecto a la estimulación aislada del NST5,14. En uno de los estudios la mejoría se ha mantenido hasta 3 años en 4 de 6 pacientes14.
Dos estudios con escaso número de pacientes han mostrado mejoría con LCIG. Cinco pacientes con bloqueos resistentes a dopamina mejoraron con infusión intraduodenal de LD durante 24 horas, con tasa nocturna al 50-80% de la diurna2,13 (NE-IV).
Otras terapias han mostrado resultados insuficientes, aunque prometedores: algunos pacientes tratados con estimulación magnética transcortical en un estudio y en otro con terapia electroconvulsiva mejoraron2,5.
Dos estudios con amantadina intravenosa en bloqueos resistentes a dopamina han mostrado resultados inconsistentes, con mejoría en un estudio prospectivo abierto en 10 pacientes (NE-IV) y no mejoría en un estudio doble ciego de 15 pacientes (NE-I)5.
Tratamientos como la atomoxetina, la rasagilina o la infiltración con toxina botulínica en los gemelos no han demostrado efectividad en este tipo de bloqueos5.
Los bloqueos inducidos por medicación dopaminérgica son raros (5%). Pueden producirse por LD y, más frecuentemente, por agonistas dopaminérgicos. El tratamiento de elección es la reducción de la medicación, primero de los agonistas dopaminérgicos y después de la LD; no es efectivo sustituir un agonista por otro2 (NE-IV). En casos aislados se ha observado mejoría con la ECP del NST al reducir la dosis de medicación dopaminérgica2 (NE-IV).
Las terapias basadas en estrategias de pistas visuales o auditivas son efectivas para el tratamiento de los bloqueos en la marcha. Según las recomendaciones de la European Federation of Neurological Societies (EFNS) para el tratamiento de la EP15, el entrenamiento basado en pistas es probablemente efectivo en los bloqueos en la marcha. La asociación de pistas visuales o auditivas con entrenamiento en cinta proporciona mayores beneficios.
Varios metaanálisis recientes15 han estudiado los efectos de la fisioterapia en el FOG. Se puede concluir que diversas intervenciones de fisioterapia son útiles en el FOG autopercibido, medido por FOG-Q, cuando la fisioterapia está dirigida a desencadenantes específicos o mecanismos subyacentes del FOG. Entre las terapias que han mostrado beneficio en el FOG se encuentran: entrenamiento con pistas, entrenamiento de acción-observación, ejercicios de prevención de caídas, entrenamiento en cinta, entrenamiento cognitivo, resistencia, marcha nórdica, entrenamiento acuático con obstáculos, marcha en trayectoria curva o entrenamiento con cinta de equilibrio16. La fisioterapia no específica no ha demostrado mejorías del FOG, aunque pueda ser útil para otros aspectos de la EP16. Respecto a la duración del efecto, existen dudas sobre si se mantiene o no en el tiempo tras suspender el tratamiento16.
La evidencia del tratamiento del FOG con fisioterapia específica está limitada por la escasez de estudios doble ciego, la variabilidad de intervenciones y las diferencias en el número y duración en las mismas de unos estudios a otros. A pesar de ello, los numerosos estudios publicados tienen NE-III y alguno NE-II. Remitimos al lector al capítulo 12 sobre ejercicio físico y fisioterapia para profundizar en estos abordajes (pag. 307).
La mejoría del FOG con pistas visuales, auditivas o vibratorias ha propiciado el desarrollo de dispositivos portátiles que permiten la implementación de estas ayudas en el entorno habitual del paciente. Estos dispositivos han evolucionado combinando tecnologías personalizadas con dispositivos comerciales como los smartphones o las gafas inteligentes (Google Glass o Epson BT200)17. Se han observado mejorías del número y duración del FOG en on y off utilizando zapatos con láser, mejoría del porcentaje de off durante la marcha con vibración pulsada, y mejoría de la frecuencia de FOG durante la marcha con giros de 360° utilizando 3 tipos de pistas (auditiva, visual y vibratoria) con Google Glass5,17. Los resultados son prometedores, pero necesitan ser evaluados en series más amplias de paciente. Se ha realizado recientemente una revisión de estos y otros dispositivos inteligentes que pueden ser de ayuda para el tratamiento de los bloqueos de la marcha por parte del Grupo de Estudio de Trastornos del Movimiento y del Comité ad hoc de Nuevas Tecnologías de la SEN y se puede consultar en enlace en el Anexo II (Pág. 374) en caso de querer profundizar en el estado de estas soluciones que de forma genérica tienen un NE-IV.

La acinesia de la marcha es uno de los principales síntomas de la EP, y un importante determinante de la calidad de vida en estadios iniciales y moderados. El control de la cadencia se mantiene a lo largo de la enfermedad, por lo que el trastorno de la marcha se atribuye a la incapacidad interna para generar pasos suficientemente amplios.
La última revisión basada en la evidencia de la MDS sobre los tratamientos para trastornos de la marcha en la EP18 (NE-IV) considera la rivastigmina probablemente eficaz en los trastornos de la marcha y caídas en pacientes parkinsonianos, basándose en un estudio con un objetivo primario de mejoría de la variabilidad del paso y un objetivo secundario de reducción de caídas, sin problemas de seguridad.
El donepezilo, el metilfenidato y la memantina se han considerado en investigación en el tratamiento de los trastornos de la marcha18 (NE-IV). El metilfenidato se considera de evidencia insuficiente debido a resultados conflictivos en varios estudios.
Entre los sistemas más utilizados en los últimos años para la mejoría de la marcha destacan el entrenamiento en cinta y los dispositivos con descarga de peso. Este sistema de entrenamiento de la marcha consiste en una suspensión con arnés, que reduce un porcentaje del peso de forma simétrica sobre ambas extremidades, mientras se camina en una cinta.
Una revisión reciente del efecto del entrenamiento con cinta con o sin descarga de peso en pacientes parkinsonianos incluyó 8 estudios con un total de 203 pacientes en estadios leve-moderado19 (NE-I). De ellos, en 7 estudios controlados con un total de 153 pacientes se observaron mejorías en la velocidad de la marcha; 5 estudios con un total de 95 pacientes observaron mejoría en la longitud del paso; 2 estudios con un total de 41 pacientes observaron aumento de la distancia recorrida, y 4 estudios con 78 pacientes no apreciaron mejoría de la cadencia. En ninguno de los estudios se detectaron efectos adversos. Las técnicas de entrenamiento con cinta son útiles para aumentar la velocidad de la marcha, la longitud del paso y la distancia recorrida en la acinesia de la marcha en los pacientes parkinsonianos en estadios I-III, si bien el número de estudios controlados es pequeño. Está por determinar su efecto a largo plazo y la duración de los efectos beneficiosos una vez terminado el tratamiento. No obstante, dada la seguridad del procedimiento, parece razonable recomendarlo como tratamiento adyuvante en pacientes en estadios I-III con acinesia de la marcha. Remitimos nuevamente al lector al capítulo 12 en caso de querer profundizar en las terapias no farmacológicas basadas en ejercicio físico y la fisioterapia (pag. 307).

Las caídas en la EP se asocian a peor pronóstico, mayor riesgo de inmovilización y fracturas y mortalidad elevada20. El origen de las caídas es multifactorial; no solo están relacionadas con síntomas de la enfermedad (bloqueos, inestabilidad, hipotensión ortostática, disfunción cognitiva, rigidez axial, discinesias), sino con otros factores como son edad, sexo, presencia de déficit visual, ingesta de fármacos sedantes, ingesta de alcohol, artrosis o sedentarismo. Es recomendable identificar y corregir los factores causales para prevenir su aparición, ya que una vez establecida es difícil de tratar.
Dentro de los factores causales de caídas en la EP, se ha destacado el papel de la situación cognitiva en los pacientes. Un estudio de fase II, doble ciego y controlado con placebo ha puesto de manifiesto una reducción significativa en la frecuencia de caídas en pacientes con EP sin demencia tratados con rivastigmina20 (NE-I). Otro estudio doble ciego ha mostrado mejoría del donepezilo en las caídas respecto a placebo, pero con baja calidad de evidencia18(NE-IV).
Las evidencias más recientes indican que los IACE pueden reducir un 50% las caídas en pacientes con EP, basándose en los datos de 3 estudios con 229 pacientes, con moderada evidencia21 (NE-II). Dicho esto, es incierto si tienen efecto en el número de pacientes parkinsonianos que experimentan caídas21 y también hasta qué punto los cambios en la función cognitiva pueden influir en la respuesta sobre la marcha.
El ejercicio físico reduce probablemente el número de caídas en un 35% y el número de pacientes que experimentan caídas en un 10%, en pacientes con EP leve a moderada según los datos extraídos de 13 estudios controlados con 1652 pacientes con moderada evidencia21 (NE-II). Entre los ejercicios que han demostrado mejorías en ensayos controlados están: entrenamiento del equilibrio, movilidad funcional, fuerza o taichí. Los estudios que combinan actividades duales, motoras y cognitivas, obtienen mejores resultados para las caídas, casi-caídas y riesgo de caídas que la fisioterapia regular21.
No se ha observado superioridad de un tipo de ejercicio sobre otro. Los ejercicios con supervisión completa son más efectivos para reducir caídas que los ejercicios con supervisión parcial o independientes21 (NE-II).
Se conoce desde hace tiempo que esta práctica milenaria favorece el equilibrio a través de movimientos de cambio de peso, desplazamiento del centro de gravedad en los límites del equilibrio y movimientos de pasos en dirección anteroposterior y lateral.
La recomendación de la práctica del taichí en la EP se ha generalizado tras publicarse los resultados de un ensayo clínico en el que participaron 176 pacientes con EP, comparando el taichí con entrenamiento con resistencia y con estiramientos de baja intensidad22 (NE-I). El taichí demostró superioridad respecto al entrenamiento con resistencia y a los estiramientos de baja intensidad: menos caídas, más longitud del paso y velocidad de la marcha y mejores parámetros de equilibrio. Los beneficios se mantuvieron 3 meses después de terminar el estudio.
Desde entonces, varias revisiones y metaanálisis han intentado evaluar los resultados reales del taichí en la EP. En el último metaanálisis publicado en 201423 (NE-I) se incluyeron 7 estudios aleatorizados y controlados, y un estudio no controlado, llegando a la conclusión de que el taichí es efectivo en pacientes parkinsonianos para mejorar el equilibrio (Escala de Equilibrio de Berg), función motora (UPDRS-III) y movilidad funcional (Timed Up and Go Test) en pacientes con EP. Comparado con otras terapias activas, el taichí aporta mejores resultados únicamente sobre el equilibrio. No hay evidencia suficiente para confirmar o refutar el efecto de taichí sobre la velocidad y resistencia de la marcha o la longitud del paso. Los resultados a largo plazo deben ser evaluados en más estudios, ya que la evidencia actual es insuficiente.
En resumen, las evidencias indican que la práctica del taichí puede recomendarse para mejorar el equilibrio y la función motora en pacientes parkinsonianos, y, en especial, que es superior a otras terapias activas en la mejoría del equilibrio.
La música rítmica proporciona pistas externas auditivas, incorpora movimientos de stepping, cambio de peso y rotación, y permite y facilita la sincronización precisa de los movimientos. La música además induce respuestas emocionales y mejora el cumplimiento con tratamientos prolongados. Moverse al ritmo de la música libera endorfinas y puede promover patrones de satisfacción que distraigan de la fatiga.
En el metaanálisis publicado en 2014 sobre el efecto del baile en pacientes parkinsonianos24 (NE-I) se analizaron los resultados de cinco estudios controlados en los que el baile se comparaba con otro tipo de ejercicio o con la no intervención. Los resultados indican mejorías significativas a corto plazo en la UPDRS-III, la Escala de Equilibrio de Berg y la velocidad en la marcha, en comparación con la no intervención. Cuando se compara con otros tipos de ejercicio físico, se observan mejorías significativas en el equilibrio y la calidad de vida. Las limitaciones son de nuevo el escaso número de pacientes y la efectividad de las terapias a largo plazo.
Basándose en dos estudios con 100 pacientes, la terapia con baile mejora más la función motora medida por la UPDRS respecto a la no intervención, y no muestra diferencias respecto al ejercicio físico24. En el equilibrio medido por la Escala de Equilibrio de Berg, y basándose en dos estudios con 43 pacientes, a los 3 meses el baile es efectivo respecto a la no intervención, y es más efectivo comparando con el ejercicio físico. Respecto a los bloqueos en la marcha, no se observaron mejorías24.
Un metaanálisis posterior25 evaluó el efecto de diferentes tipos de baile sobre el equilibrio en 612 pacientes parkinsonianos distribuidos en 14 estudios con grupo control, confirmando el efecto beneficioso del baile sobre el equilibrio, en especial en las intervenciones de más de 12 semanas. Este estudio no encontró diferencias entre sesiones de 60 o de 90 minutos, ni entre diferentes bailes, pero la representación de unos y otros tipos de baile era desigual25.
En resumen, la evidencia acumulada indica que el baile contribuye a mejorar la función motora de forma comparable al ejercicio físico y muestra eficacia para mejorar el equilibrio24,25, en especial si la duración es mayor de 12 semanas25, aunque no mejora los bloqueos de la marcha24. No obstante, son necesarios ensayos controlados de mayor calidad para establecer definitivamente los efectos de diferentes tipos de baile y su efecto a largo plazo.

1. Nutt JG, Bloem BR, Giladi N, et al. Freezing of gait: moving forward on a mysterious clinical phenomenon. Lancet Neurol. 2011;10:734-744.
2. Nonnekes J, Snijders AH, Nutt JG, et al. Freezing of gait: a practical approach to management. Lancet Neurol. 2015;14:768-78.
3. Zhang WS, Gao C, Tan YY, et al. Prevalence of freezing of gait in Parkinson’s disease: a systematic review and meta-analysis. J Neurol. 2021 Nov;268(11):4138-4150.
4. Cui CK, Lewis SJG. Future Therapeutic Strategies for Freezing of Gait in Parkinson’s Disease. Front Hum Neurosci. 2021 Nov 2;15:741918.
5. Gao C, Liu J, Tan Y, et al. Freezing of gait in Parkinson’s disease: pathophysiology, risk factors and treatments. Transl Neurodegener. 2020 Apr 15;9:12.
6. Thevathasan W, Debu B, Aziz T, et al. Pedunculopontine nucleus deep brain stimulation in Parkinson’s disease: a clinical review. Mov Disord. 2018;33(1):10-20.
7. Cao S, Cui Y, Jin J, et al. Prevalence of axial postural abnormalities and their subtypes in Parkinson’s disease: a systematic review and meta-analysis. J Neurol. 2023 Jan;270(1):139-151.
8. Espay AJ, Dwivedi AK, Payne M, et al. Methylphenidate for gait impairment in Parkinson disease: a randomized clinical trial. Neurology. 2011;76:1256-62.
9. Giladi N, Treves TA, Simon ES, et al. Freezing of gait in patients with advanced Parkinson’s disease. J Neural Transm. 2001;108:53-61.
10. Espay AJ, Fasano A, van Nuenen BF, et al. “On” state freezing of gait in Parkinson disease: a paradoxical levodopa-induced complication. Neurology. 2012 Feb 14;78(7):454-7.
11. Schlenstedt C, Shalash A, Muthuraman M, et al. Effect of high-frequency subthalamic neurostimulation on gait and freezing of gait in Parkinson’s disease: a systematic review and meta-analysis. Eur J Neurol. 2017;24(1):18-26.
12. Moreau C, Delval A, Defebvre L, et al.; Parkgait-II study group. Methylphenidate for gait hypokinesia and freezing in patients with Parkinson’s disease undergoing subthalamic stimulation: a multicentre, parallel, randomised, placebo-controlled trial. Lancet Neurol. 2012 Jul;11(7):589-96.
13. Xie T, Padmanaban M, Bloom L, et al. Effect of low versus high frequency stimulation on freezing of gait and other axial symptoms in Parkinson patients with bilateral STN DBS: a mini-review. Transl Neurodegener. 2017;6:13.
14. Valldeoriola F, Munoz E, Rumia J, et al. Simultaneous low-frequency deep brain stimulation of the substantia nigra pars reticulata and high-frequency stimulation of the subthalamic nucleus to treat levodopa unresponsive freezing of gait in Parkinson’s disease: a pilot study. Parkinsonism Relat Disord. 2019;60:153-7.
15. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
16. Gilat M, Ginis P, Zoetewei D, et al. A systematic review on exercise and training-based interventions for freezing of gait in Parkinson’s disease. NPJ Parkinsons Dis. 2021 Sep 10;7(1):81.
17. Sweeney D, Quinlan LR, Browne P, et al. A technological review of wearable cueing devices addressing freezing of gait in Parkinson’s disease. Sensors (Basel). 2019;19(6).
18. Fox SH, Katzenschlager R, Lim SY, et al.; Movement Disorder Society Evidence-Based Medicine Committee. International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson’s disease. Mov Disord. 2018 Aug;33(8):1248-1266.
19. Mehrholz J, Friis R, Kugler J, et al. Treadmill training for patients with Parkinson’s disease. Cochrane Database Syst Rev. 2010;1:CD007830.
20. Henderson EJ, Lord SR, Brodie MA, et al. Rivastigmine for gait stability in patients with Parkinson’s disease (ReSPonD): a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Neurol. 2016 Mar;15(3):249-58.
21. Camicioli R, Morris ME, Pieruccini-Faria F, et al. Prevention of Falls in Parkinson’s Disease: Guidelines and Gaps. Mov Disord Clin Pract. 2023 Sep 2;10(10):1459-1469.
22. Li F, Harmer P, Fitzgerald K, et al. Tai chi and postural stability in patients with Parkinson’s disease. N Engl J Med. 2012;366(6):511-9.
23. Yang Y, Li XY, Gong L, et al. Tai chi for improvement of motor function, balance and gait in Parkinson’s disease: a systematic review and meta-analysis. PLoS ONE. 2014;9(7):e102942.
24. Sharp K, Hewitt J. Dance as an intervention for people with Parkinson’s disease: A systematic review and meta-analysis. Neurosci Biobehav Rev. 2014;47:445-56.
25. Simpkins C, Yang F. Do dance style and intervention duration matter in improving balance among people with Parkinson’s disease? A systematic review with meta-analysis. Parkinsonism Relat Disord. 2023 Jan;106:105231.
El antecolis en la EP se define como la flexión anterior de la cabeza y cuello de al menos 45°, con posible corrección transitoria voluntaria completa o casi completa o con capacidad de ejercer fuerza con los músculos extensores del cuello ante un examinador26 (NE-IV). Aparece en el 8% de los pacientes. De inicio subagudo y curso progresivo, es más frecuente su aparición a lo largo del curso de la enfermedad, pero puede aparecer de forma aguda tras el inicio del tratamiento con agonistas dopaminérgicos y amantadina. Los pacientes con antecolis pueden presentar dolor cervical, disfagia, sialorrea, alteración visual y pérdida de equilibrio. En la exploración puede aparecer hipertrofia de la musculatura extensora y flexora, espasmos de la musculatura flexora, debilidad de músculos extensores, rigidez cervical y no mejora con gesto antagonista26.
Fisiopatológicamente se barajan dos hipótesis: 1) en los pacientes con hipertrofia muscular, con algún grado de torticolis o laterocolis y sin debilidad, se sugiere una etiología distónica, y 2) en los pacientes con debilidad de los extensores y leve atrofia de los flexores, hay que considerar una miopatía. En todos los casos puede haber rigidez asociada. En los casos en los que la postura no se corrige hay que descartar una patología ortopédica subyacente27(NE-IV).
Antes de iniciar un tratamiento se debe realizar una prueba de imagen cervical y un electromiograma (EMG). En los casos en que haya datos de miopatía inflamatoria en el EMG se puede plantear una biopsia muscular25 (NE-IV).
En cuanto a su manejo, en los casos en que predomina la distonía se puede realizar:
— Ajustar el tratamiento dopaminérgico si existe modificación de la postura en función de las fluctuaciones motoras del paciente. Retirar los agonistas si ha existido relación temporal con el inicio de agonistas dopaminérgicos29 (NE-II).
— Toxina botulínica: no hay evidencias de resultados con toxina botulínica en la musculatura flexora superficial del cuello. Se puede utilizar una guía con EMG y ecografía para inyectar la musculatura flexora profunda del cuello30 (NE-II).
En los casos en que predomina la miopatía se puede intentar tratamiento con corticoides o inmunosupresores en los pacientes en los que hay datos de miopatía inflamatoria31 (NE-IV, grado de recomendación D).

Se define como una flexión anormal (lumbar > 30° y torácica > 45°) de la región toracolumbar mientras el paciente está sentado o caminando y que desaparece casi por completo en decúbito supino. Se puede clasificar en camptocormia superior, cuando la flexión del tronco se produce entre la zona torácica baja y lumbar alta (implica bilateralmente a los músculos oblicuos externos e internos, así como rectos abdominales), y camptocormia inferior, cuando la flexión es a nivel de la cadera (implica al iliopsoas y rectos abdominales). La prevalencia de este síndrome es del 10%7 (NE-I). Los pacientes con EP que desarrollan camptocormia suelen ser mujeres de edad avanzada con una EP más grave y con más síntomas no motores. Los pacientes presentan inestabilidad y tensión de la musculatura abdominal. En la exploración asocian rigidez axial importante, espasmo de rectos abdominales y dolor de espalda32 (NE-IV).
La camptocormia en la EP se produce por varios factores: progresión de la enfermedad, distonía asociada a la EP y miopatía secundaria a la propia enfermedad o concurrente con los fármacos usados en su tratamiento (agonistas dopaminérgicos o neurolépticos). El diagnóstico diferencial hay que plantearlo principalmente con problemas espondiloartrósicos (aplastamientos vertebrales, osteoporosis, fracturas); en este caso, la falta de corrección de la postura en decúbito supino es el principal factor diferenciador33 (NE-IV).
Se recomienda realizar pruebas de imagen para descartar anomalías óseas subyacentes. También se puede valorar la realización de un EMG para el estudio de la musculatura hiperactiva. El manejo de la camptocormia consiste en:
— La camptocormia se considera un signo que no responde a LD, pero se puede ajustar el tratamiento dopaminérgico si se observa fluctuación de la postura según el estado motor. En algunos casos, cuando haya sospecha de su relación con inicio o modificación de dosis de agonistas dopaminérgicos, valorar la retirada de estos. En casos seleccionados y jóvenes en los que puede predominar el cuadro distónico, se puede intentar el tratamiento con anticolinérgicos34 (NE-IV).
—Toxina botulínica: no hay estudios con resultados positivos. Se recomienda inyectar los músculos oblicuos externos, en los casos en que no se encuentre beneficio inyectado solo los rectos anteriores o ileopsoas35 (NE-IV). ̖
— Inyección de lidocaína en los músculos oblicuos externos36 (NE-IV).
— ECP: los estudios realizados con ECP tanto en el NST como en el globo pálido interno en series pequeñas de casos han mostrado resultados variables37 (NE-III). En otro metaanálisis38 (NE-I) se ha confirmado que la ECP es un tratamiento eficaz para la camptocormia en la EP con un grado de mejoría de hasta el 68%. Los pacientes en la fase inicial de la camptocormia con un ángulo de flexión más significativo pueden beneficiarse más de la ECP. La indicación de ECP en camptocormia asociada a EP no debe considerarse aislada, sino dentro de la valoración global de la indicación de esta técnica, por sus complicaciones motoras (NE-III, grado de recomendación C).
— Cirugía ortopédica: se debe considerar la corrección de deformidades solo en casos graves seleccionados, así como cirugía local descompresiva en pacientes con fracturas o aplastamientos vertebrales que condicionen radiculopatía o mielopatía asociada39 (NE-IV).

Se define como la inclinación lateral del tronco (10°) que se corrige de forma pasiva o en decúbito supino. Hay que diferenciarla de la escoliosis, que es un término ortopédico con rotación vertebral. El síndrome de Pisa puede tener o no asociada una escoliosis. La prevalencia en la EP es del 10% y puede estar presente en otros parkinsonismos como la atrofia multisistémica. La fisiopatología es compleja y multifactorial: se ha relacionado con fármacos (neurolépticos e inhibidores de la acetilcolinesterasa), distonía y, sobre todo, con un desequilibrio en el funcionamiento de los ganglios basales y una alteración de la integración sensitivo-motora que favorecerían la postura anormal. En la mayoría de los pacientes con EP, la curvatura suele ser hacia el lado contralateral al inicio de los síntomas40 (NE-IV). El inicio es crónico y el curso progresivo. Los pacientes pueden tener desequilibrio, disnea y dolor.
Se recomienda realizar pruebas de imagen para descartar anomalías óseas subyacentes. También se puede valorar la realización de un EMG para el estudio de la musculatura hiperactiva.
El manejo del síndrome de Pisa se basa en:
Tratamiento no farmacológico41: ortesis y rehabilitación (NE-IV).
Tratamiento farmacológico:
— Se debe comprobar si se ha añadido algún fármaco, como agonistas dopaminérgicos o IACE, que pueda causar el síndrome y retirarlo. Ajustar el tratamiento dopaminérgico si se observa cambio de la postura según la situación motora del Se pueden usar clozapina y anticolinérgicos42 (NE-IV).
— Toxina botulínica: inyectar en la musculatura paravertebral, cuadrado lumbar e iliopsoas43 (NE-IV).
Tratamiento quirúrgico:
— ECP: en un reciente metaanálisis44, el 94,9% de los pacientes se sometió a ECP-STN 5,1% tenía GPi como zona diana de ECP. Se informó de un resultado positivo en el síndrome de Pisa del 72,2%. La menor edad y el menor UPDRS-III preoperatorio (on/off) se consideraron factores predictivos positivos para un efecto positivo de la ECP (NE-I).
— Cirugía ortopédica: se debe considerar la corrección de deformidades solo en casos graves seleccionados, así como la cirugía local descompresiva en pacientes con fracturas o aplastamientos vertebrales que condicionen radiculopatía y/o mielopatía asociada45 (NE-IV).

7. Cao S, Cui Y, Jin J, et al. Prevalence of axial postural abnormalities and their subtypes in Parkinson’s disease: a systematic review and meta-analysis. J Neurol. 2023 Jan;270(1):139-151.
25. Simpkins C, Yang F. Do dance style and intervention duration matter in improving balance among people with Parkinson’s disease? A systematic review with meta-analysis. Parkinsonism Relat Disord. 2023 Jan;106:105231.
26. Tinazzi M, Geroin C, Bhidayasiri R, et al.; International Parkinson and Movement Disorders Society Task Force on Postural Abnormalities. Task Force Consensus on Nosology and Cut-Off Values for Axial Postural Abnormalities in Parkinsonism. Mov Disord Clin Pract. 2022;9(5):594-603.
27. Doherty KM, Van de Warrenburg BP, Peralta MC, et al. Postural deformities in Parkinson’s disease. Lancet Neurol. 2011;10:538-49.
28. Jo G, Park J, Yoon J, et al. Effect of spinal kypho-orthosis to gait and forward flexion in Parkinson disease. J Phys Ther Sci. 2018;30:988-992.
29. Benninger F, Khlebtovsky A, Roditi Y, et al. Beneficial effect of levodopa therapy on stooped posture in Parkinson’s disease. Gait Posture. 2015;42:263-268.
30. Revuelta GJ, Montilla J, Benatar M, et al. An 18F-FDG PET study of cervical muscle in parkinsonian anterocollis. J Neurol Sci. 2014;340(1-2):174-7.
31. Savica R, Kumar N, Ahlskog JE, et al. Parkinsonism and dropped head: dystonia, myopathy, ¿or both? Parkinsonism Relat Disord. 2012;18(1):30-4.
32. Srivanitchapoom P, Hallett M. Camptocormia in Parkinson’s disease: definition, epidemiology, pathogenesis and treatment modalities. J Neurol Neurosurg Psychiatry. 2016;87(1):75-85.
33. Artusi CA, Geroin C, Nonnekes J, et al.; International Parkinson and Movement Disorders Society Task Force on Postural Abnormalities. Predictors and Pathophysiology of Axial Postural Abnormalities in Parkinsonism: A Scoping Review. Mov Disord Clin Pract. 2023;10(11):1585-1596.
34. Gerton BK, Theeler B, Samii A. Backpack treatment for camptocormia. Mov Disord. 2010;25:247-248.
35. Wijemanne S, Jiménez-Shahed J. Improvement in dystonic camptocormia following botulinum toxin injection to the external oblique muscle. Parkinsonism Relat Disord. 2014;20(10):1106-7.
36. Furusawa Y, Mukai Y, Kawazoe T, et al. Long-term effect of repeated lidocaine-injections into the external oblique for upper camptocormia in Parkinson’s disease. Parkinsonism Relat Disord. 2013;19(3):350-4.
37. Umemura A, Oka Y, Ohkita K, et al. Effect of subthalamic deep brain stimulation on postural abnormality in Parkinson disease. J Neurosurg. 2010;112:1283-8.
38. Spindler P, Alzoobi Y, Kühn AA, et al. Deep brain stimulation for Parkinson’s disease-related postural abnormalities: a systematic review and meta-analysis. Neurosurg Rev. 2022 Oct;45(5):3083-3092.
39. Koller H, Acosta F, Zenner J, et al. Spinal surgery in patients with Parkinson’s disease: experiences with the challenges posed by sagittal imbalance and the Parkinson’s spine. Eur Spine J. 2010;19:1785-1794.
40. Castrioto A, Piscicelli C, Perennou D, et al. The pathogenesis of Pisa syndrome in Parkinson’s disease. Mov Disord. 2014;29(9):1100-7.
41. Bloem BR, De Vries NM, Ebersbach G. Non pharmacological treatments for patients with Parkinson’s disease. Mov Disord. 2015;30:1504-20.
42. Bhattacharya KF, Giannakikou I, Munroe N, et al. Primary anticholinergic-responsive Pisa syndrome. Mov Disord. 2000;15:1285-1287.
43. Dupeyron A, Viollet E, Coroian F, et al. Botulinum Toxin-A for treatment of Pisa syndrome: A new target muscle. Parkinsonism Relat Disord. 2015;21(6):669-70.
44. Gandolfi M, Geroin C, Imbalzano G, et al. Treatment of axial postural abnormalities in parkinsonism disorders: A systematic review of pharmacological, rehabilitative and surgical interventions. Clin Park Relat Disord. 2024 Mar 12;10:100240.
45. Abat LB, McLain RF, Bingaman W, et al. Spinal surgery in patients with Parkinson’s disease: construct failure and progressive deformity. Spine. 2004;29:2006-2012.
En la EP son frecuentes los trastornos de la voz y del habla, más aún con la progresión de la enfermedad, y pueden llegar a ser muy limitantes y mermar de forma muy significativa la calidad de vida. Ocurren en hasta un 89% de los pacientes46. Los más frecuentes son: bajo volumen (hipofonía) y monotonía en el tono de la voz (disprosodia), articulación imprecisa, repetición de palabras, aceleración del ritmo (palilalia, taquilalia), voz entrecortada y temblor vocal. Algunos de ellos pueden deberse a la hipocinesia y a la rigidez (y por ello pueden mejorar con la terapia dopaminérgica). También existe una mala coordinación entre habla y respiración, así como alteraciones en la autopercepción acústica.
A nivel farmacológico, para mejorar los problemas del habla se debe optimizar la medicación dopaminérgica, aunque la respuesta sea parcial. Pueden ocurrir mejorías tanto con aumento como con el descenso en la medicación dopaminérgica47 (NE-IV). El tratamiento mediante estimulación subtalámica en ocasiones provoca empeoramiento en la articulación (aunque también se han descrito mejorías en pacientes disártricos)44 (NE-IV). El empeoramiento posquirúrgico puede ser reversible y se ha hipotetizado que puede variar por los cambios en la medicación o de los parámetros eléctricos de estimulación.
La logopedia emplea ejercicios respiratorios, de fonación, articulación, prosodia y entonación. Hay dispositivos de retroalimentación auditiva retardada (RAR) que, por ejemplo, emiten una vibración cuando la señal acústica es menor que un umbral fijado de forma individual. En fases avanzadas de la enfermedad, puede ser necesario emplear aparatos de comunicación (amplificadores de voz, tableros alfabeto, sistemas de salida de voz digitalizada, mensajes de voz grabados).
Existen dos revisiones sistemáticas de la literatura médica sobre tratamiento de la disartrofonía en la EP realizadas por el movimiento Cochrane en 201243,48 (NE-I). Valoran estudios realizados en un total de 159 pacientes. Concluyen que el Lee Silverman Voice Treatment (LSVT) mejora más que los ejercicios respiratorios en diversos parámetros objetivos (nivel de presión sonora y variabilidad de frecuencia en lectura y en monólogo, comunicación y volumen del habla) (NE-I).
El LSVT es un método en el que se instruye al paciente a incrementar el volumen y la inteligibilidad. Es el que, según los estudios publicados, es más eficaz en la EP. Al comparar distintas modalidades de LSVT, en la EP es más eficaz el LSVT-LOUD (el centrado en voz, en el componente respiratorio y laríngeo) que el LSVT-ARTIC (el centrado en articulación y región orofacial)49. El LSVT-LOUD es mejor en inteligibilidad del habla y nivel de presión sonora de lectura. El LSTV-LOUD incluye ejercicios de intensidad de voz, entonación y movilidad facial que mejoran las funciones respiratorias, laríngeas y articulatorias; se aplican 16 sesiones de 60 minutos durante 1 mes. Se ha observado que en ocasiones la mejoría puede mantenerse hasta 2 años46. Emplea un sonómetro para calibrar el nivel de volumen de la voz y hacer reconocer que deben aumentarlo para ser entendido (retroalimentación visual). Es un tratamiento también eficaz en la disfagia. Al comparar la aplicación de la terapia LSTV-LOUD de manera presencial con el modo online no hay diferencias significativas, salvo la presión y la aspereza en la fonación vocal sostenida a favor de la modalidad presencial. En un ensayo aleatorizado en 64 pacientes con EP se corroboró que el LSVT LOUD durante 1 mes produjo más mejoría que el LSTV-ARTIC y que en los pacientes no tratados y que esta mejoría se mantenía a los 7 meses49 (NE-I).
Tras una revisión sistemática y un metaanálisis de todos los estudios publicados con LSTV en EP, se incluyeron finalmente 10 ensayos y se concluyó que era más eficaz que la terapia respiratoria convencional. El resultado clínicamente más relevante sería la inteligibilidad, pero casi ningún resultado en estos estudios es estadísticamente significativo50 (NE-I).
Al comparar la eficacia de la RAR frente a la terapia tradicional, hay parte de resultados a favor de la RAR (articulación y tasa de conversación en lectura) y otros a favor de la terapia tradicional (inteligibilidad de lectura51).
No se encuentran publicaciones que traten de la repercusión sobre las actividades de la vida o calidad de vida, el impacto en el cuidador ni estudios sobre el impacto económico.
Los pacientes deben ser derivados a terapeutas entrenados en los métodos más beneficiosos en la EP.
Muchos individuos mejoran los parámetros de la voz y el habla justo tras completar la terapia y debe recomendarse insistentemente que los continúen en domicilio para mantener esa mejoría. Pueden beneficiarse de evaluaciones periódicas y talleres de recuerdo.

43. Dupeyron A, Viollet E, Coroian F, et al. Botulinum Toxin-A for treatment of Pisa syndrome: A new target muscle. Parkinsonism Relat Disord. 2015;21(6):669-70.
44. Gandolfi M, Geroin C, Imbalzano G, et al. Treatment of axial postural abnormalities in parkinsonism disorders: A systematic review of pharmacological, rehabilitative and surgical interventions. Clin Park Relat Disord. 2024 Mar 12;10:100240.
45. Abat LB, McLain RF, Bingaman W, et al. Spinal surgery in patients with Parkinson’s disease: construct failure and progressive deformity. Spine. 2004;29:2006-2012.
46. Herd CP, Tomlinson CL, Deane KH, et al. Comparison of speech and language therapy techniques for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002814.
47. Atalar MS, Oguz O, Genc G. Hypokinetic Dysarthria in Parkinson’s Disease: A Narrative Review. Sisli Etfal Hastan Tip Bul. 2023 Jun 20;57(2):163-170.
48. Herd CP, Tomlinson CL, Deane KH, et al. Speech and language therapy versus placebo or no intervention for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002812.
49. Ramig L, Halpern A, Spielman J, et al. Speech treatment in Parkinson’s disease: Randomized controlled trial (RCT). Mov Disord. 2018;33:1777.
47. Atalar MS, Oguz O, Genc G. Hypokinetic Dysarthria in Parkinson’s Disease: A Narrative Review. Sisli Etfal Hastan Tip Bul. 2023 Jun 20;57(2):163-170.
48. Herd CP, Tomlinson CL, Deane KH, et al. Speech and language therapy versus placebo or no intervention for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002812.
49. Ramig L, Halpern A, Spielman J, et al. Speech treatment in Parkinson’s disease: Randomized controlled trial (RCT). Mov Disord. 2018;33:1777.
50. Pu T, Huang M, Kong X, et al. Lee Silverman Voice Treatment to Improve Speech in Parkinson’s Disease: A Systemic Review and Meta-Analysis. Parkinsons Dis. 2021;2021:3366870.
51. Cosentino G, Avenali M, Schindler A, et al. A multinational consensus on dysphagia in Parkinson’s disease: screening, diagnosis, and prognostic value. J Neurol. 2022;269:1335.
Los trastornos de la deglución son un problema muy relevante en la EP, aunque muchas veces infradiagnosticados y muchas veces inadvertidos por los pacientes. Incluso en fases iniciales de la enfermedad, si se realizan estudios instrumentales, se evidencian alteraciones hasta en un 80% de los pacientes48. La edad, el tiempo de evolución de la enfermedad y la demencia son factores que de forma independiente incrementan el riesgo de disfagia. Es más frecuente en pacientes que requieren más LD y en el subtipo caracterizado por alteraciones de la marcha y el equilibrio precoces. Puede variar con las fluctuaciones y contribuir a la sialorrea. En fases avanzadas puede provocar dificultades en la administración del tratamiento oral, limitar las actividades sociales y aumenta el riesgo de desnutrición y deshidratación, así como de asfixias, neumonía por aspiración y muerte. La disfagia es el principal factor pronóstico de fallecimiento en las fases avanzadas de la enfermedad52.
En la EP se pueden afectar todas las fases de la deglución: elaboración del bolo, interferencias por movimientos anormales de la lengua (lingual pumping, lingual rocking), acúmulos de comida en la valécula y el seno piriforme, alteración de la relajación y menor apertura cricofaríngea, poca elevación del complejo hiolaríngeo, retraso en el cierre glótico, hipoestesia en estructuras laríngeas con menos reflejos protectores o alteraciones de la peristalsis esofágica. El reflejo tusígeno es muchas veces débil o incluso ausente53 (NE-II).
Su fisiopatología es compleja, relacionándose tanto con mecanismos dopaminérgicos como no dopaminérgicos (por ejemplo, asociados a la degeneración de núcleos colinérgicos del tronco). En estudios necrópsicos en enfermos con disfagia se han demostrado depósitos de α-sinucleína en axones sensitivos en la mucosa del tracto digestivo alto, así como en el nervio vago y en las uniones neuromusculares en los músculos faríngeos. También se han observado alteraciones en la musculatura lisa, de control autonómico52 (NE-II).
Un grupo de 38 expertos internacionales elaboraron en 2022 un consenso sobre el screening, el diagnóstico y el impacto de la disfagia en la EP en el pronóstico y en la calidad de vida52 (NE-IV). Realizaron una revisión sistemática de la literatura científica, tras la que se seleccionaron 85 publicaciones, la mayoría estudios tienen NE-IV.
Concluyeron que los datos en la historia que indican que debe realizarse un screening son aumento de la duración de las comidas, sensación de comida pegada, tos tras la ingesta, cambios en la voz tas deglutir (gorgoteo), atragantamiento, pérdida de peso, infecciones respiratorias frecuentes y babeo (estudios NE-I, III y IV y opinión de expertos)52 (NE-I). En esos casos debe realizarse un test de screening. En base a los estudios de clase III y IV y opinión de expertos se recomienda aplicar el test autoadministrado Swallowing Disturbance Questionnaire (SDQ), aunque hay otros que pueden ser considerados52 (NE-III).
Si el test de screening es positivo debería ser evaluado por un logofoniatra y realizarse pruebas instrumentales (estudios clase II, III y IV y opinión de expertos)52 (NE-II). El Water Swallow Test es fácil para detectar riesgo de aspiración, pero requiere que esté preservada la sensibilidad faríngea y el reflejo tusígeno.
Son dos las pruebas instrumentales que habitualmente se emplean para confirmar y analizar el diagnóstico de disfagia:
Fibroendoscopia de la deglución (FEES): permite la visualización directa de toda la superficie mucosa de la faringe y vestíbulo laríngeo, objetivando el posible residuo de secreciones o de alimentos y el riesgo de penetración/aspiración. No provoca radiación, pero no permite la valoración de la fase oral.
Videofluoroscopia (VFS): proporciona un registro funcional de todas las fases de la deglución. Es más Se utiliza material de contraste en diferentes volúmenes y consistencia.
Ambas detectan aspiración, penetración y residuo con similar sensibilidad y especificidad (NE-I, II, III y IV y opinión de expertos)52 (NE-I). Permiten valorar la eficacia de las modificaciones compensatorias de la dieta, posturas y maniobras deglutorias.
La gravedad de la disfagia se suele valorar con la escala Penetration-Aspiration Scale (PAS) que se puntúa desde 1 (no paso a vía aérea) a 8 (entra en la vía área, penetra bajo las cuerdas vocales y no se producen esfuerzos para expulsar el material).
En caso de síntomas esofágicos debe recomendarse la valoración por un gastroenterólogo52 (NE-IV).
Debe tenerse en cuenta el estado motor del paciente en el momento de aplicación de las pruebas, para poder interpretar adecuadamente los resultados. En general debe realizarse en on, salvo si hay discinesias axiales u oromandibulares52 (NE-IV).
La disfagia afecta la calidad de vida de los pacientes, condiciona restricciones dietéticas, interfiere con las relaciones sociales, asocia malestar, depresión, pérdida de autonomía y dificultad la para ingerir la medicación, con lo que eso conlleva.
En cuanto al tratamiento de la disfagia, a nivel farmacológico se debe optimizar la medicación dopaminérgica, aunque la respuesta sea parcial. La LD, la apomorfina y la rotigotina han demostrado su eficacia en algunos pacientes55 (NE-IV). Infiltraciones con toxina botulínica en el musculo cricofaríngeo pueden ser eficaces si hay un déficit de relajación del esfínter esofágico superior56 (NE-IV). En pacientes con EP avanzada es un síntoma que empeora durante los periodos off y que puede mejorar con optimización de medicación dopaminérgica. Se recomienda entonces en pacientes fluctuantes con este problema, realizar la ingesta durante los periodos on57.
Un grupo de expertos internacionales publicaron un consenso en 2021 sobre el tratamiento de la disfagia en la EP58. Realizaron una revisión de la literatura médica y finalmente analizaron 64 publicaciones de estudios principalmente (NE-IV).
El diseño del plan de tratamiento debe ser individualizado, en función de las alteraciones objetivadas en las pruebas, de los hábitos alimenticios, de la presencia o no de deterioro cognitivo y del soporte familiar.
Las terapias compensadoras para realizar una deglución más segura y eficiente (modificación del bolo, postura (por ejemplo, mentón hacía abajo), maniobras de deglución y estimulación sensitiva) tienen una eficacia inmediata58. La prueba de volumen-viscosidad determina la consistencia segura de los alimentos a ingerir y se debe perseguir también una palatabilidad adecuada.
Se ha constatado que espesar los líquidos reduce el riesgo de aspiración58 (NE-III), aunque no hay evidencia de que reduzca la incidencia de neumonía o muerte cuando se compara con la postura de bajar el mentón. El uso de la postura de bajar la barbilla hacia el pecho con líquidos poco espesos es menos eficaz en la prevención de la aspiración en comparación con utilizar líquidos espesos solos y no reduce eficazmente la incidencia de neumonía en las poblaciones con EP y demencia58. Respecto a la modificación de consistencias del bolo se necesita más investigación sobre el uso de espesantes de líquidos en relación con su efectividad en algunos tipos de disfagia.
Hay que hacer conocer al paciente y a la familia normas para una adecuada deglución: realizar la ingesta de los alimentos en situación on como comentábamos anteriormente, no forzarla y realizarla de modo atento, sin distractores, comer lentamente y en pequeñas cantidades, y asegurarse de vaciar la boca antes de ingerir de nuevo. Valorar y asesorar sobre la importancia de un buen estado nutricional.
Las terapias rehabilitadoras intentan modificar la fisiología y producir cambios a largo plazo. Requieren que el paciente no sufra demencia y sea colaborador. Hay pocas evidencias de que las terapias convencionales mejoren la disfagia en la EP (ejercicios de motricidad oral, ejercicios para potenciar la musculatura espiratoria…). Las evidencias de eficacia son muy discretas en el entrenamiento con biofeedback, entrenamiento de musculatura espiratoria, LSVT, neuroestimulación magnética y eléctrica transcutánea. Una nueva revisión sistemática y metaanálisis sobre los tratamientos de la disfagia en la EP ha sido publicado en 202357. Los autores concluyen que, pese a la escasez de estudios de alta calidad, los tratamientos estimuladores muestran beneficios significativos y a largo plazo (NE-I).
En ocasiones puede ser requerida la sonda nasogástrica provisional no solo para asegurar la nutrición sino para permitir la administración de fármacos. En fases avanzadas, cuando la disfagia es grave, se debe recomendar la gastrostomía. En caso de demencia no está indicada59 (NE-IV). Se debe tener en cuenta siempre la autonomía del paciente y fomentar la toma de decisiones previas, como la redacción de las voluntades anticipadas, antes de que se instaure un problema importante de comunicación o demencia que le impida formular sus decisiones. Se debe informar de las consecuencias negativas que tiene la no realización de la gastrostomía para alimentación, aunque no hay estudios sobre cambio de pronóstico o de calidad de vida60.

48. Herd CP, Tomlinson CL, Deane KH, et al. Speech and language therapy versus placebo or no intervention for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002812.
52. Miller N. Swallowing in Parkinson’s disease: clinical issues and management. Neurodegener Dis Manag. 2017 Jun;7(3):205-217.
53. Kim YH, Oh BM, Jung IY, et al. Spatiotemporal characteristics of swallowing in Parkinson’s disease. Laryngoscope. 2015;125(2):389-95.
54. Suttrup I, Warnecke T. Dysphagia in Parkinson’s disease. Dysphagia 2016;31(1):24-32.
55. Mu L, Sobotka S, Chen J, et al. Arizona Parkinson’s Disease Consortium. Alpha-synuclein pathology and axonal degeneration of the peripheral motor nerves innervating pharyngeal muscles in Parkinson disease. J Neuropathol Exp Neurol. 2013;72(2):119-29.
56. Mu L, Chen J, Sobotka S, et al. Arizona Parkinson’s Disease Consortium. Alpha-Synuclein Pathology in Sensory Nerve Terminals of the Upper Aerodigestive Tract of Parkinson’s Disease Patients. Dysphagia. 2015;30(4):404-17.
57. Warnecke T, Suttrup I, Schröder JB, et al. Levodopa responsiveness of dysphagia in advanced Parkinson’s disease and reliability testing of the FEES-Levodopa-test. Parkinsonism Relat Disord. 2016 Jul;28:100-6.
58. Chang MC, Park JS, Lee BJ, et al. Effectiveness of pharmacologic treatment for dysphagia in Parkinson’s disease: a narrative review. Neurol Sci. 2021 Feb;42(2):513-519.
59. Schindler A, Pizzorni N, Cereda E, et al. Consensus on the treatment of dysphagia in Parkinson’s disease. J Neurol Sci. 2021;430:120008.
60. Cheng I, Sasegbon A, Hamdy S. Dysphagia treatments in Parkinson’s disease: a systematic review and meta-analysis. Neurogastroenterol Motil. 2023;35(8):e14517.


