Manual
Es un placer poder participar con el prólogo en el Manual SEN de Recomendaciones Diagnósticas y Terapéuticas en Enfermedad de Parkinson, un libro que es referencia en la práctica clínica y que periódicamente se actualiza incorporando los avances clínicos y terapéuticos del área. Sus objetivos, desde los comienzos en los años noventa, han sido analizar de una manera global esta enfermedad. Posiblemente esta nueva edición es más que necesaria, como posiblemente lo fueron las anteriores, por los avances que hemos vivido en los últimos años. La visión más integral de la persona, con una propuesta de nueva clasificación evolutiva de la enfermedad que integra aspectos motores, no motores, cognitivos y la dependencia del paciente, que la hace más real y operativa para los pacientes del siglo XXI. Una valoración más biológica que nos ayuda a entender subtipos evolutivos, valorando la presencia de la α-sinucleína, la neuroimagen y los genes. El entender la enfermedad como un síndrome clínico que puede estar relacionado con distintas alteraciones.
Otro aspecto fundamental son los avances terapéuticos que estamos viviendo, especialmente para las fases avanzadas de la enfermedad. Todo ellos nos permiten dar una respuesta individualizada cuando los recursos terapéuticos habituales asocian eventos adversos con la evolución de la enfermedad. Esta complejidad de recursos nos obliga a tener un conocimiento global clínico de la enfermedad y todas las opciones que podemos aportar a nuestros pacientes. En el decenio de la salud cerebral, se ha demostrado la eficacia de terapias no farmacológicas, que deben formar parte de la aproximación global que realizamos a las personas. Adecuadamente indicadas tienen niveles de evidencia altos y evidencia de plausibilidad biológica.
A pesar de los grandes avances, la enfermedad de Parkinson es una enfermedad neurodegenerativa en la que acompañamos al paciente durante su vida y es importante tener conocimientos en los cuidados al final de la vida, la toma de decisiones y la importancia de saber reconocer las fases y valorar la planificación de los cuidados necesarios.
En este excelente manual de la SEN, los coordinadores Dra. Mariana Hernández González Monje, Dra. Silvia Jesús Maestre, Dr. Juan Carlos Gómez Esteban y Dr. Álvaro Sánchez Ferro han sabido coordinar y aunar el esfuerzo de los autores para sintetizar de una manera armónica y práctica todos los aspectos fundamentales que debemos conocer sobre esta compleja enfermedad.
Os invito a todos a compartir vuestra pasión por la neurología y la enfermedad de Parkinson con la lectura completa de este manual o considerándolo el texto referente de consulta. ¡Disfrutad!
Jesús Porta-Etessam
El presente Manual SEN de recomendaciones diagnósticas y terapéuticas en enfermedad de Parkinson ha sido concebido como una revisión actualizada e integradora del ya de por sí excelente trabajo realizado por nuestros estimados colegas predecesores en el año 2016, actualizado en 2019. Ambas ediciones se apoyaron también en versiones previas.
Por esta razón, se han mantenido tanto los autores originales como los de la actual revisión, reconociendo la importancia que han tenido para proporcionar al lector recomendaciones basadas en la evidencia más reciente. El objetivo de todos estos autores y los coordinadores del manual es proporcionar la mejor información y evidencia conocida a los profesionales involucrados en la atención sanitaria de las personas afectadas por la enfermedad de Parkinson.
La presente edición tiene algunas modificaciones notables. En primer lugar, se han adaptado los criterios de evaluación de la evidencia y recomendaciones de la edición previa. Para ello se han seguido normas estandarizadas, que se explican en la sección siguiente sobre metodología. Todo el contenido del manual se ha adaptado para cumplir estos criterios.
En segundo lugar, y como es menester, se ha incorporado la información más reciente para poder presentar al lector un contenido vigente y fundamentado en la mejor evidencia disponible en el momento actual. Para asegurar la máxima calidad y rigor del contenido, este se ha hecho público antes de la edición final a fin de contrastar las recomendaciones con la opinión de la comunidad médica, de pacientes y otros agentes relevantes como la industria. Esto se ha realizado siempre siguiendo la evaluación sistemática referida anteriormente para evitar posibles sesgos.
En tercer lugar, se han ampliado algunos capítulos, sobre todo los referentes a terapias no farmacológicas y cuidados paliativos, que han tenido bastante desarrollo en los últimos tiempos y que son al menos tan importantes como los abordajes diagnósticos y terapéuticos más tradicionales. También se ha añadido un algoritmo de tratamiento para la enfermedad de Parkinson en fases no iniciales/no avanzadas, donde también ha habido abundantes desarrollos terapéuticos y algunos enlaces de interés y se han actualizado los previos.
Finalmente, este manual nace en formato papel, pero en línea con las tendencias actuales, presentamos un correlato digital que facilitará por un lado tanto el acceso y
lectura de los contenidos como la revisión crítica de la evidencia presentada.
Esperamos, por tanto, que el lector disfrute del contenido y que le sea útil para el propósito último de mejorar la atención y asistencia de la enfermedad de Parkinson.
Los coordinadores:
Mariana Hernández González Monje
Silvia Jesús Maestre
Juan Carlos Gómez Esteban
Álvaro Sánchez Ferro
La elaboración de esta edición del manual de manejo de la enfermedad de Parkinson ha contado con la participación de expertos en trastornos del movimiento, miembros del Grupo de Estudio de Trastornos del Movimiento (GETM) de la Sociedad Española de Neurología (SEN). El grupo de trabajo encargado de la realización de este manual se ha organizado en tres grupos: coordinadores generales del manual, coordinadores de capítulos y autores de capítulos o de diferentes apartados de capítulos. De esta forma, la revisión y supervisión del contenido se ha estructurado en tres niveles, con objeto de garantizar su unidad, continuidad y rigor científico.
La elaboración del manual ha seguido las etapas establecidas en el proceso de la medicina basada en la evidencia (MBE), que establece cuatro pasos para la generación de los contenidos en una guía de práctica clínica1:
-
Los autores plantean una o más preguntas clínicas que deben responderse para desarrollar el tema que están abordando.
-
Los autores identifican y evalúan toda la evidencia pertinente correspondiente al tema, realizando una búsqueda bibliográfica exhaustiva. La evidencia encontrada se evalúa en función del contenido y la calidad de los estudios.
-
Los autores sacan conclusiones a partir de la evidencia seleccionada para responder a las preguntas planteadas.
-
Los autores transforman las conclusiones extraídas de la evidencia en recomendaciones de práctica clínica. Las recomendaciones están redactadas y graduadas en función de la calidad de los datos que las respaldan y en otros factores adicionales, como la evaluación de los riesgos y beneficios esperados.
El texto del manual recoge la evidencia seleccionada, con mención expresa de su nivel de evidencia, las conclusiones de los autores y coordinadores y las recomendaciones propuestas haciendo constar su grado de recomendación.
Revisión bibliográfica
Partiendo de la edición previa de la Guía oficial de práctica clínica en la enfermedad de Parkinson, editada en 20162 y actualizada en 2019, y teniendo en cuenta las recomendaciones para la Actualización de Guías de Práctica Clínica del Sistema Nacional de Salud3, el grupo de autores encargado de la redacción de contenidos realizó una búsqueda sistemática, con evaluación y selección de las publicaciones aparecidas desde entonces, así como de aquellas que, sin restricción de fecha, dan soporte a los nuevos capítulos que no figuraban en la edición anterior. Para la búsqueda bibliográfica se han utilizado las principales bases de datos electrónicas de estudios originales (MEDLINE, CENTRAL y EMBASE). Asimismo, se han revisado las referencias de las principales guías de práctica clínica internacionales sobre enfermedad de Parkinson, identificando las principales revisiones sistemáticas y ensayos clínicos incluidos en ellas. Esta literatura científica seleccionada ha complementado o sustituido a la que figuraba en la bibliografía de la guía de 2016.
Evaluación de la evidencia
Para la evaluación de la calidad de la evidencia se utilizó la clasificación numérica romana que evalúa la calidad de la información en cuatro niveles (I, II, III y IV) según el grado de confianza que ofrece la metodología empleada en los estudios. Esta clasificación es consistente con los niveles de confianza en la evidencia propuestos por el sistema GRADE, que establece cuatro niveles de calidad de la evidencia: alta, moderada, baja y muy baja4. Esta clasificación ha sido adoptada por la EFNS en la actualización de 2012 de las recomendaciones de preparación de guías de práctica clínica5. No obstante, como orientación para la evaluación inicial de los estudios recopilados, se han conservado los criterios de clasificación de estudios clínicos propuestos por la EFNS en 20046, por ser más explícitos que otras propuestas posteriores. De esta forma, el nivel I corresponde a tipos de estudios que ofrecen un alto grado de confianza, como los ensayos clínicos controlados y aleatorizados o las revisiones sistemáticas y el nivel IV a los estudios o publicaciones con un bajo nivel de confianza, como las revisiones narrativas, las series de casos o los consensos. En la siguiente tabla se resumen los tipos de estudios o publicaciones que, según las recomendaciones de la EFNS, pueden incluirse en cada uno de los cuatro niveles propuestos.
Estos niveles de evidencia se han aplicado a todas las publicaciones utilizadas como base de la redacción de los contenidos de los diferentes capítulos, excepto en lo que se refiere al capítulo 4, que trata sobre la evaluación de la enfermedad y en el que se mantienen los criterios de recomendación de la International Parkinson and Movement Disorder Society (MDS) a la hora de presentar las diferentes escalas de evaluación de la enfermedad de Parkinson.
Considerando los criterios GRADE adoptados por la EFNS en 2012, a la hora de establecer los niveles de evidencia se han tenido en cuenta ciertos factores que pueden modificar el nivel determinado por el diseño de los estudios. De esta forma, algunos factores pueden bajar el nivel de evidencia base, como el riesgo de sesgos en el diseño o ejecución, la inconsistencia entre los resultados de diferentes estudios, la disponibilidad de evidencia indirecta, la imprecisión de los estimadores del efecto o la sospecha de sesgo de publicación. De igual forma, otros factores pueden incrementar el nivel de evidencia de partida, como un objetivo de largo alcance, un evidente gradiente dosis-repuesta o la consideración del impacto de las variables de confusión4,5.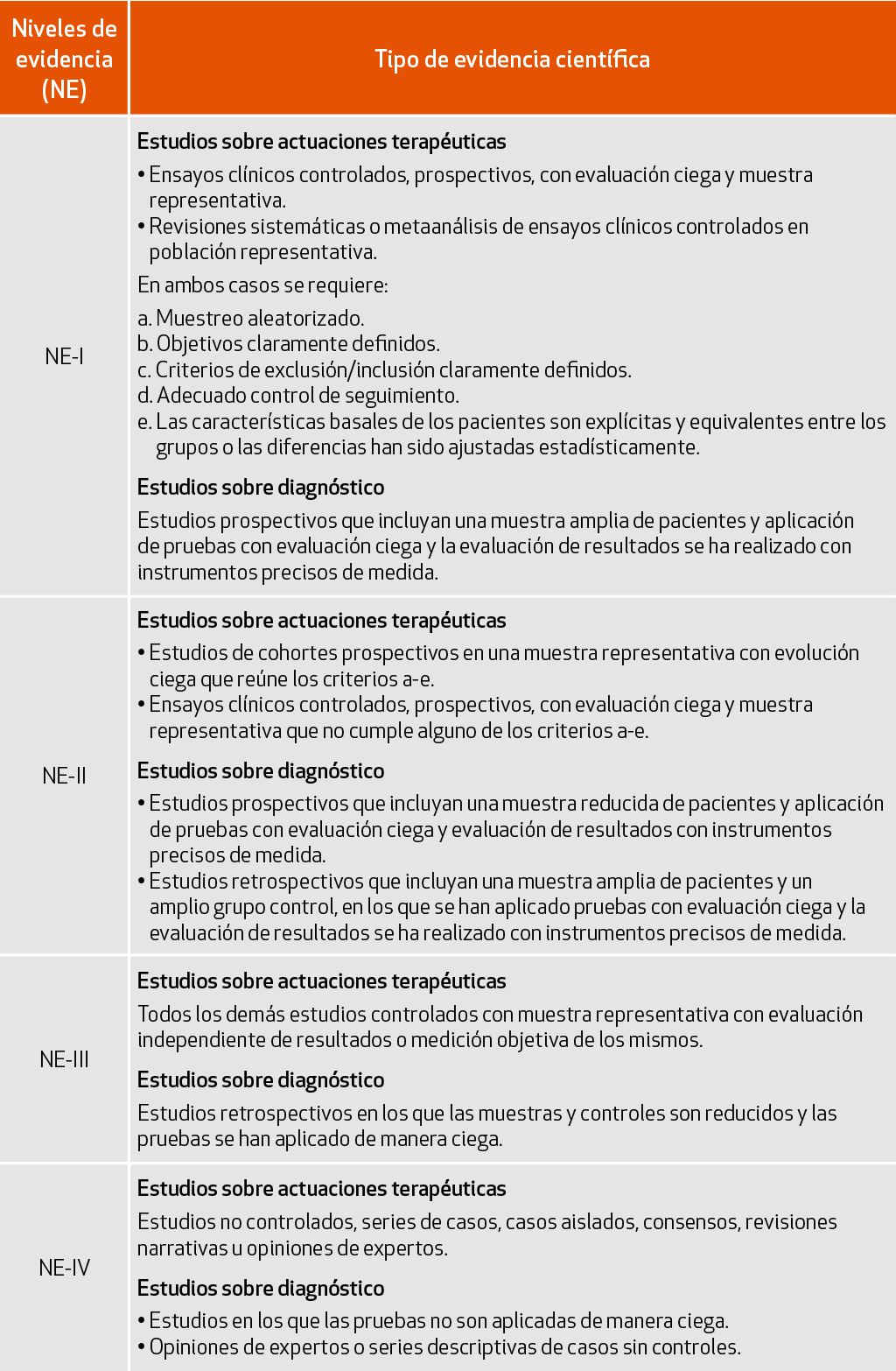
Los niveles de evidencia de los estudios se presentan en el texto en forma abreviada, a continuación del número de referencia y entre paréntesis, con las iniciales NE seguidas del número romano correspondiente al nivel determinado. Por ejemplo, para una revisión sistemática con metaanálisis de calidad, la notación sería (NE-I) y para un consenso basado en la opinión de expertos (NE-IV). En los casos en los que una misma conclusión o afirmación del texto se basa en varios estudios con diferentes niveles de evidencia, se hace constar el correspondiente al estudio de mayor nivel, considerando que es el que aporta resultados con mayor grado de confianza.
Grados de recomendación
La elaboración de recomendaciones para la práctica clínica se basa en la evaluación de la evidencia previamente realizada, así como en las conclusiones derivadas del análisis de dicha evidencia. Tal como establece el sistema GRADE, las recomendaciones pueden ser clasificadas por su dirección y su fuerza. La dirección de una recomendación la posiciona a favor o en contra de una intervención, mientras que la fuerza establece su grado de recomendación4. En este sentido los grados de recomendación se relacionan de forma directa con los niveles de evidencia que han determinado la confianza de los estudios que sustentan las recomendaciones.
En consonancia con los criterios de evaluación de la evidencia anteriormente expuestos, se establecen cuatro grados de recomendación que se identifican alfabéticamente (A, B, C y D). Estos grados identifican la fuerza de la recomendación en función del resultado probable de su aplicación en la práctica clínica. La siguiente tabla expone las definiciones de los diferentes grados de recomendación1.

Con objeto de establecer el grado de una recomendación, se ha considerado el nivel de evidencia de los estudios que la sustentan. Los criterios para la determinación de los grados de recomendación a partir de los niveles de evidencia están basados en los propuestos por la EFNS6 en 2004, para no perder su alineación con los niveles de evidencia orientativos, y se exponen en la siguiente tabla.

Las recomendaciones se presentan en el texto al final de cada capítulo precedidas, cada una de ellas, por la letra que indica su grado de recomendación. En algún caso particular se ha hecho constar el grado de recomendación dentro del desarrollo del contenido del capítulo, especialmente cuando se han considerado las indicaciones de las opciones de tratamiento.
Bibliografía
1. Gronseth GS, Cox J, Gloss D, Merillat S, Dittman J, Armstrong MJ, et al.; on behalf of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Clinical Practice Guideline Process Manual. Minneapolis, MN: The American Academy of Neurology; 2017.
2. Arbelo González JM (coord.). Guía oficial de recomendaciones clínicas en la enfermedad de Parkinson. Madrid: Sociedad Española de Neurología; 2016.
3. Grupo de trabajo para la actualización del Manual de Elaboración de GPC. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Actualización del Manual Metodológico. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; Zaragoza: Instituto Aragonés de Ciencias de la Salud (IACS); 2016. Disponible en: https://www.madrid.org/bvirtual/BVCM017418.pdf
4. Schünemann H, Brozek J, Guyatt G, Oxman A (eds.). GRADE handbook for grading quality of evidence and strength of recommendations. The GRADE Working Group, 2013. Disponible en: http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/
5. Leone MA, Brainin M, Boon P, Pugliatti M, Keindl M, Bassetti CL. Guidance for the preparation of neurological management guidelines by EFNS scientific task forces - revised recommendations 2012. Eur J Neurol. 2013 Mar;20(3):410-419.
6. Brainin M, Barnes M, Baron JC, Gilhus NE, Hughes R, Selmaj K, et al. Guidance for the preparation of neurological management guidelines by EFNS scientific task forces--revised recommendations 2004. Eur J Neurol. 2004 Sep;11(9):577-81.
Introducción
El diagnóstico de la enfermedad de Parkinson (EP) sigue siendo clínico, pero en estos últimos años se han producido importantes avances. En este capítulo revisamos los criterios diagnósticos vigentes, el papel actual de los marcadores sugestivos de sinucleinopatía subyacente con más rendimiento diagnóstico, la utilidad de los test farmacológicos y el diagnóstico diferencial.
Diagnóstico de la enfermedad
El diagnóstico correcto de la EP es fundamental para el manejo óptimo del paciente, pero obtener una certeza diagnóstica completa en vida sigue siendo hoy en día imposible, a pesar de décadas de avances. En los estudios clinicopatológicos realizados en la década de los noventa se consiguió una confirmación diagnóstica por autopsia de entre el 75 y el 95% en los pacientes que habían sido diagnosticados de EP por expertos1-4 (NE-II).
La precisión diagnóstica varía considerablemente según la duración de la enfermedad, la edad, la experiencia del médico y la evolución en nuestra comprensión de la EP (estudios más recientes muestran en general una mayor precisión).
Los errores en el diagnóstico pueden ser atribuibles a la falta de reconocimiento de otras patologías neurodegenerativas, causas de parkinsonismo secundario o de la ausencia de un auténtico parkinsonismo (por ejemplo, temblor esencial, temblor distónico, etc.). Desde la descripción de la EP se han producido cambios muy importantes tanto en aspectos clínicos, etiofisiopatológicos y terapéuticos como en el concepto que tenemos sobre la enfermedad. Entendemos mejor las manifestaciones motoras y el papel de su respuesta al tratamiento como parte de los criterios diagnósticos. Tenemos una mayor claridad en las definiciones anatomopatológicas, entendiendo que la neurodegeneración comienza antes de que se manifiesten los síntomas motores, y un mayor conocimiento sobre las manifestaciones no motoras y sobre el papel que tienen los factores genéticos y epigenéticos en la etiofisiopatología de la enfermedad.
También en los últimos años se han hecho importantes avances en el campo de los biomarcadores. Así, en el ámbito de los biomarcadores de laboratorio, hemos vivido el desarrollo de ensayos de amplificación de semilla (en inglés seeding amplification assays [SAA]), que permiten evidenciar in vitro la capacidad proagregante de α-sinucleína en varias muestras biológicas, con sensibilidad y especificidad óptimas por ahora en el líquido cefalorraquídeo (LCR), si bien con resultados prometedores en otros fluidos y tejidos (sangre, piel, etc.)5. Sin embargo, los biomarcadores de imagen presentan limitaciones. La imagen estructural por resonancia magnética (RM) (con signos como el swallow tail sign, por alteración del nigrosoma, o las secuencias de neuromelanina) aún no ha sido evaluada apropiadamente en términos de especificidad comparada con otros parkinsonismos, mientras que la imagen molecular de α-sinucleína mediante pruebas de medicina nuclear (fundamentalmente la tomografía por emisión de positrones [PET]), lleva años encontrando dificultades mayores a las observadas con la imagen molecular de amiloide-β y τ, y, por ahora, la escasa literatura científica ha mostrado algunos resultados más sólidos en atrofia multisistémica que en la propia EP6-8.
Estos avances en el conocimiento nos han obligado a replantearnos aspectos básicos, como son la definición de la EP y sus criterios diagnósticos.
De este modo, en 2015, el grupo de trabajo de la Sociedad Internacional de la Enfermedad de Parkinson y Trastornos del Movimiento (Movement Disorder Society [MDS]) presentó los criterios diagnósticos de investigación para la fase prodrómica9 (NE-IV) y para uso en la clínica para la EP clínicamente manifiesta10 (NE-IV). Estos criterios surgieron del trabajo de un grupo de expertos internacionales en el que revisaban la definición de la EP y algunos aspectos críticos que comentaremos a continuación11 (NE-IV). En primer lugar, se replanteó el papel central de la patología clásica como algo indispensable para el diagnóstico, debido a la existencia de nueva evidencia sobre EP de causa genética sin depósito de sinucleína, una alta prevalencia de cuerpos de Lewy incidentales y que los agregados de α-sinucleína pueden no estar presentes en fases preclínicas de la enfermedad12-15. Igualmente, la identificación de formas genéticas y familiares de la enfermedad condujeron a eliminar la historia familiar como criterio de exclusión. En segundo lugar, se reconoció la demencia como un aspecto frecuente en la EP, proponiendo la consideración de la demencia por cuerpos de Lewy (DCL) como una variante fenotípica de la EP y eliminando, por tanto, la presencia de demencia como un criterio de exclusión. Por último, se hizo énfasis en la importancia de reconocer la heterogeneidad de la enfermedad y la existencia de una fase prodrómica cuya caracterización permitiría el uso de estrategias neuroprotectoras cuando estuvieran disponibles.
Criterios diagnósticos en la fase prodrómica
Estos criterios fueron desarrollados para la investigación en este campo y hoy en día aún no se contempla su uso en la práctica clínica diaria. La EP prodrómica se define como la fase de la enfermedad en la que los síntomas secundarios a la neurodegeneración están presentes, pero el diagnóstico clínico de la EP no es todavía posible. Los criterios se basan en un modelo que calcula la probabilidad de sufrir una EP prodrómica tomando como base la edad y añadiendo información sobre factores de riesgo ambientales y genéticos, así como el resultado de pruebas complementarias (PET-tomografía por emisión de fotón único [SPECT], ecografía cerebral, etc.)16-18 (NE-III). Estos criterios han sido validados en cohortes prospectivas (NE-II) y tienen una especificidad relativamente alta para la conversión de una EP prodrómica probable (> 80% de probabilidad) a una EP clínica. En cambio, su sensibilidad es variable, porque depende de los marcadores presentes (se requieren marcadores altamente predictivos para una alta sensibilidad) y del tiempo de evolución del proceso patológico asociado a la EP (la sensibilidad disminuye en puntos temporales tempranos, cuando muchas características no han tenido tiempo de desarrollarse)19 (NE-II). En 2019 se publicó una actualización de estos criterios20 (NE-IV), añadiendo nuevos marcadores prodrómicos y revisando los valores predictivos de los previamente incluidos. Estos criterios actualizados presentaron una sensibilidad ligeramente mejor que los originales, pero en general por debajo del 65%21-24 (NE-II). Utilizando un punto de corte del 80%, la sensibilidad fue del 0% (en la cohorte Hellenic Longitudinal Investigation of Aging and Diet [HELIAD]), del 35% (la cohorte Tübingen Evaluation of Risk Factors for Early Detection of Neurodegeneration [TREND]) con 10 años de seguimiento22, del 40% (en el estudio Bruneck25 a 10 años de seguimiento23) y del 64% (en el estudio Bruneck25 a 5 años de seguimiento23) y utilizando un punto de corte más bajo del 50%, la sensibilidad aumentó al 4,5% (HELIAD), el 65% (TREND: 10 años de seguimiento, Bruneck: 10 años de seguimiento) y el 91% (Bruneck: 5 años de seguimiento)22-25.
Criterios diagnósticos para la enfermedad de Parkinson de la International Movement Disorder Society (MDS-PD Criteria)
Estos criterios fueron creados fundamentalmente para su uso en investigación, pero tras haber sido validados frente al gold standard26 (el diagnóstico clínico realizado por un experto y con casos confirmados neuropatológicamente)27, la MDS respalda su uso en la práctica clínica diaria28 (NE-II). Los aspectos motores y la mayoría de las características diagnósticas se identifican a través de una cuidadosa historia clínica y un examen neurológico detallado. Por consiguiente, el diagnóstico exige una formación adecuada en Neurología.
Primero se evalúan las alteraciones motoras (definidas como bradicinesia más temblor de reposo o rigidez), consideradas el eje central del diagnóstico de parkinsonismo. El siguiente paso se basa en confirmar la existencia o ausencia de criterios de exclusión y de banderas rojas, además de confirmar la existencia de otros criterios positivos adicionales que sirven de apoyo y aumenten la confianza a la hora de realizar el diagnóstico.
Se incluyen dos niveles distintos de certeza:
- EP clínicamente establecida . Su objetivo es maximizar la especificidad. La gran mayoría (es decir, al menos el 90%) de los sujetos que cumplan estos criterios tendrá una Se presume que muchos casos de EP verdaderos no cumplirán con este nivel de certeza.
- EP clínicamente probable . Su objetivo es obtener un equilibrio entre sensibilidad y Un 80% de los pacientes diagnosticados como EP probable tendrán EP y además se podrán identificar un 80% de todos los casos.
Otras características clave para la valoración de los criterios diagnósticos son las siguientes:
- Características negativas y positivas . Las primeras son aquellas que van en contra del diagnóstico (bien exclusiones absolutas o bien banderas rojas) y las segundas son aquellas que apoyan el diagnóstico de EP.
- Peso específico . No todas las características tienen el mismo peso específico a la hora de hacer el diagnóstico. Los criterios de exclusión se han dividido en dos categorías: por una parte, los que se consideran signos específicos de diagnósticos alternativos, y por otra, las banderas rojas, que son signos potenciales de patologías alternativas con menor nivel de especificidad. Las banderas rojas descartan el diagnóstico de EP solamente cuando no pueden ser contrapesadas por criterios que soportan el diagnóstico. No se ha definido el nivel de especificidad de las banderas rojas, por lo que se han utilizado las guías y las opiniones de los grupos de consenso de los criterios diagnósticos previos.
- Interpretación de los hallazgos . Algunos criterios de exclusión incluyen sugerencias interpretativas, por lo que no pueden ser aplicadas a circunstancias que son inadecuadas (por ejemplo, el diagnóstico como parkinsonismo inducido por fármacos en un paciente que toma quetiapina a dosis bajas por un trastorno de sueño, o cuando se presenta una enfermedad que claramente explica la presencia de un criterio específico, como podría ser la existencia de un trastorno sensitivo tras un ictus).
- El tiempo . La seguridad diagnóstica aumenta con el Al inicio, la progresión y la respuesta al tratamiento pueden no ser evidentes y las marcas características de otras enfermedades neurodegenerativas pueden no haber aparecido todavía. Además, algunos de los hallazgos tienen diferentes implicaciones en los diferentes estadios de la enfermedad. Algunos datos atípicos son incompatibles con la EP temprana, pero pueden ser relativamente comunes en estadios avanzados. Por ello, muchos criterios individuales incluyen componentes de duración. Si un hecho atípico ocurre fuera de la ventana de tiempo, el criterio no se aplica.
- Demencia . Deja de considerarse la demencia como un criterio de exclusión para la EP, independientemente de si ocurre o no al inicio de la evolución. Los pacientes con demencia de inicio precoz que, de acuerdo con los criterios de consenso29 (NE-IV), serían diagnosticados de DCL, también podrían ser opcionalmente clasificados como EP-subtipo DCL.
- Pruebas diagnósticas . Actualmente el diagnóstico de la EP es clínico y los criterios diagnósticos están diseñados para ser utilizados sin el apoyo de pruebas diagnósticas. Sin embargo, ocasionalmente hay pruebas complementarias que se pueden realizar para resolver casos inciertos. Se aceptan como tales aquellas que sirvan como criterios de soporte y que tengan publicados tres estudios realizados en diferentes centros con un mínimo de 60 participantes y más de un 80% de especificidad en el diagnóstico diferencial del parkinsonismo en la mayoría de los estudios. Se acepta como sustitutivo de uno de los tres estudios requeridos la existencia de un metaanálisis con menos de 60 pacientes (son imperativos los otros dos estudios). Se incluyeron el déficit olfatorio y la gammagrafía cardiaca con 123I-metayodobencilguanidina (123I-MIBG) (NE-I). Los estudios con neuroimagen funcional de la vía dopaminérgica presináptica con PET o SPECT pueden distinguir la EP de entidades que parecen una EP sin parkinsonismo (temblor esencial), así como los parkinsonismos vasculares y farmacológicos, pero no son una herramienta cualificada para diferenciar la EP de otros parkinsonismos neurodegenerativos (NE-I).
Criterios para el diagnóstico de parkinsonismo
El parkinsonismo se define como bradicinesia, en combinación con temblor de reposo, rigidez o ambos. Estos hallazgos deben ser claramente demostrables y no atribuibles a factores de confusión (envejecimiento, artritis, debilidad, etc.). El examen de todos los signos cardinales debe realizarse tal y como se describe en la sección de exploración motora (parte III) de la Escala Unificada de la Enfermedad de Parkinson Modificada por la Sociedad de Trastornos del Movimiento (MDS-UPDRS):
- Bradicinesia: se define como enlentecimiento y disminución de la amplitud o velocidad (o vacilaciones o paradas progresivas) del movimiento. Puede ser evaluada utilizando los ítems de la escala MDS-UPDRS, que cuantifican el tapping de pies y manos, movimientos de manos y piernas, pronosupinación (ítems 4, 3.5, 3.6, 3.7 y 3.8). Aunque la bradicinesia también puede ser documentada en la voz, facies, dominios axiales y en la marcha, es necesario demostrar la bradi-/hipocinesia en brazos y piernas para poder hacer el diagnóstico de parkinsonismo. La bradicinesia, tal y como se entiende aquí, combina las definiciones de bradicinesia (disminución de la velocidad o lentitud) y acinesia/hipocinesia (disminución de la amplitud del movimiento). Ambas están generalmente presentes en la exploración, aunque no siempre de forma simultánea.
- Rigidez: es definida como la resistencia de un “tubo de plomo”, es decir, una resistencia independiente de la velocidad del movimiento y que no refleja solamente un déficit en la relajación muscular (distinto de la espasticidad y la paramiotonía). Aunque el fenómeno de la rueda dentada puede estar presente (y señala la existencia de temblor), la existencia de rueda dentada sin fenómeno de tubo de plomo no cumple los criterios necesarios para definir rigidez en el Tal y como se describe en la MDS-UPDRS, la rigidez se explora por medio de “movimientos pasivos lentos de las articulaciones mayores cuando el paciente se encuentra en una posición relajada y el examinador manipula sus extremidades y el cuello”.
- Temblor de reposo: se refiere a un temblor de una frecuencia de entre 4 y 6 Hz en una extremidad en reposo absoluto y que se suprime con el inicio del movimiento. Se puede valorar durante la entrevista y la exploración (MDS-UPDRS 17, 3.18). Los temblores cinéticos y posturales por sí mismos (MDS-UPDRS 3.15 y 3.16) no permiten el diagnóstico de parkinsonismo. En la EP, el temblor de reposo en el brazo también puede observarse tras mantener una postura de forma prolongada (por ejemplo, temblor reemergente), pero, para cumplir los criterios, el temblor debe observarse también en reposo. En aquellos pacientes en los que se asocie un temblor de actitud o cinético hay que asegurarse de que la extremidad esté completamente relajada durante la exploración.
Aunque la inestabilidad postural es una característica del parkinsonismo, no se considera parte de los criterios MDS-PD. Se presenta de forma frecuente en estadios tardíos de la EP, pero su presencia en estadios precoces sugiere un diagnóstico alternativo.
Criterios diagnósticos de la enfermedad de Parkinson
Una vez establecido el diagnóstico de parkinsonismo se aplican los criterios MDS-PD para determinar si la EP es la causa del parkinsonismo.
El diagnóstico de EP clínicamente establecida requiere:
- La ausencia de criterios de exclusión
- Por lo menos dos criterios que soporten el diagnóstico.
- Que no existan banderas
El diagnóstico de EP clínicamente probable puede hacerse si:
- Hay ausencia de criterios de exclusión
- Hay banderas rojas, pero están adecuadamente contrapesadas por criterios de soporte de diagnóstico. Por ejemplo, si hay una bandera roja, tiene que haber un criterio de soporte, si hay dos banderas rojas, dos criterios. Si hay más de dos banderas rojas, no se puede hacer el diagnóstico de EP probable.
Criterios de soporte del diagnóstico
Una respuesta clara al tratamiento dopaminérgico. Para cumplir este criterio, el paciente, durante su tratamiento inicial, debe regresar casi hasta la situación funcional normal previa. No es suficiente que se documente “algo de mejoría”. La respuesta debe ser inequívoca y En ausencia de documentación de esta respuesta inicial (poca información, uso de agentes con menor eficacia o dosis bajas), la mejoría necesaria para cumplir el criterio se puede definir como una marcada mejoría a medida que se aumenta la dosis o un marcado empeoramiento con la reducción de la dosis. Se puede documentar de forma objetiva con 1) un cambio de más del 30% en la escala MDS-UPDRS parte III tras el cambio de tratamiento, o 2) la aparición inequívoca y marcada de fluctuaciones.
- Presencia de discinesias inducidas por levodopa (LD).
- Temblor de reposo en una extremidad, documentada en la exploración clínica.
- Resultado positivo de por lo menos una de las pruebas diagnósticas auxiliares que tengan al menos un 80% de especificidad para el diagnóstico diferencial entre la EP y otros Las pruebas que actualmente cumplen esta condición son:
- Déficit olfatorio (en rango anósmico o claramente hipósmico ajustado por edad y sexo) (NE-I).
- Denervación simpática cardiaca documentada por gammagrafía con 123I-MIBG (NE-I).
Criterios de exclusión absolutos
Para todos los criterios de exclusión y para las banderas rojas se asume que, si el criterio no se cumple por una causa alternativa y no relacionada, no constituye un criterio de exclusión (por ejemplo, si se observan anormalidades cerebelosas unilaterales atribuibles a un ictus cerebeloso).
La presencia de cualquiera de los siguientes hallazgos descarta una EP:
- Anormalidades cerebelosas demostradas de forma inequívoca en la exploración (marcha cerebelosa, dismetrías, alteraciones oculomotoras cerebelosas, etc.).
- Parálisis supranuclear de la mirada vertical inferior o enlentecimiemto selectivo de sacadas verticales inferiores.
- Diagnóstico probable de demencia frontotemporal en su variante conductual o afasia progresiva primaria definidas de acuerdo con los criterios de consenso30 (NE-IV) dentro de los primeros 5 años de la Este criterio se refiere únicamente a estas dos entidades asociadas a taupatías. Otras formas de demencia no son un criterio de exclusión para la EP per se.
- Signos parkinsonianos limitados a las extremidades inferiores durante más de 3 años.
- Tratamiento con antagonistas de receptores dopaminérgicos o agentes deplecionantes de dopamina utilizados a dosis y curso temporal consistentes con un parkinsonismo inducido por fármacos. Para valorarlo adecuadamente, hay que aplicar el juicio clínico con el fin de evaluar si la dosis-tiempo de tratamiento con el fármaco en cuestión es suficiente para inducir un parkinsonismo o por el contrario está desenmascarando una EP subclínica.
- La ausencia de una respuesta a altas dosis de LD a pesar de que la gravedad de la enfermedad sea El paciente debe haber recibido dosis de LD superiores a 600 mg/día durante 6 semanas. Si no es así, este criterio no se puede aplicar. La ausencia de respuesta debe ser documentada de forma adecuada, si es posible con exploraciones secuenciales.
- Déficit sensitivo cortical inequívoco (por ejemplo, agrafestesia o esteroagnosia con modalidades sensitivas primarias intactas o una clara apraxia ideomotora en las extremidades superiores o afasia progresiva).
- Estudio del sistema presináptico dopaminérgico por neuroimagen funcional normal. Este criterio no implica que el estudio de imagen dopaminérgica funcional sea necesario para el diagnóstico de Si el estudio no se ha realizado este criterio no se aplica.
- La documentación de una condición alternativa conocida que produzca parkinsonismo y que esté en relación plausible con los síntomas del O que el clínico que evalúa el paciente, basado en la valoración diagnóstica completa, opine que la existencia de un síndrome alternativo puede ser una opción más probable que la EP en ese momento evolutivo. Este criterio hace referencia no solamente a síndromes raros sino también a parkinsonismos más frecuentes como son atrofia multisistema (AMS) o la parálisis supranuclear progresiva (PSP).
Banderas rojas
Se consideran banderas rojas las siguientes:
- Una progresión rápida del trastorno de la marcha que lleve a la utilización, de forma regular, de una silla de ruedas durante los 5 años desde el inicio.
- Una ausencia completa de progresión de los síntomas motores dentro de los primeros 5 años de evolución. Este criterio pone sobre aviso de aquellos pacientes que han podido ser diagnosticados de forma equivocada de parkinsonismo.
- Disfunción bulbar precoz, definida como disfonía grave, disartria ininteligible la mayor parte del tiempo o disfagia grave (requiere comida en forma de semisólidos, sonda nasogástrica o gastrostomía) durante los primeros 5 años de evolución.
- Disfunción respiratoria inspiratoria, definida como la existencia de estridor o la presencia de “suspiros” inspiratorios frecuentes.
- Trastorno autonómico grave durante los primeros 5 años, que puede incluir:
- Hipotensión ortostática: descenso de la presión arterial tras ortostatismo de unos 3 minutos, de al menos 30 mmHg en las cifras de presión sistólica o de 15 mmHg en las de las diastólicas, en ausencia de deshidratación, toma de medicación u otras enfermedades que pudieran explicar de forma plausible la disfunción autonómica.
- Grave incontinencia o retención urinaria durante los primeros 5 años de evolución (una vez descartadas causas urológicas).
La disfunción autonómica es un hallazgo frecuente en la EP. Este criterio pretende identificar la disfunción autonómica grave asociada particularmente a la AMS.
- Caídas recurrentes (más de una al año) como consecuencia de la alteración en la estabilidad durante los primeros 3 años de evolución.
- La presencia de anterocolis desproporcionada (de naturaleza distónica) o contracturas en los brazos o piernas durante los primeros 10 años de evolución.
- La ausencia de alguno de los síntomas no motores comunes en la EP después de 5 años de evolución de esta. Incluyen:
- Trastornos del sueño: insomnio con dificultad para mantener el sueño, somnolencia diurna excesiva, síntomas sugestivos de trastorno del sueño REM.
- Disfunción autonómica: estreñimiento, urgencia urinaria diurna, hipotensión ortostática sintomática, hiposmia.
- Trastornos psiquiátricos: depresión, ansiedad o apatía.
- Signos piramidales que no pueden ser explicados por otra. Se excluye la existencia de una asimetría de reflejos discreta, que puede observarse de forma frecuente en la EP. También se excluye la respuesta extensora plantar, dada la dificultad de diferenciarla del dedo estriatal (hallazgo ocasional en la EP) y la posibilidad de que una patología no relacionada pueda producir este hallazgo.
- Parkinsonismo bilateral simétrico a lo largo del curso evolutivo de la enfermedad.


Bibliografía
-
Rajput AH, Rozdilsky B, Rajput Accuracy of clinical diagnosis in parkinsonism: a prospective study. Can J Neurol Sci. 1991;18:275-8.
-
Hughes AJ, Daniel SE, Lees Improved accuracy of clinical diagnosis of Lewy body Parkinson’s disease. Neurology. 2001;57:1497-9.
-
Hughes AJ, Daniel SE, Kilford L, et Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry. 1992;55:181-4. d
-
Tolosa E, Wenning G, Poewe W. The diagnosis of Parkinson’s disease. Lancet Neurol. 2006;5:75-86.
-
Bellomo G, De Luca CMG, Paoletti FP, et al. α-Synuclein Seed Amplification Assays for Diagnosing Synucleinopathies: The Way Forward. Neurology. 2022;99(5):195-205.
-
Mahlknecht P, Krismer F, Poewe W, et Meta-analysis of dorsolateral nigral hyperintensity on magnetic resonance imaging as a marker for Parkinson›s disease. Mov Disord. 2017;32(4):619-23.
-
Chougar L, Arsovic E, Gaurav R, et al. Regional Selectivity of Neuromelanin Changes in the Substantia Nigra in Atypical Parkinsonism. Mov Disord. 2022;37(6):1245-55.
-
Smith R, Capotosti F, Schain M, et al. The α-synuclein PET tracer [18F] ACI-12589 distinguishes multiple system atrophy from other neurodegenerative Nat Commun. 2023;14(1):6750.
-
Berg D, Postuma RB, Adler CH, et al. MDS research criteria for prodromal Parkinson›s Mov Disord. 2015;30(12):1600-11.
-
Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson›s disease. Mov Disord. 2015;30(12):1591-601.
-
Berg D, Postuma RB, Bloem B, et Time to redefine PD? Introductory statement of the MDS Task Force on the definition of Parkinson›s disease. Mov Disord. 2014;29(4):454-62.
-
Kalia LV, Lang AE, Hazrati LN, et al. Clinical correlations with Lewy body pathology in LRRK2-related Parkinson disease. JAMA Neurol. 2015;72(1):100-5.
-
Siderowf A, Concha-Marambio L, Lafontant DE, et al. Assessment of heterogeneity among participants in the Parkinson’s progression markers initiative cohort using alpha-synuclein seed amplification: a cross-sectional Lancet Neurol. 2023;22(5):407-17.
-
Van de Berg WD, Hepp DH, Dijkstra AA, et al. Patterns of α-synuclein pathology in incidental cases and clinical subtypes of Parkinson›s disease. Parkinsonism Relat Disord. 2012;18 Suppl 1:S28-30.
-
Chahine LM, Merchant K, Siderowf A, et al. Proposal for a Biologic Staging System of Parkinson›s Disease. J Parkinsons Dis. 2023;13(3):297-309.
-
Mahlknecht P, Gasperi A, Willeit P, et al. Prodromal Parkinson›s disease as defined per MDS research criteria in the general elderly Mov Disord. 2016;31(9):1405-8.
-
Fereshtehnejad SM, Montplaisir JY, Pelletier A, et al. Validation of the MDS research criteria for prodromal Parkinson’s disease: longitudinal assessment in a REM sleep behavior disorder (RBD) cohort. Mov Disord. 2017;32:865-73.
-
Mirelman A, Saunders-Pullman R, Alcalay RN, et al.; AJ LRRK2 Consortium. Application of the Movement Disorder Society prodromal criteria in healthy G2019S-LRRK2 carriers. Mov Disord. 2018;33(6):966-973.
-
Pilotto A, Heinzel S, Suenkel U, et Application of the movement disorder society prodromal Parkinson›s disease research criteria in 2 independent prospective cohorts. Mov Disord. 2017;32(7):1025-1034.
-
Heinzel S, Berg D, Gasser T, et al.; MDS Task Force on the Definition of Parkinson›s Disease. Update of the MDS research criteria for prodromal Parkinson›s Mov Disord. 2019;34(10):1464-1470.
-
Giagkou N, Maraki MI, Yannakoulia M, et al. A Prospective Validation of the Updated Movement Disorders Society Research Criteria for Prodromal Parkinson›s Disease. Mov 2020;35(10):1802-1809.
-
Yilmaz R, Suenkel U, TREND Study Team; et Comparing the Two Prodromal Parkinson›s Disease Research Criteria-Lessons for Future Studies. Mov Disord. 2021;36(7):1731-1732.
-
Marini K, Mahlknecht P, Tutzer F, et Application of a Simple Parkinson›s Disease Risk Score in a Longitudinal Population-Based Cohort. Mov Disord. 2020;35(9):1658-1662.
-
Giagkou N, Maraki MI, Yannakoulia M, et A prospective validation of the updated movement disorders society research criteria for prodromal Parkinson’s disease. Mov Disord. 2020;35(10):1802-1809.
-
Kiechl S, Willeit J. In a nutshell: findings from the Bruneck study. Gerontology. 2019;65(1):9-19.
-
Postuma RB, Poewe W, Litvan I, et al. Validation of the MDS clinical diagnostic criteria for Parkinson›s disease. Mov Disord. 2018;33(10):1601-1608.
-
Virameteekul S, Revesz T, Jaunmuktane Z, et al. Clinical Diagnostic Accuracy of Parkinson›s Disease: Where Do We Stand? Mov Disord. 2023;38(4):558-566.
-
Diagnosis of Parkinson’s disease. En: International Parkinson and Movement Disorder Society [Internet]. Disponible en: https://ur0.jp/H8XpR
-
McKeith IG, Dickson DW, Lowe J, et al; Consortium on DLB. Diagnosis and management of dementia with Lewy bodies: third report of the DLB Consortium. Neurology. 2005;65(12):1863-72.
-
Rascovsky K, Hodges JR, Knopman D, et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. 2011;134(Pt 9):2456-77.
Para la aceptación de un biomarcador, la sensibilidad y la especificidad, en particular, tienen que ser elevadas (superiores al 80%). Actualmente, entre los marcadores de α-sinucleinopatía únicamente cumplirían estas condiciones los de amplificación de α-sinucleína (αSyn-SAA, por sus siglas en inglés) en LCR y piel de forma inconsistente en la literatura científica31-33 (NE-II). El uso de otras técnicas (por ejemplo, ELISA o SIMOA para medir los niveles de α-sinucleína (o de las técnicas mencionadas previamente), pero utilizando otros tejidos, estarían reservadas para el campo de la investigación en el momento actual, por lo que no se comentarán en este capítulo.
Los SAA son técnicas novedosas y ultrasensibles que permiten detectar la capacidad proagregante de una proteína incluso en muestras con cantidades ínfimas de proteínas mal plegadas. Estas técnicas se desarrollaron inicialmente para el estudio de las encefalopatías espongiformes transmisibles usando la amplificación cíclica de mal plegamiento de proteínas (del inglés, protein misfolding cyclic amplification [PMCA]) para evaluar la presencia de proteínas priónicas patológicas. Posteriormente, reemplazando la sonificación por agitación vigorosa y combinando ensayos de fluorescencia de tioflavina T, resultó la conversión inducida por agitación en tiempo real (del inglés, real time quaking-induced conversion [RT-QuIC]), técnica más utilizada hoy en día en estas enfermedades, aunque el término genérico de SAA se está empezando a imponer.
Durante la última década, haciendo uso de la propagación interneuronal de la α-sinucleína, similar al de las enfermedades por priones, los SAA se han extendido en el campo de las sinucleinopatías (EP idiopática con y sin demencia, con resultados variables en la EP genética y la AMS)31,34 (NE-II). Una revisión sistemática y metaanálisis reciente36 (NE-I) que incluye 36 estudios con 2722 pacientes con sinucleinopatías (algunos diag- nosticados clínicamente y otros patológicamente) y 2278 controles, demostraron una sensibilidad y especificidad agrupadas de los SAA de α-sinucleína de 0,91 (0,87-0,94) y 0,96 (0,93-0,98) para las enfermedades con cuerpos de Lewy y de 0,63 (0,24-0,90) y 0,97(0,93-0,99) para la AMS. No hubo diferencias significativas entre los SAAs de α-sinucleína utilizando piel vs. LCR, pero sí que los resultados fueron significativamente peores en los ensayos que utilizaron mucosa olfatoria (sensibilidad de 0,64 [0,49-0,76]). Posteriormente, se publicó un trabajo incluyendo 1123 participantes (545 con EP, 163 controles sanos, 54 sin déficit dopaminérgico, 51 con síntomas prodrómicos y 310 portadores de mutaciones presintomáticos). Encontraron una sensibilidad de EP respecto a controles de 87,7% (intervalo de confianza del 95% (IC 95): 84,9-90,5), pero, al igual que otros grupos37 (NE-II), una sensibilidad menor en PD LRRK2 positivos 67,5% (IC 95: 59,2-75,8). También se ha demostrado que los SAA proporcionan una elevada capacidad predictiva para el desarrollo de EP o DCL en pacientes con síntomas prodrómicos, aunque en algún estudio esta ha sido moderada13,31,41,42 (NE-II).
A pesar de que los SAA son técnicas prometedoras, existen varios retos y limitaciones que necesitan ser mejorados. En primer lugar, es una técnica difícil de instaurar, ya que pequeñas variaciones en alguno de los parámetros del experimento pueden alterar los resultados y falta estandarizar la metodología entre los diferentes laboratorios. La cuantificación de resultados, aunque abordada en algunos estudios, sigue siendo una necesidad no satisfecha, ya que los resultados siguen siendo en su mayoría dicotómicos (curvas positivas vs. negativas, generalmente con 3 o 4 evaluaciones por muestra si se utiliza LCR o entre 4-8 biopsias por paciente si se emplea tejido cutáneo). Los resultados del SAA de α-sinucleína en piel varían según el número y la localización de las biopsias realizadas. Otro aspecto que debe estudiarse más es la presencia de resultados positivos debido a la existencia de copatología α-sinucleína en enfermedades caracterizadas por la agregación y depósito de otras proteínas43-45 (NE-II). Además, la sensibilidad para la sinucleinopatía AMS ha sido en general decepcionante, alrededor del 20%43,46 (NE-II), aunque algunos estudios han informado cifras con amplificación más tardía y curvas de fluorescencia máxima más bajas que la EP40,42,47. Algunos trabajos para aumentar el rendimiento diagnóstico entre EP y AMS han incorporado otros marcadores además del resultado del SAA de aS como son las cadenas ligeras de neurofilamentos (Nfl), la proteína ácida fibrilar glial (GFAP), o la ubiquitina C-terminal hidrolasa (UCH-L1)48-50 o parámetros radiológicos42,51 (NE-II), pero esto está limitado a la investigación y no hay evidencia suficiente para utilizarlo en la práctica clínica diaria.

Bibliografía
13. Siderowf A, Concha-Marambio L, Lafontant DE, et al. Assessment of heterogeneity among participants in the Parkinson’s progression markers initiative cohort using alpha-synuclein seed amplification: a cross-sectional study. Lancet Neurol. 2023;22(5):407-17.
31. Fairfoul G, McGuire LI, Pal S, et al. Alpha-synuclein RT-QuIC in the CSF of patients with alpha-synucleinopathies. Ann Clin Transl Neurol. 2016;3(10):812-818.
32. Painous C, Fernández M, Pérez J, et al. Fluid and tissue biomarkers in Parkinson›s disease: Immunodetection or seed amplification? Central or peripheral? Parkinsonism Relat Disord. 2024;121:105968.
33. Höglinger GU, Adler CH, Berg D, et al. A biological classification of Parkinson›s disease: the SynNeurGe research diagnostic criteria. Lancet Neurol. 2024;23(2):191-204.
34. Shahnawaz M, Tokuda T, Waragai M, et al. Development of a biochemical diagnosis of Parkinson disease by detection of α-synuclein misfolded aggregates in cerebrospinal fluid. JAMA Neurol. 2017;74(2):163-172.
36. Yoo D, Bang JI, Ahn C, et al. Diagnostic value of α-synuclein seeding amplification assays in α-synucleinopathies: A systematic review and meta-analysis. Parkinsonism Relat Disord. 2022 Nov;104:99-109.
37. Garrido A, Fairfoul G, Tolosa E, et al; Barcelona LRRK2 Study Group. α-synuclein RTQuIC in cerebrospinal fluid of LRRK2-linked Parkinson›s disease. Ann Clin Transl Neurol. 2019;6(6):1024-1032.
40. Shahnawaz M, Mukherjee A, Pritzkow S, et al. Discriminating α-synuclein strains in Parkinson› s disease and multiple system atrophy. Nature. 2020 Feb;578(7794):273-277.
41. Iranzo A, Fairfoul G, Ayudhaya ACN, et al. Detection of α-synuclein in CSF by RT-QuIC in patients with isolated rapid-eye-movement sleep behaviour disorder: a longitudinal observational study. Lancet Neurol. 2021 Mar;20(3):203-212.
42. Poggiolini I, Gupta V, Lawton M, et al. Diagnostic value of cerebrospinal fluid alpha-synuclein seed quantification in synucleinopathies. Brain. 2022 Apr 18;145(2):584-595.
43. Compta Y, Painous C, Soto M, et al. Combined CSF α-SYN RT-QuIC, CSF NFL and midbrain- pons planimetry in degenerative parkinsonisms: From bedside to bench, and back again. Parkinsonism Relat Disord. 2022 Jun;99:33-41.
44. Dugger BN, Adler CH, Shill HA, et al; Arizona Parkinson›s Disease Consortium. Concomitant pathologies among a spectrum of parkinsonian disorders. Parkinsonism Relat Disord. 2014 May;20(5):525-9.
45. Robinson JL, Lee EB, Xie SX, et al. Neurodegenerative disease concomitant proteinopathies are prevalent, age-related and APOE4-associated. Brain. 2018 Jul 1;141(7):2181-2193.
46. Rossi M, Candelise N, Baiardi S, et al. Ultrasensitive RT-QuIC assay with high sensitivity and specificity for Lewy body-associated synucleinopathies. Acta Neuropathol. 2020;140(1):49-62.
47. Ma Y, Farris CM, Weber S, Schade S, Nguyen H, Pérez-Soriano A, et al. Sensitivity and specificity of a seed amplification assay for diagnosis of multiple system atrophy: a multicentre cohort study. Lancet Neurol. 2024 Dec;23(12):1225-1237.
48. Schulz I, Kruse N, Gera RG, Kremer T, Cedarbaum J, Barbour R, et al. Systematic Assessment of 10 Biomarker Candidates Focusing on α-Synuclein-Related Disorders. Mov Disord. 2021 Dec;36(12):2874-2887.
49. Canaslan S, Schmitz M, Villar-Piqué A, Maass F, Gmitterová K, Varges D, et al. Detection of Cerebrospinal Fluid Neurofilament Light Chain as a Marker for Alpha-Synucleinopathies. Front Aging Neurosci. 2021 Sep 22;13:717930.
50. Mondello S, Constantinescu R, Zetterberg H, Andreasson U, Holmberg B, Jeromin A. CSF α-synuclein and UCH-L1 levels in Parkinson’s disease and atypical parkinsonian disorders. Parkinsonism Relat Disord. 2014 Apr;20(4):382-7.
51. Quadalti C, Calandra-Buonaura G, Baiardi S, et al. Neurofilament light chain and α-synuclein RT-QuIC as differential diagnostic biomarkers in parkinsonisms and related syndromes. NPJ Parkinsons Dis. 2021 Oct 11;7(1):93.
Recientemente, dos grupos han intentado definir la EP en función de los procesos patobiológicos subyacentes, proponiendo un sistema de estadificación cada uno de ellos que, con sus diferencias, comparten el considerar diferentes combinaciones de presencia de indicadores biológicos de agregación anómala de α-sinucleína, presencia de alteraciones genéticas asociadas a la EP y la documentación de degeneración dopa- minérgica por imagen52,53 (NE-IV). Históricamente, la EP ha sido definida únicamente por la presentación clínica, pero es sabido que en el momento en que los pacientes manifiestan síntomas motores y son diagnosticados con EP temprana, ya ha tenido lugar una cantidad sustancial de neurodegeneración54 (NE-II). Además, en los últimos años la heterogeneidad de la EP se ha vuelto cada vez más evidente. El objetivo de estos dos trabajos es agrupar a los pacientes por características biológicas para obtener grupos más uniformes y poder realizar un diagnóstico precoz.
La principal ventaja es que una clasificación biológica de la EP probablemente sea imperativa para que los fármacos probados en los ensayos terapéuticos sean eficaces.
El principal inconveniente es el posible impacto negativo ético y social en personas asintomáticas pero que presenten biomarcadores positivos, y que serán etiquetados como enfermas. Además, en algunos aspectos es incierto que se cumplan los requisitos para considerarlas adecuadas para el estadiaje, ya que no queda claro que sean secuenciales y reflejen la progresión de la enfermedad, puesto que los estadios numéricamente inferiores podrían al menos teóricamente no siempre preceder a los superiores55 (NE-IV). Por ello, los autores ratifican que el uso de estas clasificaciones está reservado para investigación en el momento actual.

Bibliografía
52. Simuni T, Chahine LM, Poston K, et al. A biological definition of neuronal α-synuclein disease: towards an integrated staging system for research. Lancet Neurol. 2024 Feb;23(2):178-190.
53. Höglinger GU, Adler CH, Berg D, et al. A biological classification of Parkinson›s disease: the SynNeurGe research diagnostic criteria. Lancet Neurol. 2024 Feb;23(2):191-204. Erratum in: Lancet Neurol. 2024 Mar;23(3).
54. Kordower JH, Olanow CW, Dodiya HB, et al. Disease duration and the integrity of the nigrostriatal system in Parkinson›s disease. Brain. 2013 Aug;136(Pt 8):2419-31.
55. Cardoso F, Goetz CG, Mestre TA, et al. A Statement of the MDS on Biological Definition, Staging, and Classification of Parkinson’s disease. Mov Disord. 2024 Feb;39(2):259-266.
56. Obeso JA, Calabressi P. Parkinson’s disease is a recognisable and useful diagnostic entity. Lancet Neurol. 2024 Feb;23(2):133-134.
Introducción
Los test farmacológicos con agentes dopaminérgicos consisten en la evaluación de los efectos clínicos de la facilitación rápida de la transmisión dopaminérgica central. Uno de los usos que se ha dado a dichas pruebas ha sido el de proporcionar apoyo al diagnóstico clínico de la EP, partiendo de la premisa de que la respuesta de los signos motores a la administración de fármacos dopaminérgicos es un criterio necesario para el diagnóstico de la EP57-60 (NE-II).
Los dos fármacos empleados en este tipo de test son la LD, que en tanto que precursor de la dopamina implica mecanismos presinápticos (síntesis de dopamina a partir de la LD) y postsinápticos (unión al receptor dopaminérgico), y la apormofina, cuya acción es eminentemente postsináptica, al tratarse de un agonista dopaminérgico58,59 (NE-II).
Situaciones de uso
Estos test se pueden emplear tanto en pacientes ambulantes como hospitalizados. Cuando se emplean con fines terapéuticos, habitualmente se realizan en pacientes ya tratados en periodo off, pudiéndose entender este como un off natural o habitual (esto es, el que no es producido por una suspensión o discontinuación de la medicación crónica) o como un off inducido tras la retirada de la medicación por un periodo de horas que teóricamente debiera durar de 3 a 5 semividas del fármaco o los fármacos empleados, pero nunca más de lo que el paciente pueda llegar a tolerar, siendo una norma habitual la de 12 horas de suspensión (comúnmente entre la última toma de la noche de un día y la primera del día siguiente). Por el contrario, cuando se emplean con fines diagnósticos el perfil es diferente (respuesta a fármacos antidopaminérgicos desconocida o incierta, ausencia de fluctuaciones motoras, etc.), por lo que se llevan a cabo en la situación clínica basal o habitual del paciente60-62 (NE-II).
Procedimiento
Test de levodopa
Se lleva a cabo típicamente por la mañana, tras la discontinuación de todas las medicaciones antiparkinsonianas durante la noche previa y habitualmente en situación de ayuno también nocturno. Si bien habitualmente se emplea una formulación oral estándar, la absorción se puede acelerar mediante formulaciones en suspensión (Madopar® dispersable, no disponible en España, o Sinemet® triturado) en 100-150 ml de agua carbonatada. En la última década, la difusión del uso de la infusión continua de gel intestinal de LD ofrece la opción de realizar una prueba nasoduodenal con esta formulación de LD con finalidad de prueba farmacológica para valorar la respuesta o falta de respuesta en pacientes en que se plantee la disyuntiva entre falta de respuesta por problema de absorción (por ejemplo, gastroparesia asociada a la EP) frente a parkinsonismo atípico con falta de respuesta a LD por degeneración postsináptica a nivel nigrostriatal. La reciente introducción de la LD inhalada y subcutánea tras los preceptivos ensayos clínicos fase 3 pivotales y aprobaciones por las correspondientes agencias del medicamento (en nuestro caso la EMA y la AEMPS) abre la posibilidad de su empleo con fines no solo terapéuticos sino también diagnósticos; si bien la evidencia es escasa, la base racional sería la misma, y podría ser interesante en casos en los que se sospecha que la aparente falta de respuesta a la LD oral no se deba a un diagnóstico alternativo sino a la presencia de una mala absorción intestinal del fármaco por vía oral.
En pacientes no tratados previamente se recomienda una dosis de hasta 250 mg, pero en pacientes en tratamiento crónico se suele recurrir a una dosis “supramaximal” (dosis superior a la primera dosis del día; por ejemplo, una dosis 1,5 veces la dosis matutina)63 (NE-II). Se debe esperar una respuesta clínica no antes de los 30 minutos posteriores a la administración de la dosis de LD, observándose el efecto máximo hacia los 45-90 minutos, con una duración que puede ser de varias horas.
Test de apomorfina
Se basa en la inyección subcutánea de este fármaco, ya sea como inyección única de 2 o 3 mg o en forma de dosis repetidas iniciando con 1,5 mg y prosiguiendo con incrementos escalonados de 1,5 a 3 mg a intervalos que se desaconseja sean inferiores a 45 minutos (intervalos inferiores pueden conducir a fracaso de la dosis por hallarse los receptores dopaminérgicos aún ocupados). Se recomienda impregnar al paciente con domperidona por lo menos de 3 a 7 días antes de la prueba, por la frecuencia de reacciones adversas en forma de náuseas e hipotensión ortostática. La respuesta clínica es esperable en torno a los 10 minutos de la inyección, con un efecto máximo hacia los 15-25 minutos y una duración de aproximadamente 60 minutos58 (NE-II).
En comparación con la LD, la apomorfina tiene el atractivo, al menos teórico, de no predisponer a las discinesias, pero, por el contrario, tiene una peor tolerancia, y al producir síntomas muy conspicuos (bostezos) puede fácilmente desenmascarar una evaluación ciega. También puede producir hipotensión ortostática más grave que la LD. Como sucede con las formulaciones no orales de la LD, la apomorfina puede permitir evaluar una respuesta subóptima a la LD hipotéticamente secundaria a una mala absorción intestinal de la LD oral.
Nuevamente, de forma semejante a lo que sucede con la LD, la próxima comercialización de la apomorfina sublingual podría abrir la posibilidad de efectuar el test de apomorfina empleando esta vía en vez de la subcutánea.
Evaluación de la respuesta
Debe ser llevada a cabo por profesionales experimentados, apoyándose idealmente en la videofilmación, que permita la validación a posteriori por parte de otros observadores. Se considera necesaria una mejoría motora de al menos un 30% (habitualmente medida en base a la diferencia entre la sección motora de la escala unificada de la EP, actualmente la MDS-UPDRS, basal y postest)64,65 (NE-II).
Interpretación
La falta de mejoría se ha de tomar con cautela, ya que hasta un 40% de los casos con respuesta negativa a una prueba farmacológica aguda pueden experimentar posteriormente una respuesta adecuada al tratamiento crónico con LD62 (NE-II).
En pacientes de novo esto puede deberse a que se ha empleado una dosis subumbral, por lo que es aconsejable repetir la prueba con aumentos graduales del 25% de la dosis de LD. Por su parte, en pacientes tratados, un problema de absorción puede ser la explicación de la aparente falta de respuesta, tanto aguda como crónica, a la terapia oral. En estos casos puede ser útil efectuar un test de apomorfina, o incluso emplear otra vía o forma de administración de LD, como se ha comentado previamente. Por el contrario, en casos en que se realice un test de apomorfina en primer lugar y este resulte negativo, debe realizarse un test de LD, ya que se ha documentado la respuesta a esta tras un test negativo de apomorfina.
Por último, en pacientes tratados no fluctuantes, pero con indicios de tener algún grado de respuesta a la medicación crónica, el efecto de la prueba aguda con una dosis subumbral puede quedar enmascarado por el efecto crónico del tratamiento habitual, incluso a pesar de haber procedido a la preceptiva discontinuación de medicaciones antiparkinsonianas previa a la realización de la prueba.
Recomendaciones de las guías clínicas internacionales
Actualmente las guías diagnósticas66-68 no recomiendan los test farmacológicos para el diagnóstico diferencial de la EP, puesto que estos no añaden ningún valor al de la observación de la respuesta del tratamiento crónico con LD ambulatorio y además no están exentas de riesgos o efectos adversos59,69-74 (NE-II). Además, en fases iniciales de la enfermedad, estos test farmacológicos presentan menor rendimiento diagnóstico en comparación con el manejo estándar ambulatorio con LD. Por tanto, la recomendación de estas guías es que estas pruebas agudas no deben emplearse, considerando que los pacientes en los que la bradicinesia o la rigidez no mejoren con una terapia crónica de al menos 600 mg/día de LD durante 6 semanas son “no respondedores a LD” y en estos casos la medicación debería ser suspendida gradualmente.
Estos test pueden ser útiles en otras situaciones, como, por ejemplo, para evaluar la respuesta a la medicación dopaminérgica en personas con EP candidatos a terapias avanzadas o para valorar la falta de respuesta de terapias dopaminérgicas orales secundaria a problemas de absorción (como se ha comentado antes, clásicamente la apomorfina subcutánea, pero actualmente también el gel intestinal de LD y la LD inhalada, la LD subcutánea y en un futuro inmediato la apomorfina sublingual). El test de LD también puede ser de utilidad en la reevaluación de los pacientes cuando tienen problemas relacionados con la respuesta a la medicación, como la latencia o el inicio del beneficio, la magnitud de la respuesta y la duración del beneficio62 (NE-II). Hay pacientes con un diagnóstico de EP idiopática que informan haber experimentado una respuesta subóptima con LD, a pesar de que el médico nota una mejoría en su rendimiento en las escalas de evaluación75 (NE-II). El test de LD es una excelente oportunidad tanto para el médico para confirmar la respuesta a la medicación como para el paciente para darse cuenta de que los síntomas mejoran.

Bibliografía
57. Esteguy M, Bonnet AM, Kefalos J, et al. Le test a le levodopa dans la maladie de Parkinson. Rev Neurol (Paris). 1985;141(Suppl):413-4.
58. Barker R, Duncan J, Lees AJ. Subcutaneous apomorphine as a diagnostic test for dopaminergic responsiveness in parkinsonian syndromes. Lancet.1989;1:675.
59. D’Costa DF, Abbott RJ, Pye IF, et al. The apomorphine test in parkinsonian syndromes. J Neurol Neurosurg Psychiatry. 1991;54:870-2.
60. Hughes AJ, Lees AJ, Stern GM. Challenge tests to predict the dopaminergic response in untreated Parkinson’s disease. Neurology. 1991;41:1723-5.
61. Gasser T, Schwarz J, Arnold G, et al. Apomorphine test for dopaminergic responsiveness in patients with previously untreated Parkinson’s disease. Arch Neurol. 1992;49:1131-4.
62. Albanese A, Bonuccelli U, Brefel C, et al. Consensus statement on the role of acute dopaminergic challenge in Parkinson›s disease. Mov Disord. 2001 Mar;16(2):197-201.
63. Merola A, Rizzi L, Zibetti M, et al. Medical therapy and subthalamic deep brain stimulation in advanced Parkinson›s disease: a different long-term outcome? J Neurol Neurosurg Psychiatry. 2014 May;85(5):552-9.
64. Langston JW, Widner H, Goetz CG, et al. Core assessment program for intracerebral transplantations (CAPIT). Mov Disord. 1992;7(1):2-13.
65. Defer GL, Widner H, Marie RM, et al. Core assessment program for surgical interventional therapies in Parkinson’s disease (CAPSIT-PD). Mov Disord. 1999;14:572-84.
66. Parkinson’s disease in adults: diagnosis and management. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/ guidance/ng71/chapter/Update-information
67. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS [corrected] recommendations for the diagnosis of Parkinson›s disease. Eur J Neurol. 2013 Jan;20(1):16-34.
68. Scottish Intercollegiate Guidelines Network (SIGN). Diagnosis and pharmacological management of Parkinson’s disease. A national clinical guideline. En: Parkinson’s UK [Internet]. Disponible en: https://t.ly/UzriI
69. Clarke CE, Davies P. Systematic review of acute levodopa and apomorphine challenge tests in the diagnosis of idiopathic Parkinson’s disease. J Neurol Neurosurg Psychiatry. 2000;69(5):590-594.
70. Rossi P, Colosimo C, Moro E, et al. Acute challenge with apomorphine and levodopa in Parkinsonism. Eur Neurol. 2000;43(2):95-101.
71. Hughes AJ, Lees AJ, Stern GM. Apomorphine test to predict dopaminergic responsiveness in parkinsonian syndromes. Lancet. 1990;336(8706):32-34.
72. Zappia M, Montesanti R, Colao R, et al. Short-term levodopa test assessed by movement time accurately predicts dopaminergic responsiveness in Parkinson’s disease. Mov Disord. 1997 Jan;12(1):103-6.
73. Anderson E, Nutt J. The long-duration response to levodopa: phenomenology, potential mechanisms and clinical implications. Parkinsonism Relat Disord. 2011;17:587-592.
74. Nutt JG, Carter JH, Woodward WR. Long-duration response to levodopa. Neurology. 1995 Aug;45(8):1613-6.
75. Rabel C, Le Goff F, Lefaucheur R, et al. Subjective Perceived Motor Improvement after Acute Levodopa Challenge in Parkinson›s Disease. J Parkinsons Dis. 2016 Oct 19;6(4):779-785.
Introducción
El diagnóstico diferencial de la EP incluye todas las entidades que pueden cursan con temblor o síndrome parkinsoniano, ya sea este un parkinsonismo secundario o un parkinsonismo asociado a otras enfermedades neurodegenerativas diferentes de la EP o a otras causas (Tabla I).

Como se ha comentado previamente, el diagnóstico de la EP es clínico, y es recomendable que el paciente sea remitido sin tratamiento antiparkinsoniano para su evaluación por parte de un especialista en trastornos del movimiento66 (NE-II).
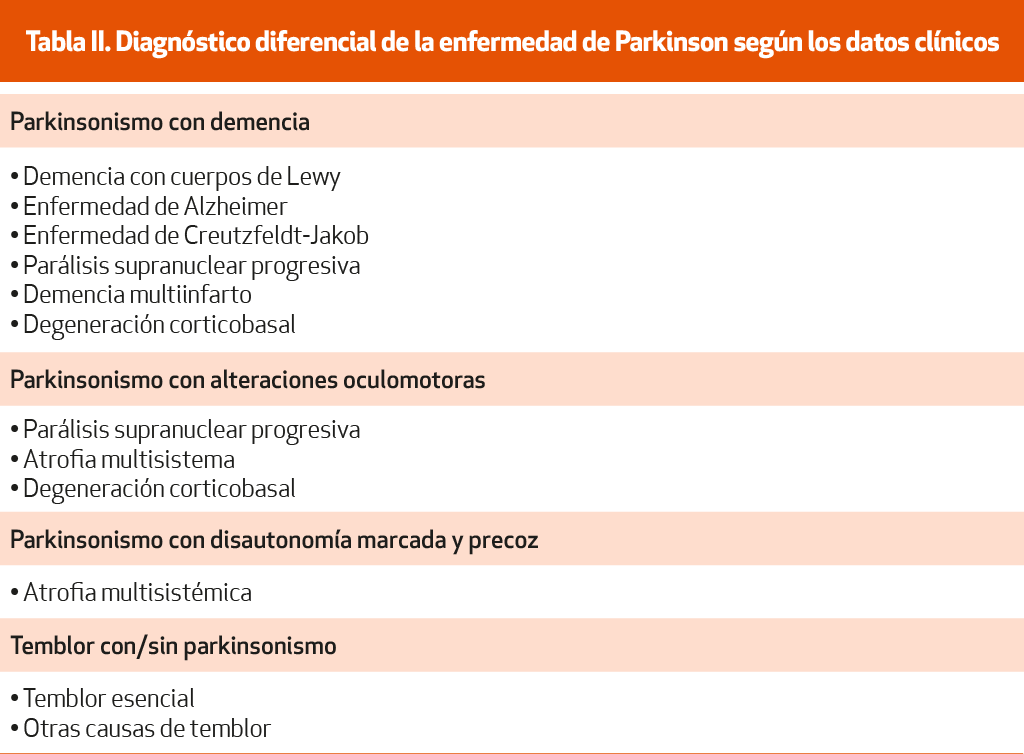
En el diagnóstico diferencial es fundamental comprobar que el paciente no presenta datos clínicos atípicos76 (NE-II), así como que existen datos de apoyo, como un curso progresivo, asimetría y respuesta a la terapia dopaminérgica (ver los criterios diagnósticos de la MDS). La presencia de caídas precoces, la falta de respuesta a la LD, la simetría de los síntomas al inicio, la rápida progresión llegando a un estadio III en la clasificación de Hoehn y Yahr en los 3 primeros años, la ausencia de temblor y la presencia de marcada disautonomía (urgencia o incontinencia urinaria o fecal, retención urinaria, disfunción eréctil o hipotensión ortostática sintomática) son datos clínicos sugestivos de otra causa de parkinsonismo diferente de la EP77 (NE-II). Dado que algunos datos atípicos no estarán presentes al inicio y pueden ir apareciendo a lo largo de la evolución, el diagnóstico debe ser revisado regularmente, reconsiderando siempre la posibilidad de un parkinsonismo atípico en aquellos pacientes que desarrollan signos de evolución atípica66 (NE-IV). La posibilidad de donación del cerebro por parte del paciente podría ser planteada por el clínico para poder hacer el diagnóstico definitivo post mortem66 (NE-IV). La Tabla II muestra diferentes entidades que se han de considerar en el diagnóstico diferencial de la EP teniendo en cuenta algunos aspectos clínicos.
No sería preciso realizar un estudio de neuroimagen estructural (tomografía computarizada [TC] o RM craneal) de forma rutinaria a todo paciente con sospecha de EP78 (NE-III). Sin embargo, sí sería recomendable realizar una TC craneal a todo paciente con sospecha de patología cerebral (tumor, hidrocefalia, etc.) que pueda estar causando o agravando el síndrome parkinsoniano68 (NE-IV), así como una RM craneal en caso de sospecha de enfermedad vascular cerebral subcortical causante de un parkinsonismo vascular o datos atípicos que sugieren un parkinsonismo atípico68 (NE-IV). Para revisar en profundidad la utilidad de las técnicas de imagen en el diagnóstico y diagnóstico diferencial de la EP, remitimos al lector al capítulo 2, donde se trata este tema de manera específica (pag. 57).
Además, en un paciente con sospecha de EP es recomendable una evaluación neuropsicológica que incluya una entrevista con el cuidador del paciente, evaluación de funciones cognitivas y cribado para trastorno de conducta del sueño REM, síntomas psicóticos y depresión67 (NE-I). No será necesario realizar estudios analíticos en el caso de una EP típica, pero serán útiles y necesarios determinados estudios (hormonas tiroideas, niveles séricos de ceruloplasmina, cobre en orina y suero, acantocitos en sangre periférica, creatina cinasa, estudio del hierro, estudios genéticos, etc.) en aquellos pacientes en los que los síntomas no estén tan claros y en los que se deban excluir otras entidades.

Parkinsonismos secundarios
Los parkinsonismos secundarios o sintomáticos son aquellos síndromes parkinsonianos producidos por una causa conocida y no por una enfermedad degenerativa. Representan entre el 25 y el 50% del total de los síndromes parkinsonianos.
Dentro de ellos, el parkinsonismo inducido por fármacos es el más frecuente. Los factores de riesgo para su desarrollo son la edad avanzada, el sexo femenino, una mayor potencia antidopaminérgica del fármaco, mayor dosis y tiempo de exposición y la presencia de un temblor de acción previo a la administración del fármaco. Será fundamental la prevención, evitando la administración de fármacos antidopaminérgicos, y en el caso de ser preciso su uso, intentar usar los que tienen un menor efecto parkinsonizante, administrarlos durante el menor tiempo y a la menor dosis posible. El parkinsonismo suele ser simétrico (aunque puede ser asimétrico) y asociar discinesias, que pueden desarrollarse tras 3 meses con el tratamiento responsable. En general, el parkinsonismo es reversible tras la supresión del fármaco causal y no se recomienda el uso de anticolinérgicos. En caso de no resolución después de 6 meses de haber retirado el fármaco, nos deberemos plantear si el paciente podría presentar una EP latente precipitada por el mismo, para lo que puede resultar útil realizar una prueba de neuroimagen funcional de la vía nigroestriada presináptica como una SPECT 3I-β-CIT (DaTSCAN®), que será normal en el caso de un parkinsonismo inducido por fármacos68,77 (NE-II).
En otras ocasiones, el parkinsonismo es ocasionado por tóxicos que dañan estructural y funcionalmente los ganglios basales, resultando muchas veces los síntomas irreversibles.
La Tabla III muestra los principales fármacos y tóxicos causantes de parkinsonismo.
Parkinsonismos heredodegenerativos
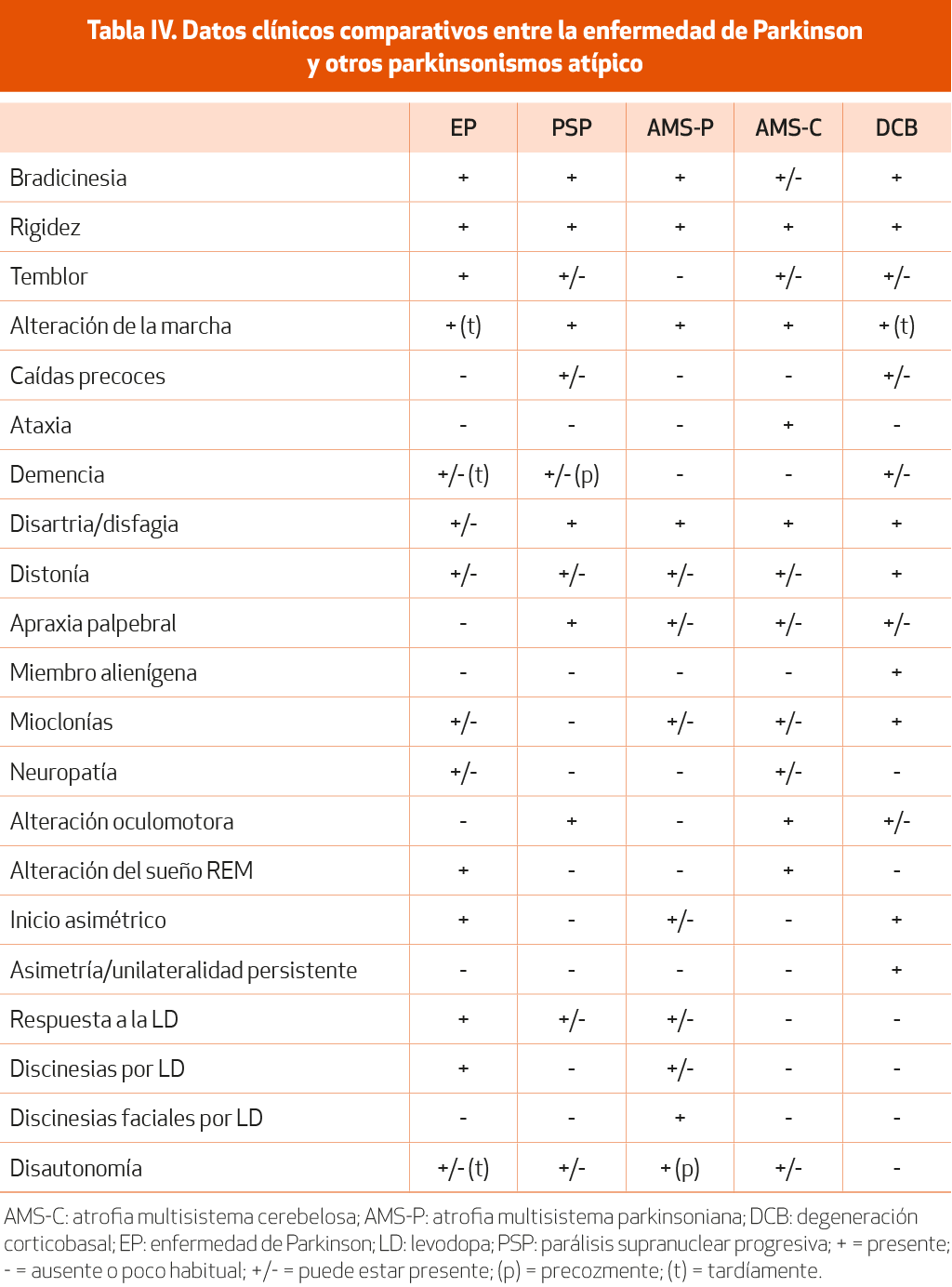
Los pacientes con parkinsonismos atípico (AMS, PSP y degeneración corticobasal [DCB]) plantean en ocasiones un reto diagnóstico, sobre todo en etapas tempranas de la enfermedad. Solo del 65 al 77% de los casos diagnosticados a finales de los años ochenta de EP idiopática cumplían criterios anatomopatológicos de EP1,3 (NE-II), el resto correspondían a otras enfermedades degenerativas que comprometían la vía nigroestriatal. Lo característico de los parkinsonismos atípicos es la nula o escasa y temporal respuesta a la LD y un peor pronóstico con una esperanza de vida reducida. En 2017 se publicaron los nuevos criterios de la PSP79 (NE-II) que, a diferencia de los previos, incluyen otras variantes además de la PSP richardsoniana. La variante PSP-parkinsonismo en concreto es la que más se asemeja a la EP, ya que los pacientes pueden presentar respuesta a la LD (habitualmente de forma temporal y baja-moderada) y un parkinsonismo simétrico o asimétrico que puede asociar temblor de reposo, que por tanto ha dejado de ser criterio de exclusión de PSP. La presencia de alteraciones oculomotoras en el plano vertical (enlentecimiento de los movimientos sacádicos o limitación de la infraversión de la mirada) sugieren el diagnóstico de PSP, pero pueden no estar presentes al inicio o incluso no estarlo en todo el transcurso de la enfermedad80 (NE-III). En cuanto a la AMS, los nuevos criterios se publicaron en 202281 (NE-II) e incluyen cuatro grados de certeza diagnóstica (definitiva, clínicamente definida, probable y posible prodrómica) y los dos fenotipos previamente conocidos (AMS-parkinsonismo y cerebelosa).
Los datos clínicos básicos comparativos vienen reflejados en la Tabla IV. Para cada uno de ellos existen criterios de certeza, y en todos los casos es necesaria la anatomía patológica para el diagnóstico definitivo.
En el capítulo 2 se revisa la utilidad de las pruebas de imagen en el diagnóstico de la EP y los parkinsonismos atípicos (pag. 57). Pruebas de olfacción como el Brief Smell Identification Test (BSIT), el University of Pennsylvania Smell Identification Test (UPSIT) o el San Diego Odor Identification Test (SDOIT) no se recomiendan en el diagnóstico diferencial de la EP con los otros parkinsonismos neurodegenerativos, porque no hay suficiente evidencia que lo apoye66 (NE-II). Los estudios de función autonómica (cardiovascular, urinaria, anorrectal y temperatura cutánea y sudoración) tampoco han demostrado ser beneficiosos67,77 (NE-IV).

Por último, el uso de SAA de α-sinucleína en LCR de forma aislada o en combinación con otros biomarcadores, como los niveles en LCR o en sangre de neurofilamentos o medidas de atrofia de mesencéfalo y protuberancia, se está mostrando de forma creciente en publicaciones como sensible y específico para diferenciar los parkinsonismos atípicos de la EP, si bien aún no están disponibles de forma ubicua para poder emplearse en la rutina clínica31,41,43,51 (NE-III). Un ejemplo de situación donde el SAA de α-sinucleína podría ser útil sería la diferenciación entre EP y PSP-P, aunque aún se dispone de evidencia limitada y la presencia de copatología podría en algunos casos justificar un SAA+, aun tratándose de una PSP; en este contexto, todavía es necesaria una metodología perfeccionada de SAA para proteína 4R-τ82 (NE-III).
Otras enfermedades neurodegenerativas que pueden cursar con parkinsonismo y que hay que tener en cuenta en el diagnóstico diferencial se reflejan en la Tabla II.
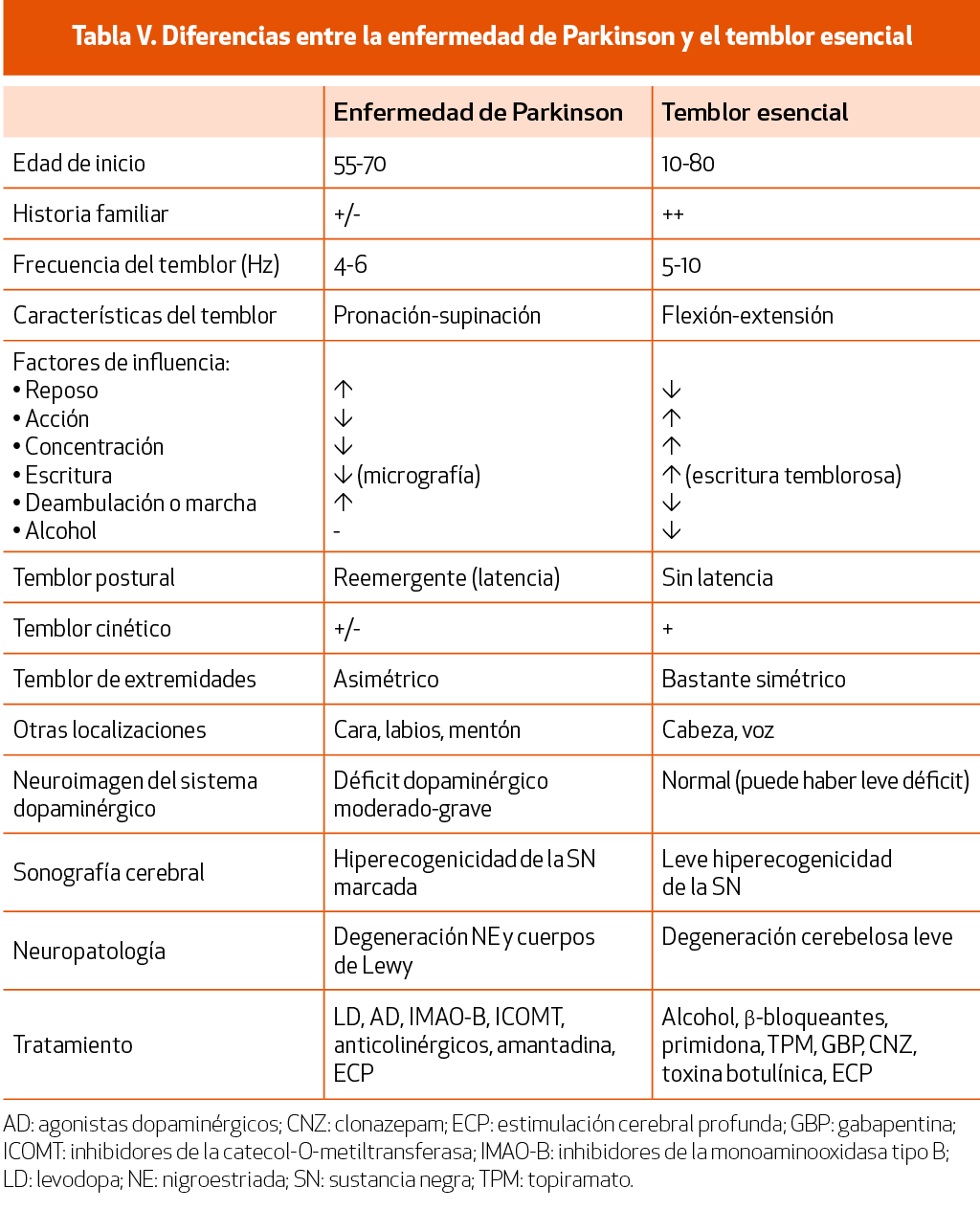
Temblor esencial y otras patologías a considerar en el diagnóstico diferencial
El temblor esencial (TE) es, posiblemente, la entidad con la que más frecuentemente se plantea el diagnóstico diferencial de la EP. Lo característico del TE (Tabla V) será la presencia de antecedentes familiares positivos de temblor, fundamentalmente postural de manos bilateral y relativamente simétrico, de cabeza y voz, y mejoría del temblor con el consumo de alcohol; no esperaríamos encontrar otros datos de parkinsonismo, aunque en ocasiones puede asociar temblor de reposo. En casos de duda, un DaTSCAN® podría ser de ayuda en el diagnóstico diferencial con la EP, que será normal en caso de TE67 (NICE 2006) (NE-III). Algunos estudios han observado que los pacientes con TE tienen más probabilidad de desarrollar EP83, por lo que se deberá tener en cuenta en su seguimiento evolutivo. El SAA de α-sinucleína negativo también puede añadirse al arsenal diagnóstico diferencial43 (NE-IV).
El parkinsonismo funcional es una causa poco frecuente. En ocasiones puede coexistir un parkinsonismo o EP con componente funcional asociado. La utilización combinada de la clínica, electrofisiología y neuroimagen funcional68,77,84 (NE-II) mejora la fiabilidad diagnóstica para distinguir entre formas de parkinsonismo funcional puras y combinadas. El parkinsonismo vascular típicamente es de predominio en extremidades inferiores, hay poca respuesta a la LD y daño vascular subcortical en los estudios de imagen craneal. Otras patologías que pueden simular un síndrome parkinsoniano y deben ser consideradas en el diagnóstico diferencial de la EP son por ejemplo un hipotiroidismo, la depresión o la patología osteoarticular.

Bibliografía
1. Rajput AH, Rozdilsky B, Rajput A. Accuracy of clinical diagnosis in parkinsonism: a prospective study. Can J Neurol Sci. 1991;18:275-8.
3. Hughes AJ, Daniel SE, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry. 1992;55:181-4. d
31. Fairfoul G, McGuire LI, Pal S, et al. Alpha-synuclein RT-QuIC in the CSF of patients with alpha-synucleinopathies. Ann Clin Transl Neurol. 2016;3(10):812-818.
41. Iranzo A, Fairfoul G, Ayudhaya ACN, et al. Detection of α-synuclein in CSF by RT-QuIC in patients with isolated rapid-eye-movement sleep behaviour disorder: a longitudinal observational study. Lancet Neurol. 2021 Mar;20(3):203-212.
43. Compta Y, Painous C, Soto M, et al. Combined CSF α-SYN RT-QuIC, CSF NFL and midbrain-pons planimetry in degenerative parkinsonisms: From bedside to bench, and back again. Parkinsonism Relat Disord. 2022 Jun;99:33-41.
51. Quadalti C, Calandra-Buonaura G, Baiardi S, et al. Neurofilament light chain and α-synuclein RT-QuIC as differential diagnostic biomarkers in parkinsonisms and related syndromes. NPJ Parkinsons Dis. 2021 Oct 11;7(1):93.
66. Parkinson’s disease in adults: diagnosis and management. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/ guidance/ng71/chapter/Update-information
67. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS [corrected] recommendations for the diagnosis of Parkinson›s disease. Eur J Neurol. 2013 Jan;20(1):16-34.
68. Scottish Intercollegiate Guidelines Network (SIGN). Diagnosis and pharmacological management of Parkinson’s disease. A national clinical guideline. En: Parkinson’s UK [Internet]. Disponible en: https://t.ly/UzriI
76. Gibb WR, Lees AJ. The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson’s disease. J Neurol Neurosurg Psychiatry. 1988;51:745-52.
77. Suchowersky O, Reich S, Perlmutter J, et al.; Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: diagnosis and prognosis of new onset Parkinson disease (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006;66(7):968-75.
78. NHS Quality Improvement Scotland. Diagnosis and pharmacological management of Parkinson’s disease. A national clinical guideline. Edimburgo: Scottish Intercollegiate Guidelines Network, EH7 5EA; 2010.
79. Höglinger GU, Respondek G, Stamelou M, et al.; Movement Disorder Society-endorsed PSP Study Group. Clinical diagnosis of progressive supranuclear palsy: The movement disorder society criteria. Mov Disord. 2017 Jun;32(6):853-864.
80. Williams DR, de Silva R, Paviour DC, et al. Characteristics of two distinct clinical phenotypes in pathologically proven progressive supranuclear palsy: Richardson›s syndrome and PSP-parkinsonism. Brain. 2005 Jun;128(Pt 6):124.
81. Wenning GK, Stankovic I, Vignatelli L, et al. The Movement Disorder Society Criteria for the Diagnosis of Multiple System Atrophy. Mov Disord. 2022 Jun;37(6):1131-1148. doi: 10.1002/mds.29005.
82. Saijo E, Metrick MA 2nd, Koga S, et al. 4-Repeat tau seeds and templating subtypes as brain and CSF biomarkers of frontotemporal lobar degeneration. Acta Neuropathol. 2020 Jan;139(1):63-77.
83. Benito-León J, Louis ED, Bermejo-Pareja F; Neurological Disorders in Central Spain Study Group. Risk of incident Parkinson’s disease and parkinsonism in essential tremor: a population based study. J Neurol Neurosurg Psychiatry. 2009;80(4):423-5.
84. Grimes D, Gordon J, Snelgrove B, et al. Canadian Guidelines on Parkinson’s disease. Can J Neurol Sci. 2012 Jul;39(4 Suppl 4):S1-30.
Como veíamos en el anterior capítulo, el diagnóstico de la EP es clínico, y resulta relativamente fácil cuando el paciente presenta los principales signos cardinales (temblor de reposo, bradicinesia y rigidez y una respuesta a la LD mantenida).
Sin embargo, en los estadios iniciales de la enfermedad, realizar un diagnóstico correcto y ser capaz de diferenciarlo de otros parkinsonismos puede resultar un auténtico reto diagnóstico para el neurólogo1. Con el fin de poder establecer el diagnóstico de EP, diferenciarlo de los parkinsonismos plus y parkinsonismos secundarios y poder monitorizar la progresión de la enfermedad, se ha considerado que la neuroimagen podría ser una herramienta de gran relevancia. No cabe duda de que un mejor diagnóstico permite poder tratar más adecuadamente a nuestros pacientes y ayuda a establecer un pronóstico más fiable
Bibliografía
1. Beach TG, Adler CH. Importance of low diagnostic accuracy for early Parkinson’s disease. Mov Disord. 2018;33(10):1551-1554.
En la EP, los cambios observados en la RM cerebral están principalmente relacionados con la degeneración de las neuronas dopaminérgicas, localizadas a nivel de la sustancia negra (SN) del mesencéfalo y del incremento de depósito de hierro en estas regiones. La correcta visualización de estos cambios dependerá de la potencia de campo utilizado en la RM y las diferentes secuencias que, aunque cada vez su uso esté más extendido, no se disponen de protocolos estandarizados en la práctica clínica.
Resonancia magnética estructural
El papel de la RM estructural de 1,5 teslas (T) en pacientes con EP idiopática es controvertido, debido a la falta de signos específicos de la enfermedad y, de acuerdo con las guías del National Institute for Health and Care Excellence (NICE), no se debe utilizar para realizar el diagnóstico de la EP2 (NE-I). Sin embargo, en la práctica clínica, la imagen cerebral y en particular la RM suele realizarse al menos una vez durante el curso de la enfermedad, con el objetivo de detectar la presencia de lesiones estructurales que causen o contribuyan al parkinsonismo, poder identificar la magnitud y extensión de la enfermedad y ayudar a diferenciar la EP de otros parkinsonismos atípicos.
Los signos radiológicos que facilitan el diagnóstico de la EP y de los parkinsonismos atípicos son (Figuras 1-4):
-
En la EP, existen depósitos de hierro en la SN, visibles en secuencias T2 en la RM cerebral. Diferentes autores han publicado que este depósito de hierro puede incluso ayudarnos a diferenciar la PSP de la EP, ya que en la PSP existen depósitos de hierro mayores a nivel del tálamo, globo pálido y núcleo rojo. En cambio, en la AMS, a diferencia de la PSP y la EP, el depósito de hierro mayor está en el putamen3(NE-II).
-
En la PSP existe una atrofia a nivel del mesencéfalo (tegmento y tubérculos cuadrigéminos superiores), junto con la conservación relativa de la morfología de la protuberancia, que permite observar en plano sagital el signo del colibrí (hummingbird sign) y en el plano axial, el signo de Mickey Mouse4. Determinados estudios han demostrado que estos hallazgos tienen una alta especificidad, del 99,5 y el 97,7% respectivamente para cada signo, pero una baja sensibilidad, del 51,6 y 38,6%5(NE-II) para el diagnóstico de PSP.
-
En la AMS-P, podemos encontrar una atrofia bilateral putaminal, con el signo del ribete o hiperintensidad en T2 del borde dorsolateral del putamen (putaminal rim sign) e hipointenso en T1. En la AMS-C destaca la atrofia del pedúnculo cerebeloso medio, cerebelo y puente del troncoencéfalo. En las formas cerebelosas de la AMS puede observarse el signo de la cruz (hot cross bun sign)4(NE-II) producido por una degeneración de las fibras pontocerebelosas que puede causar una hiperintensidad en el pedúnculo cerebral medio y protuberancia6,7(NE-II).
Estas anomalías en la neuroimagen son altamente específicas, pero su sensibilidad es relativamente baja, limitando su uso como biomarcador diferencial de parkinsonismos.
Como ya se ha explicado previamente, en la EP existen cambios degenerativos a nivel de la SN. Esta puede dividirse en la pars reticularis (SNpr) y la pars compacta (SNpc); esta última es la que alberga la mayoría de las neuronas dopaminérgicas. Aunque la composición estructural de estos elementos es sumamente compleja, se han identificado subregiones adicionales dentro de la SNpc conocidas como nigrosomas. Estas áreas se caracterizan por una densidad especialmente alta de neuronas dopaminérgicas y una concentración de hierro proporcionalmente baja. De los cinco nigrosomas totales, el nigrosoma-1 es el más grande y se ubica en la sección dorsal de la SNpc. Con las nuevas técnicas de alto campo de RM de 3 T o superiores y con las secuencias de alta resolución sensibles al hierro, como las secuencias ponderadas en T2* o las secuencias ponderadas en susceptibilidad (SWI), es posible visualizar estas estructuras en la RM. El nigrosoma-1 se visualiza como una estructura hiperintensa y ovalada en el segmento dorsolateral de la SNpc en estas secuencias, un signo radiológico conocido como cola de golondrina. En la EP existe una disminución en la concentración de neuronas dopaminérgicas y un aumento en los depósitos del hierro, siendo el nigrosoma-1 el más afecto, produciéndose una pérdida de la hiperintensidad (ausencia de cola de golondrina). Este signo radiológico ha demostrado en diversos estudios de metaanálisis una alta sensibilidad y especificidad en el diagnóstico de EP en estadios iniciales8 (NE-I). Sin embargo, no es signo patognomónico de la EP y la falta de protocolos estandarizados limita su uso en la práctica clínica.
Resonancia magnética morfométrica
La RM por volumetría permite cuantificar la atrofia cerebral. Se realiza de una forma semicuantitativa, definiendo a priori regiones de interés (ROI). Para poder diferenciar los diferentes síndromes parkinsonianos se han creado diferentes ROI, y ello ha permitido calcular las ratios de protuberancia, mesencéfalo y pedúnculos cerebelosos medio/superior, originando los índices de parkinsonismo en la RM9 (NE-II), muy útiles para el diagnóstico de PSP. Otros autores han destacado una pérdida de volumen pontocerebelar en la AMS10 (NE-II). En cambio, los volúmenes regionales suelen estar respetados en la EP.
La atrofia cerebral puede ser también evaluada a nivel global. La morfometría basada en vóxeles (VBM) es una técnica totalmente automatizada, independiente del evaluador, que no precisa una delimitación a priori de ROI. Usando esta técnica (VBM), en la EP diferentes autores han descrito una atrofia cortical sobre todo en áreas asociativas temporales, límbica, paralímbica, frontal y parietal11 (NE-II). Recientes estudios de VBM han descrito los siguientes hallazgos: en la EP se identifica una clara atrofia a nivel de los ganglios basales12 (NE-II) (debido a la degeneración nigroestriatal y la disfunción del circuito tálamo-cortical de los ganglios basales), lóbulo frontal y, de manera no específica, en el hipocampo derecho, circunvoluciones cinguladas anteriores izquierdas y giros temporales superiores. En pacientes con EP con disfunción respiratoria, se ha descrito un adelgazamiento cortical en la formación parahipocampal izquierda, giro fusiforme derecho, corteza cerebelosa derecha, y giros poscentrales izquierdos en comparación con los pacientes con EP con funciones pulmonares normales13 (NE-II). Por otro lado, en sujetos con EP avanzada, se descrito que la atrofia de la sustancia gris a nivel de las estructuras subcorticales es más pronunciada con respecto a los sujetos en etapas tempranas de la EP14 (NE-III), sirviendo de marcador de progresión de la enfermedad.
En la AMS se ha descrito una pérdida de volumen putaminal en comparación con la EP, siendo capaz de diferenciar la AMS/AMS-P de la EP con alta especificidad (92%), pero con una sensibilidad bastante baja (44%)15 (NE-II). Con respecto al diagnóstico diferencial entre los subtipos de AMS, recientes estudios han observado que tanto los pacientes con AMS-P como los de AMS-C pueden mostrar atrofia putaminal e infratentorial con considerable superposición. Sin embargo, la atrofia putaminal/ supratentorial ha demostrado ser más predominante en el subtipo AMS-P, mientras que la atrofia infratentorial lo es en el subtipo AMS-C16 (NE-III).
En cambio, en la PSP han encontrado una reducción de la sustancia blanca en protuberancia, mesencéfalo y adyacente a los ganglios basales, y reducción de la sustancia gris en tálamo, mesencéfalo, ganglios basales, corteza frontal e insular. En la PSP, la atrofia predominante a nivel del mesencéfalo se ha incorporado como una característica de imagen de apoyo en los criterios diagnósticos de la MDS17. Los autores han encontrado que las relaciones entre el área de la protuberancia y del mesencéfalo (P/M) y entre el grosor del pedúnculo cerebeloso medio y el pedúnculo cerebeloso superior (MCP/SCP) son mayores en la PSP que en la EP, AMS-P y controles. Utilizando estas relaciones, se calculó un índice como [(P/M) × (MCP/SCP)], denominado índice de parkinsonismo de RM, que demostró ser altamente sensible y específico para distinguir la PSP de la EP, AMS-P y los controles18 (NE-II). Se ha propuesto una versión revisada que incorpora el ancho del tercer ventrículo [índice de parkinsonismo de RM × (ancho del tercer ventrículo) / (ancho de los cuernos frontales)], que mostró una mayor sensibilidad (100%) y especificidad (94,3%) en la diferenciación de pacientes con parkinsonismo por PSP con lentitud de sacadas verticales de los de EP19 (NE-II).
Resonancia por difusión (diffusion weighted imaging [DWI])
La RM por difusión supone una técnica novedosa que permite valorar la integridad del cerebro a nivel microestructural, al medir el movimiento de las moléculas de agua, lo que posibilita medir la indemnidad de las fibras de la sustancia blanca. En general, en las enfermedades neurodegenerativas se produce un daño axonal y pérdida de neuronas asociado a un incremento en el movimiento de moléculas y por tanto el coeficiente de difusión. La imagen del tensor de difusión proporciona además información sobre la difusión media en un vóxel y la dirección de difusión (anisotropía fraccional). En general, la RM por difusión, a diferencia de la RM estructural, puede objetivar cambios más precoces estructurales que no son observados en la RM estructural normal.
Diferentes estudios han objetivado que la topografía del coeficiente de difusión, la difusión media y los cambios de anisotropía fraccional en los parkinsonismos atípicos muestran una alta correlación con los hallazgos histopatológicos. En este sentido, se ha observado un aumento regional de coeficiente de difusión en el pedúnculo cerebral medio que diferencia la AMS de la EP con una sensibilidad y especificidad del 84-100%20 (NE-III). Los pacientes con AMS-P presentan un aumento medio de la difusión en el putamen comparado con los pacientes con EP y PSP21 (NE-III). En cambio, los pacientes con PSP presentan una elevación del coeficiente de difusión regional en el mesencéfalo y globo pálido a diferencia de los pacientes con EP y AMS, y un aumento del coeficiente de difusión en el pedúnculo cerebeloso superior y núcleo caudado comparado con los pacientes con AMS22,23 (NE-III).
Resonancia magnética de susceptibilidad magnética (SWI)
La secuencia de susceptibilidad magnética (SWI, susceptibility weighted imaging) se basa en una secuencia T2-3D con alta resolución espacial, que utiliza el artefacto de susceptibilidad de la sangre en los vasos como si fuera contraste intrínseco. Esto va a
permitir diferenciar y detectar sustancias ferromagnéticas, diamagnéticas, como las calcificaciones y los depósitos de minerales, y las sustancias paramagnéticas, que son los productos de degradación de la sangre, hemosiderina y desoxihemoglobina24 (NE-I).
Esta secuencia tiene especial interés en el estudio de pacientes con EP por el estudio de los depósitos anómalos de hierro a nivel cerebral, principalmente en la SN. En personas sanas, el mayor porcentaje de depósito de hierro se encuentra a nivel del putamen, el globo pálido y el núcleo caudado y, en menor proporción, a nivel de la SN y el locus coeruleus. Sin embargo, la presencia de depósitos anómalos del hierro generalmente se encuentra en enfermedades neurodegenerativas, como la enfermedad de Alzheimer y la EP. Existen diferentes estudios publicados que comparan la concentración de depósitos de hierro a nivel de la SN entre sujetos sanos y pacientes con EP, las diferencias son estadísticamente significativas desde estadios iniciales de la enfermedad, haciendo posible el diagnóstico25 (NE-III). Existe una nueva técnica de RM conocida con mapeo cuantitativo de susceptibilidad (siglas en inglés QSM), con una resolución mayor, pero su uso no está extendido en la práctica clínica habitual26 (NE-III).
Recientes estudios27 (NE-III) abogan por el uso de forma conjunta de la secuencia SWI, QSM y secuencias específicas de neuromelanina en RM de 3T, con el objetivo de estudiar de forma cualitativa y cuantitativa los depósitos anómalos de hierro, principalmente a nivel de la SN. Este estudio multiparamétrico permitiría el diagnóstico de EP en estadios precoces, pero también evaluar el grado de progresión de la enfermedad.
Resonancia magnética con espectroscopia
La espectroscopia protónica por RM permite la valoración de ciertas moléculas implicadas en la bioenergía cerebral y en integridad neuronal. Particularmente, la ratio de N-acetil aspartato (NAA), como un marcador de integridad neuronal, y la creatina (Cr), como un marcador de metabolismo energético, son los pilares donde se han centrado diferentes estudios realizados en síndromes parkinsonianos. Concretamente en pacientes con EP y deterioro cognitivo, se ha descrito una disminución regional de NAA/Cr28,29 (NE-III). No obstante, el principal factor limitante es que los hallazgos pueden ser equívocos en estadios iniciales de la EP.
Transferencia magnética por imagen
Esta técnica de RM evalúa la energía transferida entre protones que se unen fuertemente a estructuras como la mielina con protones con alta movilidad en el agua. Por tanto, la magnitud de ratio de transferencia de la magnetización es altamente dependiente de la mielinización axonal. Esta técnica puede observar alteraciones que se producen en la desmielinización en enfermedades neurodegenerativas. En este sentido, se ha observado reducción de la ratio de transferencia de la magnetización en el núcleo caudado, putamen, tálamo y en la sustancia blanca periventricular, frontal y parietal en los síndromes parkinsonianos, pero todavía no se tiene la suficiente experiencia como para poder diferenciar los diferentes síndromes parkinsonianos.
Nuevas técnicas en desarrollo: RM de 7 teslas
La RM de 7 teslas (RM 7T) permite visualizar la anatomía de la SN. Usando esta técnica se ha observado una hiperintensidad en secuencias T2 de la SN en sujetos normales, y su ausencia en pacientes con EP debido a una pérdida de neuronas con melanina (nigrosomas) en la parte reticulada de la SN, y mayor depósito de hierro. La precisión diagnóstica de la RM 7 T para visualizar los nigrosomas tiene una sensibilidad del 100%, una especificidad del 87-100%, un valor predictivo positivo del 91-100% y un valor predictivo negativo del 100%, con un acuerdo intra e interevaluador alto. No obstante, las principales limitaciones que tiene todavía son la transmisión de campos no homogéneos, altos artefactos por movilidad y la alta intensidad de la señal depositada30 (NE-IV).
Resonancia magnética y neuromelanina
La neuromelanina (NM) es un pigmento que se produce durante la oxidación de la dopamina, y se encuentra principalmente a nivel de la SN y el locus coeruleus. Desde la introducción de secuencias de RM sensibles a la NM31, esta técnica ha adquirido una gran importancia en estudios de investigación con el objetivo de realizar un diagnóstico precoz de la EP y la diferenciación entre la EP, el temblor esencial (ET) y los parkinsonismos atípicos. Numerosos estudios han demostrado la existencia de niveles disminuidos de NM a nivel de la SN en fases precoces de la EP32 (NE-III). Actualmente esta técnica se utiliza en el campo de la investigación.


Bibliografía
1. Beach TG, Adler CH. Importance of low diagnostic accuracy for early Parkinson’s disease. Mov Disord. 2018;33(10):1551-1554.
2. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf 1837629189061
3. Han YH, Lee JH, Kang BM, et al. Topographical differences of brain iron deposition between progressive supranuclear palsy and parkinsonian variant multiple system atrophy. J Neurol Sci. 2013;325(1-2):29-35.
4. Saeed U, Compagnone J, Aviv RI, et al. Imaging biomarkers in Parkinson’s disease and Parkinsonian syndromes. Current and emerging concepts. Transl Neurodegener. 2017;6:8.
5. Mueller C, Hussl A, Krismer F, et al. The diagnostic accuracy of the hummingbird and morning glory sign in patients with neurodegenerative parkinsonism. Parkinsonism Relat Disord. 2018;54:90-94
6. Wenning GK, Colosimo C, Geser F, et al. Multiple system atrophy. Lancet Neurol. 2004;3(2):93-103. 7. Schwarz J, Weis S, Kraft E, et al. Signal changes on MRI and increases in reactive microgliosis, astrogliosis, and iron in the putamen of two patients with multiple system atrophy. J Neurol Neurosurg Psychiatry. 1996;60(1):98-101.
7. Schwarz J, Weis S, Kraft E, et al. Signal changes on MRI and increases in reactive microgliosis, astrogliosis, and iron in the putamen of two patients with multiple system atrophy. J Neurol Neurosurg Psychiatry. 1996;60(1):98-101.
8. Mahlknecht P, Krismer F, Poewe W, et al. Meta-analysis of dorsolateral nigral hyperintensity on magnetic resonance imaging as a marker for Parkinson’s disease. Mov Disord. 2017;32(4):619-623.
9. Quattrone A, Nicoletti G, Messina D, et al. MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology. 2008;246(1):214-21.
10. Paviour DC, Price SL, Jahanshahi M, et al. Regional brain volumes distinguish PSP, MSA-P, and PD: MRI-based clinico-radiological correlations. Mov Disord. 2006;21(7):989-96.
11. Pereira JB, Ibarretxe-Bilbao N, Marti MJ, et al. Assessment of cortical degeneration in patients with Parkinson’s disease by voxel-based morphometry, cortical folding, and cortical thickness. Hum Brain Mapp. 2012;33(11):2521-34.
12. Xu X, Han Q, Lin J, et al. Grey matter abnormalities in Parkinson’s disease: a voxel-wise meta-analysis. Eur J Neurol. 2019; 27:653-9.
13. Lee SY, Chen MH, Chiang PL, et al. Reduced gray matter volume and respiratory dysfunction in Parkinson’s disease: a voxel-based morphometry study. BMC Neurol. 2018;18:73.
14. Blair JC, Barrett MJ, Patrie J, et al. Brain MRI reveals ascending atrophy in Parkinson’s disease across severity. Front Neurol. 2019;10:1329.
15. Massey LA, Micallef C, Paviour DC, et al. Conventional magnetic resonance imaging in confirmed progressive supranuclear palsy and multiple system atrophy. Mov Disord. 2012;27:1754-62.
16. Krismer F, Seppi K, Göbel G, et al. Morphometric MRI profiles of multiple system atrophy variants and implications for differential diagnosis. Mov Disord 2019;34:1041-8.
17. Höglinger GU, Respondek G, Stamelou M, et al. Clinical diagnosis of progressive supranuclear palsy: the movement disorder society criteria. Mov Disord. 2017;32:853-64.
18. Quattrone A, Nicoletti G, Messina D, et al. MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology. 2008;246:214-21.
19. Lee W. Conventional Magnetic Resonance Imaging in the Diagnosis of Parkinsonian Disorders: A Meta-Analysis. Mov Disord Clin Pract. 2020;8(2):217-223.
20. Nicoletti G, Lodi R, Condino F, et al. Apparent diffusion coefficient measurements of the middle cerebellar peduncle differentiate the Parkinson variant of MSA from Parkinson’s disease and progressive supranuclear palsy. Brain. 2006;129(Pt 10):2679-87.
21. Baudrexel S, Seifried C, Penndorf B, et al. The value of putaminal diffusion imaging versus 18-fluorodeoxyglucose positron emission tomography for the differential diagnosis of the Parkinson variant of multiple system atrophy. Mov Disord. 2014;29(3):380-7.
22. Tsukamoto K, Matsusue E, Kanasaki Y, et al. Significance of apparent diffusion coefficient measurement for the differential diagnosis of multiple system atrophy, progressive supranuclear palsy, and Parkinson’s disease: evaluation by 3.0-T MR imaging. Neuroradiology. 2012;54(9):947-55.
23. Erbetta A, Mandelli ML, Savoiardo M, et al. Diffusion tensor imaging shows different topographic involvement of the thalamus in progressive supranuclear palsy and corticobasal degeneration. AJNR. 2009;30(8):1482-7.
24. Bajaj S, Krismer F, Palma JA, et al. Diffusion-weighted MRI distinguishes Parkinson disease from the parkinsonian variant of multiple system atrophy: A systematic review and meta-analysis. PLoS One. 2017;12(12):e0189897.
25. Martín-Bastida A, Lao-Kaim NP, Loane C, et al. Motor associations of iron accumulation in deep grey matter nuclei in Parkinson’s disease. A crosssectional study of iron-related magnetic resonance imaging susceptibility. Eur J Neurol. 2017;24:357-365.
26. Langkammer C, Pirpamer L, Seiler S, et al. Quantitative Susceptibility Mapping in Parkinson’s Disease. PLoS One. 2016; 11(9):e0162460.
27. Cao Q, Huang J, Tang D, et al. Application value of multiparametric MRI for evaluating iron deposition in the substantia nigra in Parkinson’s disease. Front Neurol. 2023;13:1096966.
28. Wang Y, Butros SR, Shuai X, et al. Different iron-deposition patterns of multiple system atrophy with predominant parkinsonism and idiopathetic Parkinson diseases demonstrated by phase-corrected susceptibility-weighted imaging. AJNR. 2012;33(2): 266-73.
29. Lewis SJ, Shine JM, Duffy S, et al. Anterior cingulate integrity: executive and neuropsychiatric features in Parkinson’s disease. Mov Disord. 2012;27(10):1262-7.
30. Lehericy S, Bardinet E, Poupon C, et al. 7 Tesla magnetic resonance imaging: a closer look at substantia nigra anatomy in Parkinson’s disease. Mov Disord. 2014;29(13):1574-81.
31. Sasaki M, Shibata E, Tohyama K, et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson’s disease. Neuroreport. 2006;17:1215-1218.
32. Jin L, Wang J, Wang C, et al. Combined visualization of nigrosome-1 and neuromelanin in the substantia nigra using 3T MRI for the differential diagnosis of essential tremor and de novo Parkinson’s disease. Front Neurol. 2019;10:100
Introducción y aspectos técnicos
La neurosonografía es una técnica no invasiva, de bajo coste y de ejecución rápida y cómoda para el sujeto de estudio, lo que ha facilitado que el volumen de sujetos estudiados sea elevado, favoreciendo la calidad y cantidad de la evidencia científica acumulada33 (NE-III).
La sonografía transcraneal (STC) del parénquima o mesencefálica debe ser realizada por exploradores experimentados de acuerdo con una sistemática estandarizada (Tabla I). Se trata de una ecografía en modo dúplex, que se realiza con el paciente en decúbito supino, con el cabecero elevado unos 30 grados. La sonda se coloca sobre la escama temporal, en la línea orbitomeatal en ambos lados, con una inclinación variable en los planos de observación mesencefálico (SN, rafe y núcleo rojo) y diencefálico (ventrículos laterales, tercer ventrículo, ganglios basales) (Figura 5).

La ausencia de una ventana temporal suficiente puede limitar su aplicación en un 5-15% de los sujetos, en especial mujeres de edad avanzada y sujetos asiáticos (15-60%). Se requiere un entrenamiento específico, asistido por expertos, y experiencia documentada suficiente34 (NE-IV). Bajo estas condiciones, la reproducibilidad y la concordancia intra e interobservador son elevadas.
En el plano axial mesencefálico (Figura 6) se visualiza el mesencéfalo en forma de mariposa delimitada por la hiperecogenicidad de las cisternas basales. En la región anterior ipsilateral se observan unas señales hiperecogénicas confluentes: corresponden a la SN mesencefálica, el principal biomarcador detectado por STC. El área de ecogenicidad de la SN sigue una distribución normal en la población, considerándose la SN hiperecogénica (hiperecogenicidad marcada, SN+) cuando su área supera el percentil 90 (P90) de una muestra de sujetos control. No se han observado variaciones significativas en la ecogenicidad de la SN según la raza, aunque sí entre ecógrafos de distintos fabricantes. Para los equipos de última generación el punto de corte de hiperecogenicidad marcada está en torno a 0,25-0,30 cm2, mientras que está en torno a 0,20 cm2 para los más antiguos34 (NE-IV).
Ecografía transcraneal en el diagnóstico de la enfermedad de Parkinson
La hiperecogenicidad de la SN en pacientes con EP fue descrita por primera vez en el año 199533. A día de hoy, el mecanismo exacto por el que se produce este fenómeno no es del todo conocido, pero sí se sabe que intervienen diferentes procesos, como son la alteración en el depósito de hierro a nivel del mesencéfalo (principalmente debido a la alteración en el metabolismo del hierro)35 y los procesos de neuroinflamación que incluyen la activación de la microglía y la presencia de gliosis36 (NE-II). Por otra parte, hay que saber que estos cambios también han sido descritos en pacientes con parkinsonismos atípicos, como PSP y AMS, pero la incidencia en la EP es mayor. En recientes metaanálisis se estima una prevalencia de hiperecogeneidad en EP idiopática en torno al 84%37, con una sensibilidad en torno al 80-95% y una especificidad que varía entre el 60 y el 96%37 (NE-I). La hiperecogenicidad de la SN en pacientes con EPI suele ser unilateral o bilateral asimétrica, sin correlacionarse con la gravedad o duración de la enfermedad39 (NE-IV). Además, se ha observado una mayor hiperecogeneidad en EP de subtipo no tremórico y su ausencia en sujetos con EP podría predecir una peor respuesta al tratamiento dopaminérgico40 (NE-IV).
¿Cómo interpretar la hiperecogenicidad de la SN en sujetos control? La mayoría de estos individuos (en torno al 80%) no desarrollará nunca una EPI, pero su riesgo relativo es de 17,37 veces el de la población con SN normal, y de hasta 48,39 si se combina con anosmia o signos motores sutiles41 (NE-IV). Diversos autores han comunicado la conversión clínica a EPI de sujetos controles con hiperecogenicidad de la SN. La frecuencia de hiperecogenicidad de la SN es mayor del 10% en sujetos control con factores de riesgo para EPI, como el sexo masculino, la edad avanzada y los antecedentes familiares de EP, y mayor aún en presencia de hiposmia, trastorno del sueño REM y depresión.
La hiperecogenicidad de la SN se encuentra presente también en pacientes con EP monogénicas (PARK-SCNA, PARK-parkin, PARK-PINK1, PARK-DJ1, PARK-LRRK2)42
(NE-IV), con la excepción de la enfermedad de Kufor-Rakeb (PARK-ATP13A2). La hiperecogenicidad también está presente en la EP asociada a mutaciones en el gen de la glucocerebrosidasa (PARK-GBA o enfermedad de Gaucher) y en portadores asintomáticos de mutaciones en este gen43 (NE-IV). La hiperecogenicidad bilateral simétrica es más frecuente en pacientes con deterioro cognitivo asociado a EP. Varios autores han observado áreas de ecogenicidad mayores en el lado contralateral al hemicuerpo más afecto. La hipoecogenicidad del rafe se ha asociado a depresión y disfunción urinaria, la dilatación de ventrículos laterales con el deterioro cognitivo, y la hiperecogenicidad del caudado con psicosis dopaminérgica44 (NE-IV).
Ecografía transcraneal en el diagnóstico diferencial de la enfermedad de Parkinson
Diversos estudios han demostrado que la STC es útil para el diagnóstico diferencial de la EPI con el temblor esencial, en el que la SN es normal por definición. No obstante, la frecuencia de SN+ puede ser algo superior a la población normal, probablemente a expensas de aquellos pacientes en los que el temblor esencial es prodrómico de una EPI45 (NE-I). Recientes estudios de metaanálisis describen una sensibilidad entre el 69-85% (IC 95) y una especificidad entre el 77-91% (IC 95) en el diagnóstico diferencial entre EPI y temblor esencial con el uso de ecografía de la SN37 (NE-I). También se ha observado que pacientes con temblor esencial e hiperecogeneidad en la SN tienen un riesgo mayor de desarrollar EP en los próximos 5 años, que es mayor si además asocian alteraciones en la fase REM del sueño46 (NE-II).
En el caso de la entidad conocida como escáner sin evidencia de degeneración dopaminérgica (scans without evidence of dopaminergic deficiency [SWEDD]) y el parkinsonismo vascular, la proporción de SN+ es similar a la población control46 (NE-IV).
Respecto al parkinsonismo inducido por fármacos con SN+, lo que probablemente ocurra es que el uso de fármacos ha desenmascarado la EP47 (NE-IV). Estudios prospectivos recientes indican que la ecogenicidad normal de la SN se asocia con una alta probabilidad de reversibilidad de los síntomas en estos pacientes, con elevado valor predictivo negativo para descartar EPI subyacente desenmascarada (96%)48 (NE-I).
En el caso de los parkinsonismos atípicos AMS, PSP, DCB y DCL, la STC tiene especial interés, ya que no solo la frecuencia de SN+ es menor que en la EPI (AMS 20% y PSP 30-39%), sino que hay otras alteraciones sonográficas más específicas que apoyan el diagnóstico de forma positiva (Figura 7). En este sentido, destacan la hiperecogenicidad del núcleo lenticular (LN+), la ampliación del tercer ventrículo (IIIV+) y la simetría en la hiperecogenicidad de la SN49 (NE-III). La combinación de SN normal y LN+ tiene una buena rentabilidad diagnóstica para discriminar parkinsonismo atípico frente a EPI (especificidad y valor predictivo positivo cercano al 100%, sensibilidad del 59%), mientras que la de SN+ y lenticular normal diagnostica EPI frente a parkinsonismo atípico con valores predictivos sobre el 90% (positivo 91%, negativo 96%)50,51 (NE-I).

Recientes estudios de metaanálisis37,38 concluyen que la ecografía de la SN permite el diagnóstico diferencial entre EP y otros parkinsonismos (AMS-P, PSP y DCB principalmente), observándose una sensibilidad del 65-93% (IC 95) y una especificidad del 70% (IC 95) entre EPI y AMS (NE-I); una sensibilidad del 83% (IC 95) y especificidad del 71% (IC 95) entre la EPI y PSP (NE-I). En el caso del diagnóstico diferencial entre PSP y DCB (NE-II), es importante valorar de forma conjunta SN, ecogenicidad lenticular y tamaño del tercer ventrículo. Estudios más recientes de práctica clínica real muestran una utilidad diagnóstica más baja si únicamente se considera la hiperecogenicidad de la SN como variable ultrasonográfica (Tabla II)40 (NE-IV).


Bibliografía
33. Becker G, Seufert J, Bogdahn U, et al. Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography. Neurology. 1995;45(1):182-4.
34. Walter U. How to measure substantia nigra hyperechogenicity in Parkinson disease:detailed guide with video. J Ultrasound Med. 2013;32(10):1837-43.
35. Behnke S, Berg D, Naumann M, et al. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry.2005;76(3):423-5.
36. Berg D, Godau J, Riederer P, et al. Microglia activation is related to substantia nigraechogenicity. J Neural Transm (Vienna). 2010;117(11):1287-92.
37. Shafieesabet A, Fereshtehnejad SM, Shafieesabet A, et al. Hyperechogenicity of substantia nigra for differential diagnosis of Parkinson’s disease: A meta-analysis. Parkinsonism Relat Disord. 2017;42:1-11.
38. Mei YL, Yang J, Wu ZR, et al. Transcranial Sonography of the Substantia Nigra for the Differential Diagnosis of Parkinson’s Disease and Other Movement Disorders: A Meta-Analysis. Parkinsons Dis. 2021;2021:8891874.
39. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain. 2007;130(Pt 7):1799-807.
40. Fernández Moreno C, Arjona Padillo A. Neuroimagen estructural: tomografía axial computarizada, resonancia magnética y ecografía craneal. En: Escamilla Sevilla F, González
41. Berg D, Seppi K, Liepelt I, et al. Enlarged hyperechogenic substantia nigra is related to motor performance and olfaction in the elderly. Mov Disord. 2010;25(10):1464-9.
42. Brockmann K, Groger A, Di Santo A, et al. Clinical and brain imaging characteristics in leucine-rich repeat kinase 2-associated PD and asymptomatic mutation carriers. Mov Disord. 2011; 26(13): 2335-42.
43. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS [corrected] recommendations for the diagnosis of Parkinson’s disease. Eur J Neurol. 2013 Jan;20(1): 16-34. Erratum in: Eur J Neurol. 2013 Feb;20(2):406.
44. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain. 2007;130(Pt 7):1799-807.
45. Lauckaite K, Rastenyte D, Surkiene D, et al. Ultrasonographic (TCS) and clinical findings in overlapping phenotype of essential tremor and Parkinson’s disease (ET-PD). BMC Neurol. 2014;14(54):54.
46. Heim B, Peball M, Hammermeister J, et al. Differentiating Parkinson’s Disease from Essential Tremor Using Transcranial Sonography: A Systematic Review and Meta-Analysis. J Parkinsons Dis. 2022;12(4):1115-1123.
47. Skidmore F, Anderson K, Fram D, Weiner W. Psychogenic camptocormia. Mov Disord. 2007;22(13):1974-5.
48. López-Sendón Moreno JL, Alonso-Cánovas A, Buisán Catevilla J, et al. Substantia nigra echogenicity predicts response to drug withdrawal in suspected drug-induced parkinsonism. Mov Disord Clin Pract. 2016;3:268-74.
49. Behnke S, Berg D, Naumann M, et al. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry. 2005;76(3):423-5.
50. Alonso-Canovas A, Tembl Ferrairó JI, Martínez-Torres I, et al. Transcranial sonography in atypical parkinsonism: How reliable is it in real clinical practice? A multicentre comprehensive study. Parkinsonism Relat Disord. 2019 Nov;68:40-45.
51. Tao A, Chen G, Deng Y, et al. Accuracy of Transcranial Sonography of the Substantia Nigra for Detection of Parkinson’s Disease: A Systematic Review and Meta-analysis. Ultrasound Med Biol. 2019 Mar;45(3):628-641.
Introducción y aspectos técnicos
Las técnicas de imagen de Medicina Nuclear requieren la administración de un radiofármaco que nos permitirá la evaluación del parámetro molecular de interés, y la adquisición de las imágenes. Estas pueden ser planares (gammagrafía) o por SPECT o PET, dependiendo del tipo de emisión radiactiva del radiofármaco empleado.
Los radiofármacos son medicamentos que contienen una dosis traza de una molécula (no tiene efecto terapéutico), que se une a un isotopo radiactivo. Los isotopos se pueden dividir en emisores gamma (99mtecnecio, 123iodo) con un periodo de semidesintegración radiactivo de varias horas, o emisores de positrones (generalmente 18flúor y excepcionalmente 11carbono) con un periodo de semidesintegración radiactivo corto (110 minutos en el caso del 18flúor, o 10 minutos en el caso del 11carbono).
Los equipos de tomográficos son actualmente equipos multimodalidad que incluyen una tomografía computarizada (SPECT/CT o PET/CT) o una RM (PET/RM) y mejoran la visualización de las estructuras cerebrales y la corrección de la atenuación. Asimismo, los equipos digitales de última generación tanto de SPECT como de PET han optimizado las prestaciones de tiempos de realización de las imágenes como parámetros de calidad de imagen como la sensibilidad y resolución espacial.
Imagen dopaminérgica
La imagen dopaminérgica mediante técnicas de medicina nuclear permite evaluar tanto la vía presináptica (nigroestriatal) como la postsináptica (unión a receptores dopaminérgico D2).
Imagen dopaminérgica presináptica
Este tipo de imágenes muestran la degeneración de la sustancia nigra mediante la evaluación de las terminales dopaminérgicas que proyectan al estriado.
El radiofármaco de SPECT que más se emplea en clínica es el ioflupano o N-3-fluo- ropropil-2b-carbometoxi-3b-(4-iodofenil) nortropano marcado con 123I (123I-FP-CIT o DaTSCAN©). Este radiofármaco se une al transportador activo de dopamina (DAT, de sus siglas en ingles) en las terminales del neoestriado reflejando la densidad del mismo. Para la realización del estudio, es necesario reducir la exposición de la tiroides a la radiación del 123I libre mediante una dosis única de solución oral de yoduro de potasio o solución de Lugol (equivalente a 100 mg de yoduro) o tableta de yoduro de potasio, perclorato de potasio (400 mg) o perclorato de sodio (600 mg). Según la ficha técnica del producto, hay que tener en cuenta los medicamentos y drogas de abuso con afinidad por los trasportadores monoaminérgicos que pueden influir en el análisis visual o cuantitativo del (123I-FP-CIT) (Tabla III)52. Otros medicamentos que también pueden influir en el resultado de la SPECT son los antagonistas del canal del calcio, la digoxina y la amiodarona. La toma de LD y agonistas dopaminérgicos (AD) no interfiere con la unión al DAT52.
Tras la administración del 123I-FP-CIT o DaTSCAN©, deben transcurrir entre 3 y 6 horas antes de realizar las imágenes de SPECT. La unión normal del radiotrazador en los estriados se visualizan como dos regiones simétricas brillantes en forma de coma, que indican una actividad intensa en el núcleo caudado y putamen. Cualquier cambio en esta morfología indica la presencia de una lesión presináptica nigroestriatal(Figura 8). La evaluación visual de las imágenes suele ser suficiente para evaluar la simetría estriatal izquierda/derecha y las subregiones estriatales. No obstante, los equipos de SPECT/CT vienen provistos de estaciones de trabajo con programas informáticos que proporcionan un análisis cuantitativo de la actividad de las diferentes estructuras estriatales respecto a la corteza occipital ya que no recibe a penas terminales dopaminérgicas (índice estriado/occipital). Los valores de este índice se deberán comparar con una base de datos de normalidad ajustada por edad ya que el 123I-FP-CIT experimenta una disminución de la unión al DAT con la edad52.
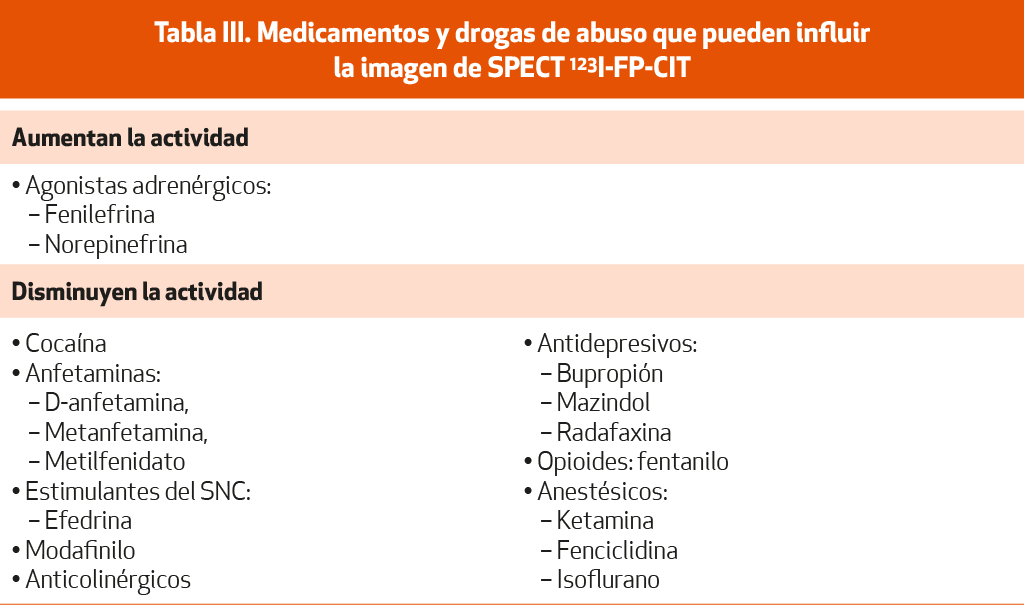
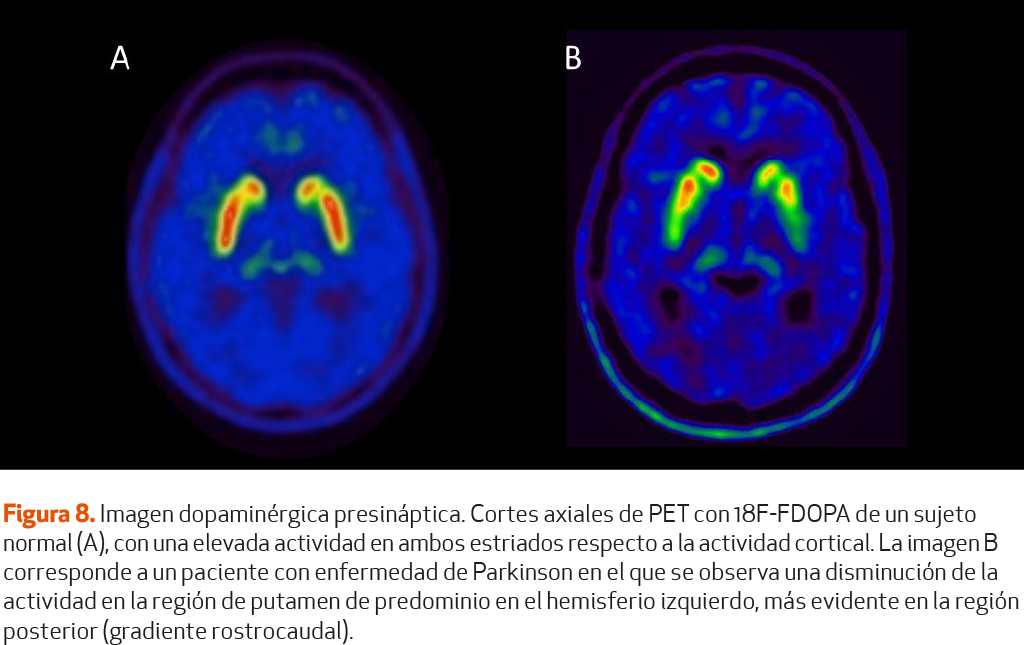
Para los estudios de PET se dispone actualmente en España de 3,4-dihydroxy-6-[18F] fluoro-L-phenylalanine (18F-FDOPA) (Figura 8). La PET con 18F-FDOPA se ha utilizado históricamente para la evaluación de síndromes parkinsonianos en entornos de investigación53. Sin embargo, con el incremento de disponibilidad de equipos PET y la comercialización de la 18F-FDOPA, esta técnica se ha integrado a la práctica clínica como herramienta de diagnóstico clínico. La PET con 18F-FDOPA refleja el transporte de la dopamina en el terminal presináptico, la metabolización de la dopamina por la dopa-descarboxilasa (cataliza la conversión del 18F-dopa en 18F-dopamina), y la capacidad de almacenamiento de la dopamina. De la misma forma que en el tratamiento con LD, es necesario administrar un inhibidor periférico de la dopadecarboxilasa sistémico que no atraviesa la barrera hematoencefálica (generalmente 150 mg de carbidopa una hora antes de la administración de 18F-FDOPA). Además, se deberá suprimir la toma de LD en las 12 horas anteriores y los agonistas dopaminérgicos 24 horas. La mayor resolución espacial de la PET facilita la valoración visual de las diferentes estructuras estriatales (caudado, putamen anterior y posterior). Al igual que con el 123I-FP-CIT, se obtienen valores de captación de las áreas del estriado respecto a la captación occipital como complemento a la interpretación visual. No obstante, la PET con 18F-FDOPA permite además cuantificar la constante de descarboxilación (Ki).
Existen otros radiofármacos PET que se emplean en la valoración de la actividad dopaminérgica presináptica como la dihidrotetrabenazina marcada con 11carbono o 18flúor (11C-DTBZ, 18F-FP-DTBZ) que mide la actividad del transportador vesicular de DA (VMAT2). No obstante, estos estudios se realizan en el ámbito de la investigación.
Los nuevos radiofármacos de unión a DAT para PET ofrecen numerosas ventajas respecto al 123I-FP-CIT de SPECT. El más desarrollado es el N-(3-iodoprop-2E-enyl)- 2β-carbo[18F]fluoroethoxy-3β-(4-methylphenyl)-nortropane (18F-FE-PE2I). Muestra una cinética más rápida, reduciendo el tiempo entre inyección y adquisición a 15-20 minutos, una elevada afinidad (KD = 12nM), mayor selectividad DAT/SERT (ratio de 29,4 frente a 2,78 con 123I-FP-CIT), y no requiere bloqueo del tiroides54 (NE-II). Es muy probable que este radiofármaco llegue a comercializarse en breve para su uso clínico.
Imagen dopaminérgica postsináptica
Los radiotrazadores más utilizados para obtener imágenes de receptores tipo D2 con SPECT han sido 123I-IBZM y para PET el 11C-raclopride. Estos derivados antagonistas del receptor de dopamina no son radiofármacos selectivos para el receptor D2, ya que también se unen al receptor D3. Sin embargo, la gran mayoría de los receptores tipo D2 en el cuerpo estriado son receptores D2. El uso clínico de los trazadores SPECT o PET para la obtención de imágenes dopaminérgicas postsinápticas está actualmente limitado por no estar disponibles en varios países y se ha sugerido que la PET con 18F-FDG supera a las imágenes SPECT D2 para el diagnóstico diferencial de los parkinsonismos como describimos en el siguiente apartado.
Imagen de la actividad sináptica neuronal
La actividad sináptica neuronal se puede evaluar mediante la PET con 2-[18F] fluoro- 2-desoxi-D-glucosa (18F-FDG) o, en su defecto, mediante la SPECT de perfusión con hexametilpropilenoamina oxima marcada con 99mtecnecio (99mTc-HMPAO).
El metabolismo de glucosa cerebral medido mediante la 18F-FDG se correlaciona estrechamente con la actividad e integridad sináptica55. La disfunción sináptica observada en los estudios PET con 18F-FDG antecede a la neurodegeneración por lo que permite su empleo en estadios relativamente tempranos de la enfermedad, antes de que la muerte neuronal sea apreciable por técnicas de imagen basadas en la estructura o anatomía (por ejemplo, secuencias estructurales en RMN cerebral o la TC cerebral).
El análisis de las imágenes en la práctica clínica se realiza visualmente de acuerdo con patrones establecidos para cada entidad. Sin embargo, actualmente las estaciones de trabajo de los equipos PET vienen provistos de programas de análisis cuantitativo basado en vóxeles, que permiten comparar las imágenes de un individuo respecto a una base de datos de normalidad ajustada por edad, mostrando las áreas de aumento o disminución de la actividad sináptica que sirven como complemento al análisis visual que disminuye la variabilidad inter- e intraevaluador.
Imagen de la inervación simpática miocárdica
La imagen de inervación simpática miocárdica se realiza mediante la gammagrafía con 123I-metayodobencilguanidina marcado con 123I (123I-MIBG). La 123I-MIBG es un análogo de noradrenalina que es transportado a los gránulos de noradrenalina de las terminales nerviosas simpáticas y visualiza la integridad de la inervación simpática cardiaca.
Existen una serie de fármacos que prolongan o reducen la captación de 123I-MIBG (Tabla IV) y que deben interrumpirse antes de la administración de 123I-MIBG, generalmente durante cuatro vidas medias biológicas que son necesarias para su completa eliminación. Al igual que con el 123I-FP-CIT, es necesario bloquear la actividad tiroidea.

La valoración visual se encuentra limitada por la heterogeneidad de la captación miocárdica, por lo que se utilizan el índice de captación corazón/ mediastino y la tasa de lavado.
Contribución al diagnóstico clínico de los síndromes parkinsonianos
Enfermedad de Parkinson
En la EP, los estudios se centran principalmente en la valoración de la vía dopaminérgica nigro-estriatal.
Los estudios de imagen dopaminérgica presináptica tanto con SPECT como PET muestran una actividad normal en sujetos sanos, temblor esencial y en parkinsonismo inducido por fármacos o en trastornos funcionales56 (NE-II). En la EP, el putamen posterior presenta una reducción progresiva en la actividad más temprana y grave en comparación con el putamen anterior o el núcleo caudado, que se correlaciona bien con la degeneración neuronal, como lo demuestran los estudios patológicos57 (NE-III). La denervación observada suele ser asimétrica, más pronunciada en el hemisferio contralateral a la sintomatología parkinsoniana, mientras puede aparecer simétrica en casos con déficits motores simétricos58 (NE-II) o en estados más avanzados (Tabla V). La afectación en el estriado observada con SPECT 123I-FP-CIT y PET 18F-FDOPA se ha demostrado que correlaciona con la gravedad de la EP y el deterioro motor59 (NE-III).
Tanto la SPECT con 123I-FP-CIT como la PET con 18F-FDOPA han demostrado ser las técnicas de imagen más precisas para demostrar la presencia de denervación dopaminérgica presináptica en pacientes con EP, aumentando la confianza en el diagnóstico y cambios en el manejo clínico en un 72% de los pacientes60-63 (NE-I). En los estudios comparativos con la valoración de la integridad estructural del nigrosoma 1 en las secuencias SWI de RM, la PET con 18F-FDOPA es más precisa para diferenciar síndromes parkinsonianos de trastornos no parkinsonianos64 (NE-III). Se han descrito algunos falsos positivos de la SPECT con 123I-FP-CIT relacionados con interferencias farmacológicas o artefactos metodológicos, ya que la SPECT tiene una menor resolución espacial. Si bien no es indispensable, la imagen dopaminérgica presináptica está incluida en los criterios diagnósticos de EP; un estudio normal es un criterio de exclusión absoluto para la EP52. No obstante, los ensayos clínicos han demostrado la presencia de un 10-15% de los pacientes con criterios clínicos de EP que presentan estudios normales con 18F-DOPA o 123I-FP-CIT (SWEDD: sujetos sin evidencia de degeneración dopaminérgica)65 (NE-II).
En los pacientes con EP inicial se han descrito efectos compensatorios de regulación de la L-aminoácido aromático descarboxilasa y la recaptación de DA en las neuronas dopaminérgicas presinápticas remanentes. Sin embargo, dichos efectos no se han traducido en una diferencia de sensibilidad en la detección de la denervación dopaminérgica entre la SPECT con 123I-FP-CIT y la PET con 18F-FDOPA66 (NE-II).
Los estudios de imagen dopaminérgica presináptica han puesto de manifiesto la presencia de denervación dopaminérgica presináptica en sujetos asintomáticos desde el punto de vista motor, tanto en pacientes con mutaciones asociadas a EP como en personas con trastornos del comportamiento del sueño REM (TCSREM), que posteriormente han desarrollado una EP (fase prodrómica)67 (NE-II).
Imagen de inervación simpática miocárdica con 123I-MIBG
En la EP existe una degeneración posganglionar del sistema nervioso autónomo a nivel cardiaco desde estadios relativamente tempranos de la enfermedad (Tabla V). Los estudios preliminares en poblaciones seleccionadas mostraron una alta sensibilidad (89%) de la gammagrafía con 123I-MIBG, con una especificidad en torno al 77%68 (NE-I). No obstante, existen múltiples factores de confusión que pueden alterar los resultados y deben tenerse en cuenta en la interpretación de los resultados, como por ejemplo la presencia de una cardiopatía isquémica o cardiomiopatía, una polineuropatía periférica por otra causa, diabetes o ciertos fármacos. Además, su rendimiento en estadios precoces de la enfermedad disminuye a expensas de un descenso en la sensibilidad (73,3% en la EP con menos de 3 años de evolución). Por ello, su precisión diagnóstica a nivel individual y aplicación en la práctica clínica es limitada69(NE-II).
En el modelo de desarrollo de EP de inicio en el cerebro (brain-first) por el que los pacientes inicialmente acumulan α-sinucleína en un hemisferio, generando un perfil asimétrico de neurodegeneración en el cerebro y aparición tardía de disfunción autonómica, la denervación dopaminérgica presináptica es asimétrica, pero la denervación simpática cardiaca no suele estar presente. Sin embargo, el modelo de inicio sistémico (body-first) predice una afectación temprana del sistema nervioso autónomo periférico con denervación simpática cardiaca en el estudio de 123I-MIBG, y afectación de las estructuras inferiores del tronco del encéfalo70 (NE-III).
Estudio PET de metabolismo cerebral de 18F-FDG
El estudio PET de metabolismo cerebral de 18F-FDG de los pacientes con EP muestra un patrón de hipermetabolismo en el núcleo lenticular (que incluye el putamen y el globo pálido), tálamo, cortex motor y el cerebelo (vermis), además de junto a un hipometabolismo variable en áreas de asociación parietooccipital y en la corteza prefrontal dorsolateral (fundamentalmente en pacientes de largo tiempo de enfermedad o con síntomas cognitivos) (Tabla V)71 (NE-III).
En la fase prodrómica de la EP, los sujetos con TCSREM muestran un patrón característico muy similar al que presentan en la fase sintomática. La presencia de este patrón predice el desarrollo de la EP con una elevada sensibilidad del 87%, especificidad del 72% (hazard ratio: 7,42, IC 95: 2,6-21,4)72 (NE-II).
No obstante, los criterios actuales de diagnóstico clínico de EP no incluyen la PET-FDG entre las pruebas de soporte. Esto ha motivado el desarrollo de diferentes estudios, entre los que destaca el metaanálisis realizado sobre 2323 pacientes con EP y 1767 sujetos control con estudios de imagen de RM estructural, secuencias DTI y PET-FDG. En este estudio se pone de manifiesto la superioridad de la PET FDG frente a las otras técnicas en la identificación de un patrón metabólico consistente en la EP73 (NE-I).
Temblor esencial y parkinsonismos secundarios
En los parkinsonismos no degenerativos, la imagen dopaminérgica presináptica permanece intacta y, por lo tanto, permite el diagnóstico diferencial con los parkinsonismos degenerativos. En los pacientes con un cuadro tremórico de origen incierto, la imagen dopaminérgica presináptica permite diferenciar aquellos con EP (denervación generalmente asimétrica con gradiente rostro-caudal) de los que padecen un temblor esencial (sin evidencia de denervación)74 (NE-I). Probablemente una de las aplicaciones más relevantes de la imagen dopaminérgica presináptica en la práctica clínica es el diagnóstico diferencial entre la EP y el parkinsonismo inducido por fármacos. El parkinsonismo farmacológico es la segunda causa de parkinsonismo en pacientes ancianos y la lista de medicamentos involucrados es muy amplia. Las técnicas de imagen de la vía dopaminérgica presináptica no muestran alteraciones de la vía nigroestriatal en más del 90% de los pacientes con parkinsonismo farmacológico, mostrando una sensibilidad y especificidad por encima del 90%75 (NE-I).
En la evaluación del parkinsonismo de origen vascular es importante realizar una fusión entre las imágenes de SPECT o PET con las estructurales de TC o RM. De esta manera se puede evaluar con precisión la colocalización de las alteraciones vasculares (microinfartos o dilataciones de espacios vasculares) con los déficits de captación focales en las imágenes de actividad dopaminérgica presináptica64. Por tanto, los patrones pueden ser muy diversos, pero en general no se aprecia una denervación dopaminérigica presináptica en el parkinsonismo vascular. En un estudio diseñado para definir la precisión de la SPECT con 123I-FP-CIT en el parkinsonismo vascular se describe una sensibilidad del 83,7% y una especificidad del 99,4%76 (NE-III).
Parkinsonismos atípicos de origen degenerativo
La imagen dopaminérgica presináptica resulta muy útil para demostrar el carácter neurodegenerativo del cuadro parkinsoniano. Se han descrito patrones diferentes relacionados con entidades concretas, como por ejemplo la denervación asimétrica con gradiente rostro-caudal en la EP, o la denervación bilateral y homogénea (mayor afectación de caudado) en la PSP (Tabla V). Sin embargo, la imagen dopaminérgica presináptica tanto mediante SPECT 123I-FP CIT como PET con 18F-FDOPA tienen un valor muy limitado para discriminar entre los parkinsonismos degenerativos (Tabla V)61,62 (NE-II).
Imagen dopaminérgica postsináptica
La imagen dopaminérgica postsináptica (SPECT con 123I-iodobenzamida (IBZM) o PET con 11C-raclopride), en general no muestra alteraciones en los pacientes con diagnóstico de EP hasta estadios avanzados de la enfermedad Tabla IV. Esta técnica fue considerada de gran utilidad en el diagnóstico diferencial entre EP y los parkinsonismos atípicos, aunque en los estudios de precisión diagnóstica tan solo se alcanza una sensibilidad de entre el 60-80%, con una tasa elevada de falsos negativos77 (NE-II). La SPECT 123I-IBZM resulta inespecífica en la AMS y se solapa con la PSP y la DCB (Tabla IV). En este sentido, la PET 18FDG ha demostrado ser superior a la SPECT 123I-IBZM en el diagnóstico diferencial de los parkinsonismos atípicos78 (NE-III).
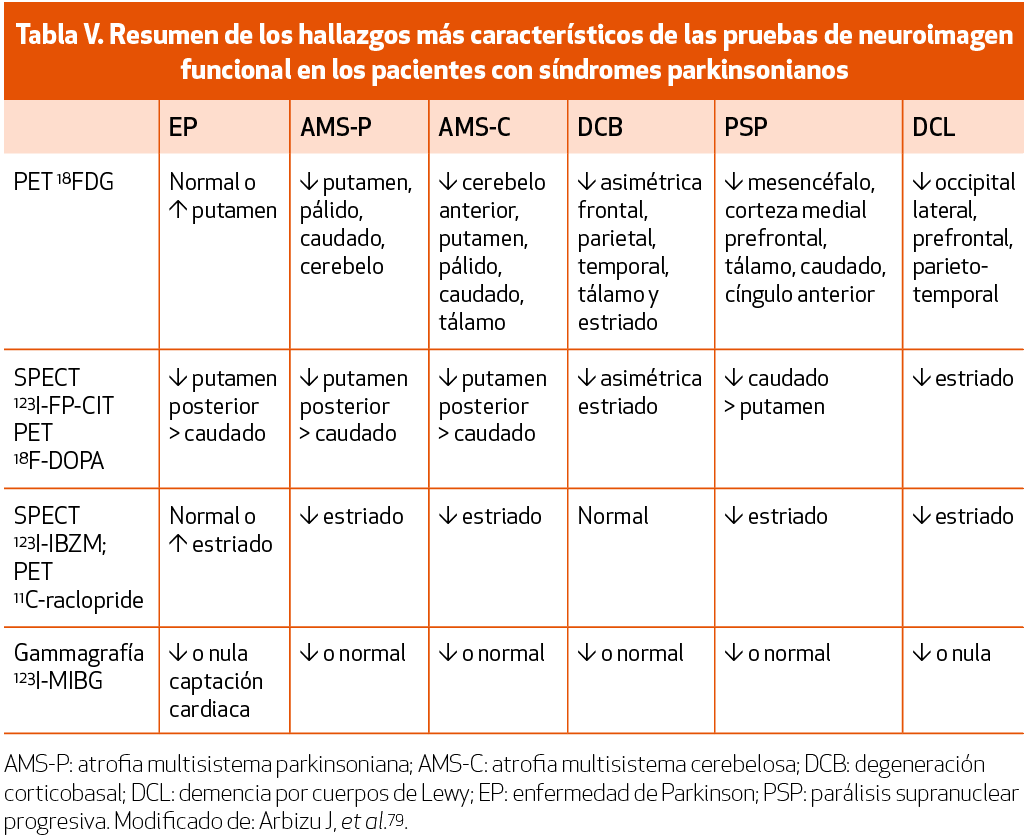
Imagen de la actividad neuronal sináptica neuronal con PET 18F-FDG
Se ha propuesto en el diagnóstico diferencial de los parkinsonismos neurodegenerativos por la elevada sensibilidad y especificidad (superior al 90% en los metaanálisis) (Tabla V, Figura 9)79,80 (NE-I). El patrón más característico es el de la PSP, y consiste en un hipometabolismo en la corteza frontal y frontoinsular, en el mesencéfalo, ganglios basales incluido caudado, tálamo, e hipermetabolismo en el cerebelo y cortezas sensoriomotoras81 (NE-III). Las variantes de PSP comparten este patrón con mayor o menor extensión, aunque la afectación resulta ser más asimétrica en la PSP variante parkinsoniana. La precisión diagnóstica de este patrón de PET 18F-FDG es muy elevada, con una sensibilidad de 80-88%, tanto para diferenciar entre pacientes con PSP y controles como entre PSP y EP, con una especificidad varía entre 90% (PSP respecto a EP) y 97% (PSP respecto a controles)78,81,82 (NE-II). El estudio de imagen PET con 18F-FDG está incluido dentro de los criterios actuales de diagnóstico clínico de PSP como soporte.
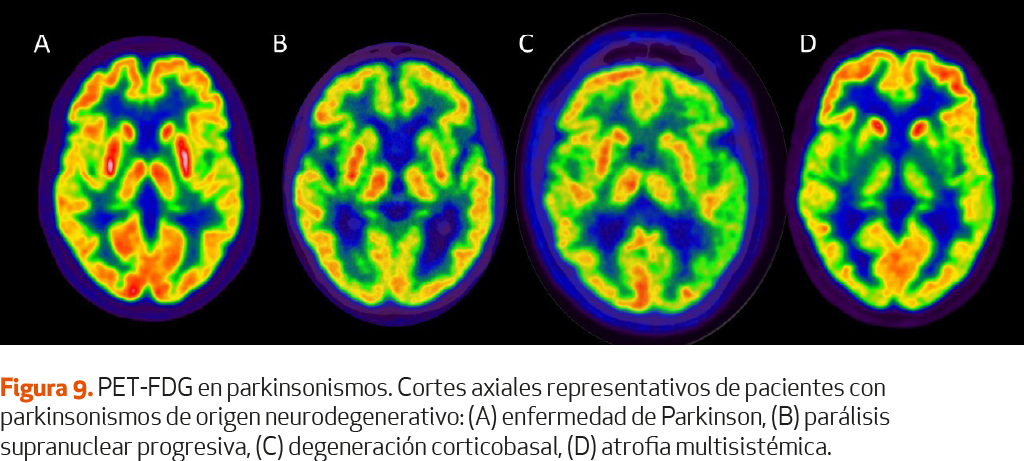
El patrón de hipometabolismo en pacientes con síndrome corticobasal difiere dependiendo de la etiología del mismo83 (NE-II). Así, los pacientes con degeneración corticobasal muestran un hipometabolismo frontoparietal marcadamente asimétrico con afectación de la corteza motora, ganglios basales y tálamo. Dicho patrón alcanza una especificidad el 92%, aunque se solapa con la PSP en un 24% de los casos84 (NE-III). En los estudios de imagen dopaminérgica presináptica se observa una denervación asimétrica a nivel del estriado lentamente progresiva, precedida en meses o años por los déficits de metabolismo en la PET con 18F-FDG85,86(NE-III).
En los pacientes con AMS, las alteraciones en PET 18FDG difieren entre la variante parkinsoniana (hipometabolismo de estriado con gradiente rostro-caudal generalmente asimétrico, contralateral al hemicuerpo clínicamente más afecto), de la cerebelosa (hipometabolismo cerebeloso bilateral y de protuberancia con afectación variable a nivel cortical). No obstante, en la práctica clínica se presentan con frecuencia patrones mixtos de combinación de ambos87 (NE-III). La presencia de un patrón AMS parkinsoniana (AMS-P) tiene una sensibilidad cercana al 95% y una especificidad del 100%. El patrón de la AMS cerebelosa permite el diagnóstico diferencial con las ataxias espinocerebelosas y otras enfermedades que cursan con ataxia y síntomas rígido-acinéticos. El valor predictivo positivo para la AMS-P es del 88% en los primeros 2 años de enfermedad y del 100% a los 5 años82, 88 (NE-III).
A diferencia de la EP, la inervación cardiaca posganglionar del sistema nervioso autónomo está preservada en la AMS, lo que facilitaría la diferenciación entre estas dos entidades. La mayoría de los parkinsonismos atípicos muestran una 123I-MIBG sin alteraciones significativas, aunque puede ser patológica hasta en un 30% de los casos (especialmente en la AMS-P). En un estudio prospectivo la 123I-MIBG mostró una precisión diagnóstica limitada del 73% (sensibilidad del 88%; especificidad del 65%; valor predictivo positivo [VPP] del 58%; valor predictivo negativo [VPN] del 91%88 (NE-III).

Bibliografía
52. Morbelli S, Esposito G, Arbizu J, et al. EANM practice guideline/SNMMI procedure standard for dopaminergic imaging in Parkinsonian syndromes 1.0. Eur J Nucl Med Mol Imaging. 2020 Jul;47(8):1885-1912.
53. Heiss WD, Hilker R. The sensitivity of 18-fluorodopa positron emission tomography and magnetic resonance imaging in Parkinson’s disease. Eur J Neurol. 2004;11(1):5-12.
54. Jakobson Mo S, Axelsson J, Jonasson L, et al. Dopamine transporter imaging with [18F] FE-PE2I PET and [123I]FP-CIT SPECT-a clinical comparison. EJNMMI Res. 2018;8(1):100.
55. Attwell D, Laughlin SB. An energy budget for signaling in the grey matter of the brain. J Cereb Blood Flow Metab. 2001;21(10):1133-45.
56. Leenders KL, Salmon EP, Tyrrell P, et al. The nigrostriatal dopaminergic system assessed in vivo by positron emission tomography in healthy volunteer subjects and patients with Parkinson’s disease. Arch Neurol. 1990;47(12):1290-8.
57. Snow BJ, Tooyama I, McGeer EG, et al. Human positron emission tomographic [18F] fluorodopa studies correlate with dopamine cell counts and levels. Ann Neurol. 1993;34(3):324-30.
58. Vingerhoets FJ, Schulzer M, Calne DB, et al. Which clinical sign of Parkinson’s disease best reflects the nigrostriatal lesion? Ann Neurol. 1997;41(1):58-64.
59. Im JH, Chung SJ, Kim JS, et al. Differential patterns of dopamine transporter loss in the basal ganglia of progressive supranuclear palsy and Parkinson’s disease: analysis with [(123) I]IPT single photon emission computed tomography. J Neurol Sci. 2006;244(1-2):103-9.
60. Suwijn SR, van Boheemen CJM, de Haan RJ, et al. The diagnostic accuracy of dopamine transporter SPECT imaging to detect nigrostriatal cell loss in patients with Parkinson’s disease or clinically uncertain parkinsonism: A systematic review. EJNMMI Res. 2015;5(1):1-8.
61. Ba F, Martin WR. Dopamine transporter imaging as a diagnostic tool for parkinsonism and related disorders in clinical practice. Parkinsonism Relat Disord. 2015 Feb;21(2):87-94.
62. Puñal-Riobóo J, Serena-Puig A, Varela-Lema L, et al. Clinical utility of (18)F-DOPA-PET in movement disorders. A systematic review. Rev Esp Med Nucl. 2009 May-Jun;28(3):106-13.
63. Dhawan V, Niethammer MH, Lesser ML, et al. Prospective F-18 FDOPA PET Imaging Study in Human PD. Nucl Med Mol Imaging. 2022 Jun;56(3):147-157.
64. Michler E, Kaiser D, Eleftheriadou K, et al. Comparison of 6-[18F]FDOPA PET with Nigrosome 1 detection in patients with parkinsonism. EJNMMI Res. 2021;11(1):16.
65. Marshall VL, Reininger CB, Marquardt M, et al. Parkinson’s disease is overdiagnosed clinically at baseline in diagnostically uncertain cases: a 3-year European multicenter study with repeat [123I]FP-CIT SPECT. Mov Disord. 2009;24(4):500-8.
66. Rinne OJ, Nurmi E, Ruottinen HM, et al. [(18)F]FDOPA and [(18)F]CFT are both sensitive PET markers to detect presynaptic dopaminergic hypofunction in early Parkinson’s disease. Synapse. 2001;40(3):193-200.
67. Iranzo A, Santamaria J, Valldeoriola F, et al. Dopamine transporter imaging deficit predicts early transition to synucleinopathy in idiopathic rapid eye movement sleep behavior disorder. Ann Neurol. 2017;82(3):419-428.
68. Treglia G, Stefanelli A, Cason E, et al. Diagnostic performance of iodine-123-metaiodobenzylguanidine scintigraphy in differential diagnosis between Parkinson’s disease and multiple-system atrophy: A systematic review and a meta-analysis. Clin. Neurol. Neurosurg. 2011;113(10):823-829.
69. Skowronek C, Zange L, Lipp A. Cardiac 123I-MIBG Scintigraphy in Neurodegenerative Parkinson Syndromes: Performance and Pitfalls in Clinical Practice. Front Neurol. 2019;10:152.
70. Horsager J, Borghammer P. Brain-first vs. body-first Parkinson’s disease: An update on recent evidence. Parkinsonism Relat Disord. 2024;122:106101
71. Meles SK, Renken RJ, Pagani M, et al. Abnormal pattern of brain glucose metabolism in Parkinson’s disease: replication in three European cohorts. Eur J Nucl Med Mol. Imaging 2020;47(2):437-450.
72. Mattioli P, Orso B, Liguori C, et al. Derivation and Validation of a Phenoconversion-Related Pattern in Idiopathic Rapid Eye Movement Behavior Disorder. Mov Disord. 2023;38(1):57-67.
73. Albrecht F, Ballarini T, Neumann J, et al. FDG-PET hypometabolism is more sensitive than MRI atrophy in Parkinson’s disease: a whole-brain multimodal imaging meta-analysis. Neuroimage Clin. 2019;21:101594.
74. Benamer HTS, Patterson J, Grosset DG, et al. Accurate differentiation of parkinsonism and essential tremor using visual assessment of [123I]-FP-CIT SPECT imaging: The [123I]-FP-CIT study group. Mov Disord. 2000;15(3):503-510.
75. Rissardo JP, Caprara ALF. Neuroimaging Techniques in Differentiating Parkinson’s Disease from Drug-Induced Parkinsonism: A Comprehensive Review. Clin Pract. 2023;13(6):1427-1448.
76. Benítez-Rivero S, Marín-Oyaga VA, García-Solís D, et al. Clinical features and 123I-FPCIT SPECT imaging in vascular parkinsonism and Parkinson’s disease. J Neurol Neurosurg Psychiatry. 2013;84(2):122-9.
77. Vlaar AM, de Nijs T, Kessels AG, et al. Diagnostic value of 123I-ioflupane and 123I-iodobenzamide SPECT scans in 248 patients with parkinsonian syndromes. Eur Neurol. 2008;59(5):258-66.
78. Hellwig S, Amtage F, Kreft A, et al. [(1)(8)F]FDG-PET is superior to [(1)(2)(3)I]IBZMSPECT for the differential diagnosis of parkinsonism. Neurology. 2012;79(13):1314-22.
79. Arbizu J, Luquin MR, Abella J, et al. Functional neuroimaging in the diagnosis of patients with Parkinsonism: Update and recommendations for clinical use. Rev Esp Med Nucl Imagen Mol. 2014;33(4):215-26.
80. Meyer PT, Frings L, Rücker G, et al. 18F-FDG PET in Parkinsonism: Differential Diagnosis and Evaluation of Cognitive Impairment. J Nucl Med. 2017;58(12):1888-1898.
81. Martí-Andrés G, van Bommel L, Meles SK, et al. Multicenter Validation of Metabolic Abnormalities Related to PSP According to the MDS-PSP Criteria. Mov Disord. 2020;35(11):2009-2018.
82. Tang CC, Poston KL, Eckert T, et al. Differential diagnosis of parkinsonism: a metabolic imaging study using pattern analysis. Lancet Neurol. 2010;9(2):149-58.
83. Pardini M, Huey ED, Spina S, et al. FDG-PET patterns associated with underlying pathology in corticobasal syndrome. Neurology. 2019;92(10):e1121-e1135.
84. Niethammer M, Tang CC, Feigin A, et al. A disease-specific metabolic brain network associated with corticobasal degeneration. Brain. 2014;137(Pt 11):3036-46.
85. Pirker S, Perju-Dumbrava L, Kovacs GG, et al. Progressive Dopamine Transporter Binding Loss in Autopsy-Confirmed Corticobasal Degeneration. J Parkinsons Dis. 2015;5(4):907-12.
86. Ceravolo R, Rossi C, Cilia R, et al. Evidence of delayed nigrostriatal dysfunction in corticobasal syndrome: a SPECT follow-up study. Parkinsonism Relat Disord. 2013;19(5):557-9.
87. Grimaldi S, Boucekine M, Witjas T, et al. Multiple System Atrophy: Phenotypic spectrum approach coupled with brain 18-FDG PET. Parkinsonism Relat Disord. 2019;67:3-9.
88. Südmeyer M, Antke C, Zizek T, et al. Diagnostic accuracy of combined FP-CIT, IBZM, and MIBG scintigraphy in the differential diagnosis of degenerative parkinsonism: a multidimensional statistical approach. J Nucl Med. 2011;52(5):733-40.
Han pasado más de 25 años desde la descripción de la primera mutación en el gen α-sinucleína (SNCA) asociada a la EP. Desde entonces se han identificado mutaciones en más de 20 genes distintos asociados a la EP. De manera global, estas mutaciones podrían explicar cerca del 30 % de las formas familiares de EP y el 3-5 % de las formas esporádicas. El sistema de locus asignados a símbolos (DYT, PARK, etc.) utilizado hasta recientemente se estableció originalmente para especificar regiones cromosómicas que habían sido ligadas a un trastorno familiar, aunque el gen fuera desconocido. Este sistema, más fácil de recordar, se aceptó por los clínicos, pero el avance genético planteó problemas como relaciones inconsistentes entre los miembros afectos y el fenotipo de los trastornos de movimiento, la existencia de más de un símbolo asignado para el mismo trastorno o incluso el hecho de que no se hayan confirmado asociaciones entre un gen o locus y un trastorno del movimiento. En la actualidad se han asignado 23 genes y locus al acrónimo PARK. En los casos previamente denominados como PARK 3, 5, 11, 13, 18 y 21, la relación no está confirmada. Además, las tres entidades previamente conocidas como PARK 10, 12 y 16 han pasado a la categoría de factor de riesgo. Finalmente, el PARK 1 y el PARK 4 se refieren al gen SNCA y son idénticos. Considerando los avances habidos en genética, que justifican un posible componente hereditario en esta enfermedad, el Task Force on Genetic Nomenclature in Movement Disorders de la MSD publicó en 2016 unas recomendaciones en las que se revisaba la nomenclatura de la genética de los trastornos de movimiento1 (NE-III) y se consideraban las condiciones necesarias para garantizar la evidencia imprescindible al asociar una alteración genética a una enfermedad determinada. Basándose en estas recomendaciones, el MSD Task Force presentó una nueva lista de parkinsonismos hereditarios, que ha sido actualizada recientemente2 (NE-III) (Tabla I).
Bibliografía
1. Marras C, Lang A, Van de Warrenburg BP, et al. Nomenclature of Genetic Movement Disorders: Recommendations of the International Parkinson and Movement Disorder Society Task Force. Mov Disord. 2016;31:436-57.
2. Lange LM, González-Latapi P, Rajalingam R, et al; on behalf of the Task Force on Genetic Nomenclature in Movement Disorders. Nomenclature of Genetic Movement Disorders: Recommendations of the International Parkinson and Movement Disorder Society Task Force - An Update. Mov Disord. 2022 May;37(5):905-935.
Las recomendaciones del grupo de trabajo son las siguientes:
-
Incluir solo aquellos genes donde es posible realizar una prueba genética diagnóstica.
-
Asignar un prefijo al fenotipo que lo relacione con el mismo. Por ejemplo, cuando el parkinsonismo es lo más llamativo de la clínica, se le asignaría el prefijo PARK, pero si es la distonía el síntoma predominante, se asignaría el prefijo DYT/PARK, como por ejemplo en el caso de DYT/PARK-ATP1A3.
-
Reemplazar el número del sufijo por el nombre del Por ejemplo, no se empleará en lo sucesivo PARK8, sino PARK-LRRK2 (Tabla I).
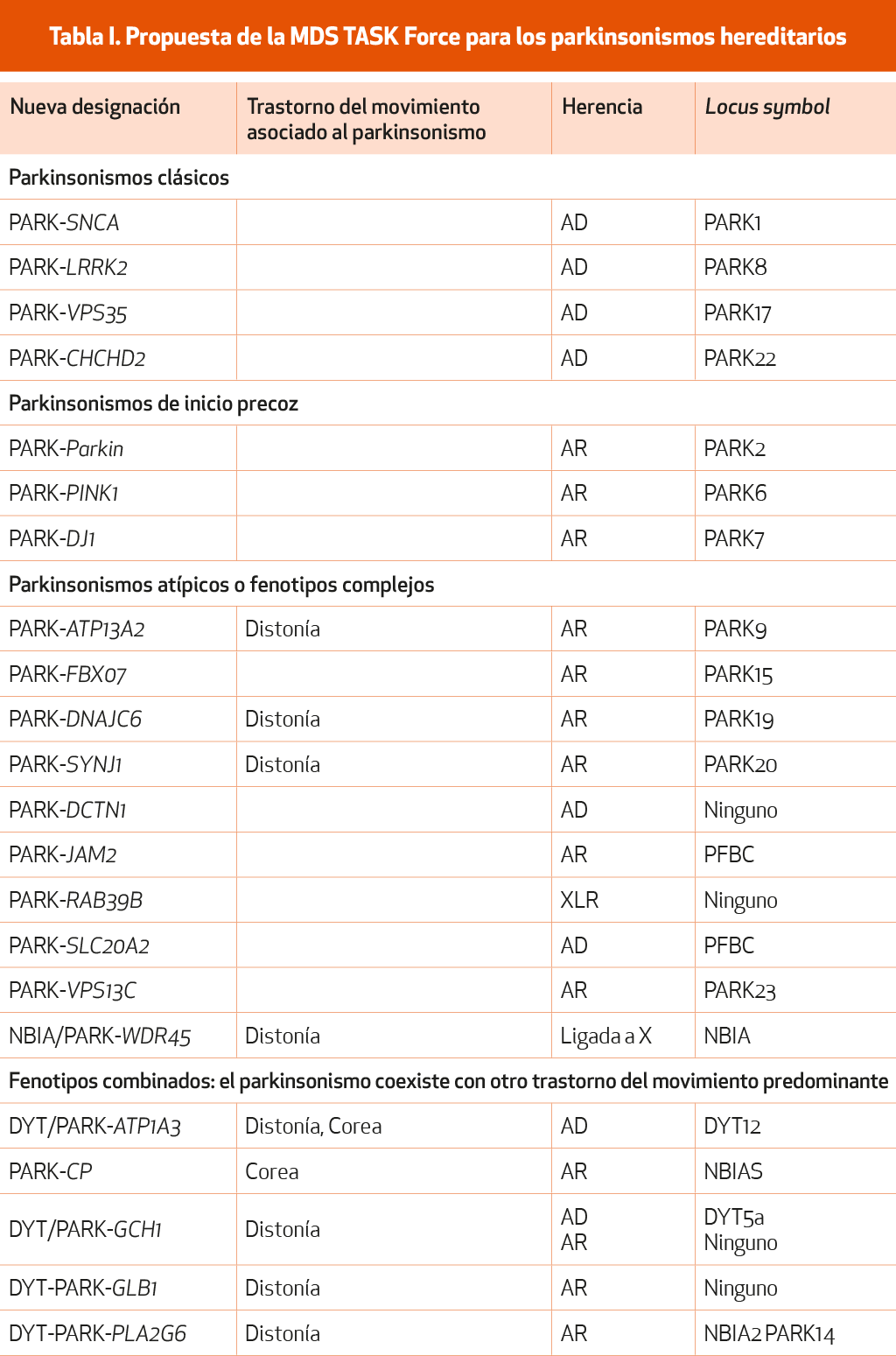
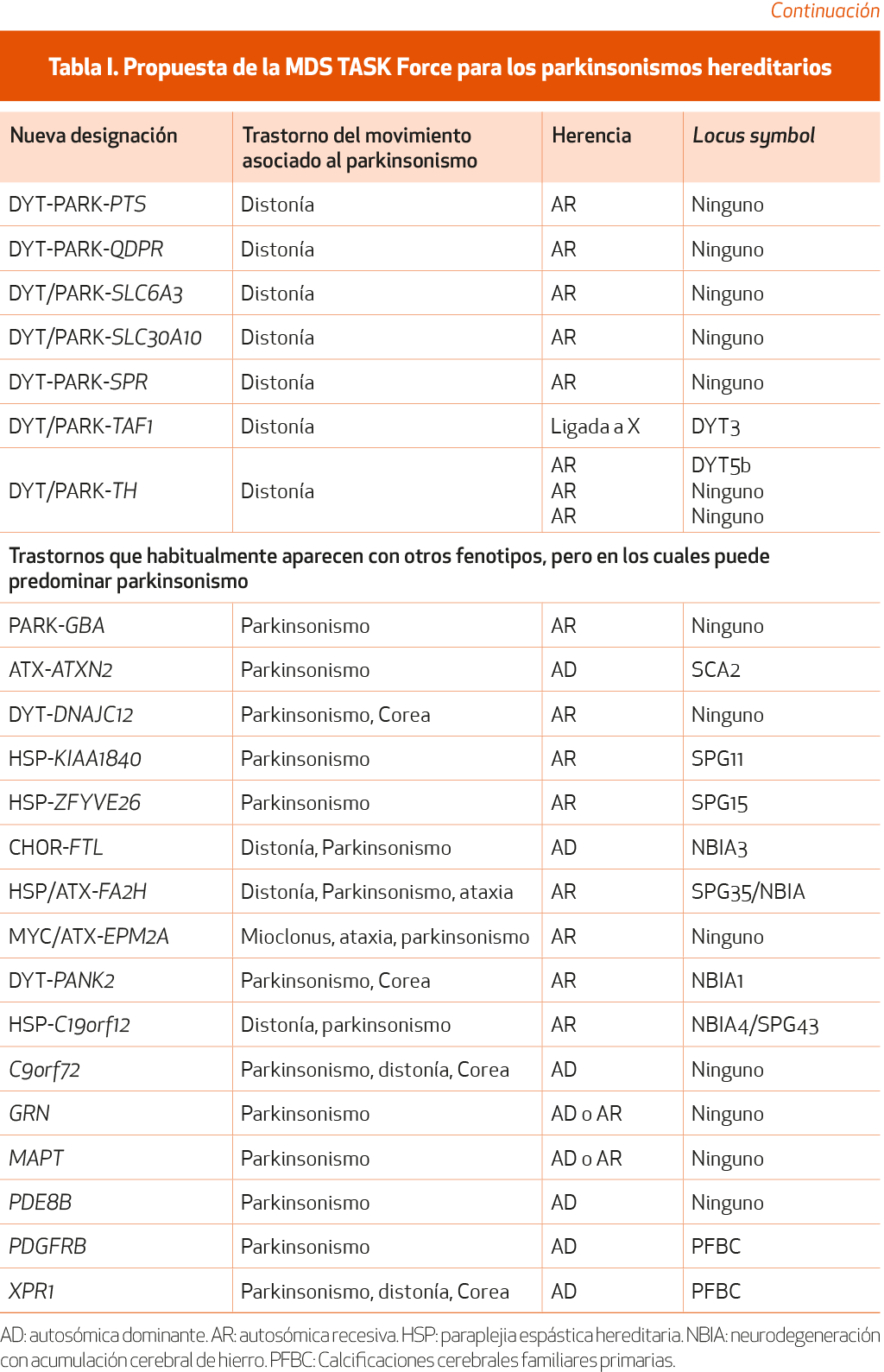
-
Separar las listas de los genes causantes de enfermedad de aquellos genes que constituyen un factor de riesgo. Sería el caso de las mutaciones en heterocigosis en el gen de la glucocerebrosidasa (GBA), que no se consideran una causa monogénica de parkinsonismo porque en sí mismas solo suponen un factor de riesgo para padecer EP, especialmente entre los judíos askenazíes, y que aparece en algunos casos con baja penetrancia.
-
Elegir el umbral de evidencia antes de asignar un locus symbol. El cumplimiento de este punto conlleva el nivel de evidencia de la causalidad en una EP de origen hereditario, y exige:
-
Presencia de las variantes patogénicas en múltiples individuos afectados no relacionados.
-
Evidencia para la segregación o asociación estadística de una variante con la enfermedad.
-
La variante debe conservarse a través de diferentes especies.
-
La variante debería alterar el efecto bioquímico normal de un producto génico y demostrarlo en pruebas funcionales en el tejido humano ya sea celular, en modelos animales, anomalías bioquímicas o histológicas.
-
Por tanto, la irrupción de la genética nos ha permitido tener una visión distinta de la enfermedad y aproximarnos a nuevos mecanismos patogénicos. Se ha demostrado que numerosos genes causantes de las formas mendelianas de EP, además de justificar el componente familiar de un número importante de casos, podrían tener un rol principal también en la EP esporádica. Este es el caso de algunas mutaciones de las formas monogénicas (por ejemplo, mutaciones en LRRK2) o de los alelos de susceptibilidad (por ejemplo, mutaciones en el gen GBA). Los resultados del último metaanálisis de estudios de asociación genómica han identificado más de 90 loci asociados a un mayor riesgo de desarrollar EP3 (NE-III). Se podría hablar, por tanto, de un espectro de la enfermedad que va desde mutaciones altamente patógenas, pasando por variantes de riesgo moderado, hasta múltiples loci que confieren pequeños incrementos del riesgo de sufrir la enfermedad.
A pesar de que la contribución de la genética a la EP podría ser mayor de lo pensado, seguimos sin conocer la etiopatogenia última de la EP, una enfermedad con un origen probablemente multifactorial y una compleja interrelación de factores genéticos y ambientales, interacciones gen-ambiente (influencia de agentes ambientales en la expresión génica) y su impacto directo en el desarrollo y envejecimiento del cerebro.
Hasta la fecha no existen directrices formalmente aceptadas por las principales sociedades científicas acerca del uso de los test genéticos en el diagnóstico de la EP, aunque, no obstante, se va perfilando una forma habitual de actuación, basada principalmente en las recomendaciones de los grupos de expertos4,5 (NE-IV). La tendencia general es hacia un uso creciente de dichos test genéticos, fruto por un lado de un mejor acceso a los mismos y por otro de la llegada de los primeros ensayos clínicos con terapias dirigidas a subtipos genéticos específicos (como LRRK2 o GBA).
Bibliografía
3. Nalls MA, Blauwendraat C, Vallerga CL, et al. Identification of novel risk loci, causal insights, and heritable risk for Parkinson’s disease: a meta-analysis of genome-wide association studies. Lancet Neurol. 2019;18:1091-1102.
4. Pal G, Cook L, Schulze J, et al. Genetic Testing in Parkinson’s Disease. Mov Disord. 2023 Aug;38(8):1384-1396.
5. Jesús Mastre S, Santos García D. Recomendaciones para el abordaje de estudios genéticos en trastornos del movimiento, ataxias y paraparesias. Madrid: SEN; 2023.
En la práctica clínica habitual, el empleo del estudio genético con fines diagnósticos está limitado por la reducida proporción de casos de EP en los que se puede encontrar una mutación genética causal (menos del 10-30%, según las poblaciones). Desde una perspectiva clínica, la ausencia de terapias modificadoras de la enfermedad y la penetrancia variable de la mayoría de las variantes conocidas limitan la utilidad de las pruebas de diagnóstico genético para la EP.
En la actualidad, estos estudios se realizan clínicamente en entornos concretos, seleccionando caso a caso. Desde una perspectiva de investigación, el estudio genético se realiza para ayudar en la tipificación, y ofrecer la oportunidad de participar en ensayos clínicos basados en su estatus genético. En este sentido, es probable que en los próximos años vean la luz los primeros fármacos diseñados para formas monogénicas (LRRK2) o variantes de riesgo (GBA), con un potencial beneficio tanto para las formas genéticas como esporádicas de EP.
Las pruebas genéticas pueden proporcionar información útil para los pacientes y sus cuidadores sobre la propia enfermedad, ayudando en la incertidumbre del pronóstico y, en algunos casos, para abordar una planificación reproductiva. Cuando se analiza la opinión de los pacientes, los que han tenido una enfermedad de inicio temprano están de acuerdo en realizarse el estudio genético, como una forma de entender mejor su enfermedad y de tomar decisiones para su futuro4 (NE-IV).
Al propio médico conocer el estatus genético del paciente le puede ofrecer una información adicional que posibilita una mejor orientación terapéutica, derivada de la seguridad del diagnóstico, y valorar la utilidad o no de algunas opciones de tratamiento, como se ha planteado en la cirugía mediante estimulación cerebral profunda en pacientes con variantes en el gen GBA, donde los resultados esperables son peores6.
Sin considerar los posibles fármacos específicos actualmente en fase de ensayo, con una perspectiva de coste-eficacia y en el ámbito puramente asistencial, las pruebas genéticas podrían quedar restringidas a aquellas poblaciones en las que es más probable identificar pacientes con EP asociada a una determinada mutación, teniendo en cuenta consideraciones como la edad, el patrón de herencia o los factores raciales (Tablas II y III)7 (NE-III). No obstante, conviene recordar que un estudio negativo no excluye una causa genética, en tanto en cuanto muchas mutaciones genéticas aún se desconocen o solo se han realizado en los genotipos más frecuentes8 (NE-IV).
Tanto en un ámbito asistencial como de investigación, el estudio genético se debe realizar en centros especializados. Se debe informar al paciente y sus familiares con detalle, obtener un consentimiento informado firmado y realizar un asesoramiento genético antes de realizar la prueba y tras el resultado de la misma. La confidencialidad del resultado debe garantizarse, y en todo caso siempre debemos ponderar detenidamente el beneficio que la prueba pueda proporcionar al paciente, más allá de satisfacer la curiosidad del médico que lo trata.
Las probabilidades de identificar mutaciones genéticas causales en pacientes con EP aumentan en dos circunstancias:
-
EP de inicio precoz (menores de 45 años) y cuando existen antecedentes familiares de la enfermedad8 (NE-IV). En los casos esporádicos de inicio precoz, cuanto más temprano es este inicio, más probable es la existencia de una causa genética, más aún si existen casos familiares con un patrón de herencia recesivo. En este contexto las mutaciones más frecuentes son las de los genes recesivos PARK-Parkin y, con una frecuencia menor, PARK-PINK1 y PARK-DJ1. El 15% de los casos de EP menores de 45 años tienen mutaciones en PARK-Parkin. Entre los casos familiares con herencia recesiva la frecuencia de mutaciones en PARK-Parkin alcanza el 50%.
-
EP de inicio tardío (mayores de 45 años). En estos casos estará indicada la realización de una prueba genética solo cuando exista una historia familiar de EP con un patrón de herencia autosómica dominante. En estos casos estaría indicado estudiar las mutaciones causales del gen LRRK2, particularmente la G2019S. En determinadas poblaciones en las que se conoce la existencia de una elevada frecuencia de mutaciones en el gen LRRK2, como sucede en el norte de España, y especialmente en el País Vasco (mutación R1441G), en poblaciones árabes del norte de África y en judíos askenazíes (mutación G2019S). En las formas de inicio tardío con individuos afectos en múltiples generaciones, una vez descartadas mutaciones en LRRK2, procede estudiar el gen SNCA, aunque sus mutaciones son muy poco frecuentes incluso en este contexto. A la hora de efectuar el consejo genético en los portadores de mutaciones en LRRK2 debe tenerse en cuenta la penetrancia incompleta de algunas de las mutaciones, así como la patogenicidad dudosa de algunas variantes9 (NE-IV).
Con respecto al tipo de estudio, el tamaño de los paneles multigénicos de laboratorios comerciales es muy variable, con paneles que incluyen desde 5 hasta más de 50 genes. Existe, por lo tanto, también la necesidad de consensuar qué genes deben incluirse en un panel multigénico de laboratorio comercial para el estudio genético de EP10 (NE-IV), aunque la tendencia actual se dirige cada vez más a realizar estudios de secuenciación masiva.
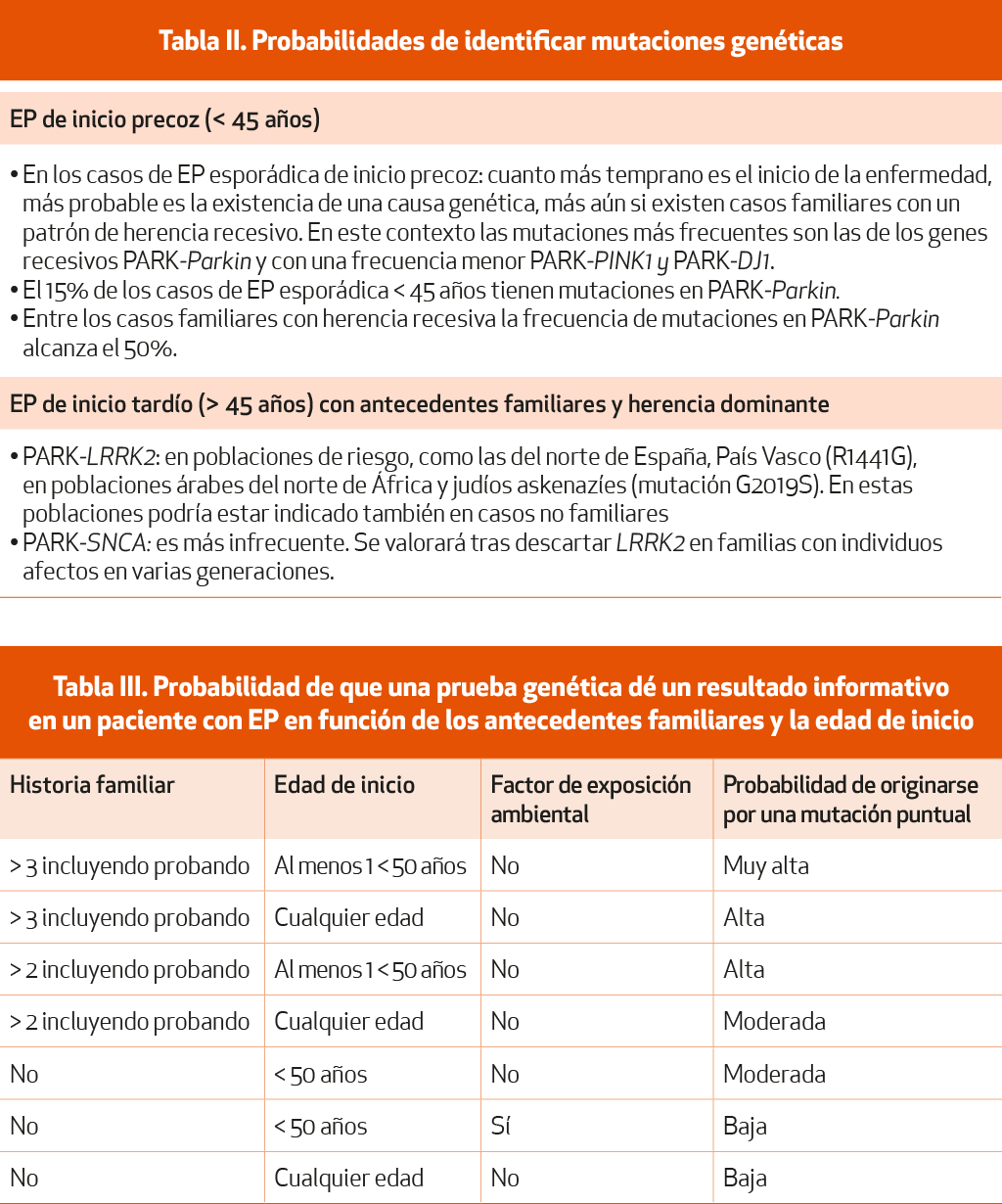
Bibliografía
4. Pal G, Cook L, Schulze J, et al. Genetic Testing in Parkinson’s Disease. Mov Disord. 2023 Aug;38(8):1384-1396.
6. Pal G, Mangone G, Hill EJ, et al. Parkinson disease and subthalamic nucleus deep brain stimulation: cognitive effects in GBA mutation carriers. Ann Neurol. 2022;91(3):424-435.
7. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS recommendations for the diagnosis of Parkinson’s disease. Eur J Neurol. 2013;20:16-34.
8. Jacobs H, Latza U, Vieregge A, et al. Attitudes of young patients with Parkinson’s disease towards possible presymptomatic and prenatal genetic testing. Genet Couns. 2001;12:55-67.
9. Klein C, Schlossmacher MG. The genetics of Parkinson disease: Implications for neurological care. Nat Clin Pract Neurol. 2006;2:136-46.
10. Cook L, Schulze J, Verbrugge J, et al.; ClinGen Parkinson’s Disease Gene Curation Expert Panel and the MDS Task Force for Recommendations for Genetic Testing in Parkinson’s Disease; Clinical Genome Resource (ClinGen) Parkinson’s Disease Gene Curation Expert Panel Authors; Movement Society Disorder (MDS) Task Force on Recommendations for Clinical Genetic Testing in Parkinson’s Disease Authors. The commercial genetic testing landscape for Parkinson’s disease. Parkinsonism Relat Disord. 2021 Nov;92:107-111.
La European Federation of Neurological Societies (EFNS) y MDS establecieron en 2013 una serie de recomendaciones, que se han actualizado posteriormente, según las cuales estaría indicada la realización de estudios genéticos para mutaciones específicas en11 (NE-III, grado de recomendación B):
-
Pacientes con EP típica e historia familiar positiva sugestiva de herencia dominante (gen LRRK2, mutaciones patogénicas).
-
Pacientes con EP esporádica de inicio tardío, solo en poblaciones con una frecuencia conocida elevada de mutaciones patogénicas (LRRK2-R1441G en País Vasco, LRRK2- G2019S y GBA en judíos askenazíes, LRRK2-G2019S en árabes del norte de África).
-
Familias con múltiples individuos afectos en más de una generación, sugestivo de herencia dominante, con edad de inicio precoz o tardía (gen SNCA).
-
EP típica con historia familiar compatible con herencia recesiva, particularmente si la edad de inicio es inferior a 50 años (genes Parkina, PINK1, DJ1).
-
EP esporádica de inicio precoz, particularmente si el inicio es antes de los 40 años y hay signos atípicos como distonía al inicio (genes Parkina, PINK1, DJ1).
La Sociedad Española de Neurología (SEN), viendo la importancia creciente de esta situación publicó en 2023 el manual denominado Recomendaciones para el abordaje de estudios genéticos en trastornos del movimiento, ataxias y paraparesias5, en el que se sintetizan las recomendaciones más actuales tanto de la EFNS como de la MDS para cada caso, teniendo en cuenta principalmente la edad y los antecedentes familiares, y estableciendo una serie de niveles diagnósticos (NE-IV, grado de recomendación D, también denominado RecSEN en el trabajo referido):
-
EP de inicio juvenil (< 21 años) y EP de inicio precoz (edad de inicio 21-45 años) independientemente de la presencia de antecedentes familiares.
− Primer nivel: PRKN.
− Segundo nivel: PINK1 y DJ1.
- Tercer nivel: solo en los casos de EP de inicio muy precoz, si no se han detectado mutaciones en los genes PRKN, PINK1 y DJ1, se debería considerar solicitar el genotipado de los genes ATP13A2, PLA2G6 y FBXO7.
- Cuarto nivel: Panel multigénico/WES.
-
EP de inicio tardío (edad de inicio > 45 años).
− Si tiene antecedentes familiares con un patrón de herencia dominante:
- Primer nivel: se recomienda realizar el estudio de las mutaciones reconocidas como patógenas en el gen LRRK2. En población general debe realizarse el estudio de la mutación G2019S, mientras que en población de ascendencia vasca debe considerarse el estudio de la mutación R1441G.
- Segundo nivel: las mutaciones en SNCA son menos frecuentes, por lo que debe valorarse su estudio tras haber descartado mutaciones en el gen LRRK2 en familias con individuos afectos en varias generaciones.
- Tercer nivel: panel multigénico/WES.
- En judíos askenazíes sin antecedentes familiares también podría estar justificado estudiar las mutaciones G2019S y R1441G, dada su alta prevalencia en esta población.

Bibliografía
5. Jesús Mastre S, Santos García D. Recomendaciones para el abordaje de estudios genéticos en trastornos del movimiento, ataxias y paraparesias. Madrid: SEN; 2023.
11. Buhat DM, Tan EK. Genetic testing of LRRK2 in Parkinson’s disease: is there a clinical role? Parkinsonism Relat Disord 2014;20 Suppl 1:S54-6.
La EP se caracteriza por manifestaciones motoras (temblor, rigidez, bradicinesia, trastornos de la marcha y del equilibrio) y múltiples síntomas no motores (trastornos cognitivos, del estado de ánimo, gastrointestinales, autonómicos, del sueño, etc.). Además, en el curso de la enfermedad pueden surgir diversas complicaciones (discinesias, fluctuaciones, psicosis) como consecuencia de la interrelación entre su progresión y los efectos del tratamiento. Todo ello deteriora gravemente el estado de salud, la autonomía y la calidad de vida del paciente.
Ante una entidad tan compleja como la EP, es necesario contar con instrumentos de evaluación que ayuden a identificar la presencia de algunas manifestaciones o complicaciones, cuantifiquen su gravedad e impacto, documenten la evolución del proceso, valoren el efecto de las intervenciones terapéuticas y faciliten el intercambio de información entre clínicos, con otros profesionales y con los propios pacientes y sus familias. Por último, estas evaluaciones pueden suponer la base para la toma de decisiones y la planificación y asignación de recursos en política sanitaria.
Tradicionalmente, la evaluación de la EP se ha centrado en los síntomas motores y en sus consecuencias directas (pérdida de capacidad funcional), así como en los resultados del tratamiento. Algunas de las escalas desarrolladas para estos fines son frecuentemente utilizadas, tales como la clasificación evolutiva de Hoehn y Yahr1 o la escala de Schwab y England (SES)2. Algunos de estos instrumentos carecen de estudios formales de validación de sus propiedades psicométricas3, aunque en los últimos años diversos estudios han paliado, al menos parcialmente, tal carencia.
La necesidad de evaluaciones multidimensionales que incluyan discapacidad, signos motores, síntomas no motores y complicaciones asociadas al tratamiento han propiciado el diseño de escalas como la UPDRS4 y las Scales for Outcomes in Parkinson’s Disease-Motor (SCOPA-M)5.
En las últimas décadas la actividad en este campo se centra en la revisión de escalas ya existentes, como la llevada a cabo por la MDS sobre la UPDRS (MDS-UPDRS)6, en el desarrollo de instrumentos para aspectos específicos de la EP (deterioro cognitivo, conductas relacionadas con control de impulsos, sueño, etc.) y para la detección y evaluación unificada de síntomas no motores, así como en las revisiones sistemáticas de estos métodos de evaluación. Diversos grupos de trabajo de la IPMDS Task Forces, por ejemplo, están llevando a cabo esta tarea desde 2003.
El desarrollo de una escala sigue una metodología que consta de diversas fases: 1) especificación de los objetivos, propósito, formato y modo de aplicación de la escala; 2) selección de los componentes del instrumento (ítems, dominios), el marco temporal, el formato y redacción de las preguntas y respuestas, y el rango de puntuación; 3) estudios piloto; 4) obtención de la versión definitiva de la escala, y 5) estudios de validación.
Validar una escala consiste en comprobar su calidad como instrumento de diagnóstico o medida, aplicando análisis estadísticos de diferentes atributos y siguiendo un conjunto de normas y estándares basados en métodos y teorías científicas de la medida de la salud7. Para ello, el instrumento se pone a prueba en un conjunto amplio y representativo de la población a la que va destinado (muestra) y los datos se analizan para determinar una serie de propiedades: 1) viabilidad (hasta qué punto la medida es utilizable en el contexto previsto); 2) aceptabilidad (se refiere a lo admisible que resulta el instrumento para la población diana y a la apropiada distribución de las puntuaciones de la escala); 3) asunciones escalares (agrupamiento de los ítems en la escala y posibilidad de su suma directa); 4) fiabilidad (hasta qué punto la escala está libre de error aleatorio, es decir, hasta qué punto existe una interrelación entre sus componentes y las puntuaciones son estables); 5) validez (establece si la escala mide realmente aquello para lo que fue diseñada); 6) precisión o sensibilidad (capacidad de la escala para detectar pequeñas diferencias); 7) sensibilidad al cambio (capacidad del instrumento para detectar cambios tras una intervención o a lo largo del tiempo), y 8) interpretabilidad (asignación de un significado fácilmente comprensible a las puntuaciones y a sus cambios). En la Tabla I se presentan las técnicas de análisis más frecuentemente utilizadas para estimar estos atributos, así como los criterios para establecer su calidad.
A la hora de utilizar una escala es necesario tener en cuenta, además, la carga del instrumento (conjunto de tiempo, esfuerzo y requerimientos necesarios para su uso) relacionada con la viabilidad, así como la necesidad de adaptación transcultural, en el caso de que se vaya a utilizar en un contexto cultural o en una población diferente a la original (por ejemplo, en otro país).
A continuación, se describen brevemente las escalas específicamente diseñadas para evaluación de la EP y que son recomendadas por la IPMDS siguiendo los principios de medicina basada en la evidencia que se han detallado de manera específica para este capítulo en el apartado de “Metodología” (Pág. 13). La clasificación de una escala como recomendada depende de que cumpla las siguientes condiciones: 1) que la escala haya sido utilizada en EP; 2) que se haya los desarrolladores originales; 3) que tenga estudios sobre sus propiedades psicométrica que al menos que incluyan fiabilidad, validez y sensibilidad al cambio.
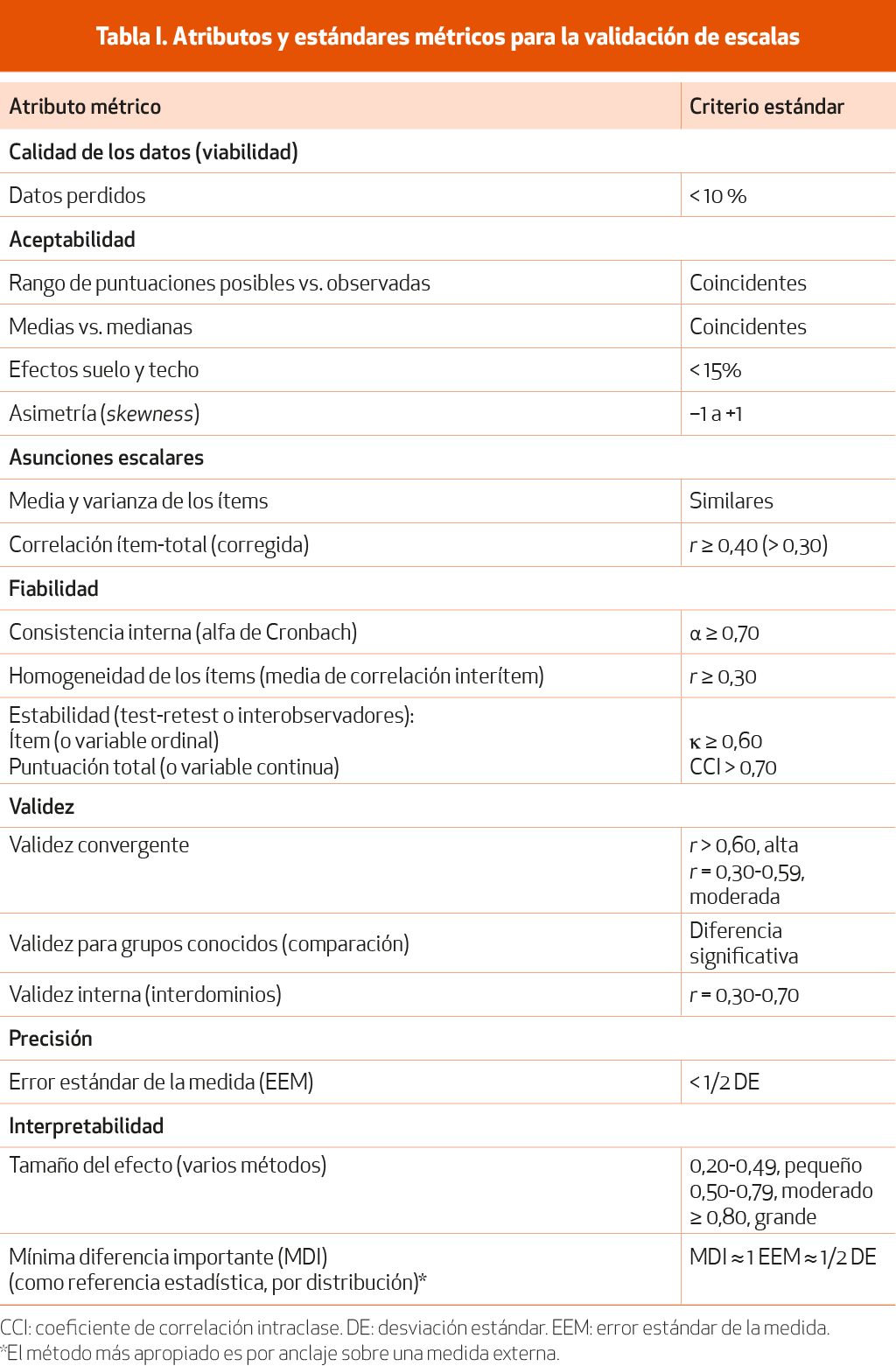
Muchas de estas escalas son propiedad de la IPMDS y su uso requiere permisoi. Otras escalas, que no cumplen las condiciones de recomendación de la IPMDS, que no son específicas de EP o que no cuentan con estudios completos de validación, se muestran en la Tabla II.
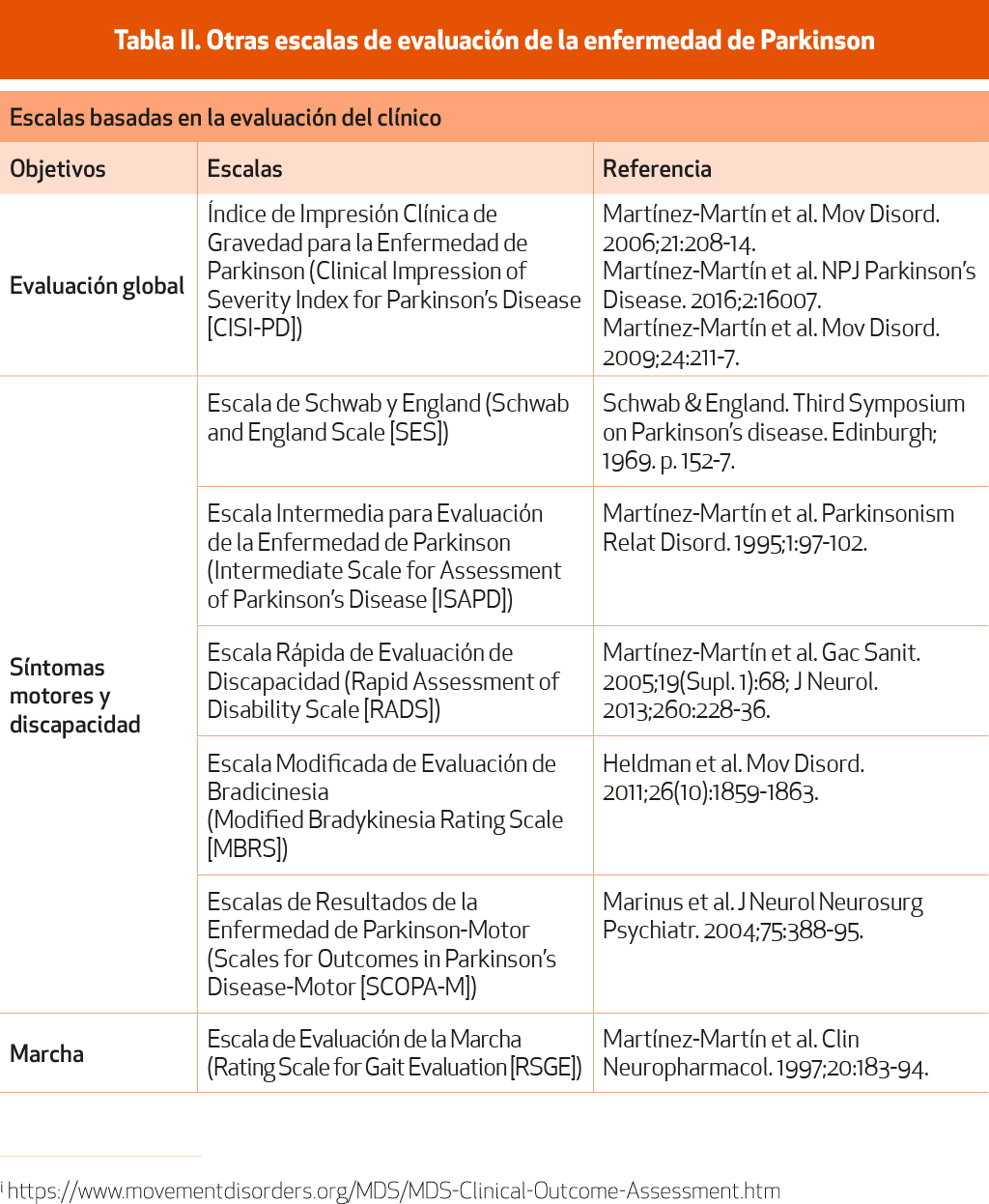
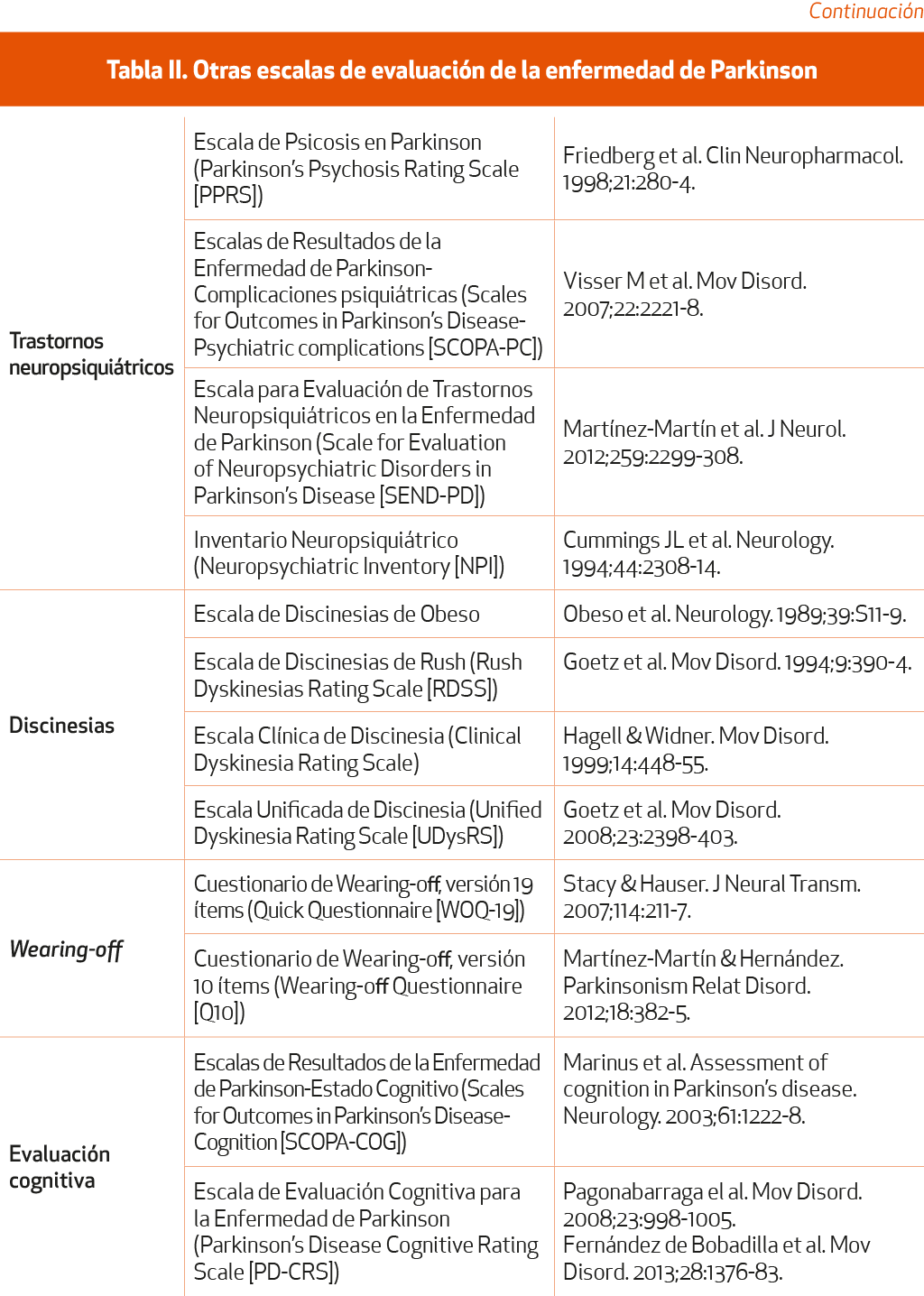
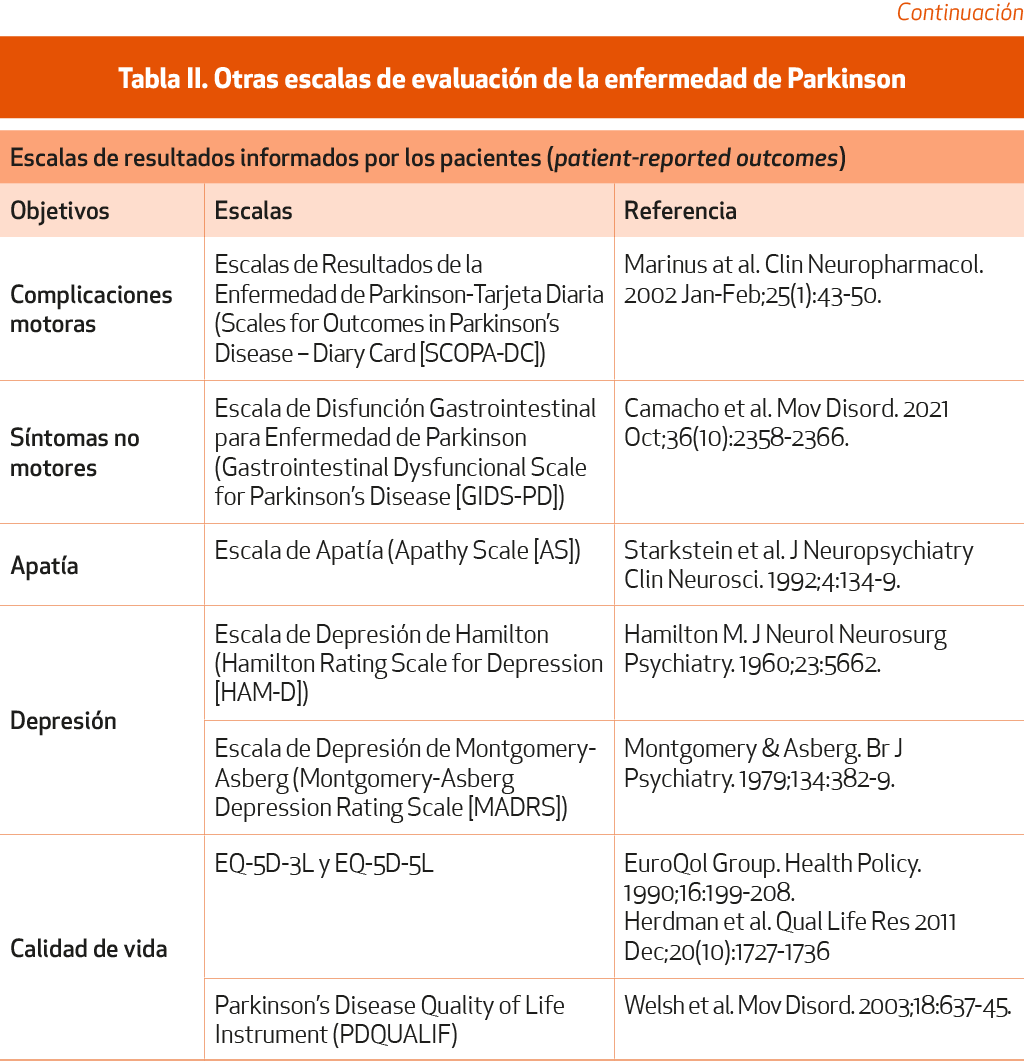
Bibliografía
1. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology. 1967;17(5):427-442.
2. Schwab R, England A. Third Symposium for Parkinson’s Disease. Livingstone; 1969.
3. Ramaker C, Marinus J, Stiggelbout AM, et al. Systematic evaluation of rating scales for impairment and disability in Parkinson’s disease. Mov Disord. 2002;17(5):867-876.
4. Fahn S, Elton R, UPDRS program members. Unified Parkinson’s disease rating scale. En: Fahn S, Marsden C, Goldstein M, et al. (eds.). Recent Developments in Parkinson’s Disease. Vol. 2. Macmillan Healthcare Information; 1987:153-163.
5. Marinus J, Visser M, Stiggelbout AM, et al. A short scale for the assessment of motor impairments and disabilities in Parkinson’s disease: the SPES/SCOPA. J Neurol Neurosurg Psychiatr. 2004;75(3):388-395.
6. Goetz CG, Fahn S, Martínez Martín P, et al. Movement Disorder Society sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS UPDRS): Process, format, and clinimetric testing plan. Mov Disord. 2007;22(1):41-47.
7. Nunnally JC, Bernstein IH. Psychometric Theory. McGraw Hill; 1994.
Escalas multidominio
Escala Unificada de la Enfermedad de Parkinson-Movement Disorder Society (Movement Disorder Society-Unified Parkinson’s Disease Rating Scale [MDS-UPDRS])
La MDS-UPDRS sustituyó a la Escala Unificada de la Enfermedad de Parkinson (UPDRS)4,8 como escala de referencia en investigación y en las agencias reguladoras.
Las limitaciones de la UPDRS, principalmente la falta de instrucciones precisas para los evaluadores, la heterogeneidad de las puntuaciones, el solapamiento y redundancia de algunos ítems, la ausencia de algunos síntomas no motores importantes y el sesgo cultural en la redacción de algunos de los ítems motivaron su revisión y el desarrollo de una nueva versión, la MDS-UPDRS6.
La MDS-UPDRS, propiedad de la MDS, se compone de cuatro secciones: Parte I. Aspectos no motores de las experiencias de la vida diaria (13 ítems: 6 evaluados por el profesional, 7 por el paciente); Parte II. Aspectos motores de las experiencias de la vida diaria (13 ítems autoevaluados por el paciente); Parte III. Exploración motora (18 ítems evaluados por el profesional, que proporcionan 33 puntuaciones al considerar la distribución en diversas regiones corporales); y Parte IV. Complicaciones motoras (2 ítems para discinesias y 4 para fluctuaciones, puntuados por el evaluador)6,.
Todos los ítems tienen instrucciones para una aplicación uniforme, dirigidas al paciente, evaluador o ambos. Cada ítem presenta 5 opciones de puntuación, de 0 (normal) a 4 (intenso, grave). La puntuación total para cada sección se obtiene por la suma de las puntuaciones de los ítems correspondientes, pero no hay una puntuación total de la escala.
La MDS-UPDRS muestra unas propiedades psicométricas satisfactorias. Sus puntuaciones diferencian significativamente entre grupos de edad, duración de la enfermedad y del tratamiento y entre estadios de Hoehn y Yahr. También muestra una adecuada sensibilidad al cambio.
Existe un programa de entrenamiento para obtener la certificación de competencia en el uso de la escalaii y la escala ha sido adaptada transculturalmente y validada en diversos países, incluyendo la versión en español.
Escalas de evaluación global de gravedad de la enfermedad de Parkinson
Clasificación de Hoehn y Yahr
La escala de Hoehn y Yahr fue desarrollada hace más de 50 años para proporcionar una evaluación global del paciente con EP (función motora y progresión de la enfermedad) de manera simple y descriptiva1. La versión original consta de seis niveles (de estadio 0: no hay signos de enfermedad, a estadio 5: confinado en silla de ruedas o encamado si no tiene ayuda).
La escala de de Hoehn y Yahr constituye un estándar de referencia para la validación de otras escalas para EP y puede ser utilizada como anclaje externo para analizar la validez discriminativa, sensibilidad al cambio e interpretabilidad de otras escalas. Sus principales limitaciones se deben a su comportamiento no lineal en la valoración del avance de la enfermedad y a ambigüedades en la definición de los estadios, con mezcla de manifestaciones motoras y discapacidad9. Sus propiedades psicométricas han sido establecidas solo parcial e indirectamente10.
Escalas de evaluación de las manifestaciones no motoras
Escala de Síntomas No Motores (Non-Motor Symptoms Scale [NMSS])
La NMSS es una escala diseñada para evaluar la carga sintomática (frecuencia e intensidad) debida a los síntomas no motores asociados a la EP11. Está formada por 30 ítems, que se agrupan en 9 dominios: cardiovascular, sueño/fatiga, estado de ánimo/apatía, problemas perceptivos/alucinaciones, atención/memoria, tracto gastrointestinal, función urinaria, función sexual y miscelánea. La intensidad del síntoma se puntúa en una escala de 0 (ninguna) a 3 (grave), y su frecuencia de 1 (raramente) a 4 (muy frecuentemente). La puntuación de cada ítem se obtiene multiplicando frecuencia por intensidad y la de los dominios y total por la suma de las puntuaciones de sus respectivos componentes. Se administra mediante entrevista con el paciente o el cuidador y el marco temporal es el último mes.
La NMSS cuenta con excelentes propiedades psicométricas, ha sido traducida y validada en diversos idiomas y está recomendada por la MDS. Facilita la valoración unificada de una amplia variedad de síntomas no motores, incluyendo aquellos que son graves pero infrecuentes y los menos graves pero persistentes, así como el seguimiento de su progresión y su respuesta al tratamiento. Tras la revisión llevada a cabo por un subcomité de la MDS se desarrolló una nueva versión (MDS-NMS).
Escala de Evaluación No-Motora de la MDS (MDS Non-Motor Rating Scale [MDS-NMS])
La MDS-NMS, propiedad de la MDS, surge de la necesidad de mejorar la evaluación de los síntomas no motores en EP, a través de la revisión de la NMSS12. La MDS-NMS evalúa 13 dominios de síntomas motores, tanto relacionados con la enfermedad como con su tratamiento, que agrupan 52 ítems. Los ítems se valoran en términos de frecuencia (0 a 4) y de gravedad (0 a 4), y la puntación de cada ítem resulta de su producto (0 a 16). Además, incluye una subescala de fluctuaciones no motoras que evalúa los cambios provocados por la medicación en 8 dominios. Sus propiedades psicométricas son satisfactorias, con adecuada consistencia interna, fiabilidad interobservador y test-retest, dominios sin efecto techo y buena validez convergente y para grupos conocidos.
La versión en español de la MDS-NMS ha sido validada en una muestra multinacional, con buenos resultados psicométricos13. Además, ha sido usada en diversos estudios en diferentes países, con buen rendimiento.
Bibliografía
1. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology. 1967;17(5):427-442.
4. Fahn S, Elton R, UPDRS program members. Unified Parkinson’s disease rating scale. En: Fahn S, Marsden C, Goldstein M, et al. (eds.). Recent Developments in Parkinson’s Disease. Vol. 2. Macmillan Healthcare Information; 1987:153-163.
6. Goetz CG, Fahn S, Martínez Martín P, et al. Movement Disorder Society sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS UPDRS): Process, format, and clinimetric testing plan. Mov Disord. 2007;22(1):41-47
8. Movement Disorder Society Task Force on Rating Scales for Parkinson’s Disease. The Unified Parkinson’s Disease Rating Scale (UPDRS): status and recommendations. Mov Disord. 2003;18(7):738-750.
9. Goetz CG, Poewe W, Rascol O, et al. Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations. Mov Disord. 2004;19(9):1020-1028.
10. Martínez Martín P, Skorvanek M, Rojo Abuin JM, et al. Validation study of the hoehn and yahr scale included in the MDS UPDRS. Mov Disord. 2018;33(4):651-652.
11. Martínez Martín P, Rodríguez Blazquez C, Abe K, et al. International study on the psychometric attributes of the non motor symptoms scale in Parkinson disease. Neurology. 2009;73(19):1584-1591.
12. Martínez Martín P, Schrag A, Weintraub D, et al. Pilot Study of the International Parkinson and Movement Disorder Society sponsored Non motor Rating Scale (MDS NMS). Mov Disord Clin Pract. 2019;6(3):227-234.
13. Cubo E, Luo S, Martínez Martín P, et al. Expanded and Independent Spanish Validation of the MDS Non Motor Rating Scale. Mov Disord Clin Pract. 2023;10(4):586-595
Escalas de evaluación de síntomas no motores
Cuestionario de Síntomas No Motores (Non-Motor Symptoms Questionnaire [NMSQuest])
El NMSQuest es un cuestionario autoadministrado para la detección de síntomas no motores de la EP14 . Consta de 30 ítems, con opciones de respuesta “Sí/No”, que pueden agruparse en 9 dimensiones relativas a alteraciones digestivas, urinarias, apatía/atención/pérdida de memoria, alucinaciones/delirio, depresión/ansiedad, función sexual, alteraciones cardiovasculares, trastornos del sueño y miscelánea.
La importancia del NMSQuest reside en que constituye el primer PRO para la detección de síntomas no motores en la EP. Por su brevedad y sencillez, resulta útil para la práctica clínica y apto para su uso en diversos contextos socioculturales. Ha sido traducido y validado en varios idiomas, con buenos resultados en relación con sus propiedades psicométricas.
Escala de Sueño de la Enfermedad de Parkinson (Parkinson’s Disease Sleep Scale [PDSS])
La PDSS es una escala de evaluación de las alteraciones del sueño nocturno (insomnio, inquietud, nocturia, etc.) y de la hipersomnia diurna, específica para pacientes con EP15. Contiene 15 ítems, cada uno de los cuales se puntúa de 0 (síntoma grave y que se sufre con frecuencia) a 10 (sin síntomas) en una escala visual analógica.
En los diferentes estudios de validación de la PDSS, la escala ha mostrado buenas propiedades psicométricas. Cubre un amplio espectro de problemas causantes de trastorno del sueño e incluye, si bien someramente representada, la hipersomnia diurna (1 ítem). Por su brevedad y sencillez, puede utilizarse tanto en investigación como en la práctica clínica. Estas razones han hecho que la PDSS sea una escala recomendada para la evaluación de problemas de sueño por la IPMDS. Sin embargo, no se ha contrastado completamente su validez frente a medidas fisiológicas del sueño y la forma de puntuación a través de escala visual analógica puede presentar sesgos culturales.
Por ello, se ha elaborado una versión modificada, la PDSS-216, que se centra exclusivamente en problemas de sueño nocturno.
La PDSS-2 consta de 15 ítems que se puntúan en una escala de 0 (nunca) a 4 (muy frecuente). La puntuación total máxima, indicativa de más problemas de sueño, es 60. La PDSS-2 ha sido traducida y validada en varios idiomas, cuenta con buenas propiedades psicométricas y muestra sensibilidad al cambio. Se han establecido valores de diferencia clínica mínimamente importante (por sus siglas en inglés, MCID) para esta escala.
Escalas de Resultados de la Enfermedad de Parkinson-Sueño (Scales for Outcomes in Parkinson’s Disease-Sleep [SCOPA-S])
La SCOPA-S es una escala de evaluación de los trastornos del sueño nocturno y de la hipersomnia diurna en la EP17 y es propiedad de la IPMDS. Consta de dos subescalas: sueño nocturno (5 ítems) e hipersomnia diurna (6 ítems). El rango de puntuaciones va de 0 (nunca) a 3 (con frecuencia). Además, incluye un ítem de evaluación de la calidad del sueño nocturno que no forma parte de la puntuación total.
En los diversos estudios de validación, los datos de calidad psicométrica de la escala han resultado satisfactorios. Se ha propuesto un punto de corte 6/7 en la subescala de sueño nocturno para distinguir entre pacientes que duermen bien y los que duermen mal17.
La escala SCOPA-S resulta de utilidad como medida fiable y válida de los trastornos de sueño y la hipersomnia diurna en los pacientes con EP. Valora la somnolencia diurna más exhaustivamente que la PDSS, aunque, a diferencia de esta, no explora posibles causas de las alteraciones del sueño en la EP y no incluye preguntas sobre algunas alteraciones del sueño frecuentes en la EP como la apnea o el síndrome de piernas inquietas. Ha sido clasificada como escala recomendada por la IPMDS.
Escalas de Resultados de la Enfermedad de Parkinson-Autonómico (Scales for Outcomes in Parkinson’s Disease-Autonomic [SCOPA-AUT])
La SCOPA-AUT, propiedad de la IPMDS, evalúa los síntomas autonómicos en la EP18 mediante 25 ítems que exploran las siguientes áreas: gastrointestinal, urinaria, cardiovascular, termorregulación, pupilomotora y disfunción sexual. Los ítems se puntúan de 0 (nunca) a 3 (con frecuencia), aunque las regiones urinaria y sexual incluyen además las opciones de respuesta “uso de catéter” y “no sexualmente activo”, respectivamente. Cuenta con diversos estudios de validación, tanto con técnicas clásicas como con análisis Rasch, que muestran propiedades psicométricas adecuadas en conjunto, aunque algunas subescalas muestran una baja consistencia interna y ausencia de correlación con pruebas electrofisiológicas de síntomas autonómicos19. Ha sido recomendada por la IPMDS para la evaluación de disautonomía en la EP.
Escala de Fatiga para Parkinson (Parkinson Fatigue Scale [PFS])
La PFS es una escala de 16 ítems que evalúa los aspectos físicos de la fatiga en pacientes con EP y su impacto en las actividades de la vida diaria20. Los ítems se puntúan en una escala de 1 (completamente en desacuerdo) a 5 (completamente de acuerdo) y la puntuación total se obtiene mediante la suma de los ítems (rango de 16 a 80 puntos), mediante la media de los ítems o mediante la suma de las respuestas positivas (“de acuerdo”). Es una escala fiable y válida, corta y sencilla de utilizar, por lo que ha sido recomendada para su uso por parte de la IPMDS.
Escalas de calidad de vida relacionada con la salud
Para determinar la calidad de vida relacionada con la salud (CVRS) de los pacientes con EP se pueden utilizar medidas genéricas y medidas específicas.
Las primeras informan sobre aspectos de salud general, se pueden aplicar a individuos sanos y a pacientes con diferentes patologías y permiten comparaciones entre distintas enfermedades y situaciones de salud. Como desventaja, su contenido puede estar poco relacionado con las manifestaciones presentes en el paciente con EP y, por tanto, su sensibilidad al cambio puede ser baja. Estos inconvenientes no se dan en las medidas específicas, pero estas no informan sobre aspectos de salud general y no se pueden usar en poblaciones diferentes a aquella para la que fueron diseñadas.
La IPMDS ha publicado una revisión sobre los instrumentos de CVRS en EP. Las escalas de evaluación de CVRS más utilizadas en EP se exponen a continuación.
Parkinson’s Disease Questionnaire (versiones de 39 ítems [PDQ-39] y de 8 ítems [PDQ-8])
El PDQ-39 está compuesto por 39 ítems que se agrupan en 8 dimensiones: movilidad (10 ítems), actividades de la vida diaria (6 ítems), bienestar emocional (6 ítems), estigma (4 ítems), apoyo social (3 ítems), estado cognitivo (4 ítems), comunicación (3 ítems) y dolor (3 ítems)21. El PDQ-8 se compone de 8 ítems que representan cada una de las dimensiones del PDQ-3922.
En ambas versiones, el marco temporal explorado es el mes pasado y cada ítem presenta 5 opciones de respuesta (de 0, nunca, a 4, siempre o incapaz de hacerlo). La puntuación para cada dominio se calcula dividiendo la suma de las puntuaciones de los ítems por la máxima puntuación posible para esa dimensión y se expresa en porcentaje. El índice sumarial del PDQ-39 y del PDQ-821,22 se calcula como la media de las puntuaciones de las 8 dimensiones o de los 8 ítems, respectivamente.
El PDQ-39 es el más estudiado de los cuestionarios específicos para EP desde el punto de vista de características métricas y adaptación transcultural. Las dos versiones han sido aplicadas a multitud de estudios sobre el efecto de diversas terapias, mostrando sensibilidad al cambio, y están clasificadas como recomendadas por la IPMDS.
Parkinson’s Disease Quality of Life Questionnaire (PDQL)
El PDQL es una escala de evaluación de la CVRS específica para EP. Consta de 37 ítems agrupados en cuatro dimensiones: síntomas parkinsonianos (14 ítems), síntomas sistémicos (7 ítems), función social (7 ítems) y función emocional (9 ítems)23. La puntuación de cada ítem varía de 1 (todo el tiempo, continuamente) a 5 (nunca). La puntuación total se obtiene sumando directamente la de los ítems. Ha demostrado poseer adecuadas propiedades psicométricas y sensibilidad al cambio, por lo que es una de las escalas recomendadas por la IPMDS.
Escalas de Resultados de la Enfermedad de Parkinson Psicosocial (Scales for Outcomes in Parkinson’s Disease-Psychosocial [SCOPA-PS])
La SCOPA-PS, propiedad de la IPMDS, está formada por 11 ítems, valorados por la persona con Parkinson sobre su función psicosocial durante el último mes24. La escala de respuesta es de 4 puntos, y la puntuación total se calcula a través de la suma de los ítems que se transforman en un porcentaje donde un valor más elevado indica peor función psicosocial. Aunque originalmente desarrollada en holandés, esta escala ha sido traducida para varios idiomas, entre los cuales el inglés y el español25, con buena aceptabilidad, consistencia interna, validez de constructo, precisión y respuesta al cambio.
Bibliografía
14. Chaudhuri KR, Martínez Martín P, Schapira AHV, et al. International multicenter pilot study of the first comprehensive self completed nonmotor symptoms questionnaire for Parkinson’s disease: the NMSQuest study. Mov Disord. 2006;21(7):916-923.
15. Chaudhuri KR, Pal S, DiMarco A, et al. The Parkinson’s disease sleep scale: a new instrument for assessing sleep and nocturnal disability in Parkinson’s disease. J Neurol Neurosurg Psychiatr. 2002;73(6):629-635.
16. Trenkwalder C, Kohnen R, Högl B, et al. Parkinson’s disease sleep scale validation of the revised version PDSS 2. Mov Disord. 2011;26(4):644 652.
17. Marinus J, Visser M, van Hilten JJ, et al. Assessment of sleep and sleepiness in Parkinson disease. Sleep. 2003;26(8):1049-1054.
18. Visser M, Marinus J, Stiggelbout AM, et al. Assessment of autonomic dysfunction in Parkinson’s disease: the SCOPA AUT. Mov Disord. 2004;19(11):1306-1312.
19. Evatt ML, Chaudhuri KR, Chou KL, et al. Dysautonomia rating scales in Parkinson’s disease: sialorrhea, dysphagia, and constipation critique and recommendations by movement disorders task force on rating scales for Parkinson’s disease. Mov Disord. 2009;24(5):635-646.
20. Brown RG, Dittner A, Findley L, et al. The Parkinson fatigue scale. Parkinsonism Relat Disord. 2005;11(1):49-55.
21. Jenkinson C, Fitzpatrick R, Peto V, et al. The Parkinson’s Disease Questionnaire (PDQ 39): development and validation of a Parkinson’s disease summary index score. Age Ageing. 1997;26(5):353-357.
22. Jenkinson C, Fitzpatrick R, Peto V, et al. The PDQ 8: Development and validation of a short form Parkinson’s Disease Questionnaire. Psychol Health. 1997;12(6):805-814.
23. De Boer AG, Wijker W, Speelman JD, et al. Quality of life in patients with Parkinson’s disease: development of a questionnaire. J Neurol Neurosurg Psychiatr. 1996;61(1):70-74.
24. Marinus J, Visser M, Martínez Martín P, et al. A short psychosocial questionnaire for patients with Parkinson’s disease: the SCOPA PS. J Clin Epidemiol. 2003;56(1):61-67.
25. Martínez Martín P, Carroza García E, Frades Payo B, et al. Psychometric attributes of the Scales for Outcomes in Parkinson’s Disease Psychosocial (SCOPA PS): validation in Spain and review. Rev Neurol. 2009;49(1):1-7
En los últimos años, y especialmente a raíz de la pandemia de COVID-19, han ido adquiriendo cada vez más importancia la telemedicina, las tecnologías móviles y los sistemas de evaluación digitales para el diagnóstico, evaluación y seguimiento de la EP26,27 .
La telemedicina usa tecnología digital (ordenadores, smartphones, tabletas) con conexión a distancia para recoger y transmitir información y proporcionar asistencia sanitaria. Uno de los formatos más comunes son las visitas virtuales por teléfono o videoconferencia con la finalidad de evaluar e intervenir28. Otra modalidad se sirve de sensores para recoger la información, de los que los más habituales son los biosensores inerciales, que incluyen acelerómetros y giroscopios integrados en dispositivos (por ejemplo, relojes) que los pacientes pueden transportar durante todo el día. Estos biosensores se conectan con programas de ordenador y aplicaciones (app) para teléfonos móviles, las cuales en los últimos años han experimentado un espectacular crecimiento debido a su facilidad de uso, accesibilidad y bajo coste29. Se utilizan principalmente para evaluar la marcha y el movimiento y detectar síntomas motores como temblores y congelación, estados on/off y fluctuaciones motoras, lo que ofrece grandes posibilidades de aplicaciones en el ámbito de la Neurología y los trastornos del movimiento.
La IPMDS ha publicado unas directrices y recomendaciones para el desarrollo, validación e implementación de la tecnología de evaluación en EP30 y además cuenta con un repositorio de aplicaciones en su web31. También existe un informe de revisión de los dispositivos para seguimiento remoto de la EP elaborado por el NICE de Reino Unido32. En la guía de NICE se realiza una recomendación condicional a cinco de ellos: Kinesia 360, KinesiaU, PDMonitor, Personal KinetiGraph (PKG) y Stat-On.
Estos dispositivos consisten en sensores portátiles que se ajustan a la muñeca, tobillo o cintura del paciente y se conectan en remoto a un ordenador o teléfono móvil, para recoger y transmitir información sobre manifestaciones motoras y fluctuaciones. Dependiendo del tipo de sensor que lleven, pueden recoger un rango más o menos amplio de síntomas y signos de la EP. Por ejemplo, Kinesia 360 cuenta con dos sensores que se llevan en muñeca y tobillo para monitorizar de manera continua temblor, bradicinesia, discinesia, postura y marcha mientras se realizan las actividades de la vida diaria, mientras que KinesiaU se lleva únicamente en la muñeca y cuantifica la gravedad del temblor, bradicinesia y dicinesia en tareas específicas o a lo largo de todo el día33. Por su parte, PD Monitor recoge información sobre periodos en off, discinesias, bradicinesia, temblor, inestabilidad postural, inactividad, y un profundo análisis de la marcha que incluye congelaciones, cadencia (pasos/minuto), velocidad (metros/segundo) y longitud de los pasos34. Uno de los dispositivos más usados, PKG, además de evaluar bradicinesia, discinesia, temblor, fluctuaciones motoras e inmovilidad durante el día y durante el sueño, permite al paciente registrar las tomas de medicación. Con esta información proporciona puntuaciones de gravedad y del porcentaje de tiempo con discinesia y bradicinesia en relación con la toma de LD. Por último, Stat-On monitoriza diversos parámetros de la marcha (longitud del paso, congelaciones, caídas), periodos en on y off, movimientos de las extremidades y discinesia del tronco y del cuello, pero no recoge datos sobre temblor, y la bradicinesia se estima a partir de la información sobre la marcha35. Otros sistemas, como los actígrafos, permiten la monitorización de los trastornos del sueño en la vida real de una forma menos costosa e invasiva que otros métodos más tradicionales como la polisomnografía36.
Estos dispositivos cuentan con estudios de validación, mostrando en general altos niveles de correlación o concordancia con las puntuaciones de escalas tales como la UPDRS y la Abnormal Involuntary Movements Scale (AIMS)26. Además, facilitan una mejor identificación de síntomas y el manejo y ajuste del tratamiento farmacológico, lo que puede mejorar el estado de salud del paciente y su calidad de vida37-40.
Se han diseñado también diferentes aplicaciones en tabletas y teléfonos móviles para recoger información sobre diversos aspectos de la EP mediante tareas que permiten el análisis de los movimientos oculomotores (por ejemplo, movimientos de fijación, sacádicos y nistagmo) para la evaluación de la función cognitiva y la gravedad de la EP, tareas manuales (por ejemplo, finger tapping) para detectar respuesta al tratamiento, fluctuaciones y bradicinesia, monitorización de síntomas no motores como el sueño, y tareas de vocalización para facilitar el diagnóstico de la enfermedad, sin necesidad de usar dispositivos añadidos41-43. Estas aplicaciones ofrecen la ventaja de que no son invasivas, proporcionan datos de manera continua y en tiempo real y se pueden utilizar en el hogar y durante las tareas habituales del paciente, lo que mejora la evaluación y el tratamiento de los pacientes.
Otro de los desarrollos tecnológicos es la digitalización de escalas (escalas electrónicas o e-escalas). El uso de escalas electrónicas tiene muchas ventajas, como la accesibilidad, la escalabilidad, la precisión y la integridad de la recopilación de datos, una administración remota más sencilla, el seguimiento en tiempo real de los datos por parte de médicos e investigadores, y la recopilación de comentarios por parte de los pacientes y participantes del estudio44. En los últimos años se está trabajando para digitalizar las principales escalas clínicas, como la MDS-UPDRS44. Las escalas digitales son especialmente útiles en el caso de las medidas de resultados informados por los pacientes. Una de estas aplicaciones son los e-diarios, en los que los pacientes pueden registrar datos de medicación, síntomas y fluctuaciones a lo largo de todo un día, con buenos resultados de aceptabilidad, fiabilidad y validez45,46.
La evaluación digital de la EP se enfrenta a varios desafíos30. El primero de ellos es garantizar que los resultados son consistentes, fiables, válidos e interpretables, imprescindible para poder usar estas herramientas para el diagnóstico y el seguimiento de la enfermedad, para lo que deben someterse a estudios de validación. En segundo lugar, estas herramientas no permiten obtener datos sobre muchos síntomas no motores, que con frecuencia son subjetivos y difícilmente cuantificables. Existen algunas iniciativas para conseguir registrar datos de síntomas no motores, aunque se trata de un área en desarrollo47. Por último, es necesario formar y entrenar a pacientes y clínicos en alfabetización digital y en el correcto uso e interpretación de las medidas obtenidas de esta forma. Además, estas tecnologías no siempre son viables para los pacientes, debido al precio, las limitaciones en el acceso a internet y restricciones regulatorias y legislativas y pueden suscitar problemas de privacidad de los datos personales y de salud28. En el caso de las e-escalas, se debe contar con la perspectiva del paciente para garantizar su usabilidad y que la adaptación sea equivalente a la versión analógica48.
En un estudio sobre la percepción de los pacientes sobre la telemedicina, el 84% de los participantes indicó que la telemedicina no es tan buena como las visitas presenciales y el 75% mostró mayor confianza en el clínico en el caso de la visita presencial, a pesar de que los niveles de satisfacción con las consultas a distancia (por teléfono o vídeo llamada) fueron altos49. Las principales preocupaciones de los pacientes en este tipo de asistencia se centran en posibles errores diagnósticos, la ruptura de la relación médico-paciente, la falta de comunicación no verbal y cuestiones éticas.

Bibliografía
26. Moreau C, Rouaud T, Grabli D, et al. Overview on wearable sensors for the management of Parkinson’s disease. NPJ Parkinsons Dis. 2023;9(1):153.
27. Hassan A, Mari Z, Gatto EM, et al. Global Survey on Telemedicine Utilization for Movement Disorders During the COVID 19 Pandemic. Mov Disord. 2020;35(10):1701 1711. doi:10.1002/mds.28284
28. Shalash A, Spindler M, Cubo E. Global Perspective on Telemedicine for Parkinson’s Disease. J Parkinsons Dis. 2021;11(s1):S11-S18.
29. López Blanco R, Sorrentino Rodríguez A, Cubo E, et al. Impacto de las nuevas tecnologías en la neurología en España. Revisión del Comité Ad Hoc de Nuevas Tecnologías de la Sociedad Española de Neurología. Neurologia. 2020;38(8):591-598.
30. Espay AJ, Hausdorff JM, Sánchez Ferro Á, et al. A roadmap for implementation of patient centered digital outcome measures in Parkinson’s disease obtained using mobile health technologies. Mov Disord. 2019;34(5):657-663.
31. Digital App Repository. En: International Parkinson and Movement Disorder Society [Internet]. Disponible en: https://www.movementdisorders.org/MDS/Application-Repository.htm
32. Devices for Remote Monitoring of Parkinson’s Disease. Diagnostics Guidance [DG51]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/dg51
33. Giuffrida JP, Riley DE, Maddux BN, et al. Clinically deployable Kinesia technology for automated tremor assessment. Mov Disord. 2009;24(5):723-730.
34. Gao C, Smith S, Lones M, et al. Objective assessment of bradykinesia in Parkinson’s disease using evolutionary algorithms: clinical validation. Transl Neurodegener. 2018;7:18.
35. Rodríguez Martín D, Cabestany J, Pérez López C, et al. A New Paradigm in Parkinson’s Disease Evaluation With Wearable Medical Devices: A Review of STAT ONTM. Front Neurol. 2022;13:912343.
36. Raschellà F, Scafa S, Puiatti A, et al. Actigraphy Enables Home Screening of Rapid Eye Movement Behavior Disorder in Parkinson’s Disease. Ann Neurol. 2023;93(2):317-329.
37. Joshi R, Bronstein JM, Keener A, et al. PKG Movement Recording System Use Shows Promise in Routine Clinical Care of Patients With Parkinson’s Disease. Front Neurol. 2019;10:1027.
38. Santiago A, Langston JW, Gandhy R, et al. Qualitative Evaluation of the Personal KinetiGraphTM Movement Recording System in a Parkinson’s Clinic. J Parkinsons Dis. 2019;9(1):207-219.
39. Dominey T, Kehagia AA, Gorst T, et al. Introducing the Parkinson’s KinetiGraph into Routine Parkinson’s Disease Care: A 3 Year Single Centre Experience. J Parkinsons Dis. 2020;10(4):1827-1832.
40. Farzanehfar P, Woodrow H, Horne M. Sensor Measurements Can Characterize Fluctuations and Wearing Off in Parkinson’s Disease and Guide Therapy to Improve Motor, Non motor and Quality of Life Scores. Front Aging Neurosci. 2022;14:852992.
41. Koch NA, Voss P, Cisneros Franco JM, et al. Eye movement function captured via an electronic tablet informs on cognition and disease severity in Parkinson’s disease. Sci Rep. 2024;14(1):9082.
42. Broeder S, Roussos G, De Vleeschhauwer J, et al. A smartphone based tapping task as a marker of medication response in Parkinson’s disease: a proof of concept study. J Neural Transm (Vienna). 2023;130(7):937-947.
43. Singh S, Xu W. Robust Detection of Parkinson’s Disease Using Harvested Smartphone Voice Data: A Telemedicine Approach. Telemed J E Health. 2020;26(3):327-334.
44. Monje MHG, Fuller RLM, Cubo E, et al. Toward e Scales: Digital Administration of the International Parkinson and Movement Disorder Society Rating Scales. Mov Disord Clin Pract. 2021;8(2):208-214.
45. Vizcarra JA, Sánchez Ferro Á, Maetzler W, et al. The Parkinson’s disease e diary: Developing a clinical and research tool for the digital age. Mov Disord. 2019;34(5):676-681.
46. Terroba Chambi C, Bruno V, Medina Escobar A, et al. Open Access Electronic Diary for Motor Fluctuation and Dyskinesia Evaluation in Parkinson Disease: Comparison With Paper Diary. Clin Neuropharmacol. 2018;41(1):20-22.
47. Tripathi S, Malhotra A, Qazi M, et al. Clinical Review of Smartphone Applications in Parkinson’s Disease. Neurologist. 2022;27(4):183-193.
48. Fuller RLM, Sánchez Ferro Á, Goetz CG, et al. In Support of Electronic Versions of Movement Disorder Society Rating Scales. Mov Disord. 2021;36(1):270-271.
49. Rajapakshe I, Menozzi E, Cunha I, et al. Patients’ Postjudice of Tele Neurology for Movement Disorders. Mov Disord Clin Pract. 2022;9(4):446-451.
La LD es el fármaco antiparkinsoniano más eficaz disponible1-6. Después de más de 50 años de uso, sigue siendo el tratamiento básico de la EP (NE-I).
La LD es fundamentalmente un profármaco de la dopamina; actúa a nivel central tras ser transportada en el intestino delgado por mecanismo activo3 . Es necesario evitar su transformación periférica por la enzima descarboxilasa (ubicua en múltiples tejidos) mediante carbidopa o benserazida. La LD alcanza la barrera hematoencefálica y es introducida por otro transportador de aminoácidos neutros al interior cerebral. Allí será convertida en dopamina por la descarboxilasa cerebral. Este es el mecanismo básico, pero no el único. LeWitt3 y muy recientemente Jenner6 comentaban las muchas lagunas existentes en el conocimiento de los mecanismos de la LD (NE-IV). La LD probablemente actúa en múltiples neuronas, no solamente en las dopaminérgicas nítricas (que, por otra parte, sobreviven en número decreciente) sino también, preferentemente en las serotoninérgicas y posiblemente en las intrínsecas estriadas2-6 (NE-IV). Se ha sugerido, además, que la LD posee mecanismos propios, con independencia de su conversión a DA; posiblemente la LD actúa como neurotransmisor en sí2-4 (NE-IV). La LD es capaz de modular, de forma directa o indirecta, múltiples sistemas de neurotransmisión, incluyendo el sistema noradrenérgico y glutamatérgico2-6. La LD es capaz de modificar la plasticidad del estriado denervado y estimular la liberación de factores tróficos en modelos experimentales7,8 (NE-IV).
Por otra parte, la supuesta toxicidad de la LD no se ha confirmado, no hay prueba clínica que demuestre el efecto toxico de la LD tras largos años de uso9 (NE-IV).
La LD es el fármaco antiparkinsoniano más eficaz disponible, aunque su uso precoz influye en la presencia de complicaciones motoras, especialmente en la aparición de discinesias y fluctuaciones motoras10-12 (NE-I). Las discinesias están más directamente relacionadas con la dosis total diaria de LD, mientras que para el desarrollo de las fluctuaciones también influyen la titulación de las tomas de LD, así como el tiempo de evolución y la gravedad de la clínica parkinsoniana. Sin embargo, el grado de denervación estriatal y la edad son los factores decisivos para la presencia de complicaciones motoras12,13 (NE-II). Aquellos pacientes con EP avanzada (sin tratamiento previo) que comienzan con LD pueden manifestar muy pronto complicaciones motoras13 (NE-IV). El papel de la LD en el trastorno del control de impulsos es marginal, los agonistas dopaminérgicos intervienen de forma mucho más contundente14 (NE-II).
En cuanto a la comparación con otros fármacos antiparkinsonianos, la LD es sin duda el más potente (con la posible excepción de apomorfina) y mejor tolerado. La LD es claramente superior a los agonistas y al resto de fármacos auxiliares1,15,16 (NE-I).
Las formulaciones de LD de liberación prolongada o retardada son eficaces en la EP, aunque no suponen ventaja frente a la LD estándar ni evitan la aparición de complicaciones motoras17. Estos preparados solo se consideran útiles para la acinesia nocturna y acinesia matutina, pero no suponen una ventaja en el resto de situaciones17 (NE-I).
El excelente trabajo ELLDOPA, hoy ya clásico, mostró que la LD era eficaz en la EP inicial, que existe una clara relación dosis respuesta y que el efecto a largo plazo sintomático se prolonga hasta la segunda semana como mínimo18 (NE-I). No obstante, la administración de LD en la EP inicial puede asociarse a la presencia más precoz de complicaciones motoras, especialmente en pacientes jóvenes1,18 (NE-I).
Recientemente, un interesante trabajo liderado por Verschuur19 estudió en EP inicial si la LD precoz suponía alguna ventaja respecto a LD administrada tras 6 meses. El estudio confirmó que, a las 80 semanas, la situación era similar en ambos grupos (inicial y tardío), con ello, el efecto neuroprotector de la LD parece no cumplirse, pero el grupo precoz consiguió una contundente mejoría funcional durante los primeros 6 meses. No se observó una diferencia significativa entre ambos grupos respecto a complicaciones motoras. En resumen, la LD no parece ser neuroprotectora, pero tampoco parece incrementar las complicaciones motoras si se usa precozmente a dosis reducidas19 (NE-I).
La LD sigue siendo eficaz en pacientes con EP avanzada con fluctuaciones motoras y no motoras1,20 (NE-IV). Ante la presencia de complicaciones motoras, es razonable aumentar la frecuencia o dosis, aunque idealmente parece prudente limitar la dosis total a menos de 500-600 mg al día1,21 (NE-II).
Recientemente se ha comercializado la LD inhalada. La LD inhalada se absorbe por el árbol bronquial y, a diferencia de la LD oral, no se asocia con carbidopa ni benserazida22-24. La acción de la LD inhalada es rápida, y la mayor parte los pacientes evaluados en ensayos clínicos responden durante los primeros 20 minutos tras la inhalación23,34 (NE-I). La LD inhalada es un fármaco adyuvante a demanda (on demand en inglés), eficaz en la mayoría de los casos, su utilidad ha sido confirmada en estudios rigurosos22-24NE-I). Es eficaz en fenómenos off fin de dosis23,34 (NE-I), incluida la acinesia matutina, y otras fluctuaciones más complejas o impredecibles.
El efecto secundario más frecuente es la tos y la irritación bronquial, que suele tolerarse sin problemas mayores22-24. El entrenamiento al paciente es un factor clave para la buena tolerancia y cumplimiento25 (NE-IV).
Las nuevas formulaciones de LD dirigidas al tratamiento de las fluctuaciones se tratan en el capítulo 7 (pag. 155). La infusión subcutánea y las infusiones continuas intraduodenales de LD se tratan en el capítulo 8 de este manual, dedicado a terapias de segunda línea (pag. 179).

Bibliografía
1. Foltynie T, Bruno V, Fox S, et al. Medical, surgical, and physical treatments for Parkinson’s disease. Lancet. 2024 Jan 20;403(10423):305-324.
2. Mercuri NB, Bernardi G. The ‘magic’ of L-dopa: why is it the gold standard Parkinson’s disease therapy? Trends Pharmacol Sci. 2005; 26: 341-344.
3. LeWitt PA. Levodopa therapy for Parkinson’s disease: Pharmacokinetics and pharmacodynamics. Mov Disord. 2015 Jan;30 (1):64-72.
4. De Deurwaerdère P, Di Giovanni G, Millan MJ. Expanding the repertoire of L-DOPA’s actions: A comprehensive review of its functional neurochemistry. Prog Neurobiol. 2017 Apr;151:57-100.
5. Albin RL, Leventhal DK. The missing, the short, and the long: levodopa responses and dopamine actions. Ann Neurol. 2017;82:4-19.
6. Jenner P, Falup-Pecurariu C, Leta V, et al. Adopting the Rumsfeld approach to understanding the action of levodopa and apomorphine in Parkinson’s disease. J Neural Transm (Vienna). 2023 Nov;130 (11):1337-1347.
7. O’Keeffe GC, Tyers P, Aarsland D, et al. Dopamine-induced proliferation of adult neural precursor cells in the mammalian subventricular zone is mediated through EGF. Proc Natl Acad Sci U S A. 2009 May 26;106 (21):8754-9.
8. Chiu WH, Depboylu C, Hermanns G, et al. Long-term treatment with L-DOPA or pramipexole affects adult neurogenesis and corresponding non-motor behavior in a mouse model of Parkinson’s disease. Neuropharmacology. 2015 Aug;95:367-76.
9. Rajput AH, Rajput ML, Robinson CA, et al. Normal substantia nigra patients treated with levodopa - Clinical, therapeutic and pathological observations. Parkinsonism Relat Disord. 2015 Oct;21 (10):1232-7.
10. Rascol O, Brooks DJ, Korczyn AD, et al. A five year study of the incidence of dyskinesia in patients with early Parkinson’s disease who were treated with ropinirole or levodopa. 056 Study Group. N Engl J Med 2000;342:1484-91.
11. Zhang Q, Chen X, Chen F, et al. Dopamine agonists versus levodopa monotherapy in early Parkinson’s disease for the potential risks of motor complications: A network meta-analysis. Eur J Pharmacol. 2023 Sep 5;954:175884.
12. García-Ruiz PJ, Del Val J, Fernández IM, et al. What factors influence motor complications in Parkinson disease?: a 10-year prospective study. Clin Neuropharmacol. 2012 Jan-Feb;35 (1):1-5.
13. Cilia R, Akpalu A, Sarfo FS, et al. The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa. Brain. 2014 Oct;137(Pt 10):2731-42.
14. Pérez-Lloret S, Rey MV, Fabre N, et al. Prevalence and pharmacological factors associated with impulse-control disorder symptoms in patients with Parkinson disease. Clin Neuropharmacol. 2012; 35:261-5.
15. PD Med Collaborative Group; Gray R, Ives N, Rick C, et al. Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson’s disease (PD MED): a large, open-label, pragmatic randomised trial. Lancet. 2014 Sep 27;384 (9949):1196-205.
16. Xie CL, Zhang YY, Wang XD, et al. Levodopa alone compared with levodopa-sparing therapy as initial treatment for Parkinson’s disease: a meta-analysis. Neurol Sci. 2015 Aug;36 (8):1319-29.
17. Koller WC, Hutton JT, Tolosa E, et al. Immediate-release and controlled-release carbidopa/levodopa in PD: a 5-year randomized multicenter study. Carbidopa/Levodopa Study Group. Neurology. 1999 Sep 22;53 (5):1012-9.
18. Fahn S, Oakes D, Shoulson I, et al.; Parkinson Study Group. Levodopa and the progression of Parkinson’s disease. N Engl J Med. 2004 Dec 9;351(24):2498-508.
19. Verschuur CVM, Suwijn SR, Boel JA, et al.; LEAP Study Group. Randomized Delayed-Start Trial of Levodopa in Parkinson’s Disease. N Engl J Med. 2019 Jan 24;380 (4):315-324.
20. Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review. JAMA. 2020 Feb 11;323 (6):548-560.
21. Tran TN, Vo TNN, Frei K, et al. Levodopa-induced dyskinesia: clinical features, incidence, and risk factors. J Neural Transm (Vienna). 2018 Aug;125 (8):1109-1117.
22. LeWitt PA, Hauser RA, Grosset DG, et al. A randomized trial of inhaled levodopa (CVT-301) for motor fluctuations in Parkinson’s disease. Mov Disord. 2016; 31:1356-65.
23. LeWitt PA, Hauser RA, Pahwa R, et al. SPAN-PD Study Investigators Safety and efficacy of CVT-301 (levodopa inhalation powder) on motor function during off periods in patients with Parkinson’s disease: a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Neurol. 2019 Feb;18 (2):145-154.
24. Glenardi G, Handayani T, Barus J, et al. Inhaled Levodopa (CVT-301) for the Treatment of Parkinson Disease: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Neurol Clin Pract. 2022 Apr;12 (2):139-148.
25. Hauser RA, LeWitt PA, Waters CH, et al. The Clinical Development of Levodopa Inhalation Powder. Clin Neuropharmacol. 2023 Mar-Apr 01;46 (2):66-78.
Los agonistas dopaminérgicos (AD) son fármacos antiparkinsonianos eficaces tanto en monoterapia como asociados a LD. A pesar de sus inconvenientes, relacionados con efectos secundarios y tolerancia, los AD constituyen una opción antiparkinsoniana potente1,20,25 (NE-IV). Algunos estudios comparativos sugieren que los AD son los fármacos adyuvantes antiparkinsonianos más eficaces24-30 (NE-I).
Los AD ergóticos (bromocriptina, pergolida, cabergolina), usados con profusión en décadas pasadas, han caído en desuso por sus efectos secundarios, aunque su efectividad antiparkinsoniana era comparable a los modernos AD. Los efectos secundarios de los AD ergóticos incluyen la fibrosis pleuropulmonar y cardiaca, lo que ha limitado su uso a una terapia marginal, solo en casos muy seleccionados31 (NE-II).
Los AD no ergóticos orales y transdérmicos son los agonistas usados en la actualidad. Todos ellos son eficaces en monoterapia en EP inicial y reducen complicaciones motoras, incluyendo las discinesias (frente a LD) en estudios controlados32-35 (NE-I).
Los AD no ergóticos (los orales pramipexol y ropinirol y el transdérmico rotigotina) son eficaces en la EP con fluctuaciones motoras y reducen en términos generales el tiempo off aproximadamente 1,5-2 horas y la dosis de LD en unos 150 mg36-42 (NE-I). Los AD poseen efectos secundarios que considerar, incluyendo alteraciones del sueño (generalmente hipersomnia diurna), problemas digestivos, edemas periféricos, confusión y alucinaciones, especialmente en pacientes ancianos, así como trastornos del control de los impulsos (TCI), tal vez el efecto secundario más temido, especialmente en jóvenes43-46 (NE-II). Los AD se asocian a TCI con distinto riesgo, en función de su afinidad por los receptores dopaminérgicos D347. El riesgo es elevado para pramipexol y ropinirol, y posiblemente algo menor para rotigotina y apomorfina43-48 (NE-III).
A pesar de los efectos secundarios, los AD son fármacos útiles y potentes que considerar en la EP1,20,26,28-30 (NE-IV). No hay claro AD oral/transdérmico superior a otro en relación con su potencia antiparkinsoniana. Los AD poseen un efecto techo y consiguen una reducción de tiempo off apreciable, de 1,5-2 horas27,29,30,41,48 (NE-I) y pueden ser particularmente útiles en el tratamiento de la apatía, la acinesia nocturna y el insomnio1,20,46 (NE-IV). En cualquier caso, es recomendable usar dosis reducidas de AD1,20,48 (NE-IV).
Los distintos AD poseen sutiles diferencias que permiten personalizar el tratamiento en determinadas ocasiones. La curva-respuesta y la relación dosis mínima eficaz/dosis máxima tolerada varía entre AD48.
El pramipexol, por su excreción renal, parece indicado en pacientes polimedicados48-50 (NE-IV); el fármaco está disponible en liberación estándar y liberación prolongada. Esta última preparación presenta similar eficacia, pero mejor tolerabilidad que la de liberación inmediata48-50. El pramipexol y el ropinirol son los AD con mayor riesgo de TCI, por lo que se aconseja vigilancia estrecha, especialmente en pacientes jóvenes44,20,4748 (NE-II).
El ropinirol es similar al pramipexol en cuanto a su potencia antiparkinsoniana, pero, a diferencia del pramipexol, su metabolismo es hepático. Los preparados de liberación inmediata parecen ofrecer similar potencia, pero mejor cumplimiento48,51 (NE-II). Más allá del riesgo ya comentado del ropinirol de producir TCI46,48 (NE-II), hay que destacar también la presencia de hipersomnia, a veces en forma de ataques de sueño, como un efecto secundario destacable y potencialmente peligroso48,51 (NE-II).
La rotigotina, único agonista transdérmico, ofrece una absorción más constante, su potencia techo es similar a la del pramipexol30,41,48 (NE-I) y tiene especial indicación en pacientes parkinsonianos con síndrome de piernas inquietas, insomnio nocturno y en pacientes con disfagia48,52 (NE-IV).
Todos los AD pueden precipitar un síndrome de privación dopaminérgica en casos de retirada brusca: la suspensión debe ser gradual siempre. Esto es especialmente relevante en los pacientes intervenidos quirúrgicamente (estimulación cerebral profunda) donde una suspensión brusca puede justificar el aumento de la incidencia de la apatía y la depresión en estos pacientes.

Bibliografía
1.Foltynie T, Bruno V, Fox S, et al. Medical, surgical, and physical treatments for Parkinson’s disease. Lancet. 2024 Jan 20;403(10423):305-324.
20. Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review. JAMA. 2020 Feb 11;323 (6):548-560.
21. Tran TN, Vo TNN, Frei K, et al. Levodopa-induced dyskinesia: clinical features, incidence, and risk factors. J Neural Transm (Vienna). 2018 Aug;125 (8):1109-1117.
22. LeWitt PA, Hauser RA, Grosset DG, et al. A randomized trial of inhaled levodopa (CVT-301) for motor fluctuations in Parkinson’s disease. Mov Disord. 2016; 31:1356-65.
23. LeWitt PA, Hauser RA, Pahwa R, et al. SPAN-PD Study Investigators Safety and efficacy of CVT-301 (levodopa inhalation powder) on motor function during off periods in patients with Parkinson’s disease: a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Neurol. 2019 Feb;18 (2):145-154.
24. Glenardi G, Handayani T, Barus J, et al. Inhaled Levodopa (CVT-301) for the Treatment of Parkinson Disease: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Neurol Clin Pract. 2022 Apr;12 (2):139-148.
25. Hauser RA, LeWitt PA, Waters CH, et al. The Clinical Development of Levodopa Inhalation Powder. Clin Neuropharmacol. 2023 Mar-Apr 01;46 (2):66-78.
26. Rizos A, Sauerbier A, Falup-Pecurariu C, et al. EUROPAR and the IPMDS Non-Motor PD Study Group. Tolerability of non-ergot oral and transdermal dopamine agonists in younger and older Parkinson’s disease patients: an European multicentre survey. J Neural Transm (Vienna). 2020 Jun;127 (6):875-879.
27. Ruan X, Lin F, Wu D, et al. Comparative Efficacy and Safety of Dopamine Agonists in Advanced Parkinson’s Disease With Motor Fluctuations: A Systematic Review and Network Meta-Analysis of Double-Blind Randomized Controlled Trials. Front Neurosci. 2021 Oct 29;15:728083.
28. Gray R, Patel S, Ives N, et al.; PD MED Collaborative Group. Long-term Effectiveness of Adjuvant Treatment With Catechol-O-Methyltransferase or Monoamine Oxidase B Inhibitors Compared With Dopamine Agonists Among Patients With Parkinson Disease Uncontrolled by Levodopa Therapy: The PD MED Randomized Clinical Trial. JAMA Neurol. 2022 Feb 1;79 (2):131-140.
29. Woitalla D, Buhmann C, Hilker-Roggendorf R, et al. Role of dopamine agonists in Parkinson’s disease therapy. J Neural Transm (Vienna). 2023 Jun;130 (6):863-873.
30. Sako W, Kogo Y, Koebis M, et al. Comparative efficacy and safety of adjunctive drugs to levodopa for fluctuating Parkinson’s disease - network meta-analysis. NPJ Parkinsons Dis. 2023 Oct 19;9 (1):143.
31. Montastruc F, Moulis F, Araujo M, et al. Ergot and non-ergot dopamine agonists and heart failure in patients with Parkinson’s disease. Eur J Clin Pharmacol. 2017 Jan;73 (1):99-103.
32. Holloway RG, Shoulson I, Fahn S, et al. Pramipexole vs levodopa as initial treatment for Parkinson disease: a 4-year randomized controlled trial. Arch Neurol. 2004;61 (7):1044-53.
33. Poewe W, Rascol O, Barone P, et al. Extended-release pramipexole in early Parkinson disease: a 33-week randomized controlled trial. Neurology. 2011;77(8):759-66.
34. Rascol O, Brooks DJ, Korczyn AD, et al. A five-year study of the incidence of dyskinesia in patients with early Parkinson’s disease who were treated with ropinirole or levodopa. N Engl J Med. 2000;342 (20):1484-91.
35. Hauser RA, Rascol O, Korczyn AD, et al. Ten-year follow-up of Parkinson’s disease patients randomized to initial therapy with ropinirole or levodopa. Mov Disord. 2007;22(16):2409-17.
36. Lieberman A, Ranhosky A, Korts D. Clinical evaluation of pramipexole in advanced Parkinson’s disease: results of a double-blind, placebo-controlled, parallel-group study. Neurology. 1997;49(1):162-8.
37. Schapira AHV, Barone P, Hauser RA, et al. Extended-release pramipexole in advanced Parkinson disease: a randomized controlled trial. Neurology. 2011 23;77(8):767-74.
38. Rascol O, Lees AJ, Senard JM, et al. Ropinirole in the treatment of levodopa-induced motor fluctuations in patients with Parkinson’s disease. Clin Neuropharmacol. 1996;19(3):234-45.
39. Pahwa R, Stacy MA, Factor SA, et al. Ropinirole 24-hour prolonged release: randomized, controlled study in advanced Parkinson disease. Neurology. 2007;68(14):1108-15.
40. LeWitt PA, Lyons KE, Pahwa R. Advanced Parkinson disease treated with rotigotine transdermal system: PREFER Study. Neurology. 2007;68(16):1262–7.
41. Poewe WH, Rascol O, Quinn N, et al. Efficacy of pramipexole and transdermal rotigotine in advanced Parkinson’s disease: a double-blind, double-dummy, randomised controlled trial. Lancet Neurol. 2007;6(6):513-20.
42. Nicholas AP, Borgohain R, Chaná P, et al. A randomized study of rotigotine dose response on “off” time in advanced Parkinson’s disease. J Parkinsons Dis. 2014;4(3):361-73.
43. Ceravolo R, Frosini D, Rossi C, et al. Impulse control disorders in Parkinson’s disease: definition, epidemiology, risk factors, neurobiology and management. Parkinsonism Relat Disord. 2009;15 Suppl 4:S111-5.
44. Weintraub D, Koester J, Potenza MN, et al. Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients. Arch Neurol. 2010;67(5):589-95.
45. García-Ruiz PJ, Martínez Castrillo JC, Alonso-Canovas A, et al. Impulse control disorder in patients with Parkinson’s disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014;85 (8):840-4.
46. Möller JC, Eggert KM, Unger M, et al. Clinical risk-benefit assessment of dopamine agonists. Eur J Neurol. 2008;15 Suppl 2:15-23.
47. Seeman P. Parkinson’s disease treatment may cause impulse-control disorder via dopamine D3 receptors. Synapse. 2015 Apr;69(4):183-9.
48. Alonso Cánovas A, Luquin Piudo R, García-Ruiz- P, et al. Dopaminergic agonists in Parkinson’s disease. Neurologia. 2014;29 (4):230-41.
49. Antonini A, Calandrella D. Pharmacokinetic evaluation of pramipexole. Expert Opin Drug Metab Toxicol. 2011;7(10):1307-14.
50. Frampton JE. Pramipexole extended-release: a review of its use in patients with Parkinson’s disease. Drugs. 2014;74(18):2175-90.
51. Tompson D, Oliver-Willwong R. Pharmacokinetic and pharmacodynamic comparison of ropinirole 24-hour prolonged release and ropinirole immediate release in patients with Parkinson’s disease. Clin Neuropharmacol. 2009 May-Jun;32(3):140-8.
52. Frampton JE. Rotigotine Transdermal Patch: A Review in Parkinson’s Disease. CNS Drugs. 2019 Jul;33(7):707-718
La apomorfina fue el primer agonista dopaminérgico usado en la EP. Por sus peculiaridades farmacocinéticas y farmacodinámicas, se separa del resto de agonistas orales y transdérmicos. La apomorfina es un agonista D1-D2, su metabolismo es fundamentalmente hepático y su catabolismo, muy rápido, explica su corta vida media plasmática. La apomorfina muestra una elevada potencia antiparkinsoniana, y es el único agonista dopaminérgico con una potencia similar a la LD53,54 (NE-II).
En la actualidad, la apomorfina se usa tanto en inyección subcutánea intermitente (ISI) como en infusión subcutánea continua (ISC) para el control de EP avanzada1,20,53-55 (NE-I). La efectividad de la apomorfina en ISI se ha confirmado en varios estudios controlados, hoy en día ya clásicos56-58 (NE-I). Esta técnica puede emplearse durante largo tiempo, en general sin problemas serios, aunque la tasa de abandono es relativamente alta por molestias locales1,20,55-57 (NE-I). Algunos efectos secundarios, especialmente las náuseas, remiten con el tiempo y pueden controlarse con la premedicación con domperidona (ver test de apomorfina en el capítulo 1, pag. 23). La apomorfina en ISI es eficaz para rescatar a los pacientes de los episodios off, tanto predecibles como súbitos, y ofrece cierta independencia a pacientes con fluctuaciones motoras graves de difícil control, con episodios off con frecuencia impredecibles54,57 (NE-I).
Antes de emplear apomorfina en ISI, se ha de realizar un estudio agudo para determinar su eficacia, observar la dosis mínima eficaz y monitorizar la aparición de hipotensión55 (NE-IV).
La ISC ha sido empleada en la EP avanzada durante más de 20 años. Esta técnica se ha estudiado en estudios retrospectivos y abiertos prospectivos muy extensos55,59,60 (NE-II). En 2018 concluyó el primer estudio multicéntrico controlado (estudio Toledo) que confirmó que la técnica es efectiva y permite una reducción en tiempo off superior a 1,89 horas frente placebo61 (NE-I).
Esta técnica permite una disminución moderada del resto de fármacos dopaminérgicos utilizados por los pacientes, pero las discinesias no suelen disminuirse de forma contundente. Existen algunos estudios recientes comparativos no controlados con LCIG y con estimulación cerebral profunda (ECP). Las tres técnicas son eficaces en la reducción del tiempo off, si bien la ECP permite mayor reducción de medicación y discinesias62 (NE-II).
La ISC no está exenta de efectos secundarios y la mayoría de los pacientes tarde o temprano presentan efectos adversos. Los más frecuentes incluyen la presencia de problemas dérmicos (especialmente nódulos subcutáneos) y alteraciones psiquiátricas (en buena parte, empeoramiento de situación previa)55,61(NE-I). También hay que notar que un cierto porcentaje de pacientes no tolera el procedimiento por distintas causas o no llega a dominar los problemas inherentes a la inserción de aguja en tejido subcutáneo o a la manipulación del sistema que, por este motivo, se ha simplificado recientemente por alguna de las casas que comercializan el fármaco55,61 (NE-I).
Recientemente se ha publicado un estudio controlado con ISC de uso exclusivamente nocturno para combatir el insomnio y la acinesia nocturna63. El estudio conforma la utilidad de ISC nocturno para esta indicación (NE-I).
La infusión continua de apomorfina subcutánea se trata en el capítulo 8 de este manual, dedicado a terapias de segunda línea (pag. 179).
La apomorfina se ha usado por diversas vías de administración, incluyendo las vías intranasal, rectal, transdérmica y sublingual64,65. En los meses posteriores a la edición de este manual, se comercializará la película sublingual de apomorfina (APL-130277) como nueva modalidad de fármaco de rescate. La película sublingual de apomorfina ha demostrado en ensayos controlados frente a placebo su eficacia clínica en el control de los episodios off66. (NE-I). Este fármaco se presentará en varias dosis y requiere una titulación precisa. Aunque generalmente es bien tolerado, hay que apreciar los efectos inflamatorios propios de la apomorfina en la mucosa bucal66, que explican la retirada del fármaco en un porcentaje de pacientes. La película sublingual de apomorfina se ha comparado con la apomorfina subcutánea en pen en un ensayo controlado67 (NE-II). La película sublingual de apomorfina es eficaz durante los primeros 10-20 minutos posdosis, y su eficacia durante los 30-90 minutos posdosis es similar a la apomorfina subcutánea, si bien la apomorfina subcutánea es más eficaz durante los 15-30 minutos posdosis67. Existe también un estudio comparativo respecto a dopa inhalada68. El estudio sugiere una potencia similar, pero la duración de efecto de la apomorfina sublingual parece prolongarse hasta los 90 minutos68 (NE-IV). La película sublingual de apomorfina es un fármaco adyuvante a demanda (on demand) que ofrece facilidad de uso y otra opción de rescate de los periodos off junto a la apomorfina subcutánea en pen y la LD inhalada.

Bibliografía
1. Foltynie T, Bruno V, Fox S, et al. Medical, surgical, and physical treatments for Parkinson’s disease. Lancet. 2024 Jan 20;403(10423):305-324.
20. Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review.JAMA. 2020 Feb 11;323 (6):548-560.
53. Rossi P, Colosimo C, Moro E, et al. Acute challenge with apomorphine and levodopa in Parkinsonism. Eur Neurol. 2000;43:95-101.
54. Deleu D, Hanssens Y, Northway MG. Subcutaneous apomorphine: an evidence-based review of its use in Parkinson’s disease. Drugs Aging. 2004;21:687-709.
55. Trenkwalder C, Chaudhuri KR, García Ruiz PJ, et al. Expert Consensus Group report on the use of apomorphine in the treatment of Parkinson’s disease--Clinical practice recommendations. Parkinsonism Relat Disord. 2015;21:1023-30.
56. Ostergaard L, Werdelin L, Odin P, et al. Pen injected apomorphine against off phenomena in late Parkinson’s disease: a double blind, placebo controlled study. J Neurol Neurosurg Psychiatry. 1995;58:681-7.
57. Dewey RB, Hutton JT, LeWitt PA, et al. A randomized, double-blind, placebo-controlled trial of subcutaneously injected apomorphine for parkinsonian off-state events. Arch Neurol. 2001;58:1385-92.
58. Pfeiffer RF, Gutmann L, Hull Jr KL, et al.; and The APO302 Study Investigators. Continued efficacy and safety of subcutaneous apomorphine in patients with advanced Parkinson’s disease. Parkinsonism Relat Disord. 2007;13(2):93-100.
59. García Ruiz PJ, Sesar Ignacio A, Ares Pensado B, et al. Efficacy of long-term continuous subcutaneous apomorphine infusion in advanced Parkinson’s disease with motor fluctuations: a multicenter study. Mov Disord. 2008;23:1130-6.
60. Borgemeester RW, Drent M, van Laar T. Motor and non-motor outcomes of continuous apomorphine infusion in 125 Parkinson’s disease patients. Parkinsonism Relat Disord. 2016;23:17-22.
61. Katzenschlager R, Poewe W, Rascol O, et al. Apomorphine subcutaneous infusion in patients with Parkinson’s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2018 Sep;17(9):749-759.
62. Dafsari HS, Martínez-Martín P, Rizos A, et al.; EUROPAR and the International Parkinson and Movement Disorders Society Non-Motor Parkinson’s Disease Study Group. EuroInf 2: Subthalamic stimulation, apomorphine, and levodopa infusion in Parkinson’s disease. Mov Disord. 2019 Mar;34(3):353-365.
63. De Cock VC, Dodet P, Leu-Semenescu S, et al. Safety and efficacy of subcutaneous night-time only apomorphine infusion to treat insomnia in patients with Parkinson’s disease (APOMORPHEE): a multicentre, randomised, controlled, double-blind crossover study. Lancet Neurol. 2022 May;21(5):428-437.
64. Montastruc JL, Rascol O, Senard JM, et al. Sublingual apomorphine: a new pharmacological approach in Parkinson’s disease? J Neural Transm Suppl. 1995;45:157-61.
65. Gancher ST, Nutt JG, Woodward WR. Absorption of apomorphine by various routes in parkinsonism. Mov Disord. 1991;6:212-6.
66. Bhargava P, Sciarappa K, Navia B, et al.; CTH-300 Study investigators. Apomorphine sublingual film for off episodes in Parkinson’s disease: a randomised, double-blind, placebo-controlled phase 3 study. Lancet Neurol. 2020 Feb;19(2):135-144.
67. Stocchi F, Rascol O, Poewe W, et al; for the CTH-302 Study Investigators. Apomorphine Sublingual Film Compared with Subcutaneous Apomorphine for OFF Episodes in Parkinson’s Disease: An Open-Label, Randomized, Crossover Study. J Parkinsons Dis. 2023;13(8):1329-1342.
68. Thach A, Zichlin ML, Kirson N, et al. Indirect comparison of apomorphine sublingual film and levodopa inhalation powder for Parkinson’s disease ‘OFF’ episodes. J Comp Eff Res. 2022 Mar;11(4):285-295.
La enzima monoaminooxidasa (MAO) es clave en el catabolismo de aminas, incluyendo la dopamina. Hay dos tipos de MAO: la MAO-A, que predomina en hígado y sistema gastrointestinal, y la MAO-B, que predomina en plaquetas y sistema nervioso central, especialmente a nivel de la glía69,70 .
Desde hace cinco décadas se conoce el efecto antiparkinsoniano de los inhibidores de la MAO (IMAO). Inicialmente se emplearon IMAO poco selectivos, y posteriormente se sintetizaron la selegilina y la rasagilina, fármacos selectivos inhibidores de la MAO-B1,20,69,70.
Los inhibidores de la MAO-B (IMAO-B) reducen el catabolismo de la dopamina e incrementan los niveles de dopamina a nivel cerebral. En la actualidad disponemos en la práctica clínica de tres fármacos con inhibición selectiva de la MAO-B. La selegilina y la rasagilina inhiben la MAO-B de manera irreversible67,68 (NE-IV). La safinamida, por el contrario, inhibe de manera reversible la MAO-B, así como los canales presinápticos de Na+, lo que se traduce en una disminución de la liberación de glutamato en regiones cerebrales con hiperexcitabilidad glutamatérgica1,20,69,70 (NE-IV).
La selegilina es un inhibidor selectivo (a dosis inferior a 20 mg/día) e irreversible de la MAO-B. La selegilina inicialmente se empleó asociada a LD en EP con fluctuaciones71, pero posteriormente, después del ya clásico DATATOP, también en monoterapia72 (NE-I).
La selegilina es eficaz en la EP avanzada, aunque fundamentalmente se ha usado en la EP inicial. El fármaco tiene efecto sintomático discreto, es bien tolerado, reduce la discapacidad funcional y retrasa la necesidad de la introducción de LD71-73 (NE-I). La selegilina es un fármaco eficaz en la EP inicial y reduce modestamente las fluctuaciones motoras en EP con fluctuaciones71-73. Fabrini73 y Cereda74 sugieren que la selegilina es un fármaco útil, aún vigente después de casi 40 años, con potencia similar a rasa- gilina73-74 (NE-III). Su mayor inconveniente es el efecto cerebral de sus metabolitos activos anfetamínicos (L-metanfetamina y L-anfetamina), que, si bien pueden tener efectos beneficiosos a nivel de hipersomnolencia diurna, pueden provocar alteraciones psiquiátricas con cuadros de hipomanía o impulsividad conductual72,74 (NE-I).
La rasagilina es un inhibidor selectivo e irreversible de la MAO-B. A diferencia de selegilina, no se metaboliza a derivados anfetamínicos y es mucho más selectivo para la MAO-B69,70 (NE-IV). La rasagilina es eficaz en la EP con fluctuaciones y reduce en 1 hora el tiempo off75,76 (NE-I); de hecho, la rasagilina presenta una eficacia similar a la de la entacapona en la reducción de tiempo off76 (NE-I). La rasagilina es un fármaco inhibidor MAO-B muy selectivo, de cómoda posología y en general bien tolerado, con efecto bien demostrado en EP inicial y avanzada1,20,75-77 (NE-I), y de rápido comienzo de acción78 (NE-II). El estudio ADAGIO, mediante diseño de delayed start en pacientes con EP inicial, evaluó si el tratamiento precoz con rasagilina podía demostrar efectos neuroprotectores. Los resultados no fueron concluyentes, pero se introdujo una herramienta potente para valorar fármacos neuroprotectores77 (NE-I). Finalmente, la rasagilina ha mostrado mejorías a nivel de funciones cognitivas de base atencional79 (NE-I).

Bibliografía
1. Foltynie T, Bruno V, Fox S, et al. Medical, surgical, and physical treatments for Parkinson’s disease. Lancet. 2024 Jan 20;403(10423):305-324.
20. Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review. JAMA. 2020 Feb 11;323(6):548-560.
67. Stocchi F, Rascol O, Poewe W, et al; for the CTH-302 Study Investigators. Apomorphine Sublingual Film Compared with Subcutaneous Apomorphine for OFF Episodes in Parkinson’s Disease: An Open-Label, Randomized, Crossover Study. J Parkinsons Dis. 2023;13(8):1329-1342.
68. Thach A, Zichlin ML, Kirson N, et al. Indirect comparison of apomorphine sublingual film and levodopa inhalation powder for Parkinson’s disease ‘OFF’ episodes. J Comp Eff Res. 2022 Mar;11(4):285-295.
69. Chen JJ, Swope DM. Clinical pharmacology of rasagiline: a novel, second-generation propargylamine for the treatment of Parkinson disease. J Clin Pharmacol. 2005;45:878-94.
70. Fernández HH, Chen JJ. Monoamine oxidase inhibitors: current and emerging agents for Parkinson disease. Clin Neuropharmacol. 2007;30:150-68.
71. Schachter M, Marsden CD, Parkes JD, et al. Deprenyl in the management of response fluctuations in patients with Parkinson’s disease on levodopa. J Neurol Neurosurg Psychiatry. 1980;43:1016-21.
72. Parkinson Study Group. DATATOP: a multicenter controlled clinical trial in early Parkinson’s disease. Arch Neurol. 1989;46:1052-60.
73. Fabbrini G, Abbruzzese G, Marconi S, et al. Selegiline: a reappraisal of its role en Parkinson disease. Clin Neuropharm. 2012;35:134-140.
74. Cereda E, Cilia R, Canesi M, et al. Efficacy of rasagiline and selegiline in Parkinson’s disease: a head-to-head 3-year retrospective case-control study. J Neurol. 2017 Jun;264(6):1254-1263.
75. Parkinson Study Group. A randomized placebo-controlled trial of rasagiline in levodopa-treated patients with Parkinson disease and motor fluctuations: the PRESTO study. Arch Neurol. 2005;62:241-8.
76. Rascol O, Brooks DJ, Melamed E, et al.; LARGO study group. Rasagiline as an adjunct to levodopa in patients with Parkinson’s disease and motor fluctuations (LARGO, Lasting effect in Adjunct therapy with Rasagiline Given Once daily, study): a randomised, double-blind, parallel-group trial. Lancet. 2005;365:947-54.
77. Olanow CW, Rascol O, Hauser R, et al. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease. N Engl J Med. 2009;361:1268-78.
78. Marsala S, Vitaliani R, Volpe D, et al. Rapid onset of efficacy of rasagiline in early Parkinson’s disease. Neurol Sci. 2013;34:2007-13.
79. Hanagasi HA, Gurvit H, Unsalan P, et al. The effects of rasagiline on cognitive deficits in Parkinson’s disease patients without dementia: a randomized, double-blind, placebo-controlled, multicenter study. Mov Disord. 2011;26:1851-8.
La safinamida representó el primer fármaco no puramente dopaminérgico introducido en décadas. La safinamida, diseñada inicialmente como fármaco antiepiléptico, mostro efectos in vitro e in vivo de interés para la EP80,81 (NE-IV). La safinamida posee varios mecanismos de acción, incluyendo la inhibición de los canales presinápticos de Na+ (con más afinidad por el receptor que la fenitoina) y de Ca+2. A través de la inhibición de los canales de Na+, es capaz de inhibir la liberación de glutamato en modelos in vitro e in vivo80-83 (NE-IV). Junto con la inhibición de los canales de Na+ y Ca2, la safinamida es un inhibidor reversible, muy selectivo y potente de la MAO-B80-83. Es interesante resaltar que la safinamida actúa como IMAO-B desde la dosis de 50 mg/día, mientras que ejerce su acción clínica antiglutamatérgica de manera más clara con la dosis de 100 mg/día (NE-I).
El primer estudio (en realidad se considera el estudio original y la extensión del mismo) observó una mejoría de las fluctuaciones motoras en pacientes con EP ya tratados con LD. Específicamente, se observó una mejoría del tiempo en off de 1,0-1,2 h en el grupo que recibió safinamida 50 mg y de 1,1-1,3 h pen el grupo tratado con 100 mg. También se observó mejoría frente a placebo en impresión clínica global de cambio (CGI-C), puntuaciones de la UPDRS-III en on y actividades de la vida diaria según la PDQ-3984,85 (NE-I). Más allá de los estudios controlados, se han realizado múltiples estudios de seguimiento, que confirman la eficacia y buena tolerancia de los ensayos clínicos, a la vez que muestran mejoría en diferentes parámetros no motores, y más específicamente a nivel de clínica depresiva, apatía, dolor y sueño86,88 (NE-II). Sin embargo, no se demostró que la safinamida fuera útil en la EP inicial en pacientes tratados con agonistas dopaminérgicos89 (NE-I).
En cualquier caso, se confirma que la safinamida es capaz de reducir las fluctuaciones motoras asociadas a la LD1,20,84,85 (NE-I) y parece ser eficaz en síntomas no motores como trastornos afectivos y dolor85-87 (NE-II). Aunque los estudios iniciales le aventuraban un posible efecto antidiscinético, en ningún estudio se ha confirmado este efecto terapéutico. Es evidente que se requieren nuevos estudios controlados para perfilar todas las posibilidades terapéuticas de este fármaco.

Bibliografía
1. Foltynie T, Bruno V, Fox S, et al. Medical, surgical, and physical treatments for Parkinson’s disease. Lancet. 2024 Jan 20;403(10423):305-324.
20. Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review. JAMA. 2020 Feb 11;323(6):548-560.
80. Caccia C, Maj R, Calabresi M, et al. Safinamide: from molecular targets to a new anti-Parkinson drug. Neurology. 2006;67(7 Suppl 2):S18-23.
81. Grégoire L, Jourdain VA, Townsend M, et al. Safinamide reduces dyskinesias and prolongs L-DOPA antiparkinsonian effect in parkinsonian monkeys. Parkinsonism Relat Disord. 2013;19:508-14-6.
82. Stayte S, Vissel B. Advances in non-dopaminergic treatments for Parkinson’s disease. Front Neurosci. 2014;8:113.
83. Deeks ED. Safinamide: first global approval. Drugs. 2015;75:705-11.
84. Borgohain R, Szasz J, Stanzione P, et al.; Study 016 Investigators. Randomized trial of safinamide add-on to levodopa in Parkinson’s disease with motor fluctuations. Mov Disord. 2014;29:229-37.
85. Borgohain R, Szasz J, Stanzione P, et al.; Study 018 Investigators. Two-year, randomized, controlled study of safinamide as add-on to levodopa in mid to late Parkinson’s disease. Mov Disord. 2014;29:1273-80.
86. Santos García D, Labandeira Guerra C, Yáñez Baña R, et al. Safinamide Improves Non-Motor Symptoms Burden in Parkinson’s Disease: An Open-Label Prospective Study. Brain Sci. 2021 Mar 2;11(3):316.
87. Bovenzi R, Liguori C, Canesi M, et al.; SYNAPSES Study Investigators Italian Group. Real-world use of Safinamide in motor fluctuating Parkinson’s disease patients in Italy. Neurol Sci. 2024 Feb;45(2):573-583.
88. Kulisevsky J, Martínez-Horta S, Campolongo A, et al. A Randomized Clinical Trial to Evaluate the Effects of Safinamide on Apathetic Non-demented Patients With Parkinson’s Disease. Front Neurol. 2022 Jun 2;13:866502.
89. Stocchi F, Borgohain R, Onofrj M, et al.; Study 015 Investigators A randomized, double-blind, placebo-controlled trial of safinamide as add-on therapy in early Parkinson’s disease patients. Mov Disord. 2012;27 (1):106-12.
La combinación de LD con un inhibidor de la dopa decarboxilasa (carbidopa, benserazida) contribuye a mejorar la biodisponibilidad de la LD. Sin embargo, la mayor parte de la LD sigue siendo metabolizada en el intestino por la catecol-O-metiltransferasa (COMT). La inhibición funcional de esta enzima mediante inhibidores de la COMT (ICOMT) es una estrategia racional para incrementar y mantener unos niveles plas- máticos de LD más estables1,20,90 (NE-IV). A su vez, la estabilidad plasmática de LD contribuye al alivio de fluctuaciones motoras90 (NE-IV).
Los dos ICOMT disponibles actualmente en el mercado son la entacapona y la opicapona. La tolcapona (ICOMT de acción central y periférica) es un fármaco potente, pero de uso marginal. La tolcapona reduce de manera significativa el tiempo off en unas 2 horas y permite disminuir de forma notable la dosis de LD (probablemente por su inhibición enzimática tanto a nivel central como periférico)91,92 (NE-I). Sin embargo, debido al riesgo de hepatotoxicidad, la tolcapona es actualmente un fármaco restringido, indicado solo para pacientes que no responden a entacapona u opicapona, y se recomienda control periódico de la función hepática93 (NE-IV).
La entacapona (inhibidor solo periférico) asociado a LD es eficaz en el alivio de EP con fluctuaciones motoras; disminuye el tiempo off de forma discreta (de 1,3 a 1,8 horas)94 (NE-I) sin los efectos secundarios hepáticos de la tolcapona. La entacapona habitualmente se asocia a la LD con carbidopa en un preparado que simplifica la posología, obteniéndose un efecto sintomático similar a la asociación de entacapona y LD carbidopa por separado95 (NE-IV).
Con la hipótesis de que la asociación precoz de entacapona asociada a LD-carbidopa disminuiría la tasa de complicaciones motoras, se realizó el ambicioso estudio STRIDE-PD. La hipótesis (racional y sustentada además por modelos experimentales) no se cumplió; aquellos pacientes tratados inicialmente con la combinación entacapona-LD-carbidopa presentaron mayor tasa de discinesias frente a aquellos únicamente tratados con LD-carbidopa96 (NE-I). En cualquier caso, levodopa/carbidopa/entacapona sigue siendo un fármaco cómodo y moderadamente eficaz para la EP con fluctuaciones94 (NE-I).
La farmacogenética ha aportado datos interesantes; Corvol et al. demostraron que el efecto de la entacapona variaba considerablemente en relación con la actividad enzimática individual de la COMT, que depende a su vez de un polimorfismo genético97 (NE-I). Estos datos explican la variabilidad de los efectos que observamos tras la administración de la entacapona.
La opicapona es un ICOMT de tercera generación que, por su mayor eficacia y simplicidad de uso, representa en la actualidad el ICOMT más usado20. Por su unión sostenida a la COMT, la opicapona asociada a la LD se administra una vez al día, mejorando la farmacocinética de la LD y mejorando de manera significativa las fluctuaciones motoras en la EP98,99 (NE-II). Un ensayo clínico frente a placebo y con entacapona como fármaco comparador activo confirmó que la opicapona es eficaz en pacientes con EP y fluctuaciones motoras, reduciendo el tiempo off en casi dos horas (116 minutos la opicapona a dosis de 50 mg; 96 minutos la entacapona y 56 minutos el placebo)100 (NE-I). En ese estudio se comprobó una clara relación dosis-respuesta, siendo la dosis de 50 mg la más efectiva clínicamente100 (NE-I). Recientemente, se ha confirmado en Japón la utilidad de la opicapona en pacientes con fluctuaciones motoras y se comprobó, además, mejoría en las escalas motoras en on101 (NE-I). Otro estudio reciente ha observado que la relación coste-efectividad era superior al añadir opicapona versus entacapona102 (NE-IV). Y el análisis agrupado de dos estudios de fase IV abiertos y prospectivos ha observado que añadir opicapona a las dosis previas de LD es más efectivo para reducir el tiempo off que aumentar 100 mg de LD, con una baja incidencia de efectos secundarios103,104 (NE-III), replicando observaciones previas donde se muestra que la opicapona presenta un mejor perfil de tolerabilidad en pacientes con fluctuaciones motoras recientes, en comparación con pacientes en estadios más avanzados105 (NE-III).

Bibliografía
1. Foltynie T, Bruno V, Fox S, et al. Medical, surgical, and physical treatments for Parkinson’s disease. Lancet. 2024 Jan 20;403(10423):305-324.
20. Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review. JAMA. 2020 Feb 11;323(6):548-560.
90. Gershanik OS. Improving L-dopa therapy: the development of enzyme inhibitors. Mov Disord. 2015;30(1):103-13.
91. Baas H, Beiske AG, Ghika J, et al. Catechol-O-methyltransferase inhibition with tolcapone reduces the “wearing off” phenomenon and levodopa requirements in fluctuating parkinsonian patients. J Neurol Neurosurg Psychiatry. 1997;63(4):421-8.
92. Adler CH, Singer C, O’Brien C, et al. Randomized, placebo-controlled study of tolcapone in patients with fluctuating Parkinson disease treated with levodopa-carbidopa. Tolcapone Fluctuator Study Group III. Arch Neurol. 1998;55(8):1089-95.
93. Olanow CW, Watkins PB. Tolcapone: an efficacy and safety review (2007). Clin Neuropharmacol. 2007 Sep-Oct;30(5):287-94.
94. Poewe WH, Deuschl G, Gordin A, et al.; Celomen Study Group. Efficacy and safety of entacapone in Parkinson’s disease patients with suboptimal levodopa response: a 6-month randomized placebo-controlled double-blind study in Germany and Austria (Celomen study). Acta Neurol Scand. 2002;105(4):245-55.
95. Hauser RA. Levodopa/carbidopa/entacapone (Stalevo). Neurology. 2004 Jan 13;62(1 Suppl 1):S64-71.
96. Stocchi F, Rascol O, Kieburtz K, et al. Initiating levodopa/carbidopa therapy with and without entacapone in early Parkinson disease: the STRIDE-PD study. Ann Neurol. 2010;68(1):18-27.
97. Corvol JC, Bonnet C, Charbonnier-Beaupel F, et al. The COMT Val158Met polymorphism affects the response to entacapone in Parkinson’s disease: a randomized crossover clinical trial. Ann Neurol. 2011;69(1):111-8.
98. Rocha JF, Almeida L, Falcao A, et al. Opicapone: a short lived and very long acting novel catechol-O-methyltransferase inhibitor following multiple dose administration in healthy subjects. Br J Clin Pharmacol. 2013;76(5):763-75.
99. Ferreira JJ, Rocha JF, Falcao A, et al. Effect of opicapone on levodopa pharmacokinetics, catechol-O-methyltransferase activity and motor fluctuations in patients with Parkinson’s disease. Eur J Neurol. 2015;22(5):815-25, e56.
100. Ferreira J, Lees A, Rocha JF, et al.; for the Bi-Park 1 investigators. Opicapone as an adjunct to levodopa in patients with Parkinson’s disease and end-of-dose motor fluctuations: a randomised, double-blind, controlled trial. Lancet Neurol. 2016 Feb;15(2):154-165. doi: 10.1016/S1474-4422(15)00336-1.
101. Takeda A, Takahashi R, Tsuboi Y, et al. Randomized, Controlled Study of Opicapone in Japanese Parkinson’s Patients with Motor Fluctuations. Mov Disord. 2021 Feb;36(2):415-423.
102. Hansen RN, Suh K, Serbin M, et al. Cost-effectiveness of opicapone and entacapone in reducing OFF-time in Parkinson’s disease patients treated with levodopa/carbidopa. J Med Econ. 2021 Jan-Dec;24(1):563-569.
103. Lee JY, Ma HI, Ferreira JJ, et al. Opicapone to Treat Early Wearing-off in Parkinson’s Disease Patients: The Korean ADOPTION Trial. Mov Disord Clin Pract. 2024 Jun;11(6):655-665.
104. Ferreira JJ, Lee JY, Ma HI, Jeon B, Poewe W, Antonini A, et al.; ADOPTION study investigators. Opicapone for the treatment of early wearing-off in levodopa-treated Parkinson’s disease: pooled analysis of patient level data from two randomized open-label studies. J Neurol. 2024 Oct;271(10):6729-6738.
105. Rocha JF, Ebersbach G, Lees A, et al. The safety/tolerability of opicapone when used early in Parkinson’s disease patients with levodopa-induced motor fluctuations: A post-hoc analysis of BIPARK-I and II. Front Neurol. 2022 Aug 23;13:994114.
La amantadina (o clorhidrato de amantadina) es un fármaco clásico antiparkinsoniano de múltiples aplicaciones y mecanismos de acción; inicialmente conocido por sus propiedades antivirales, su efecto antiparkinsoniano fue hallado de forma casual106 y confirmado posteriormente en varios estudios107,108 (NE-I).
El efecto antidiscinético de la amantadina frente a las discinesias inducidas por LD ha sido confirmado en estudios rigurosos109 (NE-I). Recientemente se ha ensayado un preparado de liberación retardada de amantadina que confirma su efecto antidiscinético en la EP110 (NE-I) y, además, parece incrementar el tiempo on sin discinesias111 (NE-I). Este fármaco aún no ha sido comercializado en el momento de esta actualización.
La amantadina es un fármaco interesante, cuyos múltiples mecanismos han sido recientemente revisados y comentados por Peter Riederer112 (NE-IV). La amantadina posee propiedades antiglutamatérgicas, es anticolinérgico e inhibidor de la fosfodiesterasa y actúa sobre canales de K+. Tal vez el mecanismo más interesante sea el incremento de actividad dopa descarboxilasa central (único fármaco antiparkinsoniano con este mecanismo)112.

Bibliografía
106. Schwad RS, England AC, Poskanzer DC, et al. Amantadine in the treatment of Parkinson’s disease. JAMA. 1969; 208:1168-1170.
107. Dallos V, Heathfield K, Stone P, et al. Use of amantadine in Parkinson’s disease. Result of a double-blind trial. Br Med J. 1970;4:24-26.
108. Butzer J, Silver D, Sahs AL. Amantadine in Parkinson’s disease. A double-blind, placebo- controlled crossover study with long-term follow-up. Neurology. 1975;25:603-606.
109. De Silva-Júnior FP, Braga-Nieto P, Suali Monte F, et al. Amantadine reduces the duration of levodopa-induced dyskinesia: A randomized, double-blind, placebo-controlled study. Parkinsonism Relat Disord 2005;11:449-452.
110. Pahwa R, Tanner CM, Hauser RA, et al. Amantadine extended release for levodopa-induced dyskinesia in Parkinson’s disease (EASED Study). Mov Disord. 2015;30:788-95.
111. Hauser RA, Walsh RR, Pahwa R, et al. Amantadine ER Significantly Increases ON Time Without Any Dyskinesia: Pooled Analyses From Pivotal Trials in Parkinson’s Disease. Front Neurol. 2021 Mar 26;12:645706.
112. Danysz W, Dekundy A, Scheschonka A, et al. Amantadine: reappraisal of the timeless diamond-target updates and novel therapeutic potentials. J Neural Transm (Vienna). 2021 Feb;128 (2):127-169.
Hablamos de la EP inicial para referirnos al periodo de tiempo que va desde el diagnóstico hasta la aparición de las primeras complicaciones motoras o fluctuaciones clínicas (FC) (motoras o no motoras).
Los fármacos que se emplean en la EP inicial son: LD combinada con un inhibidor de la decarboxilasa periférica (carbidopa o benserazida), agonistas dopaminérgicos (AD), IMAO-B, ICOMT, amantadina y anticolinérgicos. Ninguno de ellos ha podido demostrar un efecto modificador del curso de la enfermedad. Los fármacos indicados al inicio en aquellas personas con EP que precisen tratamiento sintomático son LD, IMAO-B, ICOMT o AD1 (NE-I). La combinación de LD con otros fármacos antiparkinsonianos desde la fase inicial de la EP es aceptable, con el fin de evitar dosis elevadas de LD2 (NE-I).
El tratamiento de las manifestaciones no motoras se revisa específicamente en el capítulo 9, dedicado al tratamiento y manejo de las complicaciones no motoras (pag. 213). Otro apartado importante en la EP inicial como es el ejercicio físico y otras terapias no farmacológicas se revisan en el capítulo 12, donde se tratan la actividad física, ejercicio y fisioterapia en la EP (pag. 307). En el Anexo I (Pág. 369) se puede consultar un algoritmo de manejo de la enfermedad de Parkinson inicial.
Bibliografía
1. Pringsheim T, Day GS, Smith DB, et al.; Guideline Subcommittee of the AAN. Dopaminergic Therapy for Motor Symptoms in Early Parkinson Disease Practice Guideline Summary: A literature the AAN Guideline Subcommittee. Neurology. 2021 Nov 16;97(20):942-957.
2. Lees A, Tolosa E, Stocchi F, et al. Optimizing levodopa therapy, when and how? Perspectives on the importance of delivery and the potential for an early combination approach. Expert Rev Neurother. 2023 Jan;23(1):15-24.
La LD es el gold standard del tratamiento de la EP. Es también el fármaco que tiene el perfil más seguro de efectos adversos, sobre todo en las personas de mayor edad1,3 (NE-I). Los estudios ELLDOPA, PD-MED y LEAP evaluaron la LD como tratamiento de novo para la EP4-8 (NE-I). Hasta la fecha, no hay evidencia de que la LD tenga un efecto neuroprotector9 (NE-I), pero las evidencias apoyan que no tiene tampoco un efecto tóxico tras largos años de uso10 (E-IV).
El estudio LEAP mostró que el inicio temprano de la terapia dopaminérgica se asocia con efectos positivos en la calidad de vida (CdV) de las personas con EP, incluso cuando la discapacidad es imperceptible7,8, aunque en estas fases no sería preciso comenzar tratamiento11 (NE-I). Una revisión sistemática de ensayos clínicos (EC) en personas con EP inicial que recibieron LD en monoterapia frente a terapias ahorradoras de LD (fundamentalmente AD) mostró que la LD sola podría ser superior en cuanto a control motor12(NE-II).
Cilia et al. mostraron que retrasar el inicio de LD no reduce el riesgo de desarrollar complicaciones motoras o fluctuaciones clínicas (FC)13. Dado que las FC se relacionan con la duración de la EP y no con la exposición acumulada a LD, no se recomienda retrasar su introducción4,14,15 (NE-I). No obstante, la administración de LD en la EP inicial puede asociarse a la presencia más precoz de FC, especialmente en pacientes jóvenes16 (NE-III).
Los EC en EP inicial han demostrado beneficio sintomático con LD a dosis de 150- 300 mg/día y menor riesgo de desarrollar discinesias con dosis menores a 5,5 mg/kg/día o 400 mg/día11 (NE-I). Las formulaciones de liberación prolongada no evitan el desarrollo de FC y presentan menor biodisponibilidad y mejoría menos predecible15,17,18 (NE-I y II).
Debido al riesgo de producirse un síndrome parkinsonismo-hiperpirexia por retirada brusca de LD, su discontinuación debe ser gradual19 (NE-IV).
Para mejorar la tolerabilidad gastrointestinal y el efecto hipotensor de la LD, especialmente cuando se toma antes de las comidas para evitar competición con proteínas de la dieta, se puede administrar domperidona. Es preciso valorar el riesgo cardiovascular de cada paciente y utilizar no más de 30 mg/día de este antiemético para evitar arritmias graves por prolongación del QT20-22 (NE-IV).
Bibliografía
1. Pringsheim T, Day GS, Smith DB, et al.; Guideline Subcommittee of the AAN. Dopaminergic Therapy for Motor Symptoms in Early Parkinson Disease Practice Guideline Summary: A literature the AAN Guideline Subcommittee. Neurology. 2021 Nov 16;97(20):942-957.
2. Lees A, Tolosa E, Stocchi F, et al. Optimizing levodopa therapy, when and how? Perspectives on the importance of delivery and the potential for an early combination approach. Expert Rev Neurother. 2023 Jan;23(1):15-24.
3. Klietz M, Greten S, Wegner F, et al. Safety and Tolerability of Pharmacotherapies for Parkinson’s Disease in Geriatric Patients. Drugs Aging. 2019 Jun;36(6):511-530.
4. Fahn S, Oakes D, Shoulson I, et al. Levodopa and the progression of Parkinson’s disease. N Engl J Med. 2004;351:2498-508.
5. Gray R, Patel S, Ives N, et al., PD MED Collaborative Group. Long-term Effectiveness of Adjuvant Treatment With Catechol-O-Methyltransferase or Monoamine Oxidase B Inhibitors Compared With Dopamine Agonists Among Patients With Parkinson Disease Uncontrolled by Levodopa Therapy: The PD MED Randomized Clinical Trial. JAMA Neurol. 2022 Feb 1;79(2):131-140.
6. Gray R, Ives N, Rick C, et al.; PD Med Collaborative Group. Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson’s disease (PD MED): a large, open-label, pragmatic randomised trial. Lancet. 2014 Sep 27;384(9949):1196-205.
7. Verschuur CVM, Suwijn SR, Boel JA, et al.; LEAP Study Group. Randomized Delayed-Start Trial of Levodopa in Parkinson’s Disease. N Engl J Med. 2019 Jan 24;380(4):315-324.
8. Frequin HL, Schouten J, Verschuur CVM, et al.; LEAP Study Group. Levodopa Response in Patients With Early Parkinson Disease: Further Observations of the LEAP Study. Neurology. 2023 Jan 24;100(4):e367-e376.
9. Meissner WG, Frasier M, Gasser T, et al. Priorities in Parkinson’s disease research. Nat Rev Drug Discov. 2011 May;10(5):377-93.
10. Rajput AH, Rajput ML, Robinson CA, et al. Normal substantia nigra patients treated with levodopa - Clinical, therapeutic and pathological observations. Parkinsonism Relat Disord. 2015 Oct;21(10):1232-7.
11. Olanow CW. Levodopa is the best symptomatic therapy for PD: Nothing more, nothing it. Mov Disord. 2019 Jun;34(6):812-815.
12. Zhao YT, Liu L, Zhao Y, et al. The effect and safety of levodopa alone versus levodopa sparing therapy for early Parkinson’s disease: a systematic review and meta-analysis. J Neurol. 2022 Apr;269(4):1834-1850.
13. Cilia R, Cereda E, Akpalu A, et al. Natural history of motor symptoms in Parkinson’s disease and the long-duration response to levodopa. Brain. 2020 Aug 1;143(8):2490-2501.
14. Espay AJ, Morgante F, Merola A, et al. Levodopa-induced dyskinesia in Parkinson disease: Current and evolving concepts. Ann Neurol. 2018 Dec;84(6):797-811.
15. Xie CL, Zhang YY, Wang XD, et al. Levodopa alone compared with levodopa-sparing therapy as initial treatment for Parkinson’s disease: a meta-analysis. Neurol Sci. 2015;36(8):1319-29.
16. López IC, Ruiz PJ, Del Pozo SV, et al. Motor complications in Parkinson’s disease: ten year follow-up study. Mov Disord. 2010 Dec 15;25(16):2735-9.
17. Hsu A, Yao HM, Gupta S, et al. Comparison of the pharmacokinetics iter oral extended-release capsule formulation of carbidopa-levodopa (IPX066) with immediate-release carbidopa-levodopa (Sinemet®), sustained-release carbidopa-levodopa (Sinemet® CR), and carbidopa-levodopa-entacapone (Stalevo®). J Clin Pharmacol. 2015 Sep;55(9):995-1003.
18. Dhall R, Kreitzman DL. Advances in levodopa therapy for Parkinson disease: Review of RYTARY (carbidopa and levodopa) clinical efficacy and safety. Neurology. 2016 Apr 5;86(14 Suppl 1):S13-24.
19. Grimes D, Fitzpatrick M, Gordon J, et al. Canadian guideline for Parkinson disease. CMAJ. 2019 Sep 9;191(36):E989-E1004.
20. Ramprasad C, Douglas JY, Moshiree B. Parkinson’s Disease and Current Treatments for Its Gastrointestinal Neurogastromotility Effects. Curr Treat Options Gastroenterol. 2018 Dec;16(4):489-510.
21. Victorino DB, Nejm MB, Guimarães-Marques MJ, et al. Domperidone in Parkinson’s disease: a valuable controversy, but unnecessary panic. Fam Pract. 2020 Oct 19;37(5):723-724.
22. Scorza FA, de Almeida AG, Scorza CA, et al. Gastrointestinal dysfunctions and sudden death in Parkinson patients: domperidone in FOCUS. J Investig Med. 2023 Jun;71(5):540-541.
El pramipexol, el ropinirol y la rotigotina transdérmica son AD no ergóticos eficaces en monoterapia en fases iniciales de la EP23 (NE-I). El ropinirol y el pramipexol de liberación prolongada no son menos eficaces que los de liberación inmediata24 (NE-I).
Los AD son menos eficaces que la LD para mejorar la sintomatología motora y la CdV. También, su perfil de efectos adversos es menos seguro y podrían inducir o empeorar las discinesias, una vez que se necesita asociar LD al tratamiento5,14 (NE-I). Comparado con LD, el ropinirol podría asociarse a un menor riesgo de desarrollar discinesias, y el pramipexol a un menor riesgo de fluctuaciones motoras25 (NE-I).
Entre los efectos adversos se encuentran trastornos del control de impulsos (TCI), somnolencia, alucinaciones, hipotensión ortostática, edemas o reacciones cutáneas (rotigotina). Deberá chequearse la presencia de estos efectos adversos en cada visita1,26 (NE-I). Las características que predisponen a desarrollar TCI serían: varón, joven, con historia previa de TCI o de depresión, apatía, edad más avanzada con deterioro cognitivo o historia familiar de TCI o adicciones. Deberían evitarse los AD en estos perfiles1,27,28 (NE-I).
Ninguno de los AD ergóticos (bromocriptina, lisurida, pergolida y cabergolina) deberían utilizarse como primera línea del tratamiento en la EP, y en todo caso bajo estrecha vigilancia cardiológica por su asociación con fibrosis valvular29 (NE-II).
En el supuesto de que fuera necesario retirar o bajar dosis de un AD por la aparición de efectos secundarios u otra razón, su discontinuación debe ser gradual para evitar el síndrome de abstinencia por retirada brusca de AD30 (NE-III).
Bibliografía
1. Pringsheim T, Day GS, Smith DB, et al.; Guideline Subcommittee of the AAN. Dopaminergic Therapy for Motor Symptoms in Early Parkinson Disease Practice Guideline Summary: A literature the AAN Guideline Subcommittee. Neurology. 2021 Nov 16;97(20):942-957.
5. Gray R, Patel S, Ives N, et al., PD MED Collaborative Group. Long-term Effectiveness of Adjuvant Treatment With Catechol-O-Methyltransferase or Monoamine Oxidase B Inhibitors Compared With Dopamine Agonists Among Patients With Parkinson Disease Uncontrolled by Levodopa Therapy: The PD MED Randomized Clinical Trial. JAMA Neurol. 2022 Feb 1;79(2):131-140.
14. Espay AJ, Morgante F, Merola A, et al. Levodopa-induced dyskinesia in Parkinson disease: Current and evolving concepts. Ann Neurol. 2018 Dec;84(6):797-811.
23. Baker WL, Silver D, White CM, et al. Dopamine agonists in the treatment of early Parkinson’s disease: a meta-analysis. Parkinsonism Relat Disord. 2009 May;15(4):287-94.
24. Ferreira JJ, Katzenschlagerb R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
25. Zhang Q, Chen X, Chen F, et al. Dopamine agonists versus levodopa monotherapy in early Parkinson’s disease for the potential risks of motor complications: A network meta-analysis. Eur J Pharmacol. 2023 Sep 5;954:175884.
26. Connolly BS, Lang AE. Pharmacological treatment of Parkinson’s disease: a review. JAMA. 2014;311:1670-83.
27. Santos-García D, de Deus Fonticoba T, Cores Bartolomé C, et al.; COPPADIS Study Group. Depression is Associated with Impulse-compulsive Behaviors in Parkinson’s disease. J Affect Disord. 2021 Feb 1;280(Pt B):77-89.
28. Marín-Lahoz J, Sampedro F, Martinez-Horta S, et al. Depression as a Risk Factor for Impulse Control Disorders in Parkinson Disease. Ann Neurol. 2019 Nov;86(5):762-769.
29. Schade R, Andersohn F, Suissa S, et al. Dopamine agonist and the risk of cardiac-valve regurgitation. N Engl J Med. 2007;356:29-38.
30. Garcia X, Mohammad ME, Patel S, et al. Dopamine agonist withdrawal syndrome associated factors: A retrospective chart review. Clin Park Relat Disord. 2022 Jul 16;7:100153.
La selegilina y la rasagilina en monoterapia tienen un efecto sintomático leve, y su uso puede retrasar un tiempo la necesidad de añadir otros tratamientos dopaminérgicos31 (NE-I). La combinación de AD y rasagilina puede ofrecer un mejor control de los síntomas que la monoterapia con AD32 (NE-I). En un ensayo clínico, doble ciego, controlado con placebo, la combinación de safinamida y pramipexol en un mismo comprimido demostró superioridad con respecto a sus componentes individuales, y es comparable con las dosis comerciales de pramipexol, con menor somnolencia y menos eventos adversos dopaminérgicos33 (NE-I).
La safinamida posee un mecanismo de acción dual: dopaminérgico (inhibición selectiva y reversible de la MAO-B) y no dopaminérgico (modulación de glutamato). Un estudio mostró que añadir 100 mg de safinamida en pacientes con EP inicial que recibían un solo AD se asoció con una mejoría motora con respecto a placebo, aunque esta mejoría no se confirmó con 200 mg diarios34 (NE-I). La evidencia actual para la eficacia de safinamida en la EP inicial sin fluctuaciones como tratamiento adyuvante a los AD es aún limitada, si bien muestra un buen perfil de seguridad entre 50 mg y 200 mg, sin diferencias significativas en EA35 (NE-I).
Bibliografía
31. Olanow CW, Rascol O, Hauser R, et al. A double-blind, delayed-start trial of rasagiline in Parkinson’s disease. N Engl J Med. 2009;361:1268-78.
32. Hauser RA, Silver D, Choudhry A, et al.; ANDANTE study investigators. Randomized, controlled trial of rasagiline as an add-on to dopamine agonists in Parkinson’s disease. Mov Disord. 2014;29(8):1028-34.
33. Hauser RA, Giladi N, Poewe W, et al. P2B001 (Extended Release Pramipexole and Rasagiline): A New Treatment Option in Development for Parkinson’s Disease. Adv Ther. 2022 May;39(5):1881-1894.
34. Stocchi F, Borgohain R, Onofrj M, et al.; Study 015 Investigators. A randomized, double-blind, placebo-controlled trial of safinamide as add-on therapy in early Parkinson’s disease patients. Mov Disord. 2012 Jan;27(1):106-12.
35. Giossi R, Carrara F, Mazzari M, et al. Overall Efficacy and Safety of Safinamide in Parkinson’s Disease: A Systematic Review and a Meta-analysis. Clin Drug Investig. 2021 Apr;41(4):321-339.
En el estudio STRIDE-PD, las personas con EP inicial tratadas con LD/entacapona (LCE) presentaron un riesgo mayor de desarrollar discinesias tempranas36 (NE-II).
Un estudio aleatorizado, doble ciego, evidenció que los pacientes no fluctuantes también se beneficiaban del tratamiento con LCE, evidenciando mejores puntuaciones de las actividades de la vida diaria (AVD) y un leve menor requerimiento de LD, con buena tolerancia al tratamiento37 (NE-I).
En un metaanálisis reciente en pacientes con EP inicial que recibían LCE frente a LD, la LCE presentó mejores resultados en cuanto a función motora y actividades de la vida diaria, si bien también se asoció con mayor riesgo de efectos adversos y de abandono38 (NE-I). El estudio EPSILON, aún en curso, pretende evaluar la opicapona en dosis de 50 mg como tratamiento adyuvante a LD en la EP inicial. Los resultados preliminares indican que añadir opicapona a LD supondría una mejoría en función motora y menor riesgo de FC39-41 (NE-I)
Bibliografía
36. Stocchi F, Rascol O, Kieburtz K, et al. Initiating levodopa/carbidopa therapy with and without entacapone in early Parkinson disease: the STRIDE-PD study. Ann Neurol. 2010;68(1):18-27.
37. Brooks DJ, Sagar H; UK-Irish Entacapone Study Group. Entacapone is beneficial in both fluctuating and non-fluctuating patients with Parkinson’s disease: a randomised, placebo controlled, double blind, six month study. J Neurol Neurosurg Psychiatry. 2003 Aug;74(8):1071-9.
38. Liao X, Wu N, Liu D, et al. Levodopa/carbidopa/entacapone for the treatment of early Parkinson’s disease: a meta-analysis. Neurol Sci. 2020 Aug;41(8):2045-2054.
39. Ferreira JJ, Poewe W, Rascol O, et al. Opicapone as an Add-on to Levodopa in Patients with Parkinson’s Disease Without Motor Fluctuations: Rationale and Design of the Phase III, Double-Blind, Randomised, Placebo-Controlled EPSILON Trial. Neurol Ther. 2022 Sep;11(3):1409-1425.
40. Ferreira JJ, Rascol O, Stocchi F, et al. Opicapone as adjunctive to levodopa-treated Parkinson´s disease patients without motor complications: Preliminary data from the EPSILON Study. Presentado en el International Congress of Parkinson’s Disease and Movement Disorders (MDS); 27-31 de agosto de 2023; Copenhague, Dinamarca.
41. Jenner P, Rocha JF, Ferreira JJ, et al. Redefining the strategy for the use of COMT inhibitors in Parkinson’s disease: the role of opicapone. Expert Rev Neurother. 2021 Sep;21(9):1019-1033.
La amantadina sería un fármaco probablemente eficaz y seguro para el tratamiento de la EP inicial, tanto en monoterapia como asociado a LD, con un efecto sintomático leve, similar al de los IMAO-B42 (NE-II). Un estudio reciente retrospectivo que analizó datos de historias clínicas durante siete años mostró que las personas con EP inicial que recibieron amantadina como adyuvante a LD durante al menos seis meses presentaron un riesgo menor de discinesias con respecto a las que habían recibido fármacos anticolinérgicos o IMAO-B43 (NE-III). En un ensayo clínico en fase 1, aleatorizado, doble ciego, controlado con placebo, presentado en la MDS, aún no publicado, la combinación de amantadina con LD en la EP inicial redujo en un 50% la aparición de discinesias tras 18 meses, con un deterioro menor en cuanto a los resultados de bloqueos de la marcha, fatiga y calidad de vida44 (NE-I).
Los eventos adversos más frecuentes de la amantadina son las alucinaciones visuales, confusión, visión borrosa, edema en las piernas, sequedad de boca y estreñimiento, y son más frecuentes con dosis más altas. Con menor frecuencia de aparición y a dosis altas, podría prolongar el intervalo QT, con el riesgo de torsades de pointes y muerte súbita45 (NE-I). Además, hay estudios retrospectivos abiertos con un elevado número de pacientes que han mostrado una asociación del uso de amantadina con TCI46,47 (NE-III).
Se puede producir un síndrome de abstinencia por retirada brusca de amantadina, por lo que su discontinuación debe ser gradual48 (NE-IV).
Bibliografía
42. Rascol O, Fabbri M, Poewe W. Amantadine in the treatment of Parkinson’s disease and other movement disorders. Lancet Neurol. 2021 Dec;20(12):1048-1056.
43. Wang CC, Wu TL, Lin FJ, et al. Amantadine treatment and delayed onset of levodopa-induced dyskinesia in patients with early Parkinson’s disease. Eur J Neurol. 2022 Apr;29(4):1044-1055.
44. Rascol O, Ory-Magne F, Azulay JP, et al. Decreased occurrence of dyskinesia when combining amantadine to L-DOPA in early Parkinson disease (PD): the PREMANDYSK trial. Presentado en el 2023 International Congress de la IPMDS. Disponible en: https://www.mdsabstracts.org/abstract/decreased-occurrence-of-dyskinesia-when-combining-amantadine-to-l-dopa-in-early-parkinson-disease-pd-the-premandysk-trial/
45. Rascol O, Fabbri M, Poewe W. Amantadine in the treatment of Parkinson’s disease and other movement disorders. Lancet Neurol. 2021 Dec;20(12):1048-1056.
46. Weintraub D, Koester J, Potenza MN, et al. Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients. Arch Neurol. 2010;67(5):589-95.
47. García-Ruiz PJ, Martínez Castrillo JC, Alonso-Cánovas A, et al. Impulse control disorder in patients with Parkinson’s disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014;85(8):840-4.
48. Murray JP, Kerins A. Amantadine withdrawal syndrome masquerading as COVID-19 encephalopathy: a case report and review of the literature. Oxf Med Case Reports. 2021 Feb 15;2021(2):133.
Tienen un efecto leve sobre el temblor, por ejemplo, trihexifenidilo en dosis iniciales progresivas de 1-2 mg cada 8 h, y se recomienda su uso en pacientes más jóvenes, aunque no hay suficiente evidencia para su utilización, que se ve limitada por efectos adversos cognitivos y psiquiátricos 24 (NE-II).

Bibliografía
24. Ferreira JJ, Katzenschlagerb R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
Con la progresión de la EP, los pacientes experimentan una pérdida progresiva de la eficacia sintomática del tratamiento dopaminérgico y la aparición de las complicaciones motoras, generalmente relacionadas con la LD: fluctuaciones y discinesias. Son las complicaciones más frecuentes del tratamiento con fármacos dopaminérgicos y siguen siendo el reto terapéutico más complejo. La probabilidad de sufrir dichas complicaciones es del 40% tras 4-6 años de tratamiento con LD1.
Los factores de riesgo para el desarrollo de complicaciones incluyen:
-
Gravedad de la enfermedad y tiempo de evolución.
-
Tratamiento crónico con LD: después de iniciar el tratamiento con LD desarrollan complicaciones motoras un 10% de pacientes por año. Influyen negativamente diferentes factores:
-
Dosis elevadas ( > 600 mg/día) de LD en etapas iniciales.
-
Forma de administración del fármaco: estimulación crónica pulsátil de los receptores dopaminérgicos postsinápticos frente a estimulación continua.
-
-
Edad de inicio de la EP (inicio joven).
-
Fenotipo clínico rígido-acinético y presencia de algunos síntomas no motores (depresión y ansiedad al inicio de la EP).
-
Factores farmacogenéticos: existen polimorfismos genéticos de los receptores dopaminérgicos que favorecen el desarrollo de complicaciones.
-
Mujeres y pacientes con bajo peso se han relacionado con mayor incidencia de discinesias.
En este capítulo abordaremos el tratamiento de las fluctuaciones motoras iniciales que ocurren tras esos primeros años de enfermedad con buena respuesta a fármacos o ya en fases no iniciales, pero con una intensidad leve-moderada, que se puede concretar en tiempos off < 2 horas o < 1 hora de discinesias incapacitantes si nos atenemos a los criterios 5-2-12 para identificar la EP ya más avanzada y que requería valorar la indicación de las terapias de segunda línea que se revisan en el capítulo 8 de este manual (pag. 179).
Bibliografía
1. Ahlskog JE, Muenter MD. Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature. Mov Disord. 2001;16:448-58.
2. Malaty IA, Martínez-Martín P, Chaudhuri KR, et al. Does the 5–2-1 criteria identify patients with advanced Parkinson’s disease? Real-world screening accuracy and burden of 5–2-1-positive patients in 7 countries. BMC Neurol. 2022 Jan 24;22(1):35.
En la génesis de las complicaciones motoras participan numerosos factores:
-
Pérdida de neuronas dopaminérgicas de la SN compacta con la consiguiente denervación dopaminérgica y reducción de dopamina estriatal.
-
Factores farmacocinéticos centrales como:
-
Reducción de la síntesis de dopamina a partir de LD.
-
Conservación del metabolismo de dopamina por las enzimas MAO y COMT.
-
Disminución de la capacidad para almacenar dopamina presináptica.
-
Dependencia directa del aporte externo de LD.
-
-
Factores farmacodinámicos de la LD que provocan una estimulación anormal pulsátil de los receptores y cambios possinápticos. La vida media de los fármacos influye en la forma de estimulación de los receptores y se considera importante un mecanismo de estimulación dopaminérgica continuada.
-
Factores farmacocinéticos de la LD periféricos que modifican los niveles plasmáticos y su disponibilidad cerebral (absorción gastrointestinal).
En las discinesias, además de los mecanismos ya referidos, se debe considerar:
-
Hipersensibilidad de los receptores D1 por estimulación pulsátil postsináptica.
-
Mecanismos no dopaminérgicos serotoninérgicos que transforman la LD exógena a dopamina, pero sin mecanismos de control.
-
Respuesta anormal estriatal de las neuronas medianas espinosas gabaérgicas, con estimulación de la vía directa con hipoactividad del pálido interno y núcleo subtalámico y activación talamocortical.
Aumento de la actividad glutamatérgica al estriado desde el córtex cerebral.
Las fluctuaciones motoras se definen como la presencia de variaciones, falta de respuesta adecuada, poca duración del beneficio y en ocasiones respuesta clínica impredecible a una dosis de LD. El paciente presenta periodos con menor beneficio farmacológico a la LD y reaparición de los síntomas parkinsonianos, que son los denominados periodos off. Estos se suelen alternar con fases de mejoría de los síntomas después de la administración de una dosis de LD, descritos como estado on, y en los que se pueden presentar movimientos involuntarios denominados discinesias. Pueden asociarse a síntomas no motores (fluctuaciones no motoras)3.
La respuesta a la LD se suele dividir en tres franjas de tiempo: 1) inicio de beneficio de dosis (beginning of dose), que es cuando el paciente nota el primer beneficio y el paso a estado on; 2) pico de dosis (peak dose) o máximo beneficio de los síntomas, y 3) fin de dosis (end of dose), cuando reaparecen los síntomas parkinsonianos.
Fluctuaciones motoras
Los diferentes tipos de fluctuaciones motoras (Tabla I) son:
-
Deterioro de fin de dosis predecible (wearing-off): es la reaparición gradual de los síntomas parkinsonianos al final de cada dosis de LD. La duración del beneficio de la LD es igual o inferior a 4 horas y se produce un declive regular y previsible de su Cuanto más corto es el periodo de beneficio, más grave es el fenómeno de wearing-off. Se relaciona con los niveles plasmáticos de LD.
-
Acinesia matutina: presencia de los síntomas parkinsonianos, efecto de la última dosis del día anterior; suele ser la primera manifestación de fluctuación motora.
-
Off súbito impredecible: aparición aguda de los síntomas parkinsonianos, no relacionado con la toma de LD. Los síntomas suelen aparecer en pocos segundos (sudden off), son muy intensos y en forma de acinesia muy Se presenta en una fase más avanzada de la enfermedad.
-
Fallo de dosis, respuesta parcial o retrasada: una dosis de LD no consigue el beneficio esperado en un paciente que responde a la LD. El beneficio puede retrasarse minutos u horas (delayed on), no ser óptimo (partial on) o estar ausente (doce failure o no on). Esta falta de eficacia suele producirse por la tarde-noche y en pacientes con fluctuaciones graves que requieren gran número de tomas al día.
-
Empeoramiento de inicio de dosis (beginning of dose worsening): empeoramiento transitorio de los síntomas, principalmente del temblor, en los primeros minutos después de la dosis de LD, antes del inicio del beneficio.
-
Rebote de final de dosis (end of dose rebound): exacerbación o rebote de los síntomas parkinsonianos, que son más intensos que los del estado basal sin tratamiento y aparecen al final de la dosis. Es muy infrecuente.
-
Fluctuaciones on-off/yo-yoing: también denominadas oscilaciones al azar u on-off El término se utiliza para describir cambios rápidos u oscilaciones predecibles o impredecibles entre el estado on y el estado off durante el curso de una dosis de LD o a lo largo del día.
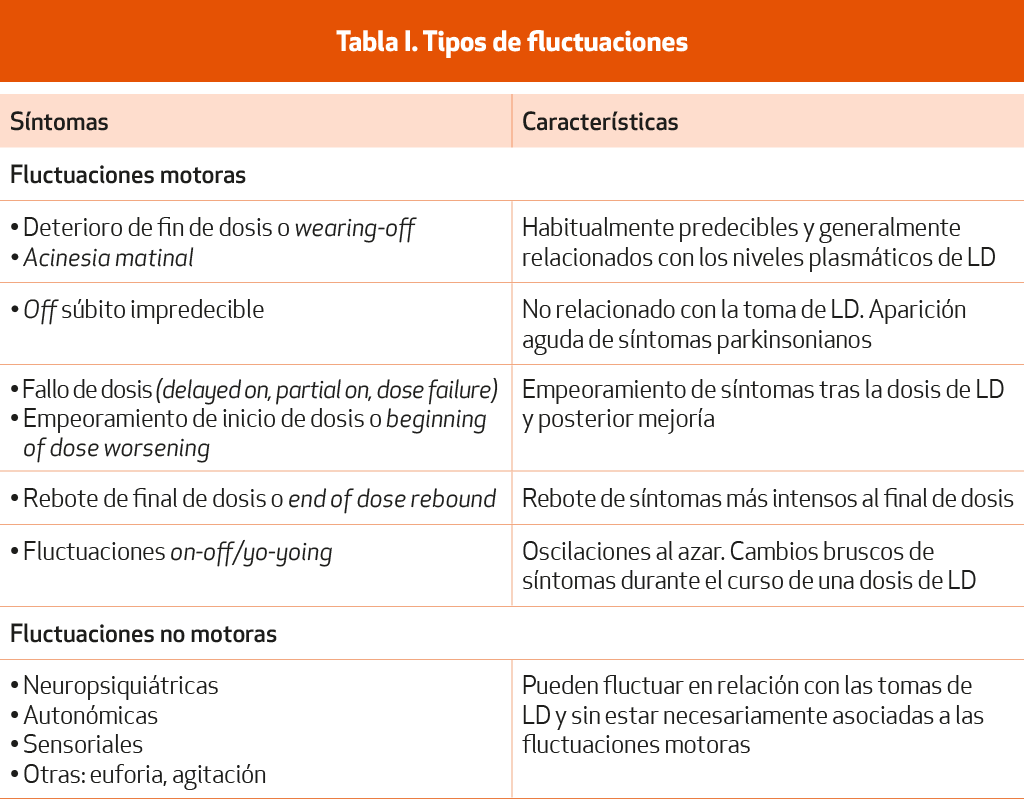
Discinesias
Son movimientos involuntarios debido al tratamiento crónico con agentes dopaminérgicos. Su expresión clínica más frecuente es la corea y la distonía y, más raros, el balismo y el mioclono.
Se deben considerar tres aspectos en el manejo de las discinesias:
-
Fenomenología del movimiento: tipo (corea, distonía o balismo) y distribución (piernas o parte superior del cuerpo).
-
Momento de aparición en relación con la dosis de LD (discinesias de dosis alta y discinesias de dosis baja).
-
Percepción de la discinesia por el paciente.
Los diferentes tipos se pueden clasificar en discinesias de dosis alta y discinesias de dosis baja (Tabla II):
- Discinesias de dosis alta:
-
Discinesias de pico de dosis y, con menor frecuencia, las discinesias en meseta a lo largo de todo el periodo on: se producen en el estado on, 1-2 horas después de la dosis de LD. Se manifiestan con movimientos coreicos, inicialmente en el cuello y la cara, que en fases posteriores se extienden al tronco y extremidades, junto con posturas distónicas de extremidades y cuello (distonía on). En casos más graves se pueden producir movimientos balísticos. Muchos pacientes solo las presentan en las tomas de la tarde o la noche, lo que se debe a la dosis de LD acumulada durante el día. Pueden mejorar reduciendo la dosis de los fármacos, aunque a veces a costa de disminuir su eficacia antiparkinsoniana. Muchos pacientes no las reconocen o no les molestan y, por tanto, no se recomienda reducir la medicación excepto cuando son molestas o se quiere evitar el empeoramiento.
-
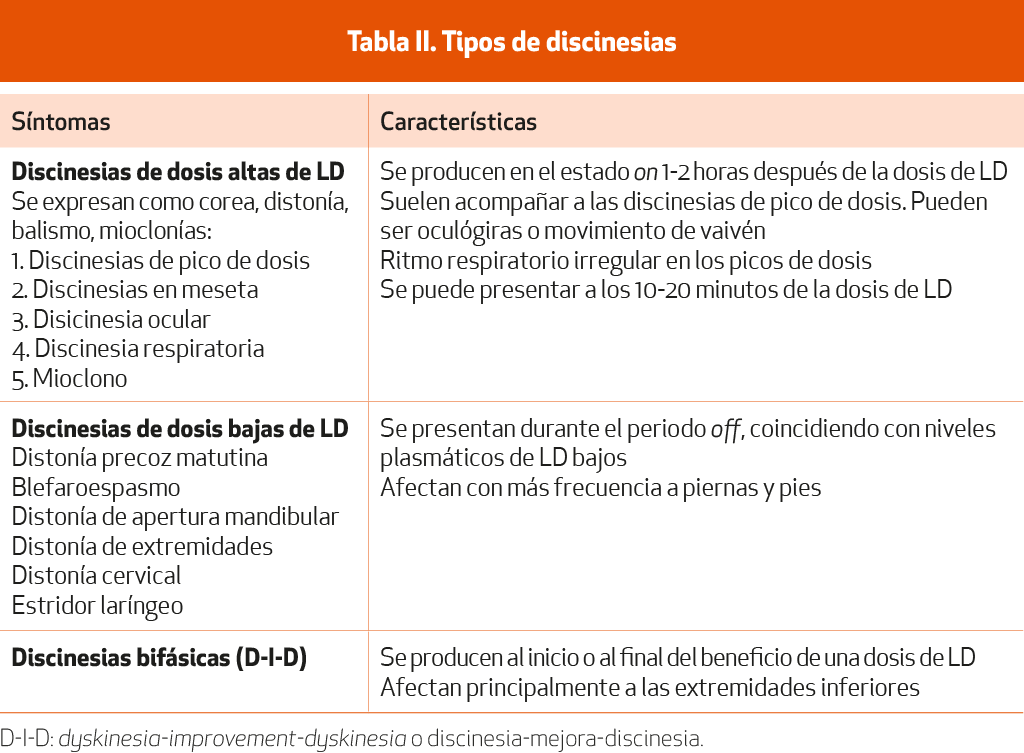
-
Discinesia ocular: suele acompañar a las discinesias de pico de Existen dos patrones: desviación de la mirada hacia arriba (crisis oculógiras) y movimientos lentos en vaivén.
-
Discinesia respiratoria: ritmo respiratorio irregular y profundo por afectación de la musculatura respiratoria en la discinesia de pico de
-
Mioclono: es poco frecuente, se suele producir en los primeros 10-20 minutos de la dosis de LD y desaparecer en el estado on Suele aparecer en pacientes con demencia.
-
Discinesias de dosis baja: son distonías off; la discinesia se produce durante el periodo off y wearing-off, es predominantemente distónica y tiende a afectar piernas y pies (inversión del tobillo y extensión o flexión del dedo gordo del pie). Puede ser dolorosa, provocar deformidad, dificulta la marcha y es molesta para el La forma más frecuente es la que se presenta por la mañana antes de la primera dosis de LD (distonía precoz matutina o early morning dystonia). Otras formas más raras de distonía off son: blefarospasmo, distonía de apertura mandibular, de la mano o pierna, cervical o estridor laríngeo. La distonía off se correlaciona con niveles plasmáticos bajos de LD.
-
Discinesia bifásica: también denominada fenómeno D-I-D o dyskinesia-improvement-dyskinesia. Se produce al inicio o al final del beneficio de una dosis, que corresponde respectivamente cuando los niveles plasmáticos de LD están aumentando o disminuyendo. Dura varios minutos y crea importante discapacidad al Tiende a afectar principalmente las piernas, se combinan movimientos distónicos y coreicos, manifestándose con movimientos lentos estereotipados, rápidos y alternando las piernas, y en ocasiones patadas balísticas.
Fluctuaciones no motoras
Son fluctuaciones de síntomas no motores que pueden coincidir en ambos periodos on y off. Los síntomas pueden fluctuar en respuesta a la LD y, aunque son más frecuentes en off, pueden presentarse también en on, mejorando con un buen estado dopaminérgico. Pueden ser: neuropsiquiátricos (ansiedad, depresión, apatía, fatiga); autonómicos (disfagia, molestias abdominales) y sensoriales (dolor, parestesias, acatisia). En otros casos se presentan en la fase on como euforia, agitación o psicosis.
Bibliografía
3. Aquino CC, Fox SH. Clinical spectrum of levodopa-induced complications. Mov Disorders. 2015;30:80-9.
Metodología: revisión de ensayos clínicos, preferentemente publicados en los últimos 5 años, pero también previos si el trabajo es de interés (Medline, Cochrane) así como guías terapéuticas, tanto de la American Academy of Neurology (AAN) como de la European Federation of Neurological Societies (EFNS).
Preparados de levodopa con un inhibidor de la dopa-decarboxilasa
Levodopa
Levodopa estándar
Es el fármaco más importante en la EP avanzada. Es práctica común modificar la frecuencia y la dosis de LD para mejorar las fluctuaciones o discinesias. Sin embargo, no existen estudios de nivel I que evalúen estas estrategias.
En los periodos de fin de dosis es útil acortar el intervalo entre dosis de LD. En ocasiones es preciso también disminuir la cantidad de LD en cada toma, estrategia que también mejora las discinesias (NE-II). Al realizar estos ajustes hay que tener en cuenta que: 1) dosis frecuentes pueden empeorar las discinesias vespertinas, debido a los niveles mantenidos de LD, y 2) dosis bajas pueden inducir discinesias bifásicas.
Levodopa de liberación prolongada
Numerosos estudios han comparado la LD de liberación prolongada con la LD estándar. La reducción del off fue variable (20-70%) y se precisó un aumento de la dosis de LD (20%) con reducción del número de tomas de solo el 30%4 (NE-III).
Aunque los resultados de los ensayos clínicos no sean concluyentes parece que: 1) la LD de liberación prolongada permite un pequeño aumento del tiempo on (menos de 1 hora al día). 2) Puede ser útil cuando se utiliza en combinación con la LD estándar para el tratamiento de los episodios de fin de dosis. Esta combinación es especialmente útil con la primera dosis de la mañana si existe retraso en el on. 3) Una dosis nocturna de LD de liberación prolongada es útil para mejorar la acinesia nocturna y matutina (aunque hay dudas de que sea más eficaz que la LD estándar5 [NE-IV]).
Dado que la farmacocinética es poco predecible, existe riesgo de empeoramiento de las discinesias (especialmente vespertinas y bifásicas) (NE-II).
IPX203
Se trata de una nueva formulación de LD oral, aun no disponible en nuestro medio, con una liberación dual inmediata y prolongada. No retrasa el inicio del efecto del fármaco y permite una mayor estabilidad en la concentración plasmática en sangre (NE-I). El tiempo off con IPX203 fue del 19,3% del día frente al 33,5% con LD de liberación inmediata, es decir hasta 2,3 horas menos de tiempo off con IPX203 que con LD convencional. Mientras que las concentraciones de LD de liberación inmediata se mantienen solo 1,5 horas por encima del 50% de la concentración máxima, en el caso de la nueva formulación se mantiene durante 4,6 horas6 (NE-I). Este perfil farmacocinético sugiere que la dosificación de tres veces al día es factible y puede conducir a una menor variabilidad en la clínica y mayor beneficio para el paciente, frente a tomas cada dos o tres horas de LD de liberación inmediata. Esto no conlleva un aumento de las discinesias de pico de dosis incapacitantes7 (NE-II). No presenta más efectos secundarios que la LD convencional (NE-II).
Levodopa en solución
Estos preparados permiten una absorción más rápida de la LD y, por tanto, de su inicio de acción. En un estudio piloto con cuatro pacientes, la LD líquida demostró aumentar la duración del on sin aumentar las discinesias, permitiendo una respuesta más rápida a los periodos off8 (NE-III).
La melevodopa es una formulación líquida de LD. Un estudio evaluó su eficacia en acortar el inicio del on en la primera dosis de LD de la tarde. La melevodopa fue superior a la LD estándar, sin aumentar la duración del tiempo en on ni las discinesias. Otro estudio evaluó la eficacia de melevodopa frente a LD estándar en pacientes con fluctuaciones motoras y al menos 2 horas de off al día. No se encontraron diferencias en la reducción del tiempo en off (objetivo primario) ni en otras variables secundarias (NE-I).
Las soluciones de LD pueden ser de utilidad en pacientes con un retraso importante del on (vaciamiento gástrico enlentecido), ya que la LD líquida pasa más fácilmente el píloro y por tanto se facilita su absorción. Para ello basta con disolver la dosis de LD en agua y vitamina C. También puede utilizarse como dosis única para retrasos en el on puntuales (matutina, después de comer)9.
Los comprimidos solubles de LD consisten en un dispositivo dosificador de microtabletas de LD/carbidopa (5/1,25 mg) fácilmente dispersables en agua, para la individualización de tratamiento. La bioequivalencia de las microtabletas de LD/carbidopa es similar a las formulaciones convencionales. La ventaja de los comprimidos solubles de LD radica en que permiten un ajuste fino de dosis y por tanto una dosificación frecuente, obteniéndose unas concentraciones plasmáticas de LD más estables10 (NE-II). Están comercializados en los países escandinavos bajo la indicación de EP avanzada, en aquellos pacientes que desean posponer el inicio de tratamientos más invasivos, como perfusiones subcutáneas o gel intestinal. Permiten una administración sencilla y no invasiva, con dosis más individualizadas, ya que permiten incrementos de LD de 5 mg11,12 (NE-II).
Levodopa inhalada
Está indicada para el tratamiento intermitente de fluctuaciones motoras episódicas (episodios off) en pacientes con EP tratados con LD y un inhibidor de dopa-descarboxilasa13 (NE-I). Es eficaz en fenómenos off fin de dosis14-16 (NE-I), incluida la acinesia matutina17 (NE-II) y otras fluctuaciones más complejas o impredecibles18 (NE-IV). También permite mejorar la respuesta al tratamiento en pacientes con retraso del efecto de alguna toma o delayed on. Mejora tanto los síntomas motores como no motores asociados a los periodos off. La dosis indicada de LD inhalada es de dos cápsulas, en dos inhalaciones seguidas, no separadas más de 10 minutos (33 mg polvo para inhalación por cápsulas, 66 mg de LD por dosis, equivalente a 50 mg de LD que se absorbe por esta vía)19. Es segura y bien tolerada, siendo la tos el efecto adverso más frecuente, aunque no suele ser causa de abandono del tratamiento. El entrenamiento al paciente es un factor clave para la buena tolerancia y cumplimiento (NE-IV).
Infusión continua de LD
Los tratamientos con foslevodopa/foscarbidopa en perfusión subcutánea, levodopa/carbidopa y levodopa/carbidopa/entacapona en infusión intestinal están indicados una vez el paciente presenta complicaciones motoras moderadas. Estos tratamientos se tratan en el capítulo 8 de este manual (pag. 179), dedicado a terapias de segunda línea. Estas terapias están indicadas cuando otras opciones terapéuticas como las revisadas en este capítulo no han conseguido corregir los síntomas y las fluctuaciones de manera satisfactoria.
Inhibidores de la catecol-O-metiltransferasa
Los inhibidores de la ICOMT actualmente disponibles son la tolcapona, la entacapona y la opicapona. Estos inhibidores aumentan la biodisponibilidad de la LD un 40-80%, consiguiendo una reducción significativa del tiempo off frente a placebo (1,3-1,8 horas para entacapona, 2,3-3,2 horas para tolcapona y 1,2 a 2,0 horas para opicapona). La tolcapona presenta riesgo bajo de hepatotoxicidad fulminante, lo que restringe notablemente su uso.
Tolcapona
Estudios con NE-I han demostrado que la tolcapona (frente a placebo) es eficaz reduciendo el tiempo off y es más potente que la entacapona20-22 (NE-I).
Antes del inicio del tratamiento con tolcapona se debe descartar que el paciente presente alguna hepatopatía. Generalmente es necesario reducir entre un 25-30% la dosis de LD para evitar discinesias. Es necesaria la monitorización de transaminasas (cada 2-4 semanas durante los primeros 6 meses y posteriormente según criterio médico).
Entacapona
Diversos estudios (NE-I) comparados con placebo han demostrado que la entacapona reduce el tiempo en off. La reducción del tiempo off es comparable a la obtenida con rasagilina. Esta mejoría se mantiene en el tiempo, tal y como demostró un metaanálisis de estudios con NE-I y sus extensiones abiertas. En cuanto a la dosis útil de entacapona un estudio no encontró diferencias entre 100 y 200 mg en cada toma20,23.
La entacapona, asociada a LD o en un mismo comprimido de LD-carbidopa-entacapona, es especialmente útil para el tratamiento del fenómeno de fin de dosis, sin necesidad de acortar el tiempo entre dosis24 (NE-IV). Un efecto adverso frecuente es el empeora- miento de las discinesias, que puede mejorar reduciendo la dosis de LD en cada toma.
Opicapona
La opicapona es el último inhibidor de la COMT aprobado por la Agencia Europea del Medicamento en junio del 2016. Se utiliza en el tratamiento de las fluctuaciones moto- ras en pacientes tratados con LD.
Estudios con NE-I han demostrado que la opicapona es eficaz en el control de las fluctuaciones motoras, produciendo una disminución del tiempo off y no inferioridad a entacapona.
El plan de desarrollo clínico de la opicapona se ha basado en diferentes estudios fase I, dos estudios de fase II con el objetivo de evaluar la farmacocinética y eficacia de diferentes dosis del fármaco25,26 (NE-II) y en dos estudios de fase III de eficacia y seguridad27,28 (NE-I). Estos ensayos han demostrado que opicapona es segura y bien tolerada a corto y largo plazo, incluso en pacientes mayores de 70 años29 (NE-II), y que reduce el tiempo off, incrementando el tiempo on sin discinesias molestas. La dosis de 50 mg una sola vez al día, produce prácticamente una hora de reducción del tiempo off respecto al placebo. La comparación con entacapona en el estudio BIPARK-I27 (NE-I) sugiere un efecto de mayor magnitud con el uso de la opicapona, pero estos resultados deberían ser replicados en un ensayo de comparación directa. La mejoría en la función motora también se observa en pacientes con LD y uso concomitante de agonistas dopaminérgicos o inhibidores de la MAO30 (NE-IV). En el caso de las fluctuaciones motoras tempranas, en el estudio ADOPTION se compara la adición de la opicapona con el aumento de 100 mg de LD a la dosis habitual en pacientes con fluctuaciones de menos de 2 años de inicio. La opicapona fue más eficaz que LD en reducir el tiempo off y tuvo un buen perfil de seguridad31,32 (NE-III). El efecto adverso más frecuente son discinesias, y no se ha observado asociación con disfunción hepática ni en el cambio de coloración de la orina.
Se recomienda tomar una cápsula de 50 mg día, una hora después de la última dosis del preparado de LD (LD/inhibidor de la dopa-descarboxilasa).
Inhibidores de la monoaminooxidasa B
Actualmente existen tres IMAO-B comercializados en nuestro país, selegilina, rasagilina y safinamida. Con los IMAO se ha descrito el llamado efecto tiramina o efecto queso (IMAO-A y selegilina a dosis altas): hipertensión paroxística por ingesta de alimentos ricos en tiramina (queso, vino, cerveza). La asociación con inhibidores de la recaptación de serotonina (ISRS) puede producir un síndrome serotoninérgico.
Rasagilina
Dos estudios con NE-I han demostrado que rasagilina es eficaz en disminuir el tiempo off en aproximadamente una hora. El estudio PRESTO comparó rasagilina (0,5 y 1 mg) con placebo33. Ambas dosis fueron superiores a placebo en la reducción del tiempo en off. La rasagilina 1 mg produjo discinesias molestas (no con 0,5 mg) y los efectos secundarios leves fueron más frecuentes. Sin embargo, no se encontraron diferencias en las tasas de abandono entre ambas dosis33,34. Otro estudio comparó la rasagilina (1 mg) con entacapona y placebo. Se encontró un aumento del tiempo on, sin aparición de discinesias molestas respecto a placebo34.
Es un fármaco de fácil administración y bien tolerado, exento del efecto tiramina. En algunos estudios se ha utilizado con antidepresivos ISRS sin que se haya descrito ningún efecto adverso. No obstante, en la ficha técnica se recomienda evitar el uso concomitante con fluoxetina o fluvoxamina y vigilancia con el resto de ISRS y otros antidepresivos. No se debe asociar a simpaticomiméticos (descongestionantes nasa- les). Más allá de su utilidad para las complicaciones motoras, la rasagilina también ha mostrado un efecto limitado en mejorar los episodios de congelación de la marcha.
Selegilina
Los estudios de corta duración (NE-I) no mostraron efecto consistente en la reducción del tiempo off. Una nueva formulación de selegilina bucodispersable ha mostrado resultados contradictorios en la reducción del tiempo en off20 (NE-IV).
La dosis recomendada de selegilina es 10 mg, en una o dos tomas. Con esta dosis no hay riesgo de efecto tiramina. No se recomienda su uso con antidepresivos ISRS, ISRS y noradrenalina, tricíclicos, otros IMAO (por ejemplo, el antibiótico linezolid), petidina ni simpaticomiméticos. Debido a sus metabolitos derivados (anfetamínicos) produce insomnio y no es recomendable adminístralo en dosis nocturna.
Safinamida
Presenta un mecanismo de acción dual: inhibidor reversible de la MAO-B y bloqueante de canales de sodio voltaje-sensitivos, actuando como modulador de la liberación excesiva de glutamato.
En un estudio de NE-I, la safinamida (50 y 100 mg) aumentó el tiempo on sin producir discinesias molestas (24 semanas de seguimiento). El aumento de tiempo en on con safinamida fue de 1,37 h, frente a 0,9 h en el grupo placebo. Del mismo modo, el tiempo en off se redujo aproximadamente una hora (1,42 h vs. 0,57 h, safinamida vs. placebo respectivamente)35. A largo plazo (24 meses), las discinesias no empeoraron y se observó una reducción de las discinesias moderadas-graves con 100 mg. La mejoría sobre la función motora, las actividades de la vida diaria, los síntomas depresivos, el estado clínico y la calidad de vida se mantuvieron a los 24 meses35 (NE-I).
Comparandado safinamida con rasagilina, se observa una mayor reducción del tiempo en off con safinamida (0,85 h vs. 0,27 h) y un aumento mayor del tiempo en on (0,4-0,6 h con safinamida vs. 0,39 h con rasagilina)33,35.
La safinamida fue bien tolerada y la frecuencia de efectos adversos fue similar a la del grupo placebo. Más recientemente, un estudio basado en población real que incluyó 1610 pacientes entre los que se incluyeron pacientes mayores de 75 años, con comorbilidades médicas y psiquiátricas previas, mostró un buen perfil de seguridad36. Un subanálisis de la población española de este estudio mostró resultados similares, siendo los efectos secundarios algo más frecuentes en pacientes con deterioro cognitivo37.
Con la safinamida no hay riesgo de efecto tiramina y su gran especificidad por la MAO-B hace posible que se pueda administrar junto con ISRS (fluoxetina y fluvoxatina a dosis bajas) sin riesgo de síndrome serotoninérgico.
Agonistas dopaminérgicos
Diversos estudios mostraron que el uso precoz de agonistas dopaminérgicos se asocia a una menor incidencia de complicaciones motoras en comparación con el inicio del tratamiento con LD38 (NE-I). Sin embargo, no estaba claro si el retraso en la aparición de complicaciones motoras se relacionaba con el inicio del tratamiento con un agonista dopaminérgico o, más bien, con la duración de la enfermedad y con dosis diarias más bajas de LD. Finalmente, Cilia et al.39 confirmaron que las complicaciones motoras están claramente condicionadas por la duración de la enfermedad y las dosis de LD. En este sentido, los agonistas dopaminérgicos juegan un papel como ahorradores de LD (NE-I).
Agonistas dopaminérgicos de liberación inmediata
Dados los efectos cardiopulmonares graves, como la fibrosis valvular, los agonistas dopaminérgicos ergóticos se usan solo en situaciones excepcionales.
Dentro de los agonistas dopaminérgicos no ergóticos orales, se manejan en nuestro medio el ropinirol y el pramipexol:
-
Ropinirol: en fases avanzadas de la enfermedad, asociado a tratamiento con LD, mejora las fluctuaciones motoras y permite reducir la dosis de LD40 (NE-II). Los estudios prospectivos, aleatorizados, doble ciego, apuntan al ropinirol como tratamiento eficaz en la EP avanzada reduciendo las fluctuaciones motoras.
-
Pramipexol: en la enfermedad avanzada es efectivo en el tratamiento de las fluctuaciones motoras, reduciendo el tiempo off. En un ensayo con 363 pacientes a 6 meses, comparado con placebo en tratamiento asociado a LD, la reducción del tiempo off al día fue de 2,5 horas con pramipexol frente a 10 minutos con placebo41 (NE-II). El pramipexol en EP avanzada es eficaz en la disminución de la aparición de fluctuaciones
Cuando empeoran las discinesias como efecto adverso al asociar un agonista dopaminérgico a LD, se recomienda primero reducir las dosis de LD.
Agonistas dopaminérgicos orales de liberación prolongada
-
Ropinirol: en pacientes con enfermedad de moderada a avanzada se ha visto una rápida mejoría incluso en las 2 primeras semanas, en probable relación con la más rápida y sencilla titulación de la formulación prolongada. En la enfermedad avanzada, en el tratamiento asociado a LD, se ha demostrado frente a placebo una reducción del tiempo en off y reducción de la dosis de LD mayor o igual al 20%. La última revisión centrada en la medicina basada en la evidencia concluye que ropinirol de liberación prolongada es eficaz en el tratamiento de las fluctuaciones motoras, pero no hay suficiente evidencia en el manejo de las discinesias20 (NE-IV).
-
Pramipexol: la última revisión centrada en la medicina basada en la evidencia concluye que para pramipexol de liberación prolongada no hay suficiente evidencia en el manejo de las complicaciones motoras20 (NE-IV).
Agonistas dopaminérgicos de liberación transdérmica
Rotigotina
Es el único agonista dopaminérgico transdérmico comercializado en nuestro medio. Respecto a las complicaciones motoras, en un ensayo clínico a 28 semanas frente a placebo con dos dosis de rotigotina de 8 y 12 mg/día, en 351 pacientes con fluctuaciones motoras y más de 2,5 horas de off al día, hubo una reducción del tiempo en off al día significativa (56%) en ambos brazos de rotigotina42 (NE-I). En otro estudio que comparaba rotigotina (dosis media 12,95 mg/día), pramipexol (media 3,1 mg/día) y placebo, en 506 pacientes con más de 2,5 horas de off al día, hubo una reducción significativa del tiempo off de 1,58 horas en el brazo de rotigotina, con un aumento del tiempo on sin discinesias problemáticas de +2,8 horas comparado con +1,4 horas en el brazo placebo40 (NE-I). Basándose en la evidencia de los estudios disponibles, la rotigotina es eficaz en el tratamiento de las fluctuaciones motoras.
Apomorfina subcutánea intermitente
Las inyecciones subcutáneas de apomorfina mediante un inyector de pluma permiten el tratamiento agudo de los episodios off. Su eficacia ha sido evaluada en tres estudios pivotales, con un diseño prospectivo, aleatorizado, controlado con placebo. Un estudio (APO202)44 (NE-I) fue realizado en pacientes que nunca habían recibido apomorfina y los otros dos en pacientes tratados como mínimo durante 3 meses antes de ser incluidos (APO301, APO302)45,46 (NE-I). En el estudio APO202 inicialmente se evaluaba al paciente ingresado y en un off inducido, al no recibir tratamiento antiparkinsoniano oral, con dosis progresivas de apomorfina o placebo. Esta fase iba seguida de 1 mes de tratamiento con apomorfina o placebo para tratar episodios off espontáneos según necesidad, en un máximo de 5 al día. En los estudios APO301 y APO302 se valoraba la respuesta a una dosis única de apomorfina o placebo, administrada al inicio de un episodio off espontáneo. En los tres ensayos, aproximadamente a los 20 minutos la mejoría en la puntuación media en la escala UPDRS respecto a la puntuación basal fue significativamente mejor con apomorfina que con placebo. La mejoría media también fue significativa respecto a placebo a los 10 (APO301 y APO302) y 60 minutos (APO302) pero no a los 90 minutos (APO302). En el estudio APO202, la apomorfina revertió con éxito el 90% de los off (en comparación al 23% con placebo) y redujo el número de horas off en 2 horas al día (en comparación con la no reducción del tiempo off con placebo). El tiempo en el que se alcanzaba la mejoría fue significativamente más corto con apomorfina que con placebo en los tres estudios. En los tres estudios los efectos secundarios experimentados con apomorfina fueron de intensidad leve e incluían bostezos, somnolencia, mareos, rinorrea y náuseas. Los problemas en el sitio de inyección como hematomas, dolor, reacciones cutáneas o nódulos fueron similares en ambas ramas de tratamiento.
La eficacia de la apomorfina subcutánea intermitente ha sido evaluada en otros dos pequeños estudios controlados con placebo47,48. En ambos hubo una reducción significativa del tiempo off y de su intensidad, respecto al placebo (NE-I).
Apomorfina sublingual
Está indicada para el tratamiento intermitente de los episodios off en pacientes con EP, que no estén suficientemente controlados mediante la medicación antiparkinsoniana oral49 (NE-I). Fue aprobada por la AEMPS en diciembre de 2023. Se trata de una película sublingual, desarrollada para superar las limitaciones de la administración subcutánea, con diferentes dosis de 10, 15, 20, 25 y 30 mg. La dosis adecuada para cada paciente se determina mediante incrementos de la pauta posológica, que pueden realizarse en el domicilio tras testar la tolerabilidad de la primera dosis en el entorno controlado de un centro clínico especializado. En los ensayos pivotales se ha podido observar una respuesta clínica ya a los 15 minutos de la administración, la cual se mantiene a los 90 minutos50-52 (NE-I). Los efectos adversos son los característicos de la apomorfina, como somnolencia, náuseas e hipotensión, que pueden tratarse si fuera necesario con domperidona. Las reacciones locales en mucosa oral, como irritación o eritema se han observado con frecuencia, con una gravedad leve o moderada53,54.
Apomorfina subcutánea en perfusión continua
La infusión continua de apomorfina subcutánea se trata en el capítulo 8 de este manual, dedicado a terapias de segunda línea (pag. 179).
Amantadina
Es un antagonista no selectivo de los receptores NMDA del glutamato, con propiedades antiparkinsonianas descritas en el año 1969. Posteriormente, en los años noventa, diversos estudios demostraron que era beneficioso en el tratamiento de las complicaciones motoras con disminución del tiempo en off y se demostró un efecto antidiscinético en ensayos clínicos aleatorizados, pero con pocos pacientes. No obstante, la duración de dicha eficacia está en debate.
Dos estudios aleatorizados, controlados con placebo, tipo wash-out, reportaron la eficacia del tratamiento con amantadina sobre las discinesias y que esta se mantenía a largo plazo. En un estudio55 (NE-II) se aleatorizaron 32 pacientes que estaban en tratamiento con amantadina para controlar las discinesias durante un mínimo de 1 año y con dosis promedio de 298 mg/día. Fueron aleatorizados de forma ciega, y un grupo continuó con el mismo tratamiento y en el otro grupo se cambió la amantadina por placebo, presentando un empeoramiento significativo de las discinesias a las 3 semanas y un aumento de las discinesias incapacitantes en tiempo on. El segundo estudio, AMANDYSK trial56 (NE-I), fue realizado con un diseño similar, pero con mayor seguimiento (3 meses). Se aleatorizaron 57 pacientes que recibían amantadina entre 6 meses y 3 años. Los resultados también mostraron que el grupo que cambió a placebo presentaba un empeoramiento de las discinesias. El efecto antidiscinético era significativamente superior en el grupo que continuaba con amantadina, el efecto se mantenía después de varios años de administración y la dosis media era 250 mg/día. Se demostró con un NE-II que la retirada de amantadina comportaba un empeoramiento significativo de las discinesias en 7 días.
La amantadina de liberación prolongada (ADS-5102), aun no comercializada en nuestro país, ha demostrado una reducción significativa de las discinesias y un aumento del tiempo on sin discinesias57 (NE-I). La reducción del tiempo off no llegó a ser significativa. Dicho beneficio es dependiente de dosis y con buena tolerancia. La dosis de 340 mg/día en una toma al acostarse ha demostrado el mejor equilibrio entre eficacia y seguridad.


Bibliografía
4. Goetz CG, Koller WC, Poewe W. Management of Parkinson’s disease: an evidence-based review. Mov Disord 2002;17(Suppl 4):S1-S166.
5. Pahwa R, Lyons K, McGuire D, et al. Early morning akinesia in Parkinson’s disease: effect of standard carbidopa/levodopa and sustained-release carbidopa/levodopa. Neurology. 1996 Apr;46(4):1059-62.
6. Hauser RA, Espay AJ, Ellenbogen AL, et al. IPX203 vs Immediate-Release Carbidopa- Levodopa for the Treatment of Motor Fluctuations in Parkinson Disease: The RISE- PD Randomized Clinical Trial. JAMA Neurol. 2023 Oct 1;80(10):1062-1069.
7. Modi NB, Mittur A, Dinh P, et al. Pharmacodynamics, Efficacy, and Safety of IPX203 in Parkinson Disease Patients With Motor Fluctuations. Clin Neuropharmacol. 2019 Sep/ Oct;42(5):149-156.
8. Kurth MC, Tetrud JW, Irwin I, et al. Oral levodopa-carbidopa solution versus tablets in Parkinson’s patients with severe fluctuations A pilot study. Neurology. 1993;43:1036-9.
9. López Lozano JJ, Moreno Cano R. Preparación de una disolución de levodopa/carbidopa en ácido ascórbico (citrodopa) y valoración de su estabilidad durante 24 horas mediante cromatografía y detección electroquímica. Neurologia. 1995 Apr;10(4):155-8.
10. Senek M, Nyholm D, Nielsen EI. Population pharmacokinetics of levodopa/carbidopa microtablets in healthy subjects and Parkinson’s disease patients. Eur J Clin Pharmacol. 2018;74(10):1299-1307.
11. Johansson D, Ericsson A, Johansson A, et al. Individualization of levodopa treatment using a microtablet dispenser and ambulatory accelerometry. CNS Neurosci Ther. 2018;24(5):439-447.
12. Grétarsdóttir HM, Widman E, Johansson A, Nyholm D. Personalized Medicine Approach in Treating Parkinson’s Disease, Using Oral Administration of Levodopa/Carbidopa Microtablets in Clinical Practice. J Pers Med. 2021;11(8):720.
13. Inbrija 33 mg polvo para inhalación, cápsulas duras. En: CIMA-AEPMS [Internet]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1191390002/FT_1191390002.html
14. Lipp MM, Hickey AJ, Langer R, et al. A technology evaluation of CVT-301 (Inbrija): an inhalable therapy for treatment of Parkinson’s disease. Expert Opin Drug Deliv. 2021 Nov;18(11):1559-1569.
15. LeWitt PA, Hauser RA, Pahwa R, et al.; SPAN-PD Study Investigators. Safety and efficacy of CVT-301 (levodopa inhalation powder) on motor function during off periods in patients with Parkinson’s disease: a randomised,
16. Glenardi G, Handayani T, Barus J, et al. Inhaled Levodopa (CVT-301) for the Treatment of Parkinson Disease: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Neurol Clin Pract. 2022 Apr;12(2):139-148.
17. Hauser RA, Isaacson SH, Ellenbogen A, et al. Orally inhaled levodopa (CVT-301) for early morning OFF periods in Parkinson’s disease. Parkinsonism Relat Disord. 2019 Jul;64:175-180.
18. Saranza G, Lang AE. Inhaled Levodopa as a Potential Treatment for Diphasic Dyskinesia. Mov Disord. 2021 Jan;36(1):265-266.
19. Safirstein BE, Ellenbogen A, Zhao P, et al. Pharmacokinetics of Inhaled Levodopa Administered With Oral Carbidopa in the Fed State in Patients With Parkinson’s Disease. Clin Ther. 2020 Jun;42(6):1034-1046.
20. Fox SH, Katzenschlager R, Lim SY, et al. The Movement Disorder Society Evidence-Based Medicine Review Update: Treatment for the motor symptoms of Parkinson’s disease. Mov Disord. 2011;26(Suppl 3):S2-S41.
21. Baas H, Beiske AG, Ghika J, et al. Catechol-O-methyltransferase inhibition with tolcapone reduces the “wearing off” phenomenon and levodopa requirements in fluctuating parkinsonian patients. J Neurol Neurosurg Psychiatry. 1997;63(4):421-8.
22. Adler CH, Singer C, O’Brien C, et al. Randomized, placebo-controlled study of tolcapone in patients with fluctuating Parkinson disease treated with levodopa-carbidopa. Tolcapone Fluctuator Study Group III. Arch Neurol. 1998;55(8):1089-95.
23. Poewe WH, Deuschl G, Gordin A, et al.; Celomen Study Group. Efficacy and safety of entacapone in Parkinson’s disease patients with suboptimal levodopa response: a 6-month randomized placebo-controlled double-blind study in Germany and Austria (Celomen study). Acta Neurol Scand. 2002 ;105(4):245-55.
24. Hauser RA. Levodopa/carbidopa/entacapone (Stalevo). Neurology. 2004 Jan 13;62(1 Suppl 1):S64-71.
25. Rocha JF, Almeida L, Falcao A, et al. Opicapone: a short lived and very long acting novel catechol-O-methyltransferase inhibitor following multiple dose administration in healthy subjects. Br J Clin Pharmacol. 2013;76(5):763-75.
26. Ferreira JJ, Rocha JF, Falcão A, et al. Effect of opicapone on levodopa pharmacokinetics, catechol-O-methyltransferase activity and motor fluctuations in patients with Parkinson’s disease. Eur J Neurol. 2015;22(815-25):e56.
27. Ferreira JJ, Lees A, Rocha JF, et al. Opicapone as an adjunct to levodopa in patients with Parkinson’s disease and end-of-dose motor fluctuations: a randomised, double-blind, controlled trial. Lancet Neurol. 2015;15:154-65.
28. Lees AJ, Ferreira J, Rascol O, et al. Opicapone as adjunct to levodopa therapy in patients with parkinson disease and motor fluctuations: a randomized clinical trial. JAMA Neurol. 2016;74:197-206.
29. Ferreira JJ, Lees A, Rocha JF, et al. Efficacy and safety of opicapone in patients over 70 years with Parkinson’s disease and motor fluctuations. Mov Disord. 2015;30:S99.
30. Lopes N, Ferreira J, Lees A, et al. Exploratory efficacy of opicapone in combination with dopamine agonists or MAO-B inhibitors on the treatment of motor fluctuations inParkinson’s disease. Mov Disord. 2015;30:S10.
31. Lee JY, Ma HI, Ferreira JJ, et al. Opicapone to Treat Early Wearing-off in Parkinson’s Disease Patients: The Korean ADOPTION Trial. Mov Disord Clin Pract. 2024 Apr 9.
32. Ferreira JJ, Lee JY, Ma HI, Jeon B, Poewe W, Antonini A, et al.; ADOPTION study investigators. Opicapone for the treatment of early wearing-off in levodopa-treated Parkinson’s disease: pooled analysis of patient level data from two randomized open-label studies. J Neurol. 2024 Oct;271(10):6729-6738.
33. Parkinson Study Group. A randomized placebo-controlled trial of rasagiline in levodopa- treated patients with Parkinson disease and motor fluctuations: the PRESTO study. Arch Neurol. 2005;62:241-8.
34. Rascol O, Brooks DJ, Melamed E, et al.; LARGO study group. Rasagiline as an adjunct to levodopa in patients with Parkinson’s disease and motor fluctuations (LARGO), Lasting effect in Adjunct therapy with Rasagiline Given Once daily, study): a randomised, double- blind, parallel-group trial. Lancet. 2005;365:947-54.
35. Borgohain R, Szasz J, Stanzione P, et al. Randomized trial of safinamide add-on to levodopa in Parkinson’s disease with motor fluctuations. Mov Disord. 2014;29:229-37.
36. Abbruzzese G, Kulisevsky J, Bergmans B, Gomez-Esteban JC, Kägi G, Raw J, et al.; SYNAPSES Study Investigators Group. A European Observational Study to Evaluate the Safety and the Effectiveness of Safinamide in Routine Clinical Practice: The SYNAPSES Trial. J Parkinsons Dis. 2021;11(1):187-198.
37. Kulisevsky J, Esquivel A, Freire-Álvarez E, Gómez-Esteban JC, Legarda-Ramírez I, Avilés A, et al. SYNAPSES. Estudio observacional europeo para evaluar la seguridad y la efectividad de la safinamida en la práctica clínica habitual: análisis post hoc de la población española del estudio. Rev Neurol. 2023 Oct 15;77(s02):1-12.
38. Stowe RL, Ives NJ, Clarke C, et al. Dopamine agonist therapy in early Parkinson’s disease. Cochrane Database Syst Rev. 2008 Apr 16;(2):CD006564.
39. Cilia R, Akpalu A, Sarfo FS, et al. The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa. Brain. 2014 Oct;137(Pt 10):2731-42.
40. Rascol O, Lees AJ, Senard JM, et al. Ropinirole in the treatment of levodopa-induced motor fluctuations in patients with Parkinson’s disease. Clin Neuropharmacol. 1996;19(3):234-45.
41. Möller JC, Oertel WH, Köster J, et al. Long-term efficacy and safety of pramipexole in advanced Parkinson’s disease: results from a European multicenter trial. Mov Disord. 2005;20(5):602-10.
42. LeWitt PA, Lyons KE, Pahwa R; SP 650 Study Group. Advanced Parkinson disease treated with rotigotine transdermal system: PREFER Study. Neurology. 2007;68(16):1262-7.
44. Dewey Jr. RB, Hutton JT, LeWitt PA, et al. A randomized, double-blind, placebo-controlled trial of subcutaneously injected apomorphine for parkinsonian off-state events. Arch Neurol. 2001;58:1385-92.
45. Data on file. Vernalis Pharmaceuticals Inc. Study APO301.
46. Pfeiffer RF, Gutmann L, Hull Jr KL, et al.; and The APO302 Study Investigators. Continued efficacy and safety of subcutaneous apomorphine in patients with advanced Parkinson’s disease. Parkinsonism Relat Disord. 2007;13(2):93-100.
47. Van Laar T, Jansen EN, Essink AW, et al. A double-blind study of the efficacy of apomorphine and its assessment in ‘off’-periods in Parkinson’s disease. Clin Neurol Neurosurg. 1993;95:231-5.
48. Ostergaard L, Werdelin L, Odin P, et al. Pen injected apomorphine against off phenomena in late Parkinson’s disease: a double blind, placebo controlled study. J Neurol Neurosurg Psychiatry. 1995;58:681-7.
49. Kynmobi 10 mg + 15 mg + 20 mg + 25 mg + 30 mg película sublingual. En: CIMA-AEMPS [Internet]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/88979/FT_88979.html
50. Stocchi F, Rascol O, Poewe W, et al.; for the CTH-302 Study Investigators. Apomorphine Sublingual Film Compared with Subcutaneous Apomorphine for OFF Episodes in Parkinson’s Disease: An Open-Label, Randomized, Crossover Study. J Parkinsons Dis. 2023;13(8):1329-1342.
51. Olanow CW, Factor SA, Espay AJ, et al.; CTH-300 Study investigators. Apomorphine sublingual film for off episodes in Parkinson’s disease: a randomised, double-blind, placebo- controlled phase 3 study. Lancet Neurol. 2020 Feb;19(2):135-144.
52. Kassubek J, Stocchi F, Martínez EB, et al.; CTH-302 Study Investigators. Feasibility of home dose optimization of apomorphine sublingual film in Parkinson’s disease patients with OFF episodes: results from the dose-optimization phase of an open-label, randomized crossover study. Ther Adv Neurol Disord. 2023 Nov 9;16:17562864231209240.
53. Hui JS, Fox SH, Neeson W, et al.; CTH-300 Study Investigators. Open-label titration of apomorphine sublingual film in patients with Parkinson’s disease and “OFF” episodes. Parkinsonism Relat Disord. 2020 Oct;79:110-116.
54. Hauser RA, Ondo WG, Zhang Y, et al.; CTH-301 Study Investigators. Dose Optimization of Apomorphine Sublingual Film for OFF Episodes in Parkinson’s Disease: Is the Prophylactic Use of an Antiemetic Necessary? J Parkinsons Dis. 2023;13(3):403-414.
55. Wolf E, Seppi K, Katzenschlager R, et al. Long-term antidyskinetic efficacy of amantadine in Parkinson’s disease. Mov Disord. 2010;25:1357-63.
56. The AMANDYSK trial: Withdrawing amantadine in dyskinetic patients with Parkinson disease. Neurology. 2014;82:300-7.
57. Pahwa R, Tanner CM, Hauser RA, et al. Amantadine Extended Release for levodopa-induced dyskinesia in Parkinson’s disease (EASED Study). Mov Disord. 2015;30(6):788-95.
58. Rizos A, Sauerbier A, Antonini A, et al.; EUROPAR and the IPMDS Non-Motor-PD-Study Group. A European multicentre survey of impulse control behaviours in Parkinson’s disease patients treated with short- and long-acting dopamine agonists. Eur J Neurol. 2016 Aug;23(8):1255-61.
59. García-Ruiz PJ, Martínez Castrillo JC, Alonso-Canovas A, et al. Impulse control disorder in patients with Parkinson’s disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014 Aug;85(8):840-4.
El término enfermedad de Parkinson avanzada (EPA o, en inglés, advanced Parkinson’s disease) se viene utilizando desde hace décadas en la literatura médica para hacer referencia a sus fases más tardías, en oposición a la enfermedad inicial o en fases más tempranas (early Parkinson’s disease). Hoehn y Yahr publicaron en 1967 su conocida clasificación de la EP que refleja la progresión en pacientes no tratados1: los estadios 4 y 5 se corresponden con la enfermedad más avanzada, cuando los pacientes ya presentan incapacidad funcional grave. La disponibilidad de tratamientos farmacológicos eficaces modificó la historia natural de la enfermedad, y el término “avanzado” comenzó a utilizarse en referencia a aquellos pacientes tratados con fármacos dopaminérgicos que al cabo de un tiempo dejan de obtener beneficio satisfactorio, generalmente por el desarrollo de complicaciones motoras invalidantes. En numerosos estudios sobre terapias neuroquirúrgicas (trasplantes, palidotomía, estimulación cerebral profunda [ECP]) se ha utilizado ampliamente este término en el sentido indicado, puesto que el fracaso de los tratamientos convencionales se considera un requisito ético obligado para estas terapias. Con este mismo sentido, la indicación de otras terapias invasivas, como las perfusiones enterales de LD (también la perfusión subcutánea de LD), ha sido restringida formalmente en su ficha técnica para pacientes en estado avanzado.
Sin embargo, a pesar de su amplia difusión, no ha existido una definición explícita del término EPA. El diccionario de la Real Academia Española señala que una enfermedad avanzada es aquella que ha alcanzado un cierto grado de irreversibilidad2. De esta forma, si tuviera interés establecer una definición nosológica más precisa, sería necesario seleccionar determinados biomarcadores de progresión (sean clínicos, paraclínicos o anatomopatológicos) y establecer un determinado punto de corte. No obstante, el interés clínico sobre esta cuestión no es en realidad definir un momento concreto en la progresión del proceso patológico, sino su aplicabilidad práctica para identificar aquellos pacientes subsidiarios de terapias no convencionales. En este sentido, en el estudio Consenso sobre la definición de la Enfermedad de Parkinson Avanzada (CEPA), el 92% de 149 neurólogos españoles encuestados en 2013 estuvo de acuerdo con la siguiente definición: “Fase de la enfermedad en la que están presentes determinados síntomas y complicaciones que repercuten de forma importante sobre el estado de salud del paciente y responden de forma insuficiente al tratamiento convencional”3 (NE-IV). Por tanto, en nuestro entorno también se acepta mayoritariamente el término EPA para designar a aquellos pacientes que ya no obtienen un beneficio satisfactorio con las distintas estrategias farmacológicas de administración más sencilla (por vía oral, transdérmica, subcutánea intermitente o, más recientemente, inhalatoria).
En este contexto, y con el objetivo de obtener un mejor control de las complicaciones motoras, es cuando se contemplan otras terapias, basadas en el uso de dispositivos, y que implican cierto grado de invasión terapéutica (de menor a mayor): perfusiones subcutáneas (apomorfina o foslevodopa/foscarbidopa), perfusiones enterales (LCIG o LECIG) y ECP, que se abordarán en este capítulo y en el algortimo de manejo de la EPA del Anexo I (pág. 369). Estas terapias suponen un nuevo reto para los pacientes y sus cuidadores, ya que deben asumir nuevos riesgos e inconvenientes en la vida cotidiana, con el objetivo de mejorar globalmente su calidad de vida.
Aunque las terapias mencionadas son eficaces en cuanto a mejorar las complicaciones motoras (y también aspectos no motores) de la EP, son diferentes en cuanto a sus objetivos, perfiles beneficio/riesgo y aspectos prácticos relacionados, de tal forma que la selección de los candidatos más idóneos para cada una es crucial para su éxito terapéutico. Es importante señalar que, si bien el diagnóstico de EPA (en el sentido antes expresado) es un requisito para considerar estas terapias, en ocasiones están contraindicadas precisamente por la existencia de datos clínicos de enfermedad más avanzada: demencia/psicosis grave, o periodos on subóptimos (con síntomas motores refractarios o afectación axial grave). Debemos, por tanto, considerar también el concepto de EP en fase paliativa4 (NE-IV), como último periodo en el que ya no sería apropiado iniciar estas terapias. La terapia paliativa se detalla en el capítulo 14 de este manual (pag. 325).
En las ediciones previas de este manual alertábamos sobre la extensión del uso en español del término “terapias avanzadas” para referirnos a las perfusiones continuas de fármacos y a la cirugía, pues se enfrenta al uso oficial de este término en las normativas regulatorias europeas y nacionales, que lo restringen a aquellas terapias basadas en genes, células o tejidos5. Además, la asociación de conceptos “enfermedad avanzada-terapia avanzada” podía generar, en entornos no especializados, mayor confusión que beneficio, puesto que, como se ha indicado, muchos pacientes con EPA no son candidatos a estas terapias y, por otro lado, pueden contemplarse puntualmente en pacientes menos “avanzados”. En este contexto, proponíamos el término “terapias de segunda línea”, más acorde con sus características y objetivos, que hoy en día es comúnmente utilizado
Bibliografía
1. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology. 1967;17(5):427-42.
2. Enfermedad. Diccionario de la Lengua Española [Internet]. Disponible en: https://dle.rae.es/enfermedad
3. Grupo de Estudio de Trastornos del Movimiento de la Sociedad Española de Neurología. Consenso sobre la definición de la Enfermedad de Parkinson Avanzada. Estudio CEPA [Internet]. Disponible en: http://cepa.medynet.com/
4. Oliver D, Veronese S. Specialist palliative care for Parkinson’s disease. Ann Palliat Med. 2020;9(Suppl 1):S52-S62.
5. Human regulatory: overview. En: European Medicines Agency [Internet]. Disponible en: https://www.ema.europa.eu/en/human-regulatory-overview/advanced-therapy-medicinal-products-overview
La apomorfina es un fármaco agonista dopaminérgico derivado de la morfina. Debido a su estructura similar a la dopamina, actúa sobre los receptores D1 y D2, y es muy lipofílica, lo que le permite atravesar rápidamente la barrera hematoencefálica, lo que explica su rapidez de acción. Su vida media plasmática es de 33 minutos, con una acción farmacológica de 45-60 minutos. Se considera el agonista dopaminérgico más potente con una potencia similar a la LD6 (NE-IV) y, aunque también se ha probado su administración por otras vías (oral, intranasal, sublingual, transdérmica, rectal), la más eficiente es la vía subcutánea. Desde el punto de vista terapéutico, se aplica de dos maneras: inyecciones subcutáneas intermitentes como rescate en los periodos off o mediante infusión subcutánea continua en pacientes con EPA.
El tratamiento con apomorfina en perfusión subcutánea continua (A-PS) se ha aplicado para la EPA desde hace más de 35 años. Pese a ello, hasta 2018 no se dispuso de los resultados de un estudio para poder recomendarlo con un alto nivel de evidencia. Hasta entonces se disponía de numerosos estudios de menor calidad metodológica, en los que se basaban sus indicaciones y contraindicaciones. En 2018 se publicaron los resultados del estudio TOLEDO, un ensayo en fase III, multicéntrico, de grupos paralelos, doble ciego y controlado con placebo durante 12 semanas7 (NE-I), con una fase abierta durante otras 52 semanas8 (NE-II). Se incluyeron 107 pacientes con ≥ 4 tomas diarias de LD y ≥ 3 horas al día en situación off (53 asignados a A-PS y 54 a placebo), de los que 71 completaron las 12 semanas (41 con A-PS y 30 con placebo). El estudio de extensión comenzó con 84 pacientes, y se pudieron analizar los datos de 59 a las 52 semanas8. En los apartados de “Eficacia” y “Efectos adversos” se detallarán los resultados de ambos estudios. También hay estudios que comparan la A-PS con otros tratamientos para la EPA9 (NE-I).
La A-PS se administra generalmente durante las horas de vigilia a dosis variables entre 4-7 mg/h (0,8-1,4 ml/h). Se recomienda tratar al paciente con domperidona 10 mg, tres veces al día, durante 5 días antes del inicio del tratamiento. La titulación ha de hacerse de forma lenta para prevenir efectos secundarios: se comienza con un ritmo de infusión bajo (1 mg/h) y en los días siguientes se va incrementando hasta obtener una respuesta adecuada. Si la respuesta a la LD no es buena, puede deberse a dificultades en su absorción por gastroparesia; en estos casos debe hacerse una prueba de apomorfina antes de iniciar el tratamiento en infusión continua y, si la prueba fuera positiva, el inicio de la perfusión podría realizarse de forma ambulatoria. Es muy importante que el paciente/cuidador comprendan el manejo básico del perfusor, lo que pueden esperar del tratamiento y sus posibles efectos adversos.
No se ha establecido una pauta de descenso/supresión de la medicación antiparkinsoniana. Se puede suspender la medicación distinta a la LD previamente al inicio de la apomorfina, o bien se puede ir retirando conforme se vaya alcanzando respuesta con la perfusión. En el estudio TOLEDO se llevó a cabo una reducción/supresión jerárquica según se precisara durante la perfusión, comenzando por agonistas, inhibidores de la MAO-B, inhibidores de la COMT y LD, sin modificación de amantadina ni anticolinérgicos7 (NE-I). Hay que tener en cuenta que el objetivo no es alcanzar la monoterapia, sino proporcionar al paciente el mejor control de sus síntomas. Por tanto, la reducción, e incluso supresión, de la LD es aceptable siempre que se mantenga una buena respuesta global.
Eficacia
El estudio TOLEDO ha demostrado que el tratamiento con A-PS consigue una reducción significativa del tiempo off en pacientes con EPA, sin incremento de discinesias7 (NE-I). Se trataba de pacientes con una media de 63 años, 11 años de evolución de la enfermedad y 6,7 horas al día en situación off. Al cabo de 12 semanas la reducción en el tiempo off fue de 2,47 horas al día en el grupo con A-PS y de 0,58 horas en el grupo con placebo (diferencia estadísticamente significativa de 1,89 horas). La ganancia en el tiempo on fue sin discinesias problemáticas. Mejoró la impresión global de cambio por parte del paciente, pero no hubo diferencias significativas en cuanto a calidad de vida (PDQ-8). El estudio de extensión abierto durante 52 semanas lo completaron 59 de 84 pacientes (70,2%) que mostraron, sobre su situación basal, una reducción media del tiempo off de 3,7 horas y una reducción de 543 mg en la dosis equivalente de LD8 (NE-II).
Un estudio prospectivo evaluó la A-PS en 22 pacientes con EPA en fase algo más temprana, definida como < 71 años y < 3 años desde el diagnóstico de EPA10 (NE-IV). La edad media de los pacientes reclutados fue 59,4 años y la duración de enfermedad 8,7 años. Tras 6 meses de tratamiento, se observó una reducción media del tiempo off de 3,5 horas al día. Las discinesias no empeoraron, a pesar de un incremento global en la dosis equivalente de LD. Mejoraron los síntomas no motores (especialmente la apatía y la calidad del sueño), así como la calidad de vida. Si bien no hubo cambios globales en la esfera cognitiva, se encontró una leve mejoría de las funciones ejecutivas.
En 2015, un grupo internacional de expertos publicó una serie de recomendaciones para la utilización de este fármaco11 (NE-IV). Proponen su uso en los siguientes casos: 1) necesidad de excesivas dosis de rescate con bolos de apomorfina; 2) discinesias que impiden la optimización del tratamiento con terapia convencional; 3) síntomas no motores muy molestos asociados al off; 4) regímenes terapéuticos muy complejos que dificultan su cumplimiento; 5) como alternativa a la ECP por incumplimiento de criterios o preferencia del paciente y 6) absorción de LD enlentecida por gastroparesia.
Efectos adversos
Los efectos adversos más frecuentes son los dopaminérgicos, tanto periféricos como centrales (mareos, náuseas, vómitos, discinesias, alucinaciones, delirio), y los nódulos subcutáneos en el lugar de la inyección. Las reacciones alérgicas son menos frecuentes. Rara vez puede aparecer una anemia hemolítica o un síndrome eosinofílico6 (NE-IV). Los nódulos fueron el motivo más común de abandono del tratamiento en los primeros tiempos de su utilización. Posteriormente se consiguió minimizar este problema insistiendo en la higiene, la rotación de los lugares de punción, el uso de agujas Teflón® insertadas con un ángulo de 45-90°, masajes en la zona de infusión o utilizando parches de silicona. En caso de que los nódulos sean muy numerosos, la aplicación de ultrasonidos puede ser de utilidad.
En el estudio TOLEDO, los efectos secundarios en las primeras 12 semanas fueron frecuentes (92,6% de los pacientes), si bien con una intensidad leve o moderada. Los más comunes fueron problemas cutáneos, náuseas y somnolencia7 (NE-I). Seis pacientes abandonaron el tratamiento por efectos adversos, 3 de ellos considerados graves (hipotensión grave, leucopenia/anemia e infarto de miocardio, este último no relacionado con el tratamiento). A largo plazo (mediana de seguimiento: 52 semanas), los efectos secundarios más frecuentes (≥ 10% de los pacientes) fueron: nódulos sub- cutáneos, náuseas, somnolencia, discinesias, caídas, insomnio, estreñimiento, mareo, eritema local y cefalea. Catorce pacientes (16,7%) abandonaron el tratamiento por efectos adversos: 4 de ellos por reacciones locales y el resto por causas diversas8.

Bibliografía
6. Auffret M, Drapier S, Vérin M. Pharmacological insights into the use of apomorphine in Parkinson’s Disease: Clinical Relevance. Clin Drug Investig. 2018;38(4):287-312.
7. Katzenschlager R, Poewe W, Rascol O, et al. Apomorphine subcutaneous infusion in patients with Parkinson’s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2018;17(9):749-759.
8. Katzenschlager R, Poewe W, Rascol O, et al. Long-term safety and efficacy of apomorphine infusion in Parkinson’s disease patients with persistent motor fluctuations: Results of the open-label phase of the TOLEDO study. Parkinsonism Relat Disord. 2021;83:79-85.
9. Kukkle PL, Garg D, Merello M. Continuous subcutaneous infusion delivery of apomorphine in Parkinson’s Disease: a systematic review. Mov Disord Clin Pract. 2023;10(9):1253-1267.
10. Fernández-Pajarín G, Sesar Á, Jiménez Martín I, et al. Continuous subcutaneous apomorphine infusion in the early phase of advanced Parkinson’s disease: A prospective study of 22 patients. Clin Park Relat Disord. 2021;6:100129.
11. Trenkwalder C, Chaudhuri KR, García Ruiz PJ, et al. Expert consensus group report on the use of apomorphine in the treatment of Parkinson’s disease. Clinical practice recommendations. Parkinsonism Relat Disord. 2015;21:1023-30.
El tratamiento con LD en perfusión enteral continua consiste en la administración de este fármaco a nivel del duodeno a través de una gastrostomía, utilizando un sistema de perfusión externo. De esta forma, se evitan las consecuencias de un vaciamiento gástrico errático, proporcionando una absorción dopaminérgica más continua12 (NE-III). Su objetivo clínico es reducir las fluctuaciones motoras en la EPA.
Actualmente se dispone de dos formulaciones, que se administran utilizando diferentes sistemas de perfusión externos:
-
LD con carbidopa (CD) para perfusión enteral (LCIG), aprobada por la AEMPS en Se trata de una fórmula galénica de LD/CD en suspensión micronizada en gel. Tiene una proporción de LD/CD de 4/1. Se presenta en contenedores de 100 ml (LD 2000 mg, CD 500 mg)13.
-
LD/CD con entacapona (EC) para perfusión enteral (LECIG). Aprobada por la AEMPS en 2021. Es un gel que contiene una proporción de LD/CD/EC de 4/1/4. Se presenta en cartuchos de 47 ml (LD 940 mg, CD 235 mg, EC 940 mg)14. La dosis equivalente de LD en cada cartucho sería 1222 mg, teniendo en cuenta que la adición de EC multiplica la dosis de LD × 1,315 (NE-I).
Eficacia
-
LCIG
Se ha llevado a cabo un estudio multicéntrico doble ciego, aleatorizado, controlado con placebo, que comparó la eficacia de LC-PE vs. el tratamiento convencional optimizado16 (NE-I). A las 12 semanas, el grupo tratado con LCIG mostró una reducción del tiempo off de 4 horas al día, superando al grupo control en 1,9 horas de forma estadísticamente significativa; la ganancia en el tiempo on fue sin discinesias problemáticas. Esta reducción del tiempo off se confirmó en un estudio de extensión abierto posterior17 (NE-II), y también se ha constatado en el registro GLORIA18 (NE-II), siendo incluso más notoria a largo plazo.
Estos resultados son congruentes con los de otros estudios prospectivos observacionales comparando los efectos de LCIG respecto al estado basal con tratamiento convencional. Así, un estudio con 354 pacientes seguidos 54 semanas mostró una reducción del tiempo off de 4,4 horas al día (equivalente a un 65,6%), un incremento del tiempo on sin discinesias problemáticas de 4,8 horas, y una reducción del tiempo con discinesias graves de casi 30 minutos (equivalente a un 22,5%)19 (NE-II). Otro estudio con 375 pacientes seguidos durante 1 año mostró una reducción del tiempo off de 4,7 horas al día20 (NE-III). A pesar de los diferentes métodos para cuantificar las fluctuaciones, la mayoría de los trabajos muestran una reducción del tiempo off diario de en torno a unas 4 horas20,24 (NE-III). En algunos casos conlleva la desaparición de los momentos off durante el día. De forma consecuente, el tiempo on diario se incrementa entre 4-6 horas, generalmente con reducción de las discinesias a medio-largo plazo.
El estudio DYSCOVER es un estudio multicéntrico, abierto, en el que 63 pacientes fueron asignados aleatoriamente a recibir tratamiento con LCIG vs. tratamiento convencional optimizado25 (NE-I). A las 12 semanas, la puntuación en la UDysRS se redujo de forma significativa en el grupo con LCIG (24 pacientes, -17,37 puntos) respecto al grupo control (26 pacientes, -2,33 puntos). Esta mejoría de las discinesias se acompañó de mejoría del dolor y de la calidad de vida26 (NE-I). El estudio observacional DUOGLOBE también confirma la reducción en la UDysRS al año de seguimiento27 (NE-III).
Múltiples trabajos han evaluado el efecto de la LCIG sobre los síntomas no motores de la EPA con diferentes métodos de evaluación. Varios estudios observacionales han empleado escalas específicas como la Non-Motor Symptoms Scale for Parkinson’s Disease (NMSS), mostrando mejoría global y, específicamente, en los ítems de fatiga, sueño, atención, cognición, estado de ánimo y síntomas gastrointestinales18,23,28 (NE-III). En un estudio comparativo con otras terapias de segunda línea, la mejoría global en esta escala fue superior en los pacientes tratados con LCIG o ECP respecto a los tratados con A-PS, aunque con diferentes perfiles considerando sus distintos dominios29,30 (NE-II).
La LCIG mejora la calidad de vida (PDQ-39) a las 12 semanas respecto a placebo16 (NE-I). Numerosos estudios observacionales demuestran mejoría de la calidad de vida a más largo plazo, incluidos estudios multicéntricos con importante tamaño muestral (> 250 pacientes)18,31 (NE-II). Un metaanálisis de 26 estudios, con 1556 pacientes, confirma la mejoría en las actividades cotidianas y en la calidad de vida desde el inicio, que se mantiene a los 12-24 meses de tratamiento32 (NE-I).
Estudios observacionales a largo plazo muestran una significativa reducción de la politerapia tras iniciar LCIG. Hasta el 73% se mantienen en monoterapia con este fármaco al año de tratamiento19 (NE-II), y el 63% a los 4 años33 (NE-III).
Aunque la recomendación general es mantener la terapia con LCIG durante 16 horas diurnas, en determinadas circunstancias puede ser recomendable un régimen de 24 horas, como cuando existe importante sintomatología motora nocturna, acinesia matutina o discinesias bifásicas34,35 (NE-III). Aunque no hay evidencia clara, en estos casos podría ser recomendable una menor dosis durante las horas nocturnas, si bien no se ha documentado un incremento llamativo de efectos secundarios al prolongar las horas de la terapia35 (NE-III). Por el contrario, se ha descrito mejoría de los síntomas axiales durante el día en pacientes tratados con LCIG durante 24 horas36 (NE-III).
-
LECIG
Se trata de una terapia más reciente y, por tanto, cuenta con evidencias más limitadas. Al asociar EC como inhibidor de la COMT se consigue, a igualdad de dosis, una concentración plasmática de LD más elevada37. El menor volumen necesario permite utilizar un dispositivo de perfusión de tamaño y peso más reducido, suponiendo una ventaja práctica para muchos pacientes, aunque para otros su manejo podría ser más dificultoso38,39 (NE-IV).
Un estudio farmacocinético cruzado y abierto durante 48 horas comparó en 11 pacientes el tratamiento con LCIG vs. LECIG (esta última con una reducción del 20% en la dosis de LD), demostrando que, tanto la exposición plasmática a LD como la respuesta clínica fueron similares, con la ventaja del ahorro de LD con LECIG40 (NE-II). Según la ficha técnica del fármaco, se recomienda reducir entre un 20-35% la dosis de LD continua al utilizar LECIG.
Existen publicaciones sobre experiencia en vida real, y estudios observacionales a 6-12 meses, que comparan los efectos de LECIG respecto al estado basal con tratamiento convencional y tras el cambio desde LCIG, y que documentan una mejoría de las fluctuaciones motoras y un patrón de seguridad similar al de LCIG, pero con mayor comodidad para los pacientes en relación con el menor tamaño y peso del perfusor41-43 (NE-III). Así, un estudio con 74 pacientes43 mostró una reducción significativa del tiempo off de 4 horas al día, una disminución tanto del porcentaje de pacientes que presentaban discinesia como la intensidad de los episodios y disminución significativa de la acinesia matutina, los off impredecibles y los freezings.
En otro estudio de 73 pacientes, seguidos una media de 6 meses, se mostró una reducción significativa del tiempo off de 3,8 horas y de la UPDRS-III. En este mismo estudio se muestra la mejoría significativa del tiempo off (2,4 horas al día) tras pasar los pacientes de LCIG a LECIG44. En la actualidad se está llevando a cabo un estudio observacional multicéntrico con seguimiento a 24 meses (estudio ELEGANCE, identificador de ClinicalTrials.gov: NCT05043103).
Efectos adversos
LCIG
Los efectos adversos son frecuentes (55-90%), en su mayoría por problemas relacionados con la gastrostomía/perfusión, y generalmente reversibles18,19,45 (NE-II). En un ensayo clínico controlado con placebo a 12 semanas, con doble enmascaramiento, no hubo diferencias en los efectos adversos relacionados con el propio fármaco entre los que fueron tratados por vía oral vs. enteral (todos eran portadores de un sistema de perfusión enteral)16 (NE-I).
En el anterior ensayo, y en estudios observacionales a largo plazo, los efectos adversos relacionados con la gastrostomía/perfusión fueron más comunes en la primera semana posgastrostomía (65%), para disminuir a partir de la cuarta semana a un 17%19,31,46,47(NE-II).
A largo plazo, un estudio con seguimiento de hasta 8 años muestra un adecuado perfil de seguridad, con tasas de abandono por efectos adversos del 3-8,3%47 (NE-II). Sin embargo, es necesario prestar atención a algunas complicaciones observadas, como la pérdida de peso y la aparición de polineuropatía en un 3% de los pacientes48,49 (NE-II). La polineuropatía también se ha descrito en pacientes tratados a largo plazo con LD oral a altas dosis, y parece estar relacionada a con niveles aumentados de homocisteína y disminución del metabolismo de la cobalamina. En publicaciones recientes, se ha encontrado una reducción de los niveles de las vitaminas B12 y B6, con aumento de los niveles de homocisteína. Algunos autores sugieren que la formulación en gel enteral podría causar malabsorción de nutrientes. Se recomienda realizar controles de vitamina B12 y homocisteína antes de comenzar el tratamiento y posteriormente durante el mismo, y ocasionalmente suplementarlas de forma preventiva o si los niveles se encuentran bajos, así como vigilancia del peso corporal27,45,48,50-52 (NE-I).
LECIG
Si bien la evidencia disponible sobre su seguridad es menor, en gran parte puede extra- polarse de la experiencia con LCIG. Adicionalmente a las complicaciones de LCIG, en un estudio observacional con seguimiento variable (mediana: 305 días), 3 de 21 pacientes (14%) suspendieron el tratamiento por diarrea atribuida a EC41 (NE-III).
Se ha postulado que la adición de EC podría ser favorable respecto al posible desarrollo de polineuropatía53 (NE-IV), si bien son necesarios estudios a largo plazo.

Bibliografía
12. Bestetti A, Capozza A, Lacerenza M, et al. Delayed gastric emptying in advanced Parkinson disease: correlation with therapeutic doses. Clin Nucl Med. 2017;42(2):83-87.
13. Duodopa 20 mg/ml + 5 mg/ml gel intestinal. En: AEMPS-CIMA [Internet]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/66547/FichaTecnica_66547.html
14. Lecigon 20 mg/ml + 5 mg/ml + 20 mg/ml gel intestinal. En: AEMPS-CIMA [Internet]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/86092/FT_86092.html
15. Tomlinson CL, Stowe R, Patel S, et al. Systematic review of levodopa dose equivalency reporting in Parkinson’s disease. Mov Disord. 2010;25(15):2649-53.
16. Olanow CW, Kieburtz K, Odin P, et al. Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson’s disease: a randomised, controlled, double-blind, double-dummy study. Lancet Neurol. 2014;13(2):141-9.
17. Slevin JT, Fernández HH, Zadikoff C, et al. Long-term safety and maintenance of efficacy of levodopa-carbidopa intestinal gel: an open-label extension of the double-blind pivotal study in advanced Parkinson’s disease patients. J Parkinsons Dis. 2015;5(1):165-74.
18. Antonini A, Poewe W, Chaudhuri KR, et al. Levodopa-carbidopa intestinal gel in advanced Parkinson’s: final results of the GLORIA registry. Parkinsonism Relat Disord. 2017;45:13-20.
19. Fernández HH, Standaert DG, Hauser RA, et al. Levodopa-carbidopa intestinal gel in advanced Parkinson’s disease: Final 12-month, open-label results. Mov Disord. 2015;30(4):500-9.
20. Antonini A, Yegin A, Preda C, et al. Global long-term study on motor and non-motor symptoms and safety of levodopa-carbidopa intestinal gel in routine care of advanced Parkinson’s disease patients; 12-month interim outcomes. Parkinsonism Relat Disord. 2015;21:231-5.
21. Nilsson D, Nyholm D, Aquilonius SM. Duodenal levodopa infusion in Parkinson’s disease-long-term experience. Acta Neurol Scand. 2001;104:343-8.
22. Puente V, De Fabregues O, Oliveras C, et al. Eighteen month study of continuous intraduodenal levodopa infusion in patients with advanced Parkinson’s disease: Impact on control of fluctuations and quality of life. Parkinsonism Relat Disord. 2010;16:218-21.
23. Cáceres-Redondo MT, Carrillo F, Lama MJ, et al. Long-term levodopa/carbidopa intestinal gel in advanced Parkinson’s disease. J Neurol. 2014;261:561-9.
24. Buongiorno M, Antonelli F, Cámara A, et al. Long-term response to continuous duodenal infusion of levodopa/carbidopa gel in patients with advanced Parkinson disease: The Barcelona registry. Parkinsonism Relat Disord. 2015;21(8):871-6.
25. Freire-Álvarez E, Kurča E, López Manzanares L, et al. Levodopa-Carbidopa intestinal gel reduces dyskinesia in Parkinson’s disease in a randomized trial. Mov Disord. 2021;36(11):2615-23.
26. Freire-Álvarez E, Vanni P, Kurča E, et al. Dyskinesia and pain in advanced Parkinson’s disease: Post hoc analysis from the phase 3b, open-label, randomized DYSCOVER Study. Neurol Ther. 2024;13(2):437-47.
27. Standaert DG, Aldred J, Anca-Herschkovitsch M, et al. DUOGLOBE: one-year outcomes in a real-world study of levodopa carbidopa intestinal gel for Parkinson’s disease. Mov Disord Clin Pract. 2021;8(7):1061-74.
28. Honig H, Antonini A, Martínez-Martín P, et al. Intrajejunal levodopa infusion in Parkinson’s disease: a pilot multicenter study of effects on nonmotor symptoms and quality of life. Mov Disord. 2009;24:1468-74.
29. Martínez-Martín P, Reddy P, Katzenschlager R, et al. EuroInf: a multicenter comparative observational study of apomorphine and levodopa infusion in Parkinson’s disease. Mov Disord. 2015;30:510-6.
30. Dafsari HS, Martínez-Martín P, Rizos A, et al. EuroInf 2: Subthalamic stimulation, apomorphine, and levodopa infusion in Parkinson’s disease. Mov Disord. 2019;34(3):353-65.
31. Fernández HH, Boyd JT, Fung VSC, et al. Long-term safety and efficacy of levodopa-carbidopa intestinal gel in advanced Parkinson’s disease. Mov Disord. 2018;33(6):928-36.
32. Standaert DG, Patel V, Snedecor SJ, et al. Impact of carbidopa-levodopa enteral suspension on quality of life and activities of daily living in patients with advanced Parkinson’s disease: Results from a pooled meta-analysis. Parkinsonism Relat Disord. 2021;86:52-57.
33. Nyholm D, Klangemo K, Johansson A. Levodopa/carbidopa intestinal gel infusion longterm therapy in advanced Parkinson’s disease. Eur J Neurol. 2012;19:1079-85.
34. Thakkar S, Fung VSC, Merola A, et al. 24-Hour Levodopa-Carbidopa Intestinal Gel: Clinical Experience and Practical Recommendations. CNS Drugs. 2021;35(2):137-149.
35. Busk K, Nyholm D. Long-term 24-h levodopa/carbidopa gel infusion in Parkinson’s disease. Parkinsonism Relat Disord. 2012;18(8):1000-1.
36. Sensi M, Preda F, Trevisani L, et al. Emerging issues on selection criteria of levodopa carbidopa infusion therapy: considerations on outcome of 28 consecutive patients. J Neural Transm (Vienna). 2014 Jun;121(6):633-42.
37. Nyholm D, Jost WH. Levodopa-entacapone-carbidopa intestinal gel infusion in advanced Parkinson’s disease: real-world experience and practical guidance. Ther Adv Neurol Disord. 2022;15:17562864221108018.
38. Othman M, Widman E, Nygren I, et al. Initial experience of the levodopa-entacapone-carbidopa intestinal gel in clinical practice. J Pers Med. 2021;11:254.
39. Klarich A, Noonan TZ, Reichlen C, et al. Usability of smart infusion pumps: a heuristic evaluation. Appl Ergon. 2022;98:103584.
40. Senek M, Nielsen EI, Nyholm D. Levodopa-entacapone-carbidopa intestinal gel in Parkinson’s disease: a randomized crossover study. Mov Disord. 2017;32:283-286.
41. Öthman, M, Widman E, Nygren I, et al. Initial Experience of the Levodopa–Entacapone–Carbidopa Intestinal Gel in Clinical Practice. J Pers Med. 2021;11(4):254.
42. Viljaharju V, Mertsalmi T, Pauls KAM, et al. Levodopa-Entacapone-Carbidopa intestinal gel treatment in advanced Parkinson’s disease: A single-center study of 30 patients. Mov Disord Clin Pract. 2024;11(2):159-165.
43. Szász JA, Dulamea AO, Constantin VA, et al. Levodopa-Carbidopa-Entacapone intestinal gel in advanced Parkinson disease: A multicenter real-life experience. Am J Ther. 2024;31(3):e209-e218.
44. Santos Garcia D, López-Manzanares L, Muro I, et al. Effectiveness and safety of levodopa–entacapone–carbidopa infusion in Parkinson disease: A real-world data study. Eur J Neurol. 2025 Jan;32(1):e16535.
45. Lang AE, Rodríguez RL, Boyd JT, et al. Integrated safety of levodopa-carbidopa intestinal gel from prospective clinical trials. Mov Disord. 2016;31:538-546.
46. Valldeoriola F, Grandas F, Santos-García D, et al. Long-term effectiveness of levodopa-carbidopa intestinal gel in 177 Spanish patients with advanced Parkinson’s disease. Neurodegener Dis Manag. 2016;6:289-98.
47. Lopiano L, Modugno N, Marano P, et al. Motor and nonmotor outcomes in patients with advanced Parkinson’s disease treated with levodopa/carbidopa intestinal gel: final results of the GREENFIELD observational study. J Neurol. 2019;266:2164-76.
48. Müller T, van Laar T, Cornblath DR, et al. Peripheral neuropathy in Parkinson’s disease: levodopa exposure and implications for duodenal delivery. Parkinsonism Relat Disord. 2013;19(5):501-7; discussion 501.
49. Merola A, Romagnolo A, Zibetti M, et al. Peripheral neuropathy associated with levodopa-carbidopa intestinal infusion: a long-term prospective assessment. Eur J Neurol. 2016;23(3):501-9.
50. Mancini F, Comi C, Oggioni GD, et al. Prevalence and features of peripheral neuropathy in Parkinson’s disease patients under different therapeutic regimens. Parkinsonism Relat Disord. 2014;20(1):27-31.
51. Romagnolo A, Merola A, Artusi CA, et al. Levodopa-induced neuropathy: a systematic review. Mov Disord Clin Pract. 2019;6:96-103.
52. Santos-García D, Macías M, Llaneza M, et al. Serum vitamin B12 and folate levels in Parkinson’s disease patients treated with duodenal levodopa infusion. Mov Disord. 2011;26:558-9.
53. Jost WH. Apprends-moi l’art des petits pas: Levodopa, Carbidopa Intestinal Gel plus Entacapone. J Neural Transm (Vienna). 2023;130(11):1379-82.
La administración de LD en perfusión subcutánea continua ha supuesto un avance sustancial, al permitir mantener unos niveles plasmáticos estables de una forma menos invasiva respecto a la perfusión enteral.
La foslevodopa/foscarbidopa (pLD/pCD) es un profármaco que permite conseguir una elevada concentración de LD en un mínimo volumen de dilución, con pH de 7,4 y osmolaridad de aproximadamente 2200-2500 mOsmol/kg. Se encuentra comercializado en viales de vidrio de 10 ml que contienen 240 mg/ml de pLD y 12 mg/ml de pCD, con una equivalencia de 170 mg/ml de LD y 9 mg/ml de CD, para administración continua durante 24 horas. Se trata de una solución transparente, o ligeramente opalescente, que puede variar desde incolora hasta una tonalidad amarillenta o rojiza. Las variaciones de color están previstas y no afectan a la calidad del producto54,55 (NE-II). Se administra mediante un dispositivo de perfusión (Vyafuser®) con batería recargable que permite un rango de dosis entre 0,15-1,04 ml/h, con ajustes de 0,01 ml/h (aproximadamente 1,7 mg de LD). Es posible programar hasta un total de tres flujos diferentes, también administrar una dosis de carga (después de al menos 3 horas de interrupción de la bomba), así como dosis extra (máximo: 0,30 ml) cuando se precise. Esta bomba de perfusión va conectada al inyector que debe quedar alojado a nivel subcutáneo, siendo necesario sustituirlo en un máximo de 72 horas. Una vez administrado, el profármaco se transforma rápida y casi completa- mente en LD por medio de fosfatasas alcalinas, consiguiéndose unos niveles plasmáticos elevados, similares a los obtenidos mediante LCIG56-59 (NE-II).
Existen otras dos moléculas en desarrollo para administración de LD en perfusión subcutánea continua: DIZ102 y ND061260 (NE-II), habiéndose publicado recientemente los resultados de un estudio en fase III con esta última61 (NE-I).
Eficacia
Los niveles plasmáticos de LD que se consiguen a través de la perfusión subcutánea de pLD/pCD (pLC-PS), son superponibles a los obtenidos con LCIG, con mínimas fluctuaciones en ambos casos55 (NE-II). Sin embargo, existe un retardo de aproximadamente 2 horas en alcanzar un nivel estable, por lo que el efecto de una dosis extra puede tener una mayor latencia con respecto a LCIG57,62 (NE-II).
Se ha llevado a cabo un estudio multicéntrico doble ciego, aleatorizado, controlado con placebo, que comparó la eficacia de pLC-PS vs. LD/CD oral63 (NE-I). A las 12 semanas, el grupo tratado con pLC-PS mostró una reducción del tiempo off de 2,7 horas al día, superando al grupo control en 1,8 horas de forma estadísticamente significativa; la ganancia en el tiempo on fue sin discinesias problemáticas.
Otro estudio de brazo único, abierto, evaluó la seguridad y eficacia de pLC-PS en 244 pacientes64 (NE-III). Al año, los 137 pacientes que completaron el seguimiento redujeron el tiempo off una media de 3,5 horas al día y aumentaron el tiempo on sin discinesias problemáticas una media de 3,8 horas al día. También experimentaron mejorías en la acinesia matutina, en la calidad del sueño y en la calidad de vida.
El beneficio del tratamiento también está presente en los pacientes en una fase más precoz dentro de la EP fluctuante, como se refleja en un subanálisis realizado en pacientes ≤ 65 años, con estadio de Hoehn-Yahr ≤ 2 en on y sin haber transcurrido más de 3 años desde el inicio de las fluctuaciones65 (NE-III).
La optimización de la dosis (cuando ya no se modificó la perfusión basal durante ≥ 15 días consecutivos) se alcanzó en estos estudios tras una media de 2,4 y 3,5 visitas, respectivamente; tras 2 visitas se consiguió esta optimización en el 40-60% de los pacientes. La LD administrada oscila entre 600-4260 mg/24 h, permitiendo la monoterapia en muchos casos63-67 (NE-I).
La administración continua durante 24 horas aporta un beneficio relevante de los síntomas motores nocturnos y de la acinesia matutina63,64 (NE-I), de tal forma un 75-80% de los pacientes se despiertan en situación on. También se consigue una reducción de las discinesias incapacitantes en comparación con el tratamiento oral, tal como ocurre con LCIG. En un subanálisis presentado en el Congreso de la MDS en 2023 se describió una mejoría significativa de la nicturia, con incidencia en la calidad de vida68 (NE-II). En el momento actual la evidencia en relación con otros síntomas no motores es escasa, si bien se trata de un aspecto prometedor, teniendo en cuenta la similitud farmacocinética con la LCIG57 (NE-II).
Efectos adversos
La presencia de efectos adversos es elevada, como es habitual en las perfusiones subcutáneas continuas, en su mayoría por complicaciones a nivel local. Más del 90% de los pacientes presentaron algún tipo de efecto adverso en relación con el tratamiento en los estudios pivotales63,64 (NE-I), generalmente de intensidad leve o moderada en la zona de la infusión, resolviéndose sin o con tratamiento: eritema, nódulo, absceso, celulitis, edema, dolor y/o reacción cutánea.
En el estudio de eficacia a 12 semanas, el 85% de los tratados con pLC-PS presentaron algún efecto adverso, frente al 63% del grupo placebo (solución salina por vía subcutánea), con discontinuación por este motivo en el 22 vs. el 1% respectivamente. Sin embargo, no hubo gran diferencia en cuanto a efectos adversos graves (8 vs. 6% respectivamente)63 (NE-I). En el estudio de seguridad a 1 año, el 44% discontinuó el tratamiento, el 23% del total por efectos adversos64 (NE-III). Es necesario considerar que la pandemia por COVID-19 vino a suponer una dificultad añadida en el seguimiento de este estudio. Un 25,8% presentaron algún efecto adverso grave en el transcurso de 1 año (se incluyen 5 fallecimientos no relacionados con el tratamiento)64.
La mayor parte de las discontinuaciones se produjeron en las primeras 6-10 semanas63,64 (NE-I), enfatizando la necesidad de un estrecho seguimiento tras el inicio de la terapia. Prevenir los efectos adversos locales es clave para el éxito terapéutico: se recomienda una educación sanitaria previa y continuada para garantizar las condiciones de asepsia necesarias59 (NE-IV). Especial mención merecen los efectos adversos en la esfera neuropsiquiátrica, presentando alucinaciones el 15-17% de los pacientes63,64 (NE-I). Si bien se trataba en su mayoría de pacientes tratados con agonistas dopaminérgicos, se postula su posible relación con el tratamiento continuado durante 24 horas (en el estudio de seguridad al año se permitió reducir la dosis nocturna en un 20%). Hasta la fecha no se han reportado casos de polineuropatía o pérdida de peso relevante, como se ha descrito con la administración de LCIG.

Bibliografía
54. Duodopa 240 mg/ml + 12 mg/ml solución para perfusión. En: AEMPS-CIMA [Internet]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/88677/FT_88677.html
55. Rosebraugh M, Liu W, Neenan M, Facheris MF. Foslevodopa/foscarbidopa is well tolerated and maintains stable levodopa and carbidopa exposure following subcutaneous infusion. J Parkinsons Dis. 2021;11(4):1695-1702.
56. Rosebraugh M, Stodtmann S, Liu W, Facheris MF. Foslevodopa/foscarbidopa subcutaneous infusion maintains equivalent levodopa exposure to levodopa-carbidopa intestinal gel delivered to the jejunum. Parkinsonism Relat Disord. 2022 Apr;97:68-72.
57. Savaryn JP, Smith RL, Rosebraugh M, et al. Metabolite profiling of foslevodopa/foscarbidopa in plasma of healthy human participants by LC-HRMS indicates no major differences compared to administration of levodopa/carbidopa intestinal gel. Pharmacol Res Perspect. 2024 Apr;12(2):e1190.
58. Van Laar T, Chaudhuri KR, Antonini A, et al. Infusion therapies in the treatment of Parkinson’s disease. J Parkinsons Dis. 2023;13(5):641-657.
59. Fung VSC, Aldred J, Arroyo MP, et al. Continuous subcutaneous foslevodopa/foscarbidopa infusion for the treatment of motor fluctuations in Parkinson’s disease: Considerations for initiation and maintenance. Clin Park Relat Disord. 2024;10:100239.
60. Bergquist F, Ehrnebo M, Nyholm D, et al. Pharmacokinetics of intravenously (DIZ101), subcutaneously (DIZ102), and intestinally (LCIG) infused levodopa in advanced Parkinson disease. Neurology. 2022;99(10):e965-e976.
61. Espay AJ, Stocchi F, Pahwa R, et al.; BouNDless Study Group. Safety and efficacy of continuous subcutaneous levodopa-carbidopa infusion (ND0612) for Parkinson’s disease with motor fluctuations (BouNDless): a phase 3, randomised, double-blind, double-dummy, multicentre trial. Lancet Neurol. 2024;23(5):465-476.
62. Rosebraugh M, Voight EA, Moussa EM, Jameel F, Lou X, Zhang GGZ, et al. Foslevodopa/ Foscarbidopa: A New Subcutaneous Treatment for Parkinson's Disease. Ann Neurol. 2021 Jul;90(1):52-61.
63. Soileau MJ, Aldred J, Budur K, et al. Safety and efficacy of continuous subcutaneous foslevodopa-foscarbidopa in patients with advanced Parkinson’s disease: a randomised, double-blind, active-controlled, phase 3 trial. Lancet Neurol. 2022;21(12):1099-1109.
64. Aldred J, Freire-Álvarez E, Amelin AV, et al. Continuous subcutaneous foslevodopa/ foscarbidopa in Parkinson’s disease: Safety and efficacy results from a 12-month, single-arm, open-label, phase 3 study. Neurol Ther. 2023;12(6):1937-58.
65. Antonini A, Bergmans B, Kern D, et al. Improvement in motor symptoms and quality of life in patients with an earlier stage of advanced Parkinson’s disease treated with foslevodopa/foscarbidopa subcutaneous 24-hour infusion. Mov Disord 2023;38(suppl. 1):S10.
66. Santos García D, Bergmann L, Bergmans B, et al. Concomitant medication use and levodopa equivalent daily dose requirements after foslevodopa/foscarbidopa initiation. Mov Disord 2022;37(suppl. 2): S349-S350.
67. Antonini A, D’Onofrio V, Guerra A. Current and novel infusion therapies for patients with Parkinson’s disease. J Neural Transm (Vienna). 2023;130(11):1349-58.
68. Chaudhuri K, Bouchard M, Freire-Álvarez E, et al. Improvement of nocturia symptoms and associated quality of life in patients with Parkinson’s disease treated with foslevodopa/foscarbidopa: Results from 2 phase 3 trials. Mov Disord 2023;38(suppl. 1): S18.
El tratamiento quirúrgico se contempla como opción terapéutica en pacientes seleccionados con síntomas motores que no se controlan adecuadamente con un tratamiento médico optimizado y que repercuten significativamente sobre su calidad de vida. Las técnicas ablativas unilaterales por radiofrecuencia (talamotomía, palidotomía) fueron prácticamente desplazadas a finales de los años 90 por la técnica de ECP, debido a su mejor perfil beneficio/riesgo, su capacidad para modular circuitos cerebrales de forma ajustable y reversible y, especialmente, al permitir procedimientos bilaterales69-73.
La ECP consiste en la implantación estereotáctica de electrodos, situando su extremo con los contactos activos en la diana seleccionada. En la EPA, la diana utilizada es habitualmente el núcleo subtalámico (NST) o, alternativamente, el globo pálido interno (GPi); en ambos casos nos referiremos a partir de ahora a procedimientos bilaterales.
Estos electrodos se conectan mediante cables subcutáneos a un generador de pulsos eléctricos programable, implantado también subcutáneamente en la región torácica o abdominal.
Un equipo multidisciplinar con experiencia y entrenamiento adecuado es un requerimiento fundamental para conseguir el éxito de esta terapia. Habitualmente participan, entre otras especialidades, Neurología, Neurocirugía, Neurorradiología, Neurofisiología, Neuroanestesia y Neuropsicología.
Estimulación cerebral profunda del núcleo subtalámico
Selección de pacientes y predictores
Tratándose de una terapia neuroquirúrgica, la selección del potencial candidato debe ser muy cuidadosa. Un examen médico minucioso y una evaluación neuropsicológica exhaustiva son esenciales. En general, la ECP del NST (ECP-NST) se debe considerar en aquellos pacientes con EP que cumplan los criterios expresados en la Tabla I.
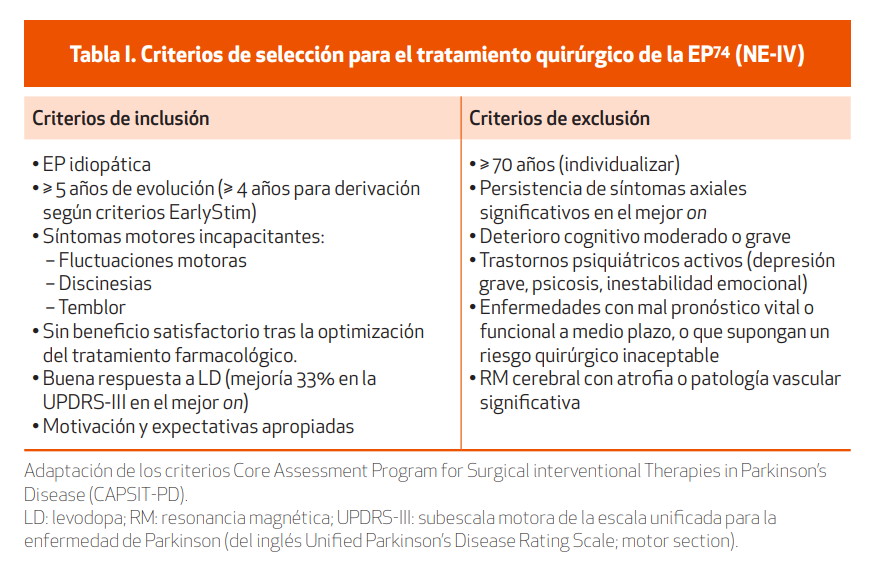
En base a varios estudios, la respuesta preoperatoria a LD en un test formal es predictiva de la mejoría obtenida tras ECP75,76 (NE-II). Generalmente, los síntomas que mejoran con LD son también los que mejoran tras ECP, mientras que los refractarios a LD, como ocurre en ocasiones con algunos trastornos axiales, serían también refractarios a la ECP. Un síntoma para considerar separadamente es el temblor, pues a menudo responde mejor a ECP que a LD77 (NE-II).
Asimismo, una menor edad y una duración más corta de la enfermedad posiblemente predicen una mejoría más notable tras la ECP-NST75 (NE-II). No se ha identificado un umbral concreto de edad a partir del cual no se deba ofrecer la terapia, pero se debe tener en cuenta que los pacientes de mayor edad tendrán con frecuencia otras contraindicaciones, y que la ganancia en calidad de vida tenderá ser menor en intensidad y duración. En un estudio, la mejoría calidad de vida tras ECP-NST fue más modesta en pacientes con ≥ 70 años (45%) respecto a aquellos con < 60 años (68%)78 (NE-III). En la práctica clínica, una edad más avanzada aumenta las probabilidades de asociar trastornos motores axiales refractarios a LD (y por lo tanto a ECP), deterioro cognitivo significativo u otras comorbilidades que puedan aumentar el riesgo quirúrgico. Se recomienda individualizar minuciosamente en cada caso.
En el proceso de selección de los candidatos se debe explicar muy claramente las expectativas de la ECP ya que, si nos son apropiadas, podrían contribuir a resultados poco satisfactorios, incluso existiendo mejoría objetiva evidente79 (NE-III).
Eficacia
Los factores que influyen en el resultado clínico de la ECP son: la correcta selección de los pacientes, la precisión en la localización de los electrodos y el manejo posoperatorio, conjugando la programación de la estimulación eléctrica y los ajustes farmacológicos.
Varios estudios aleatorizados multicéntricos han demostrado la superioridad de la ECP-NST sobre el tratamiento médico optimizado para mejorar las fluctuaciones motoras, las discinesias y la calidad de vida a los 6 meses tras la intervención80-83 (NE-I). La dosis equivalente de LD se pudo reducir en distintos estudios en un 24-40% a los 6-12 meses84-85 (NE-II). El estudio Intrepid, multicéntrico, doble ciego, con asignación aleatoria a recibir estimulación con control de corriente independiente vs. simulada, confirmó el beneficio clínico de la estimulación eléctrica a los 3 meses86 (NE-I).
En otros estudios a más largo plazo (5 y 10 años), los síntomas y signos con respuesta a LD mejoraron de forma significativa87,88 (NE-II). Se observó una mejoría media del 50% en la escala UPDRS-III comparando la situación off-medicación/on-estimulación posoperatoria con la off-medicación preoperatoria. Las discinesias se redujeron una media del 69%.
En el mencionado estudio a 5 años, sin grupo control, que comparó la escala UPDRS-III posoperatoria off-medicación/on-estimulación con la preoperatoria off-medicación, el beneficio motor obtenido al año se mantuvo al cabo de 5 años para el temblor y la rigidez. Sin embargo, la bradicinesia, aunque mejoró al año, no mantuvo el mismo grado de mejoría a los 5 años. La distonía en off desapareció en la mayoría de los pacientes. Las discinesias se redujeron un 71% en duración, y un 58% en discapacidad, al cabo de 1 año, y no variaron hasta los 5 años. La dosis equivalente de LD se redujo una media del 65% al cabo de 1 año y se mantuvo a los 5 años. Las valoraciones de la escala UPDRS-III en on-medicación demostraron un empeoramiento progresivo a lo largo de los 5 años, a expensas de los trastornos axiales, como el habla, la marcha y los reflejos posturales87 (NE-II).
En el otro estudio a 10 años, sin grupo control, pero con evaluaciones ciegas, el beneficio motor de la ECP-NST se mantuvo durante todo el seguimiento, incluyendo el temblor y la bradicinesia. También se mantuvo la mejoría sobre las fluctuaciones motoras, las discinesias, la capacidad funcional y la reducción en la dosis equivalente de LD. Sin embargo, el beneficio sobre los síntomas axiales se fue perdiendo a lo largo del tiempo88 (NE-II). Esta tendencia al empeoramiento de las manifestaciones axiales se suele atribuir a la propia evolución natural de la enfermedad, sin embargo, faltan estudios controlados para demostrarlo.
Earlystim, un estudio multicéntrico, aleatorizado, doble ciego, a 2 años, comparó la eficacia de la ECP-NST frente a un grupo control con tratamiento médico optimizado. Las características de los pacientes fueron diferentes a las de los incluidos en otros estudios controlados: más jóvenes (52 vs. 59-62 años), con menor duración de la enfermedad (7,5 vs. 12 años) y con menor tiempo de evolución de las complicaciones motoras (1,7 años). Los pacientes intervenidos obtuvieron una mejoría del 26% en la calidad de vida (cuestionario PDQ-39), mientras que el grupo control empeoró un 1%. La escala UPDRS-III en off mejoró un 53% en el grupo intervenido vs. 4% en el grupo control. La escala UPDRS-IV (complicaciones motoras) mejoró un 61% en el grupo intervenido vs. empeoramiento del 13% en el grupo control. La dosis equivalente de LD se redujo un 39% en el grupo intervenido vs. incremento del 21% en el grupo control89 (NE-I).
Respecto a las formas monogénicas de EP, un metaanálisis de 17 estudios retrospectivos sobre pacientes con mutaciones en LRRK2, PRKN o GBA, reveló que la eficacia de la ECP-NST no difiere de la descrita en la EP idiopática. No obstante, los pacientes con mutaciones en GBA redujeron menos la dosis de medicación y tuvieron una peor evolución desde el punto de vista cognitivo 2-7 años después90 (NE-I).
En relación con las manifestaciones no motoras de la EP, un estudio controlado encontró una mejoría significativa en la escala para síntomas no motores a los 3 años de la ECP-NST, sobre todo en sueño, fatiga y síntomas urinarios, en comparación con el grupo control tratado con el mejor tratamiento médico91 (NE-II).
Los resultados sobre la calidad de vida se han analizado en un estudio a 5 años, que sugiere que la ECP-NST es altamente eficaz a corto plazo tras la cirugía (1 año), mientras que a largo plazo (5 años) se produce un empeoramiento hasta niveles prequirúrgicos, excepto en algunos dominios específicos, como estigma, bienestar emocional y malestar corporal, en los que se mantiene el beneficio92 (NE-III). En un metaanálisis, la calidad de vida se mantuvo por encima de sus niveles prequirúrgicos a los 5 años93 (NE-I). Un estudio retrospectivo con seguimiento prolongado confirmó que la mejoría motora y de la calidad de vida puede mantenerse incluso hasta 15 años después94 (NE-III). Una revisión sistemática destaca la dificultad para identificar predictores para la mejoría en la calidad de vida, que no siempre es paralela a la mejoría motora, especialmente a medio y largo plazo95 (NE-I). Esta divergencia radica en la heterogeneidad de los pacientes intervenidos y de las medidas de resultado utilizadas, que no siempre capturan todos los aspectos que más inciden en la evolución de la calidad de vida.
Efectos adversos
Las complicaciones más graves están relacionadas directamente con el procedimiento quirúrgico, en general poco frecuentes, como la hemorragia cerebral (1,3%; con mayor riesgo a mayor edad). A lo largo del seguimiento pueden aparecer complicaciones relacionadas con los dispositivos implantados, como infecciones, escaras cutáneas o rotura de los electrodos que, en ocasiones, requieren intervención quirúrgica. Como consecuencia de la terapia, pueden aparecer otras complicaciones como: apraxia de la apertura ocular (1,8-30%), disartria/hipofonía (4-17%), trastorno de la marcha (14%), inestabilidad postural (12,5%), aumento de peso (8,4%) o reducción de la fluidez verbal96 (NE-II).
En una publicación se describió un riesgo incrementado de suicidio tras la ECP-NST97 (NE-II); sin embargo, un estudio controlado con asignación aleatoria en 2 fases (ECP vs. el mejor tratamiento médico y, posteriormente, ECP-NST vs. ECP-Gpi) no encontró asociación directa entre la ECP y un mayor riesgo de ideación o conductas suicidas98 (NE-I).
En un estudio controlado con asignación aleatoria a ECP-NST vs. el mejor tratamiento farmacológico, el estado cognitivo global de los pacientes no empeoró significativamente tras la ECP en la mayoría de los casos, aunque se observaron algunas disfunciones cognitivas de tipo frontal. Además, comparado con el tratamiento farmacológico, los pacientes intervenidos no empeoraron respecto a la afectividad, y mejoraron en ansiedad y calidad de vida99 (NE-I).
En cuanto a efectos adversos neuropsiquiátricos, el delirio o confusión posoperatoria son frecuentes; también puede aparecer depresión, apatía o manía/hipomanía100 (NE-I). Hay resultados contradictorios sobre algunas de estas manifestaciones, debido en parte a la variabilidad metodológica entre distintos estudios. La ansiedad y la depresión tienden a mejorar, mientras que la apatía tiende a empeorar, posiblemente más por el descenso de los fármacos dopaminérgicos, aunque faltan estudios concluyentes al respecto101-103 (NE-II). En un estudio se ha descrito estado hipomaniaco en el 4% de los pacientes tras ECP-NST, en relación con una posición ventromedial de los electrodos104 (NE-IV).
Una revisión sistemática encontró que la mejoría motora tras ECP-NST no se ve influida por el estado cognitivo (ni previo a la cirugía, ni posteriormente en pacientes que desarrollaron deterioro cognitivo postquirúrgico); por otro lado, se trata de un procedimiento seguro desde el punto de vista cognitivo, excepto por una reducción moderada de la fluidez verbal105 (NE-I).
Coste-efectividad
En España se estima que la ECP-NST implica un gasto adicional de 34.389 € por cada año de vida ajustado por calidad de vida (QALY) ganado, en comparación con el mejor tratamiento médico, lo que se considera coste-efectivo106 (NE-II). En Estados Unidos esta estimación ascendió a 49.194 $ por QALY107 (NE-II). Un análisis económico alemán concluyó que la ECP-NST resulta rentable a partir del segundo año tras la cirugía108 (NE-III). La ECP fue también considerada coste-efectiva en una revisión estructurada más reciente, siendo superior en este sentido a otras terapias basadas en dispositivos109 (NE-III).

Estimulación cerebral profunda del globo pálido interno
La palidotomía fue revitalizada en la década de los años 90 tras los trabajos de Laitinen et al., y pronto la ECP del globo pálido interno (ECP-GPi) comenzó a extenderse como alternativa a la palidotomía, con las ventajas ya mencionadas de la ECP sobre la lesión. No obstante, en aquellos años, los estudios sobre la ECP-NST emergieron con fuerza hasta el punto de ser pronto el procedimiento de elección en la mayoría de los centros, si bien no se dispuso de estudios comparativos rigurosos hasta años después.
Uno de los estudios mencionados en el apartado anterior sobre ECP-NST, que comparó la ECP vs. el mejor tratamiento médico, incluyó tanto pacientes con ECP-NST (n = 60) como con ECP-Gpi (n = 61), demostrando globalmente la superioridad de la ECP sobre la función motora, fluctuaciones y calidad de vida a los 6 meses81 (NE-I).
Otros estudios han analizado los resultados de la ECP-NST vs. ECP-Gpi110-113 (NE-I). Un estudio multicéntrico aleatorizado, que incluyó 159 pacientes seguidos durante 3 años, no mostró diferencias significativas entre ambas dianas; si bien la escala de demencia de Mattis declinó más rápido en el grupo intervenido mediante ECP-NST111 (NE-I). Por otro lado, otro estudio que incluyó 128 pacientes, seguidos también durante 3 años, encontró un mayor beneficio motor en medidas secundarias tras la ECP-NST, además de una mayor reducción de la medicación112,113NE-I). Dos metaanálisis que incluyeron todos los estudios comparativos hasta 2014 concluyeron que ambos procedimientos pueden ser igualmente eficaces para mejorar las manifestaciones motoras. Aunque la ECP-NST utiliza un menor voltaje de estimulación y permite una mayor reducción de la medicación, también podría asociarse a una peor evolución en algunas medidas de ánimo y cognición114,115 (NE-I).
Queda por dilucidar que subgrupos de pacientes se beneficiarían más con uno u otro procedimiento. Se ha sugerido que la ECP-Gpi podría ser más apropiada para aquellos pacientes con bajo umbral para desarrollar discinesias, o con mayor riesgo de deterioro anímico o cognitivo tras la cirugía116 (NE-IV).

Técnicas ablativas sin craneotomía: HIFU
En las últimas décadas se ha desarrollado una tecnología que permite administrar ultrasonidos focalizados de alta intensidad (HIFU, del inglés high-intensity focused ultrasound) en estructuras cerebrales profundas, con guía mediante RM (también denominada MRgFUS, del inglés magnetic resonance-guided focused ultrasound), para realizar de esta forma lesiones térmicas controladas, sin necesidad de cirugía convencional mediante craneotomía. También pueden lesionarse estructuras profundas aplicando radiación con extraordinaria precisión: se trata del denominado Gamma knife® o bisturí gamma; si bien, a diferencia del HIFU, sus efectos clínicos ocurren de forma diferida. Estas técnicas, a pesar de que suponen un retorno a la cirugía ablativa (irreversible, no modulable, en un principio unilateral), tienen una creciente aceptación, pues evitan la cirugía convencional y la dependencia de dispositivos implantados. Además, pueden aplicarse a determinados pacientes con contraindicaciones para ECP.
En 2016, la FDA de Estados Unidos aprobó la aplicación de HIFU para realizar talamotomías unilaterales (núcleo ventral intermedio talámico) como tratamiento sintomático del temblor esencial refractario, incluyendo a partir de 2018 el temblor asociado a la EP. En 2021 se extendió la aprobación a pacientes con EPA. En 2022 se aprobó la talamotomía bilateral en dos tiempos, con un intervalo de al menos 9 meses. En Europa el HIFU tiene el marcado CE para el tratamiento del temblor esencial refractario a medicación (uni- o bilateral) y para el tratamiento unilateral de la EP tremórica.
Eficacia
Diversos estudios abiertos, así como algunos ensayos clínicos controlados, han evaluado los efectos de la talamotomía, subtalamotomía y palidotomía unilateral mediante HIFU en pacientes con EP117
Talamotomía
Un ensayo clínico controlado con un procedimiento simulado evaluó la talamotomía unilateral por HIFU en pacientes con EP tremórica118 (NE-I). Se incluyeron 20 pacientes en el brazo tratado y 7 en el simulado, demostrando a los 3 meses una diferencia estadísticamente significativa a favor del HIFU en la escala del temblor para la mano tratada, si bien los autores señalan un destacable efecto placebo en el grupo control. En un análisis posterior se constató mejoría en la capacidad funcional y en la calidad de vida119 (NE-II).
Subtalamotomía
Varios estudios habían evaluado en el pasado la subtalamotomía por radiofrecuencia, pero la disponibilidad del HIFU, y los avances en las técnicas de localización por imagen, han motivado un renovado interés por investigar esta diana120
Un ensayo clínico controlado en pacientes con EP marcadamente asimétrica (no eran candidatos a ECP o habían rechazado este tratamiento) comparó la subtalamotomía unilateral por HIFU (27 pacientes) vs. un procedimiento simulado (13 pacientes). En comparación con el grupo control, la subtalamotomía mejoró significativamente las manifestaciones motoras contralaterales a los 4 meses121 (NE-I). Doce de los 13 pacientes del grupo control fueron tratados posteriormente. El seguimiento abierto de 32 pacientes al cabo de 3 años mostró una mejoría media en la subescala motora de la MDS-UPDRS en off del 22,9%, pero sin acompañarse de cambio favorable en el resto de subescalas, en la calidad de vida (PDQ-39), ni en la dosis de LD122 (NE-IV). Otro estudio abierto ha evaluado la subtalamotomía por HIFU en pacientes con EP temprana (< 5 años desde el diagnóstico), observando una mejoría media en la subescala motora de la MDS-UPDRS en off del 49% al año del tratamiento123 (NE-IV).
Respecto a la subtalamotomía bilateral en 2 tiempos, un estudio evaluó a 6 pacientes a los 6 meses de un segundo procedimiento contralateral (mediana del intervalo: 3,2 años). La mejoría media en la subescala motora de la MDS-UPDRS en off respecto a la basal (antes del primer procedimiento) fue del 52,6%124 (NE-IV).
Palidotomía
Un ensayo clínico controlado en pacientes con fluctuaciones motoras o discinesias comparó la palidotomía unilateral por HIFU (69 pacientes) vs. un procedimiento simulado (25 pacientes). A los 3 meses 65 y 22 pacientes, respectivamente, completaron las evaluaciones. La proporción de pacientes con mejoría predefinida (al menos 3 puntos en la subescala motora de la MDS-UPDRS en off para el lado tratado o bien en la UDysRS en on) fue significativamente mayor en el grupo tratado (69% vs. 32%)125 (NE-I). De los 39 pacientes que mejoraron y fueron evaluados al año, 30 (77%) mantenían el beneficio obtenido.
Efectos adversos
Históricamente, una de las principales consideraciones respecto a la cirugía ablativa era la posibilidad de dañar estructuras adyacentes a la diana, induciendo efectos adversos transitorios o permanentes. En este sentido, el carácter reversible y modulable de la ECP vino a aportar una mayor seguridad. Aunque los avances en la localización por imagen permiten en la actualidad una elevada precisión, en todos los estudios sobre HIFU se describe un porcentaje no desdeñable de efectos adversos relacionados con la lesión, si bien en su mayoría son de intensidad leve-moderada y con frecuencia reversibles a medio-largo plazo.
Talamotomía
En el ensayo clínico controlado antes mencionado (n = 20) se recogieron como efectos adversos, en la evaluación a los 3 meses: hemiparesia (2 casos), parestesias (5 casos) y ataxia (1 caso)118 (NE-I). No se encontraron diferencias entre grupos en cuanto a cognición, ánimo o conducta119 (NE-II).
Subtalamotomía
En el ensayo clínico controlado antes mencionado (n = 27) se recogieron, como efectos adversos en la evaluación a los 4 meses: trastorno del habla (15 casos, reversible en 12), trastorno de la marcha (13 casos, reversible en 11), discinesias (12 casos, 6 en off y 6 en on, reversible en 3 y 5 casos respectivamente), paresia de miembros (5 casos, reversible en 3) y paresia facial (3 casos, reversible en 2)121 (NE-I). En el seguimiento abierto posterior, 6 pacientes (22%) seguían presentando déficits al año del tratamiento121. A los 3 años (n = 30), 8 pacientes (27%) presentaban discinesias “pico de dosis” en el hemicuerpo tratado; otros efectos adversos fueron: torpeza de una mano (1 caso), trastorno del habla (2 casos) y aumento de peso (2 casos). No hubo cambios significativos en cognición y conducta122 (NE-IV).
Tras una segunda subtalamotomía bilateral (mediana del intervalo: 3,2 años) 4 de 6 pacientes presentaron discinesias contralaterales (resultas en 3 meses). Otros efectos adversos fueron: trastorno del habla (4 casos, resuelto antes de los 6 meses en 2) y desequilibrio/disfagia en 1 caso (resuelto en 1 semana). No hubo cambios significativos en cognición y conducta a los 6 meses124 (NE-IV).
Palidotomía
En el ensayo clínico controlado antes mencionado (n= 69) se recogieron en las primeras semanas: disartria (2 casos), trastorno de la marcha (2 casos), pérdida del gusto (2 casos), trastorno visual (1 caso) y debilidad facial (1 caso)125 (NE-I). Al año persistía únicamente disartria moderada en 1 paciente.

Bibliografía
69. The National Collaborating Centre for Chronic Conditions: Parkinson’s disease: National clinical guideline for diagnosis and management in primary and secondary care. Londres: Royal College of Physicians; 2006.
70. Pahwa R, Factor SA, Lyons KE, et al. Practice Parameter: Treatment of Parkinson disease with motor fluctuations and dyskinesia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006;66(7):983-95.
71. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20(1):5-15.
72. Deuschl G, Antonini A, Costa J, et al. European Academy of Neurology/Movement Disorder Society - European Section guideline on the treatment of Parkinson’s disease: I. Invasive therapies. Eur J Neurol. 2022 Sep;29(9):2580-2595.
73. Hartmann CJ, Fliegen S, Groiss SJ, et al. An update on best practice of deep brain stimulation in Parkinson’s disease. Ther Adv Neurol Disord. 2019 Mar 28;12.
74. Mínguez Castellanos A, Muñoz Ruiz T. Terapias de segunda línea (III): tratamiento quirúrgico. En: Escamilla Sevilla F, González Torres V, Moya Molina MA (eds.). Recomendaciones de Práctica Clínica en la Enfermedad de Parkinson 2022. Grupo Andaluz de Trastornos del Movimiento. Sociedad Andaluza de Neurología. Barcelona: Glosa; 2022. pp. 213-222.
75. Welter ML, Houeto JL, Tezenas du Montcel S, et al. Clinical predictive factors of subthalamic stimulation in Parkinson’s disease. Brain. 2002;125:575-83.
76. Kleiner-Fisman G, Fisman DN, Sime E, et al. Long-term follow up of bilateral deep brain stimulation of the subthalamic nucleus in patients with advanced Parkinson disease. J Neurosurg. 2003;99:489-95.
77. Limousin P, Foltynie T. Long-term outcomes of deep brain stimulation in Parkinson disease. Nat Rev Neurol 2019;15(4):234-242.
78. Dafsari HS, Reker P, Stalinski L, et al. Quality of life outcome after subthalamic stimulation in Parkinson’s disease depends on age. Mov Disord. 2018;33:99-107.
79. Geraedts VJ, Kuijf ML, van Hilten JJ, et al. Selecting candidates for deep brain stimulation in Parkinson’s disease: the role of patients’ expectations. Parkinsonism Relat Disord. 2019;66:207-211.
80. Deuschl G, Schade-Brittinger C, Krack P, et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. The German Parkinson Study Group, Neurostimulation Section. N Engl J Med. 2006;355:896-908.
81. Weaver FM, Follett K, Stern M, et al. Bilateral deep brain stimulation vs best medical therapy for patients with advanced Parkinson disease: a randomized controlled trial. JAMA. 2009;301:63-73.
82. Williams A, Gill S, Varma T, et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomised...
83. Okun MS, Gallo BV, Mandybur G, et al. Subthalamic deep brain stimulation with a constant-current device in Parkinson’s disease: an open-label randomised controlled trial. Lancet Neurol 2012; 11(2):140–149.
84. Rodríguez-Oroz MC, Obeso JA, Lang AE, et al. Bilateral deep brain stimulation in Parkinson’s disease: a multicentre study with 4 years follow-up. Brain. 2005;128(Pt 10):2240-9.
85. Mínguez-Castellanos A, Escamilla-Sevilla F, Katati MJ, et al. Different patterns of medication change after subthalamic or pallidal stimulation for Parkinson’s disease: target related effect or selection bias? J Neurol Neurosurg Psychiatry. 2005;76:34-9.
86. Vitek J, Jain R, Chen L, et al. Subthalamic nucleus deep brain stimulation with a multiple independent constant current- controlled device in Parkinson’s disease (INTREPID): a multicentre, double-blind, randomised, sham-controlled study. Lancet Neurol 2020;19(6):491–501.
87. Krack P, Batir A, Van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med. 2003;349:1925-34.
88. Castrioto A, Lozano AM, Poon YY, et al. Ten-year outcome of subthalamic stimulation in Parkinson disease: a blinded evaluation. Arch Neurol. 2011;68(12):1550-6.
89. Schuepbach WMM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson’s disease with early motor complications. N Engl J Med. 2013;368(7):610-22.
90. Artusi CA, Dwivedi AK, Romagnolo A, et al. Association of subthalamic deep brain stimulation with motor, functional, and pharmacologic outcomes in patients with monogenic Parkinson disease: A systematic review and meta-analysis. JAMA Netw Open. 2019;2(2):e187800.
91. Jost ST, Sauerbier A, Visser-Vandewalle V, et al. A prospective, controlled study of non-motor effects of subthalamic stimulation in Parkinson’s disease: results at the 36-month follow-up. J Neurol Neurosurg Psychiatry 2020;91(7):687–694.
92. Lezcano E, Gómez-Esteban JC, Tijero B, et al. Long-term impact on quality of life of subthalamic nucleus stimulation in Parkinson’s disease. J Neurol. 2016;263:895-905.
93. Lachenmayer ML, Murset M, Antih N, et al. Subthalamic and pallidal deep brain stimulation for Parkinson’s disease-meta-analysis of outcomes. NPJ Parkinson’s Dis 2021;7(1):77.
94. Bove F, Mulas D, Cavallieri F, Castrioto A, Chabardès S, Meoni S, et al. Long-term outcomes (15 years) after subthalamic nucleus deep brain stimulation in patients with Parkinson disease. Neurology. 2021;97(3):E254-E262.
95. Geraedts VJ, Feleus S, Marinus J, van Hilten JJ, Contarino MF. What predicts quality of life after subthalamic deep brain stimulation in Parkinson’s disease? A systematic review. Eur J Neurol. 2020 Mar;27(3):419-428.
96. Hariz MI, Rehncrona S, Quinn NP, Speelman JD, Wensing C. Multicenter study on deep brain stimulation in Parkinson’s disease: an independent assessment of reported adverse events at 4 years. Mov Disord. 2008;23(3):416-21.
97. Voon V, Krack P, Lang AE, et al. A multicentre study on suicide outcomes following subthalamic stimulation for Parkinson’s disease. Brain 2008;131:2720-28.
98. Weintraub D, Duda JE, Carlson K, et al. Suicide ideation and behaviours after STN and GPi DBS surgery for Parkinson’s disease: results from a randomised, controlled trial. J Neurol Neurosurg Psychiatry. 2013;84:1113-8.
99. Witt K, Daniels C, Reiff J, et al. Neuropsychological and psychiatric changes after deep brain stimulation for Parkinson’s disease: a randomised, multicentre study. Lancet Neurol. 2008;7:605-14.
100. Appleby BS, Duggan PS, Regenberg A, et al. Psychiatric and neuropsychiatric adverse events associated with deep brain stimulation: a metaanalysis of ten years’ experience. Mov Disord. 2007;22:1722-8.
101. Czernecki V, Pillon B, Houeto JL, et al. Does bilateral stimulation of the subthalamic nucleus aggravate apathy in Parkinson’s disease? J Neurol Neurosurg Psychiatry. 2005; 76:775-9.
102. Drapier D, Drapier S, Sauleau P, et al. Does subthalamic nucleus stimulation induce apathy in Parkinson’s disease? J Neurol. 2006;253:1083-91.
103. Castrioto A, Lhommée E, Moro E, Krack P. Mood and behavioural effects of subthalamic stimulation in Parkinson’s disease. Lancet Neurol. 2014;13:287-305.
104. Chopra A, Tye SJ, Lee KH, et al. Underlying neurobiology and clinical correlates of mania status after subthalamic nucleus deep brain stimulation in Parkinson’s disease: a review of the literature. J Neuropsychiatry Clin Neurosci 2012; 24: 102–110.
105. Sisodia V, Malekzadeh A, Verwijk E, et al. Bidirectional interplay between Deep Brain Stimulation and cognition in Parkinson’s disease: A systematic review. Mov Disord. 2024 May;39(5):910-915.
106. Valldeoriola F, Morsi O, Tolosa E, et al. Prospective comparative study on cost-effectiveness of subthalamic stimulation and best medical treatment in advanced Parkinson’s disease. Mov Disord. 2007;22:2183-91.
107. Tomaszewski KJ, Holloway RG. Deep brain stimulation in the treatment of Parkinson’s disease: a cost-effectiveness analysis. Neurology. 2001;57:663-71.
108. Meissner W, Schreiter D, Volkmann J, et al. Deep brain stimulation in late stage Parkinson’s disease: a retrospective cost analysis in Germany. J Neurol. 2005;252:218-23.
109. Smilowska K, VanWamelen DJ, Pietrzykowski T, et al. Cost-effectiveness of device-aided therapies in Parkinson’s disease: a structured review. J Parkinsons Dis. 2021;11(2):475-89.
110. Follett KA, Weaver FM, Stern M, et al. Pallidal versus subthalamic deep-brain stimulation for Parkinson’s disease. N Engl J Med 2010;362(22):2077–2091.
111. Weaver FM, Follett KA, Stern M, et al. Randomized trial of deep brain stimulation for Parkinson disease: thirty-six-month outcomes. Neurology. 2012;79(1):55-65.
112. Odekerken VJ, van Laar T, Staal MJ, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson’s disease (NSTAPS study): a randomised controlled trial. Lancet Neurol 2013;12(1):37–44.
113. Odekerken VJ, Boel JA, Schmand BA; NSTAPS study group. GPi vs STN deep brain stimulation for Parkinson disease: Three-year follow-up. Neurology. 2016;86(8):755-61.
114. Liu Y, Li W, Tan C, et al. Meta-analysis comparing deep brain stimulation of the globus pallidus and subthalamic nucleus to treat advanced Parkinson disease. J Neurosurg. 2014;121(3):709-18.
115. Sako W, Miyazaki Y, Izumi Y, Kaji R. Which target is best for patients with Parkinson’s disease? A meta-analysis of pallidal and subthalamic stimulation. J Neurol Neurosurg Psychiatry. 2014;85(9):982-6.
116. Escamilla-Sevilla F, Mínguez-Castellanos A. Deep-brain stimulation for Parkinson’s disease. N Eng J Med 2010;363(10):987; author reply 988.
117. Moosa S, Martínez-Fernández R, Elias WJ, et al. The role of high-intensity focused ultrasound as a symptomatic treatment for Parkinson’s disease. Mov Disord. 2019;34(9):1243-1251.
118. Bond AE, Shah BB, Huss DS, et al. Safety and efficacy of focused ultrasound thalamotomy for patients with medication-refractory, tremor-dominant Parkinson disease: a randomized clinical trial. JAMA Neurol. 2017;74:1412–1418.
119. Sperling SA, Shah BB, Barrett MJ, et al. Focused ultrasound thalamotomy in Parkinson disease: Nonmotor outcomes and quality of life. Neurology. 2018 Oct 2;91(14):e1275-e1284.
120. Máñez-Miró JU, Rodríguez-Rojas R, Del Álamo M, et al. Present and future of subthalamotomy in the management of Parkinson’s disease: a systematic review. Expert Rev Neurother. 2021;21(5):533-545.
121. Martínez-Fernández R, Máñez-Miró JU, Rodríguez-Rojas R et al. Randomized trial of focused ultrasound subthalamotomy for Parkinson’s disease. N Engl J Med. 2020;383(26):2501-2513.
122. Martínez-Fernández R, Natera-Villalba E, Máñez Miró JU et al. Prospective long-term follow-up of focused ultrasound unilateral subthalamotomy for Parkinson disease. Neurology. 2023;100(13):e1395-e1405.
123. Martínez Fernández R, Natera Villalba E, Rodríguez-Rojas R, et al. Unilateral focused ultrasound subthalamotomy in early Parkinson’s disease: a pilot study. J Neurol Neurosurg Psychiatry. 2024 Feb 14;95(3):206-213.
124. Martínez-Fernández R, Natera-Villalba E, Rodríguez-Rojas R, et al. Staged bilateral MRI-guided focused ultrasound subthalamotomy for Parkinson disease. JAMA Neurol. 2024;81(6):638-644.
125. Krishna V, Fishman PS, Eisenberg HM, et al. Trial of globus pallidus focused ultrasound ablation in Parkinson’s disease. N Engl J Med. 2023;388(8):683-693.
Los síntomas no motores de la EP son una parte importante de su clínica, y llegan a ser tan incapacitantes como los signos motores. Se incluyen, entre otros, los síntomas neuropsiquiátricos como depresión, apatía, ansiedad, trastorno del control de impulsos, síntomas psicóticos, déficits cognitivos y demencia, y también las alteraciones del sueño, hiposmia, trastornos autonómicos y sensitivos. Afectan a la calidad de vida del paciente y de sus cuidadores, incluso cuando el control motor es bueno.
Los trastornos del sueño incluyen la somnolencia diurna excesiva (SDE), las alteraciones del sueño nocturno con el insomnio y el trastorno de conducta durante el sueño REM (TCSR) (Tabla I). Estos trastornos del sueño son especialmente frecuentes en la EP avanzada, probablemente debido a la combinación de diversos factores, como por ejemplo el incremento en el tratamiento dopaminérgico y el uso de otros fármacos, el empeoramiento de los síntomas motores de la enfermedad y, quizás, la neurodegeneración de las áreas encefálicas que regulan la vigilia y el sueño. Una excepción sería el TCSR, que con frecuencia antecede a los síntomas motores de la enfermedad o puede estar ya presente en el momento del diagnóstico de la EP.
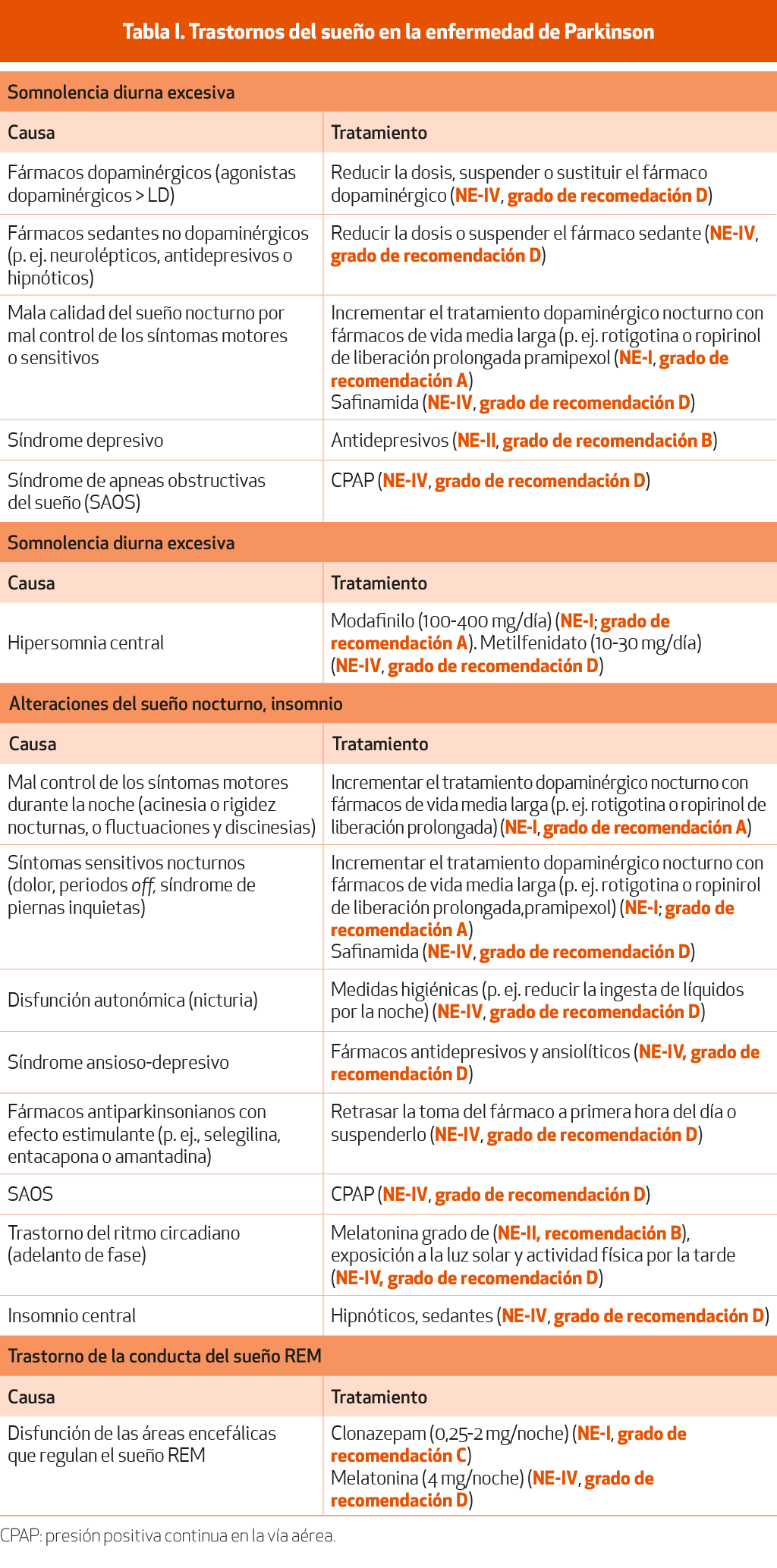
Somnolencia diurna excesiva
Puede afectar a entre un 12 y un 84% de los pacientes. En un 0,5-20% de ellos, la SDE se puede presentar en la forma de episodios súbitos de sueño irresistible o ataques de sueño1.
Las causas de somnolencia en la EP pueden ser diversas. La SDE puede ser un efecto secundario de los fármacos dopaminérgicos, incluyendo la LD, pero en especial de todos los agonistas dopaminérgicos. En algunos pacientes la relación entre la SDE y los fármacos dopaminérgicos es clara, pues la somnolencia aparece al introducir o incrementar la dosis del fármaco. Otra causa de SDE en la EP puede ser la administración como consecuencia de comorbilidades neuropsiquiátricas de otros fármacos con efecto sedante, como por ejemplo neurolépticos, antidepresivos o hipnóticos. Un insomnio y un sueño nocturno insuficiente por los problemas asociados a un mal control de los síntomas motores o sensitivos por la noche también pueden dar lugar a SDE. La SDE en la EP también puede estar en relación con la presencia de una depresión, otro síntoma no motor frecuente en la EP. Si bien el SAOS no ocurre con más frecuencia en la EP que en la población general, un SAOS coincidental también puede ser la causa de una SDE en un paciente con EP. Finalmente, la SDE puede ser un síntoma propio de la EP, causado por la degeneración de las estructuras encefálicas que promueven la vigilia, incluyendo el hipotálamo y estructuras del tronco como el locus coeruleus, el área dopaminérgica ventral-tegmental mesencefálica, el núcleo pedunculopontino o los núcleos del rafe. Así pues, el tratamiento de la somnolencia en la EP dependerá de la causa, y es importante considerar que en un mismo paciente pueden coexistir varias de ellas.
En cuanto al tratamiento, el primer paso será alertar al paciente sobre la peligrosidad de conducir o realizar otras actividades de riesgo hasta que la somnolencia no se resuelva. El siguiente paso será evaluar si la somnolencia puede tener una causa farmacológica. Si está en relación con algún fármaco dopaminérgico, se puede considerar reducir la dosis o incluso suspender el fármaco, o bien cambiar a otro medicamento dopaminérgico2,3 (NE-IV), si bien todo ello puede comportar un empeoramiento de los síntomas motores. Si existe alguna medicación no dopaminérgica sedante, se debe valorar la posibilidad de suprimirla o disminuir la dosis4 (NE-IV). Si no existe una causa farmacológica, se deberá considerar si hay un mal control de los síntomas motores o sensitivos nocturnos que puedan causar un sueño nocturno insuficiente, y si es preciso optimizar el tratamiento antiparkinsoniano por la noche evitando dosis elevadas antes de dormir y usar formulaciones retard, aunque hay resultados contradictorios5 (NE-IV). Si existe una depresión, se deberá tratar adecuadamente6 (NE-I). Por otro lado, se debe preguntar, sobre todo al cónyuge o al cuidador del paciente, por la presencia de ronquidos y apneas, y si se sospecha un SAOS, realizar un polisomnograma. Si se confirma un índice elevado de apneas obstructivas, estará indicado realizar una prueba terapéutica con presión positiva continua en la vía aérea (CPAP)7 (NE-IV). Cuando no exista ninguna causa evidente y se considere que la SDE puede ser un síntoma propio de la EP, se puede valorar realizar una prueba con fármacos estimulantes como el modafinilo (entre 100 y 400 mg al día) (existen tres estudios con NE-I: en dos se sugiere que es un tratamiento eficaz para la somnolencia en la EP y en el otro que es ineficaz)8-10.
Alteraciones del sueño nocturno
Hasta un 55% de los pacientes con EP presentan sueño fragmentado y despertar precoz, que son los tipos de insomnio más frecuentes11. El insomnio en la EP también puede tener diferentes causas, pudiendo estar en relación con los síntomas motores y no motores de la enfermedad u otros factores. Un mal control de los síntomas motores durante la noche, como la presencia de acinesia o rigidez, así como de fluctuaciones o discinesias, podría despertar al paciente y causar un sueño fragmentado. Por otro lado, la existencia de síntomas sensitivos nocturnos, como dolor por la rigidez, por la imposibilidad de cambiar de postura, o dolor en relación con los periodos off, o bien la presencia de un síndrome de piernas inquietas, también pueden fragmentar el sueño. Una disfunción autonómica como la nicturia, la depresión o la ansiedad son otras causas de una mala calidad y fragmentación del sueño. Además, fármacos antiparkinsonianos como la selegilina, la amantadina o la entacapona pueden alertar excesivamente al paciente durante la noche12 (NE-IV).
Otros fármacos también utilizados en el tratamiento de estos pacientes, como anticolinesterásicos, ISRS o venlafaxina también pueden aumentar el insomnio12. Por otro lado, en los pacientes con EP pueden coexistir otros trastornos del sueño que son frecuentes en las personas de edad avanzada y que pueden fragmentar el sueño y causar un despertar precoz, como serían el SAOS o un trastorno del ritmo circadiano en la forma de un adelanto de fase. Finalmente, el insomnio también podría ser un síntoma propio de la EP, causado por la degeneración de las estructuras encefálicas que regulan la vigilia y el sueño. Establecer cuál de todos estos factores es el responsable de la alteración del sueño nocturno en un paciente con EP puede ser difícil.
Medidas específicas (dependerá de las causas) para tratar el insomnio en la EP incluyen la supresión de la selegilina o la amantadina cuando se administran por la tarde o por la noche13 (NE-II) o, cuando hay síntomas motores o sensitivos nocturnos significativos, optimizar el tratamiento antiparkinsoniano con la administración de agentes dopaminérgicos de vida media larga o de liberación sostenida como la rotigotina o el ropirinol de liberación prologada, que pueden ser útiles para evitar los periodos off durante la noche14-15 (NE-I). Si el paciente presenta un síndrome de piernas inquietas asociado, el uso de agentes dopaminérgicos de larga duración o, en su caso, fármacos como la gabapentina podría ser de utilidad16 (NE-II). En el caso de existir una depresión o un síndrome ansioso, deben ser tratados de forma correcta17 (NE-IV).
Otros fármacos, como la safinamida, han mostrado un efecto beneficioso en el sueño nocturno y sobre la somnolencia diurna18-20 (NE-IV).
La estimulación cerebral profunda del núcleo subtalámico y los tratamientos de perfusión como la apomorfina subcutánea y LD/carbidopa intestinal mejoran la calidad del sueño, aunque no están indicadas con este objetivo21 (NE-III).
Trastorno de la conducta del sueño REM
Caracterizado por la presencia de pesadillas y conductas violentas durante el sueño REM, está presente entre un 23 y un 58% de los pacientes con EP22. La fisiopatología de esta parasomnia en la EP está en relación con la degeneración de las áreas del tronco encefálico que modulan el sueño REM. El clonazepam es el fármaco más utilizado en dosis única de 0,5 a 2 mg antes de acostarse, con una alta tasa de respuesta en distintas series23 (NE-I).
Cuando el clonazepam no es eficaz, una posible alternativa sería la melatonina 4 mg 2 horas antes de acostarse24 (NE-IV). Siempre es importante considerar la posibilidad de otro trastorno de sueño diferente al TCSR como la causa de las conductas anormales durante el sueño, como por ejemplo un SAOS, sobre todo si el clonazepam se muestra ineficaz y agrava las conductas anormales, y en especial si hay antecedentes de ronquidos y apneas observadas. En tal caso estaría indicado realizar un videopolisomnograma para confirmar el diagnóstico de un TCSR o descartar un SAOS, que por otro lado podría ser agravado por el tratamiento con clonazepam.
Bibliografía
1. Ondo WG, Dat Vuong K, Khan H, et al. Daytime sleepiness and other sleep disorders in Parkinson’s disease. Neurology. 2001;57:1392-1396.
2. Razmy A, Lang AE, Shapiro CM. Predictors of impaired daytime sleep and wakefulness in patients with Parkinson disease treated with older (ergot) vs newer (nonergot) dopamine agonists. Arch Neurol. 2004;61:97-102.
3. Pal S, Bhattacharya KF, Agapito C, et al. A study of excessive daytime sleepiness and its clinical significance in three groups of Parkinson’s disease patients taking pramipexole, cabergoline and levodopa mono and combination therapy. J Neural Transm 2001;108:71–77.
4. Martins Rodrigues T, Castro Caldas A, Ferreira JJ. Pharmacological interventions for daytime sleepiness and sleep disorders in Parkinson’s disease: systematic review and meta-analysis. Parkinsonism Relat Disord. 2016;27:25-34.
5. Chahine LM, Daley J, Horn S, et al. Association between dopaminergic medications and nocturnal sleep in early-stage Parkinson’s disease. Parkinsonism Relat Disord. 2013 Oct;19(10):859-63.
6. Menza M, Dobkin RD, Marín H, et al. A controlled trial of antidepressants in patients with Parkinson disease and depression. Neurology. 2009 Mar 10;72(10):886-92.
7. Neikrug AB, Liu L, Avanzino JA, et al. Continuous positive airway pressure improves sleep and daytime sleepiness in patients with Parkinson disease and sleep apnea. Sleep. 2014;37(1):177-185.
8. Adler CH, Caviness JN, Hentz JG, et al. Randomized trial of modafinil for treating subjective daytime sleepiness in patients with Parkinson’s disease. Mov Disord. 2003;18:287-93.
9. Högl B, Saletu M, Brandauer E, et al. Modafinil for the treatment of daytime sleepiness in Parkinson’s disease: a double-blind, randomized, crossover, placebo-controlled polygraphic trial. Sleep. 2002;25:905-9.
10. Ondo WG, Fayle R, Atassi F, et al. Modafinil for daytime somnolence in Parkinson’s disease: double blind, placebo controlled parallel trial. J Neurol Neurosurg Psychiatry. 2005;76:1636-9.
11. Dodet P, Houot M, Leu-Semenescu S, et al. Sleep disorders in Parkinson’s disease, an early and multiple problem. NPJ Parkinsons Dis. 2024 Feb 29;10(1):46.
12. Taximaimaiti R, Luo X, Wang XP. Pharmacological and non-pharmacological treatments of sleep disorders in Parkinson’s disease. Curr Neuropharmacol. 2021;19(12):2233-49.
13. Fahn S, Isgreen WP. Long-term evaluation of amantadine and levodopa combination in parkinsonism by double-blind corssover analyses. Neurology. 1975 Aug;25(8):695-700.
14. Pahwa R, Stacy MA, Factor SA, et al. Ropinirole 24-hour prolonged release: randomized, controlled study in advanced Parkinson disease. Neurology. 2007;68:1108-15.
15. Trenkwalder C, Kies B, Rudzinska M, et al. Rotigotine effects on early morning motor function and sleep in Parkinson’s disease: a double-blind, randomized, placebo-controlled study (RECOVER). Mov Disord. 2011;26:90-9.
16. García-Borreguero D, Larrosa O, de la Llave Y, et al. Treatment of restless legs syndrome with gabapentin: a double-blind, cross-over study. Neurology. 2002 Nov 26;59(10):1573-9.
17. Kay DB, Tanner JJ, Bowers D. Sleep disturbances and depression severity in patients with Parkinson’s disease. Brain Behav. 2018 Jun;8(6):e00967.
18. Santos García D, Cabo López I, Labandeira Guerra C, et al. Safinamide improves sleep and daytime sleepiness in Parkinson’s disease: results fromthe SAFINONMOTOR study. Neurol Sci. 2022;43(4):2537-44.
19. Bianchi MLE, Riboldazzi G, Mauri M, et al. Efficacy of safinamide on non-motor symptoms in a cohort of patients affected by idiopathic Parkinson’s disease. Neurol Sci. 2019;40(2):275-279.
20. Liguori C, Stefani A, Runi R, et al. Safinamide effect on sleep disturbances and daytime sleepiness in motor fluctuating Parkinson’s disease patients: A validated questionnaires- controlled study. Park Relat Disord. 2018;57:80-81.
21. Zibetti M, Romagnolo A, Merola A, et al. A polysomnographic study in parkinsonian patients treated with intestinal levodopa infusion. J Neurol. 2017 Jun;264(6):1085-1090.
22. Zhang J, Xu CY, Liu J. (2017). Meta-analysis on the prevalence of REM sleep behavior disorder symptoms in Parkinson’s disease. BMC Neurol. 2017;17(1):23.
23. Shin C, Park H, Lee WW, et al. Clonazepam for probable REM sleep behavior disorder in Parkinson’s disease: A randomized placebo-controlled trial. J Neurol Sci. 2019 Jun 15;401:81-86.
24. Byun JI, Shin YY, Seong YA, et al. Comparative efficacy of prolonged-release melatonin versus clonazepam for isolated rapid eye movement sleep behavior disorder. Sleep Breath. 2023 Mar;27(1):309-318.
Los trastornos afectivos son frecuentes desde las fases iniciales de la EP. Dentro de ellos debe diferenciarse la presencia de depresión, ansiedad y apatía. Si bien coexisten con frecuencia en un mismo paciente, su diferenciación implica el uso de fármacos específicos para cada problema. El desarrollo de apatía sin depresión, además, se asocia con un mayor riesgo de progresión hacia la demencia. Debe tenerse en cuenta que los trastornos de ansiedad representan el síntoma afectivo más frecuente, y se manifiestan desde fases muy iniciales de la enfermedad25,26 (NE-IV). La depresión y la ansiedad también son frecuentes en los periodos off, que ocurren en el 35% de los pacientes como parte de fluctuaciones no motoras. Las fluctuaciones no motoras pueden ser psiquiátricas, cognitivas, autonómicos o sensoriales, y pueden variar durante el transcurso del día. Distinguir los síntomas afectivos persistentes de los que ocurren en el contexto de periodos off no siempre es sencillo y algunos pacientes pueden tener ambos26 (NE-IV).
Diagnóstico
Se basa fundamentalmente en una entrevista adecuada, que reconozca los síntomas propios de cada problema. Los pacientes con trastorno depresivo manifiestan síntomas apáticos, mientras que aquellos con apatía aislada o predominante (15-25%) solo manifiestan síntomas de desmotivación. Ciertos síntomas como la anhedonia, la anergia y el enlentecimiento psicomotor son comunes a la apatía y la depresión27 (NE-IV). La ansiedad se manifiesta mediante trastorno por ansiedad generalizada, crisis de pánico e irritabilidad, fobia social o agorafobia. Hasta en el 80% coexiste con la depresión.
Una dificultad añadida en el diagnóstico de la depresión en la EP es la limitación para utilizar los criterios diagnósticos de depresión del Manual diagnóstico y estadístico de los trastornos mentales (Diagnostic and Statistical Manual of Mental Disorders [DSM]), dado el solapamiento entre síntomas físicos y cognitivos presentes tanto en la depresión primaria como en la EP28 (NE-IV). Como alternativa, varios estudios han intentado describir las notas de corte de escalas de depresión aceptadas para su uso en la EP. Teniendo en cuenta la limitación que supone que aún no se haya diseñado ninguna escala de depresión específica para la EP, el grupo de trabajo de la MDS Task Force para el diagnóstico de depresión en la EP determinó qué escalas son las más útiles en esta enfermedad29 (NE-IV). Entre las escalas aconsejadas destacan la Escala de Depresión de Montgomery-Asberg (Montgomery-Asberg Depression Rating Scale [MADRS]) y la Escala de Depresión Geriátrica (Geriatric Depression Scale [GDS]), útiles tanto para el cribado como para el seguimiento de la clínica depresiva; la subescala para la depresión de la Escala de Ansiedad y Depresión Hospitalaria (Hospital Anxiety and Depression Scale [HADS-D]) es útil para el cribado de la depresión. Las notas de corte para el diagnóstico de depresión con estas tres escalas son: MADRS ≥ 15, GDS-15 ≥ 6 y HADS-D ≥ 11. La Escala de Depresión de Hamilton (Hamilton Rating Scale for Depression [HAM-D]) y el Inventario de Depresión de Beck (Beck Depression Inventory [BDI]) son escalas muy bien validadas en la depresión primaria, pero incluyen muchos ítems somáticos que se solapan con la EP 29. Aun así, se han establecido notas de corte para el cribado de la depresión en poblaciones de EP (HAM-D ≥ 16; BDI ≥ 14), y varios estudios las han utilizado también para el seguimiento y la respuesta terapéutica 30.
Para el diagnóstico de la apatía, tres escalas han mostrado una buena validez de constructo y han sido validadas para su uso en la EP31 (NE-IV). La Escala de Apatía (Apathy Scale [AS]), con nota de corte ≥ 14, y la Escala de Apatía de Lille (Lille Apathy Rating Scale [LARS]), con nota de corte ≥ 17, son útiles para el cribado, seguimiento y respuesta al tratamiento, mientras que el ítem 7 del Inventario Neuropsiquiátrico (Neuropsychiatric Inventory [NPI]), con nota de corte ≥ 4, puede ser útil para el cribado, pero no para el seguimiento ni la valoración de cambio del síntoma en el tiempo.
Hasta el momento actual, la mayoría de los estudios que han evaluado la ansiedad en la EP han utilizado la subescala para la ansiedad de la HADS (HADS-A), la Escala de Ansiedad de Hamilton (Hamilton Anxiety Rating Scale [HAM-A]) o el Inventario de Ansiedad de Beck (Beck Anxiety Inventory [BAI]). Para estas escalas, sin embargo, no hay notas de corte para la EP y tampoco se han evaluado todas sus propiedades psicométricas en esta enfermedad32. Mejor comportamiento en la EP parece tener el Inventario de Ansiedad Geriátrica (Geriatric Anxiety Inventory [GAI]), y recientemente se ha diseñado una escala específica, la Escala de Ansiedad en Parkinson (Parkinson’s Anxiety Scale [PAS]), que parece tener mayor validez de constructo y presenta buenas propiedades psicométricas33 (NE-IV).
Tratamiento
Múltiples estudios abiertos, cruzados o doble ciego comparados con placebo han intentado comprobar cuáles son los mejores fármacos para el tratamiento de la depresión en la EP. El solapamiento con síntomas propios de la enfermedad, los factores psicosociales que acompañan a un paciente con una enfermedad degenerativa crónica y el desarrollo de depresión en diferentes momentos evolutivos de la EP dificultan dar una respuesta unívoca a esta pregunta. Basándonos en la evidencia aportada por ensayos a doble ciego, aleatorizados y comparados con placebo, así como en revisiones, guías y metaanálisis recientes26,34-36 (NE-I), los fármacos antidepresivos con mayor respaldo de la literatura científica son citalopram 10-20 mg/día, paroxetina 10-20 mg/día, venlafaxina 75-150 mg/día, nortriptilina 50 mg/día y desipramina 50-75 mg/día (NE-I). En la práctica clínica habitual, los inhibidores selectivos de la recaptación de serotonina (sertralina 50-100 mg/día, escitalopram 10-15 mg/día) y los inhibidores duales de la recaptación de serotonina y noradrenalina (duloxetina 60 mg/día) y venlafaxina (75-150 mg) son los fármacos antidepresivos más utilizados (NE-I)36.
Fármacos recientes como la vortioxetina (5-20 mg) han demostrado su utilidad en estudios prospectivos abiertos (NE-IV).
Un ensayo doble ciego y controlado con placebo también demostró la eficacia del pramipexol (2,1 mg/día) para el tratamiento de la depresión en la EP 37 (NE-I).
Los IMAO-B, como la safinamida, también han mostrado beneficios sobre los síntomas depresivos en estudios recientes38-39 (NE-IV).
Tratamientos no farmacológicos como la terapia cognitiva conductual, la estimulación magnética transcraneal sobre la corteza prefrontal dorsolateral izquierda o la terapia electroconvulsiva han demostrado su eficacia en pacientes con enfermedad de Parkinson40-43 (NE-I).
Menor evidencia existe para el tratamiento de la apatía. Este síntoma depende de diferentes sustratos neuroquímicos (déficits colinérgico y dopaminérgico). En pacientes con mayor deterioro cognitivo, el déficit colinérgico parece de mayor relevancia, mientras que, en pacientes sin demencia, el déficit dopaminérgico a nivel del estriado ventral aparece como el factor causal más importante. Aun así, y en función de los estudios publicados, la rivastigmina a 9,5 mg/día se ha mostrado igualmente eficaz para la mejoría de la clínica apática en pacientes con y sin demencia44 (NE-I) . En un estudio a doble ciego controlado con placebo, el uso de piribedil ha mostrado mejorías estadísticamente significativas45 (NE-II), y en series abiertas de pacientes el uso de pramipexol, rotigotina y safinamida también ha mostrado mejorías en la puntuación de las escalas de apatía46,47 (NE-IV).
No existen estudios específicos para el tratamiento de la ansiedad en la EP y las opciones terapéuticas aconsejadas se basan en la eficacia demostrada de las benzodiacepinas en pacientes de edad avanzada con ansiedad primaria o asociada a otras enfermedades degenerativas48. Se considera preferible el uso de benzodiacepinas de vida corta, como el alprazolam, y benzodiacepinas que se metabolicen más fácilmente, como el lorazepam48,49 (NE-III). Para el manejo a largo plazo de la ansiedad generalizada es aconsejable el uso de antidepresivos ISRS e ISRNS49 (NE-IV). Sin duda, se requieren estudios bien dirigidos y diseñados para determinar el tratamiento de la ansiedad en la EP.
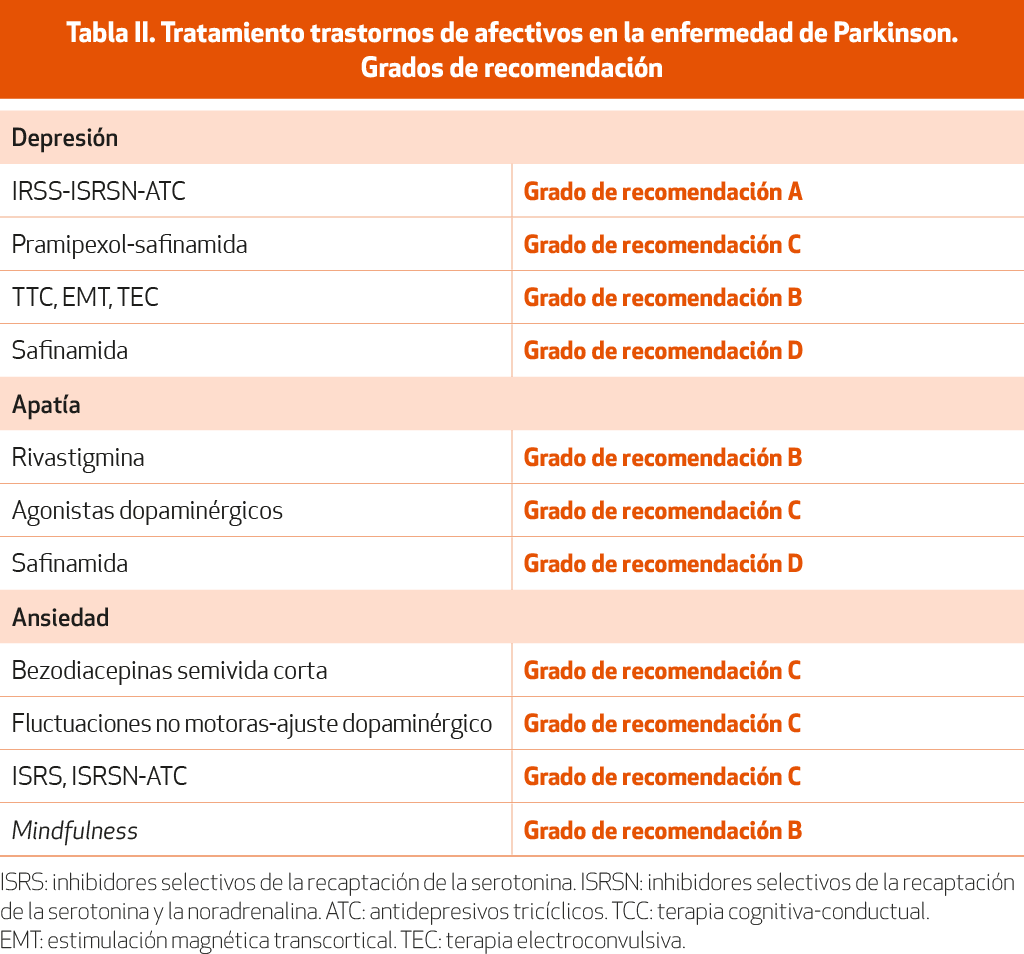
Los síntomas de ansiedad, si aparecen como fluctuaciones no motoras, se manejarán primero con ajustes en los tratamientos dopaminérgicos26,34,49 (NE-III). Se ha demostrado recientemente que el uso de la safinamida también podría tener un efecto en los trastornos del ánimo y, entre ellos, en la apatía en los pacientes con EP. El beneficio se obtenía tanto con dosis de 50 mg como con 100 mg19,47 (NE-IV).
Otros tratamientos no farmacológicos, como el mindfulness, pueden ser útiles en tratar la ansiedad y depresión en la enfermedad de Parkinson50 (NE-I) (ver capítulo 15 sobre terapias alternativas en la enfermedad de Parkinson (pag. 345).
Bibliografía
19. Bianchi MLE, Riboldazzi G, Mauri M, et al. Efficacy of safinamide on non-motor symptoms in a cohort of patients affected by idiopathic Parkinson’s disease. Neurol Sci. 2019;40(2):275-279.
25. Aarsland D, Marsh L, Schrag A. Neuropsychiatric symptoms in Parkinson’s disease. Mov Disord. 2009;24:2175-86.
26. Weintraub D, Aarsland D, Chaudhuri KR, et al. The neuropsychiatry of Parkinson’s disease: advances and challenges. Lancet Neurol. 2022;21(1):89-102.
27. Pagonabarraga J, Kulisevsky J, Strafella AP, et al. Apathy in Parkinson’s disease: clinical features, neural substrates, diagnosis, and treatment. Lancet Neurol. 2015;14:51831.
28. Marsh L, McDonald WM, Cummings J, et al.; NINDS/NIMH Work Group on Depression and Parkinson’s Disease. Provisional diagnostic criteria for depression in Parkinson’s disease: report of an NINDS/NIMH Work Group. Mov Disord. 2006;21(2):14858.
29. Schrag A, Barone P, Brown RG, et al. Depression rating scales in Parkinson’s disease: critique and recommendations. Mov Disord. 2007;22(8):1077-92.
30. Leentjens AF, Verhey FR, Lousberg R, et al. The validity of the Hamilton and Montgomery- Asberg depression rating scales as screening and diagnostic tools for depression in Parkinson’s disease. Int J Geriatr Psychiatry. 2000 Jul;15(7):644-9.
31. Leentjens AF, Dujardin K, Marsh L, et al. Apathy and anhedonia rating scales in Parkinson’s disease: critique and recommendations. Mov Disord. 2008;23:2004-14.
32. Leentjens AF, Dujardin K, Marsh L, et al. Anxiety rating scales in Parkinson’s disease: a validation study of the Hamilton anxiety rating scale, the Beck anxiety inventory, and the hospital anxiety and depression scale. Mov Disord. 2011 Feb 15;26(3):407-15.
33. Dissanayaka NN, Torbey E, Pachana NA. Anxiety rating scales in Parkinson’s disease: a critical review updating recent literature. Int Psychogeriatr. 2015;27:1777-84.
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
36. Mills KA, Greene MC, Dezube R, et al. Efficacy and tolerability of antidepressants in Parkinson’s disease: a systematic review and network meta-analysis. Int J Geriatr Psychiatry. 2018;33(4):642-51.
37. Barone P, Poewe W, Albrecht S, et al. Pramipexole for the treatment of depressive symptoms in patients with Parkinson’s disease: a randomised, double-blind, placebo- controlled trial. Lancet Neurol. 2010;9:573-80.
38. De Masi C, Liguori C, Spanetta M, et al. Non-motor symptoms burden in motor-fluctuating patients with Parkinson’s disease may be alleviated by safinamide: the VALE-SAFI study. J Neural Transm (Vienna). 2022;129(11):1331-1338.
39. Stocchi F, Antonini A, Berg D, et al. Safinamide in the treatment pathway of Parkinson’s Disease: a European Delphi Consensus. NPJ Parkinsons Dis. 2022;8(1):17.
40. Dobkin RD, Mann SL, Gara MA, et al. Telephone-based cognitive behavioral therapy for depression in Parkinson disease: a randomized controlled trial. Neurology. 2020;94(16):e1764-e1773.
41. Dobkin RD, Mann SL, Weintraub D, et al. Innovating Parkinson’s care: a randomized controlled trial of telemedicine depression treatment. Mov Disord. 2021;36(11):2549-58.
42. Li S, Jiao R, Zhou X, et al. Motor recovery and antidepressant effects of repetitive transcranial magnetic stimulation on Parkinson disease: a PRISMA-compliant meta- analysis. Medicine (Baltimore). 2020;99(18):e19642.
43. Takamiya A, Seki M, Kudo S, et al. Electroconvulsive therapy for Parkinson’s disease: a systematic review and meta-analysis. Mov Disord. 2021;36(1):50-8.
44. Devos D, Moreau C, Maltête D, et al. Rivastigmine in apathetic but dementia and depression- free patients with Parkinson’s disease: a double-blind, placebo-controlled, randomised clinical trial. J Neurol Neurosurg Psychiatry. 2014;85(6):668-74.
45. Thobois S, Lhommée E, Klinger H, et al. Parkinsonian apathy responds to dopaminergic stimulation of D2/D3 receptors with piribedil. Brain. 2013;136(Pt 5):1568-77.
46. Mele B, Van S, Holroyd-Leduc J, et al. Diagnosis, treatment and management of apathy in Parkinson’s disease: a scoping review. BMJ Open. 2020;10(9):e037632.
47. Labandeira CM, Alonso Losada MG, Yáñez Baña R, et al. Effectiveness of Safinamide over Mood in Parkinson’s Disease Patients: Secondary Analysis of the Open-label Study SAFINONMOTOR. Adv Ther. 2021;38(10):5398-5411.
48. Baldwin DS, Anderson IM, Nutt DJ, et al. Evidence-based guidelines for the pharmacological treatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. J Psychopharmacol. 2005;6:567-96.
49. Weintraub D. Management of psychiatric disorders in Parkinson’s disease: Neurotherapeutics. 2020;17(4):1511-24.
50. Lin HW, Tam KW, Kuan YC. Mindfulness or meditation therapy for Parkinson’s disease: A systematic review and meta-analysis of randomized controlled trials. Eur J Neurol. 2023;30(8):2250-2260.
Las conductas impulsivas y compulsivas (CIC) comprenden los trastornos del control de impulsos (TCI), el trastorno por dependencia de fármacos dopaminérgicos o síndrome de desregulación dopaminérgica (SDD) y distintos trastornos compulsivos. Se trata de trastornos complejos de la conducta, caracterizados por un incremento de la impulsividad, con respuestas rápidas, repetitivas y poco planificadas ante estímulos internos y externos, desinhibidas y con poca valoración de las consecuencias negativas tanto para el propio sujeto como para los demás51 (NE-IV). Entre los trastornos compulsivos, el punding, por ejemplo, se caracteriza por conductas repetitivas y estereotipadas con detrimento de la normal actividad diaria (por ejemplo, limpiar, ordenar cosas, etc.), el hobbysmo es un punding más elaborado (como tocar un instrumento musical, escribir, etc.), el walkabout consiste en vagar sin rumbo en exceso y el hoarding es un acaparamiento excesivo que conlleva el acopio de gran número de elementos de poco o ningún valor objetivo. El SDD se caracteriza por un uso compulsivo de la medicación dopaminérgica, asemejándose a la adicción a drogas de recreo. Entre los TCI, los más frecuentemente observados en la EP son la ludopatía, la ingesta impulsiva, la compra compulsiva y la hipersexualidad, si bien se han descrito casos de piromanía y cleptomanía. Estos trastornos agravan de forma marcada el deterioro funcional de la EP y dañan la calidad de vida del paciente y de sus familiares y cuidadores.
Frecuencia
Las CIC se caracterizan por ser una comorbilidad sorprendentemente frecuente tanto en la EP sin tratar como en controles sanos51 (NE-IV) y se observan en un 13-35% de los pacientes tratados51, aunque solo lo manifiesten espontáneamente un 12%. Su prevalencia oscila entre un 13% de los primeros estudios usando como criterio diagnóstico el DSM-IV52,53 (NE-III) y el 40% de las últimas series, cuando el criterio diagnóstico empleado es el Cuestionario para Trastornos Impulsivos-Compulsivos en la Enfermedad de Parkinson (Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease Rating Scale [QUIP-RS])54 (NE-III).
Causas
El principal factor de riesgo es el uso de agonistas dopaminérgicos. Otros factores de riesgo que contribuyen a su aparición son la vulnerabilidad psicobiológica personal (antecedentes impulsividad, ansiedad y personalidad con búsqueda de novedad), los antecedentes familiares de trastornos psiquiátricos (depresión, trastorno bipolar, adicciones), el sexo masculino, la edad de inicio precoz de la EP y una mayor duración de la enfermedad. Entre los diferentes subtipos de TCI, el juego patológico y la hipersexualidad encuentran mayor relación con el sexo masculino, y la ingesta y la compra compulsivas con el sexo femenino. Existen también factores socioculturales; en nuestro medio son más frecuentes la hipersexualidad y la ingesta compulsiva55 (NE-IV).
Aunque todavía no está aclarada su fisiopatología en la EP, están implicados los circuitos mesolímbicos, el estriado ventral y el córtex prefrontal entre otras estructuras56 (NE-IV).
Tratamiento
No existen guías ni método establecido basado en la evidencia sobre el tratamiento y corrección de estos trastornos. Una revisión reciente sobre el manejo clínico de las CIC57 (NE-IV) resume las principales acciones que se han de considerar en estos pacientes. La mayoría de las recomendaciones que se realizan en guías están basadas en opinión de expertos o datos empíricos26,34,35 (NE-III).
Medidas preventivas-correctivas
Típicamente, la primera estrategia es la disminución de la dosis o retirada del agonista dopaminérgico, que suele ser una medida efectiva para solucionar el problema57-59 en un 75% de los casos aproximadamente (NE-IV). Sin embargo, en un importante número de casos, conlleva el agravamiento de los signos motores de la enfermedad y las fluctuaciones motoras, que puede ser compensado con un aumento de dosis de LD (a veces con agravamiento de discinesias) o adición de ICOMT. La asociación de IMAO-B es más controvertida, puesto que, en algunos estudios, la rasagilina se ha asociado con la presencia de TCI53 (NE-III). Otros tratamientos complejos, como la ECP o la infusión de gel intestinal de LD-carbidopa (GILC), que pueden permitir la supresión de agonistas dopaminérgicos, se han mostrado eficaces en casos concretos. Aunque, la ECP tradicionalmente se había asociado al desarrollo de CIC, un estudio reciente prospectivo a largo plazo ha demostrado que la ECP en el núcleo subtalámico bilateral reduce los CIC60 (NE-II). A pesar de ello, revisiones de expertos recientes indican que se necesita más evidencia de calidad para hacer recomendaciones respecto a la ECP en el manejo de las CIC57 (NE-IV). Recientemente, tres estudios abiertos prospectivos de 6 meses61, 3 años62 y 8 años63 de seguimiento, informan de un manejo satisfactorio de las CIC con el tratamiento de infusión de GILC (NE-III).
El segundo problema secundario a la supresión de agonistas dopaminérgicos es el síndrome de retirada de agonistas dopaminérgicos, que puede ocurrir en un 15-20% o hasta en un tercio de estos pacientes. Este síndrome consiste en depresión e incluso ideación suicida, angustia, fatiga, dolor y necesidad de tomar el agonista (craving). No existe ningún tratamiento eficaz del síndrome, no se resuelve con un aumento de dosis de LD, puede mejorar con el trascurso del tiempo o bien puede persistir y necesitar la reintroducción del agonista, aunque a dosis mínima o su retirada más gradual64 (NE-IV).
Tratamientos farmacológicos y psicológicos
Aunque se han usado varios tratamientos farmacológicos y psicológicos para controlar las CIC, en la actualidad ninguno ha resultado eficaz de forma suficientemente contrastada.
Un estudio con naltrexona (NE-I)65 mostró resultados positivos en la escala Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease (QUIP), aunque no mejoró la impresión clínica global, si bien no existen más datos al respecto, como para hacer una recomendación. Estudios con amantadina (NE-II)66, atomoxetina (NE-II)67 y terapia cognitiva conductual (NE-I)68 mostraron resultados positivos. Sin embargo, estudios retrospectivos abiertos con un elevado número de pacientes han mostrado una asociación del uso de amantadina con TCI52,53 (NE-III). En estudios aislados y abiertos con pocos casos, la zonisamida69 (NE-IV), el topiramato70 (NE-IV), el valproato71 (NE-II), la clozapina y la finasterida han mostrado una cierta eficacia en reducir la gravedad de los TCI refractarios a la disminución de dosis de los agonistas dopaminérgicos (NE-IV)70.
Un estudio con naltrexona (NE-I)65 mostró resultados positivos en la escala Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease (QUIP), aunque no mejoró la impresión clínica global, si bien no existen más datos al respecto, como para hacer una recomendación. Estudios con amantadina (NE-II)66, atomoxetina (NE-II)67 y terapia cognitiva conductual (NE-I)68 mostraron resultados positivos. Sin embargo, estudios retrospectivos abiertos con un elevado número de pacientes han mostrado una asociación del uso de amantadina con TCI52,53 (NE-III). En estudios aislados y abiertos con pocos casos, la zonisamida69 (NE-IV), el topiramato70 (NE-IV), el valproato71 (NE-II), la clozapina y la finasterida han mostrado una cierta eficacia en reducir la gravedad de los TCI refractarios a la disminución de dosis de los agonistas dopaminérgicos (NE-IV)70.
En el manejo del SDD, que conlleva una paulatina disminución de LD, el valproato ha sido particularmente útil (NE-II)71.
No parece indicado el tratamiento con otros neurolépticos, por su limitada evidencia en eficacia y su asociación con el deterioro del parkinsonismo motor57 (NE-IV).
El trabajo conjunto con médicos especialistas en conductas adictivas puede ser necesario en muchos casos. En este sentido, el uso de antidepresivos y ansiolíticos puede ser útil para el manejo de la comorbilidad psiquiátrica que estos pacientes presentan con frecuencia.
Bibliografía
26. Weintraub D, Aarsland D, Chaudhuri KR, et al. The neuropsychiatry of Parkinson’s disease: advances and challenges. Lancet Neurol. 2022;21(1):89-102.
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
51. Augustine A, Winstanley CA, Krishnan V. Impulse control disorders in Parkinson’s disease: from bench to bedside. Front Neurosci. 2021;15:654238.
52. Lee JY, Jeon BS. Maladaptive reward-learning and impulse control disorders in patients with Parkinson’s disease: a clinical overview and pathophysiology update. J Mov Disord. 2014;7(2):67-76.
53. Weintraub D, Koester J, Potenza MN, et al. Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients. Arch Neurol. 2010;67(5):589-95.
54. García-Ruiz PJ, Martínez Castrillo JC, Alonso-Cánovas A, et al. Impulse control disorder in patients with Parkinson’s disease under dopamine agonist therapy: a multicentre study. J Neurol Neurosurg Psychiatry. 2014;85(8):840-4.
55. Sáez-Francàs N, Martí Andrés G, Ramírez N, et al. Clinical and psychopathological factors associated with impulse control disorders in Parkinson’s disease. Neurologia. 2015 Jun 18. pii: S0213-4853(15)00113-9.
56. Jiménez-Urbieta H, Gago B, de la Riva P, et al. Dyskinesias and impulse control disorders in Parkinson’s disease: From pathogenesis to potential therapeutic approaches. Neurosci Biobehav Rev. 2015;56:294-314.
57. Debove I, Paschen S, Amstutz D, et al. Management of Impulse Control and Related Disorders in Parkinson’s Disease: An Expert Consensus. Mov Disord. 2024;39(2):235-248.
58. Mamikonyan E, Siderowf AD, Duda JE, et al. Long-term follow-up of impulse control disorders in Parkinson’s disease. Mov Disord. 2008;23:75-80.
59. Bastiaens J, Dorfman BJ, Christos PJ, et al. Prospective cohort study of impulse control disorders in Parkinson’s disease. Mov Disord. 2013;28(3):327-33.
60. Abbes M, Lhommée E, Thobois S, et al. Subthalamic stimulation and neuropsychiatric symptoms in Parkinson’s disease: results from a long-term follow-up cohort study. J Neurol Neurosurg Psychiatry 2018;89(8):836-843.
61. Catalán MJ, De Pablo-Fernández E, Villanueva C, et al. Levodopa infusion improves impulsivity and dopamine dysregulation syndrome in Parkinson’s disease. Mov Disord. 2013;28(14):2007-10.
62. Todorova A, Ray Chaudhuri K. Subcutaneous apomorphine and non-motor symptoms in Parkinson’s disease. Parkinsonism Relat Disord. 2013;19(12):1073-8.
63. De Fabregues O, Dot Bach J, Abu-Suboh Abadia M, et al. Eight years’ experience with continuous intraduodenal levodopa infusion in Parkinson’s disease. 19th International Congress of Parkinson’s disease and Movement Disorders. San Diego, EEUU, 14-18 Jun 2015. Poster. Mov Disord. 2015;30 Suppl 1:S78-19.
64. Rabinak CA, Nirenberg MJ. Dopamine agonist withdrawal syndrome in Parkinson disease. Arch Neurol. 2010 Jan;67(1):58-63.
65. Papay K, Xie SX, Stern M, et al. Naltrexone for impulse control disorders in Parkinson disease: a placebo-controlled study. Neurology. 2014;83(9):826-33.
66. Thomas A, Bonanni L, Gambi F, et al. Pathological gambling in Parkinson disease is reduced by amantadine. Ann Neurol. 2010;68:400-4.
67. Kehagia AA, Housden CR, Regenthal R, et al. Targeting impulsivity in Parkinson’s disease using atomoxetine. Brain. 2014;137(Pt 7):1986-97.
68. Okai D, Askey-Jones S, Samuel M, et al. Trial of CBT for impulse control behaviors affecting Parkinson patients and their caregivers. Neurology. 2013;80:792-9.
69. Bermejo PE, Ruiz-Huete C, Anciones B. Zonisamide in managing impulse control disorders in Parkinson’s disease. J Neurol. 2010;257(10):1682-5.
70. Zhang JF, Wang XX, Feng Y, et al. Impulse control disorders in Parkinson’s disease: epidemiology, pathogenesis and therapeutic strategies. Front Psychiatry. 2021;12:635494.
71. Sriram A, Ward HE, Hassan A, et al. Valproate as a treatment for dopamine dysregulation syndrome (DDS) in Parkinson’s disease. J Neurol. 2013;260:521-7.
La psicosis, con una prevalencia de más del 50%, es una de las principales causas de ingreso de los pacientes con EP en centros asistidos. El principal factor de riesgo es la demencia asociada a la enfermedad, seguido por edad avanzada, larga evolución, clínica motora grave, trastornos del sueño, trastorno autonómico y depresión.
El diagnóstico se basa en la presencia de al menos uno de los siguientes síntomas: alucinaciones, delirio, ilusiones o sensaciones falsas de presencia, que deben aparecer sin alteración del nivel de conciencia y con curso crónico (al menos 1 mes), de forma continua o recurrente72 (NE-IV).
Las alucinaciones son el síntoma psicótico más frecuente. Suelen aparecer por la noche, cuando disminuyen los estímulos ambientales externos. En los primeros años de la enfermedad, son típicas las alucinaciones menores (alucinaciones minor), que son breves y con autocrítica conservada. Incluyen tres fenómenos: alucinaciones visuales transitorias o de pasaje (el paciente ve sombras en la periferia de su campo visual, que desaparecen cuando se gira para verlas), alucinaciones de presencia (el paciente siente que hay alguien detrás pero no lo ve) e ilusiones ópticas (objetos reales que se trasforman en otros; por ejemplo, flores que parecen caras, bocas de riego que parecen perros, etc.).
Con el tiempo, las alucinaciones se vuelven más complejas: visión de personas, animales, partes del cuerpo aisladas u objetos móviles. No generan miedo ni preocupación, por lo que el paciente no suele darles importancia y no lo cuenta, pudiendo pasar fácilmente inadvertidas en la anamnesis. En fases más avanzadas las alucinaciones son más estructuradas, se pierde la autocrítica y el paciente presenta ante ellas irritación, agitación e incluso agresividad. Pueden asociar delirio, que suele ser paranoide o de celotipia. Con menos frecuencia se han descrito también alucinaciones auditivas, táctiles, olfatorias o gustativas73 (NE-IV).
Fisiopatología
La fisiopatología de la psicosis en la EP no está clara. Se cree debida a una interacción complicada entre fenómenos fisiopatológicos intrínsecos y variables extrínsecas74 (NE-IV). Los procesos intrínsecos incluyen cambios neuroquímicos que afectan a la dopamina, la serotonina y la acetilcolina, patrones de activación aberrantes en corteza y tronco, daño visual primario y alteración atencional, cognitiva y visuoespacial. Entre las variables extrínsecas, el uso de fármacos dopaminérgicos y anticolinérgicos es el más habitual75 (NE-I).
Tratamiento
El tratamiento de la psicosis y las alucinaciones en la EP supone un reto complicado, ya que la mejoría de la clínica neuropsiquiátrica suele conllevar un empeoramiento del control motor, lo que no siempre es bien aceptado por el paciente y sus cuidadores.
En primer lugar, debemos descartar otras causas posibles del cuadro, sobre todo cuando el comienzo es brusco y agudo, entre otras: delirio, infecciones, urgencias como el síndrome neuroléptico maligno u otras (ver capítulo 11, pag. 283) y trastornos toxicometabólicos. El siguiente paso consistirá en suspender la medicación no antiparkinsoniana que no sea imprescindible para el paciente y que pueda contribuir a la aparición de psicosis como: antidepresivos tricíclicos, benzodiacepinas, anticolinérgicos y opioides. En tercer lugar, hay que disminuir o incluso suspender la medicación antiparkinsoniana. Primero los IMAO-B (selegilina, rasagilina), luego la amantadina, después los agonistas dopaminérgicos (pramipexol, ropinirol y rotigotina), después los ICOMT (tolcapona, entacapona opicapona) y finalmente, si es necesario, se reducirá la dosis de LD34,35 (NE-I).
Si con estos pasos no conseguimos una respuesta adecuada, debemos considerar añadir al tratamiento fármacos antipsicóticos, como neurolépticos o inhibidores de la acetilcolinesterasa. Los neurolépticos típicos producen un agravamiento del parkinsonismo e incluso un síndrome neuroléptico maligno, por lo que están contraindicados en la EP, usándose solo los atípicos, que tienen menor riesgo de estas complicaciones. La Food and Drug Administration (FDA) advierte de que diversos estudios han demostrado un aumento del riesgo de morbimortalidad por patología cerebrovascular en pacientes mayores de 75 años tratados con neurolépticos, sobre todo si se asocia deterioro cognitivo. En la actualidad, no hay ningún fármaco con indicación aprobada por la FDA para psicosis en la EP, los utilizamos fuera de guía y por uso compasivo.
Los neurolépticos atípicos más utilizados para tratar las alucinaciones y la psicosis en general en la EP son la clozapina y la quetiapina34,35,74,75 (NE-IV).
Clozapina
Es el más eficaz en el tratamiento de la psicosis sin empeorar la clínica motora76 (NE-I).
Se ha descrito, asociado a su uso, un riesgo menor del 1% de producir agranulocitosis, no relacionado con la dosis del fármaco, por lo que debe monitorizarse el tratamiento con un hemograma semanal durante las primeras 18 semanas de tratamiento y al menos una vez cada 4 semanas durante el tiempo que continúe el tratamiento. La dosis indicada varía según los casos (6,25-50 mg/día). Otros efectos secundarios descritos de la clozapina son somnolencia, sedación, hipotensión ortostática y sialorrea74,75 (NE-I).
Quetiapina
Un metaanálisis reciente concluye que, aunque inferior a la clozapina, la quetiapina era superior al placebo, con una adecuada seguridad76 (NE-I). Su uso es seguro, el manejo sencillo y no se necesita realizar monitorización del hemograma durante el tratamiento, por eso es el más utilizado en la práctica clínica diaria. La dosis media suele variar entre 50 y 150 mg/día. Los efectos secundarios incluyen somnolencia, sedación e hipotensión ortostática.
Ziprasidona
Una revisión sistemática concluye que la ziprasidona es tan eficaz como la clozapina y que el perfil de seguridad, efectos secundarios y eficacia es similar al de otros antipsicóticos usados en los síntomas psicóticos en la enfermedad de Parkinson77 (NE-II). Produce menos hipotensión ortostática neurogénica, al bloquear poco los receptores α-1-adrenérgicos; sin embargo, puede alargar el QT, lo que puede provocar arritmias.
Otros fármacos
Entre los inhibidores de la acetilcolinesterasa, la rivastigmina y el donepezilo se han valorado como tratamiento crónico de síntomas psicóticos leves-moderados en la EP. No se han realizado estudios largos, doble ciego, controlados frente a placebo, con psicosis en EP como objetivo primario, pero varios pequeños estudios de series de casos abiertos han visto de forma secundaria cómo mejoran las alucinaciones y el delirio74 (NE-IV). En un estudio contralado con rivastigmina con deterioro cognitivo como objetivo primario, se observó reducción de alucinaciones visuales frente a placebo78 (NE-I).
Estudios recientes sugieren que la pimavanserina es una prometedora opción de tratamiento de la psicosis asociada a la EP79 (NE-I). Actúa como agonista inverso de los receptores 5-HT2A sin que tenga efecto antidopaminérgico. Es un fármaco seguro que controla los síntomas psicóticos con dosis 100 veces menores que la dosis que produce efectos secundarios, por lo que es bien tolerado y tiene un perfil de seguridad similar al placebo. Dos metaanálisis recientes encontraron que la pimavanserina era un fármaco seguro y efectivo para el tratamiento de los trastornos psicóticos en la enfermedad de Parkinson75-79 (NE-I). Está aprobado por la FDA, pero no está disponible en Europa en la fecha de edición de este manual.
Bibliografía
72. Ravina B, Marder K, Fernández HH, et al. Diagnostic criteria for psychosis in Parkinson’s disease: Report of an NINDS, NIMH Work Group. Mov Disord. 2007;22:1061-68.
73. Feneleon G, Mahieux F, Huon R, et al. Hallucinations in Parkinson´s disease. Prevalence, phenomenology and risk factors. Brain. 2000;123:733-45.
74. Friedman JH. Parkinson disease psychosis: Update. Behav Neurol. 2013;27(4):46977.
75. Zhang H, Wang L, Fan Y, et al. Atypical antipsychotics for Parkinson’s disease psychosis: a systematic review and meta-analysis. Neuropsychiatr Dis Treat. 2019;15:2137-49.
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
74. Friedman JH. Parkinson disease psychosis: Update. Behav Neurol. 2013;27(4):46977.
75. Zhang H, Wang L, Fan Y, et al. Atypical antipsychotics for Parkinson’s disease psychosis: a systematic review and meta-analysis. Neuropsychiatr Dis Treat. 2019;15:2137-49.
76. Iketani R, Furushima D, Imai S, et al. Efficacy and safety of atypical antipsychotics for psychosis in Parkinson’s disease: a systematic review and Bayesian network meta- analysis. Parkinsonism Relat Disord. 2020;78:82-90.
77. Younce JR, Davis AA, Black KJ. A systematic review and case series of ziprasidone for psychosis in Parkinson’s disease. J Parkinsons Dis. 2019;9(1):63-71.
78. Emre M, Aarsland D, Albanese A, et al. Rivastigmine for dementia associated with Parkinson’s disease. N Engl J Med. 2004;351(24):2509-2518.
79. Mansuri Z, Reddy A, Vadukapuram R, et al. Pimavanserin in the treatment of Parkinson’s disease psychosis: meta-analysis and meta-regression of randomized clinical trials. Innov Clin Neurosci.2022;19(1-3):46-51.
Sialorrea
El babeo, en la EP, se produce por la acumulación de saliva y alteración de su manejo dentro de la boca, producida por las dificultades de deglución que aparecen en el curso de la enfermedad, conduciendo a su caída o aspiración80.
No disponemos de criterios diagnósticos, aunque sí de múltiples herramientas que pre- tenden observarlo (UPDRS-II, SCOPA-AUT, PD-NMSQuest), por lo que en diferentes estudios la prevalencia varía entre el 10% y el 84%81.
En cuanto al tratamiento, se aconseja retirar todos los fármacos que puedan aumentarlo, como los inhibidores de la acetilcolinesterasa o los antipsicóticos, y corregir el tratamiento dopaminérgico a criterio del clínico.
Se han realizado estudios con atropina, bromuro de ipratropio, tropicamida y glicopirrolato, siendo este último el único que demostró, en un estudio aleatorizado, a doble ciego y cruzado (1 mg oral tres veces al día), un efecto beneficioso82 (NE-I), si bien no se dispone de evidencia para tratamientos de más de 1 semana de duración. El glicopirrolato oral no está disponible en nuestro país, pudiendo obtenerse para fórmulas magistrales.
La infiltración de toxina botulínica en las glándulas salivares es una medida eficaz en el tratamiento de la sialorrea83 (NE-I). Concretamente la incobotulinumtoxina A, en un estudio fase III ha demostrado ser útil infiltrando 100 u distribuidas entre parótidas y submandibulares84 (NE-I).
Otros tratamientos sin evidencia suficiente, como el colirio oftálmico de atropina al 1% sublingual, también se utilizan85 (NE-IV).
Hipotensión ortostática
Se define como la reducción en la presión arterial sistólica en más de 20 mmHg o diastólica en más de 10 mmHg tras pasar del decúbito a la bipedestación durante 3 minutos. Es, probablemente, consecuencia de la denervación simpática vascular a la que pueden contribuir otros factores como los fármacos antihipertensivos o antipsicóticos concomitantes, en su caso, o la amantadina y agonistas dopaminérgicos, así como del efecto vasodilatador, diurético e inotrópico negativo de la dopamina secundaria a la metabolización periférica de la LD. Puede estar presente en más del 52% de los pacientes con EP y con mayor frecuencia en otros parkinsonismos34 (NE-I).
Los síntomas que produce son sincopes y presíncopes al ponerse de pie, y en ocasiones sensación de dolor de cuello y hombros y fatiga.
Su manejo precisa de una primera fase en la que se reduzcan y controlen los posibles precipitantes: fragmentación de las comidas evitando las ingestas copiosas de carbohidratos, aumento del consumo de agua y sal (> 8 g/día), uso de calcetines de presión o maniobras para recuperar la tensión ante los primeros síntomas, como ponerse en cuclillas, inclinarse hacia delante o cruzar las piernas haciendo presión en los muslos y pantorrillas34-35 (NE-IV).
Cuando estas maniobras no son suficientes, se pueden emplear fármacos. No disponemos de evidencia suficiente de la eficacia de la fludrocortisona86 ni de la domperidona 10 mg/8 horas (NE-IV).
La droxidopa está aprobada por la FDA a dosis de 100-300 mg/8 horas, tiene mayor nivel de evidencia, mejorando los síntomas y el impacto de los síntomas en las actividades de la vida diaria, pero no está disponible en España87 (NE-I). Por su parte, la midodrina, un agonista de los adrenorreceptores α1 en dosis de 2,5-10 mg tres veces al día está aprobada en Europa y América88 (NE-I) y otros, como la yohimbina (antagonista adrenérgico α2) están aún bajo estudio en fase III en Estados Unidos. Un estudio parece sugerir que aumenta su acción con la administración combinada de atomoxetina, un inhibidor del transportador de norepinefrina (yohimbina 5,4 mg y atomoxetina 18,0 mg)89 (NE-IV). La piridostigmina, que aumenta la acetilcolina ganglionar en la vía eferente simpática, parece ser inferior a la fludrocortisona para el control de síntomas de hipotensión ortostática en pacientes con EP90 (NE-III).
Hay que tener cuidado y evitar la administración de estos fármacos en dosis nocturna (después de las 17:00 horas), especialmente la midodrina, ya que pueden agravar la hipertensión arterial en decúbito que presentan frecuentemente estos pacientes, que se puede tratar con medidas no farmacológicas (elevar el cabecero o tomar un pequeño snack nocturno rico en carbohidratos) o farmacológicas con IECA de vida media corta como captopril a 25 mg o ARA-II como losartán a 25-50 mg91 (NE-IV).
Disfunción vesical y sexual
Disfunción vesical
Se manifiesta clínicamente en forma de urgencia miccional, aumento de la frecuencia con más de siete micciones al día, nicturia, con más de 3-4 micciones por la noche, o urge-incontinencia. En la mayor parte de los casos, se relaciona con la hiperactividad del músculo detrusor secundaria a la alteración de los mecanismos reguladores dopaminérgicos y noradrenérgicos del SNC, así como en los centros pontinos de la micción, implicados en la inhibición parasimpática de dicho músculo. Está presente en un 30-60% de los pacientes con EP, y puede verse potenciada por otros factores como la edad.
A pesar de la frecuencia del síntoma, no disponemos de estudios cuyo diseño establezca evidencia de los tratamientos aplicados, por lo que el tratamiento92 (NE-IV) se enfoca atendiendo a los conocimientos generales. Los pacientes con disfunción vesical deben someterse a una valoración urológica antes de plantear la mejor opción terapéutica. No es infrecuente la asociación en pacientes varones de hiperplasia benigna de próstata, que facilita la hiperactividad del detrusor y cuyo tratamiento quirúrgico se asocia con mayor frecuencia que en la población general a incontinencia posterior. Se recomienda la cateterización intermitente en los pacientes con residuo miccional superior a los 100 ml. En caso de hipertonía del detrusor sin presentar residuo, puede plantearse el uso de los anticolinérgicos, preferiblemente los selectivos de los receptores muscarínicos M3, responsables de la contracción del detrusor, para reducir el riesgo de efectos secundarios cognitivos y el estreñimiento34,35,85 (NE-I). Entre ellos, la solifenacina (NE-I), la oxibutinina, que también existe en parches transdérmicos, la tolterodina, la propiverina, la fesoterodina o el cloruro de trospio (NE-III) pueden utilizarse34,35,85.
Los agonistas adrenérgicos β3 como el mirabegrón relajan el detrusor durante el llenado vesical y podrían plantearse como una opción en estos pacientes93 (NE-I). También los antagonistas α1 (tamsulosina, doxazosina) relajan el cuello vesical y facilitan la micción94 (NE-IV). Existen sugerencias de que algunos pacientes pueden mejorar tras el tratamiento con ECP. En la actualidad, la toxina botulínica se considera el tratamiento de elección en los pacientes que no responden a los tratamientos orales95 (NE-I).
La safinamida en un estudio retrospectivo ha demostrado que podría mejorar los síntomas urinarios96 (NE-II). En el estudio Surinpark se achaca el beneficio tanto al efecto dopaminérgico como al no dopaminérgico del fármaco96.
Disfunción sexual
Es más frecuente en la EP que en la población general, aunque no es fácil establecer hasta qué punto está relacionada directa y exclusivamente con la fisiopatología o clínica de la enfermedad ya que, al menos en hombres, su frecuencia es similar a otras enfermedades crónicas no neurológicas. La disfunción eréctil, en más del 60% de los pacientes, y la dificultad para eyacular y conseguir un orgasmo son frecuentes en varones, mientras la tensión vaginal, falta de lubricación, incontinencia urinaria, ansiedad e inhibición son predominantes en las mujeres. Los pacientes varones, pero no las mujeres, parecen mejorar la percepción de su vida sexual tras la ECP. Puede estar implicada la comorbilidad en forma de depresión, disautonomía o hipotestosteronemia, así como los fármacos hipotensores o antidepresivos97 (NE-IV).
La disfunción eréctil es el único aspecto de la disfunción sexual en la EP que tiene un tratamiento farmacológico basado en la evidencia, los inhibidores de la fosfodiesterasa 5 (PDE5-inh). El sildenafilo dispone de un NE-IV para su utilización en pacientes con EP98, y el vardenafilo y el tadalafilo pueden considerarse probablemente efectivos en base a los estudios disponibles99. Los PDE5-inh están contraindicados en pacientes con hipotensiones previas (90 mmHg/50 mmHg documentadas), en tratamiento con vasodilatadores derivados de la nitroglicerina (podría plantearse el cambio a su cardiólogo), con retinitis pigmentaria o historia de priapismo. En pacientes con EP, debe hacerse un mayor control de la aparición de hipotensión ortostática en pacientes que no la presentaran previamente. Con frecuencia debe recurrirse a dosis máximas (50-100 mg en sildenafilo, 20 mg en vardenafilo y tadalafilo), y el inicio del efecto puede retrasarse por los problemas de absorción, lo que debería avisarse al inicio del tratamiento.
En los casos en que no se obtuviera respuesta satisfactoria, podrían plantearse otras opciones de tratamiento, como los parches transdérmicos de testosterona, la apomorfina sublingual en dosis de 2-4 mg (inicio: 10-15 minutos)95,97 (NE-IV). La formulación referida de apomorfina sublingual es difícil de conseguir en España y habrá que ver si con las formulaciones que se comercializarán proximamente, de 10 a 30 mg, tienen evidencia para usarla en esta indicación. También se pueden considerar las las inyecciones intracavernosas de prostaglandina E1 (alprostadil), o los dispositivos de vacío tras la valoración urológica, pero no se dispone de resultados específicos de estos dos últimos tratamientos en pacientes con EP. En casos refractarios o que deseen una solución permanente, se puede optar por una prótesis quirúrgica, que tiene unos altos índices de eficacia en la población general no específicamente afecta de EP (entre el 92-100%)95 (NE-IV).
Estreñimiento
El estreñimiento en la EP es secundario a la neurodegeneración en los plexos mientéricos y centros autonómicos, pero también a la disinergia del suelo pélvico, indicación esta última para la que se utiliza la toxina botulínica en el músculo puborrectal o en el esfínter anal externo han mostrado eficacia100 (NE-IV).
Es el trastorno autonómico más frecuente entre los pacientes EP, afectando hasta al 80% de ellos. Puede preceder en años la aparición de los síntomas motores. El tratamiento debe empezar con medidas dietéticas, ejercicio físico, beber abundante agua34,35-75 (NE-IV). El macrogol, un laxante osmótico, resultó eficaz en un estudio doble ciego, aleatorizado, controlado con placebo y de grupos paralelos en el que no se describieron efectos secundarios101 (NE-I). Aunque no hay estudios específicos en la EP, se utilizan con frecuencia reguladores del tránsito intestinal, sobre todo aumentadores del volumen del bolo como metilcelulosa o Plantago ovata.
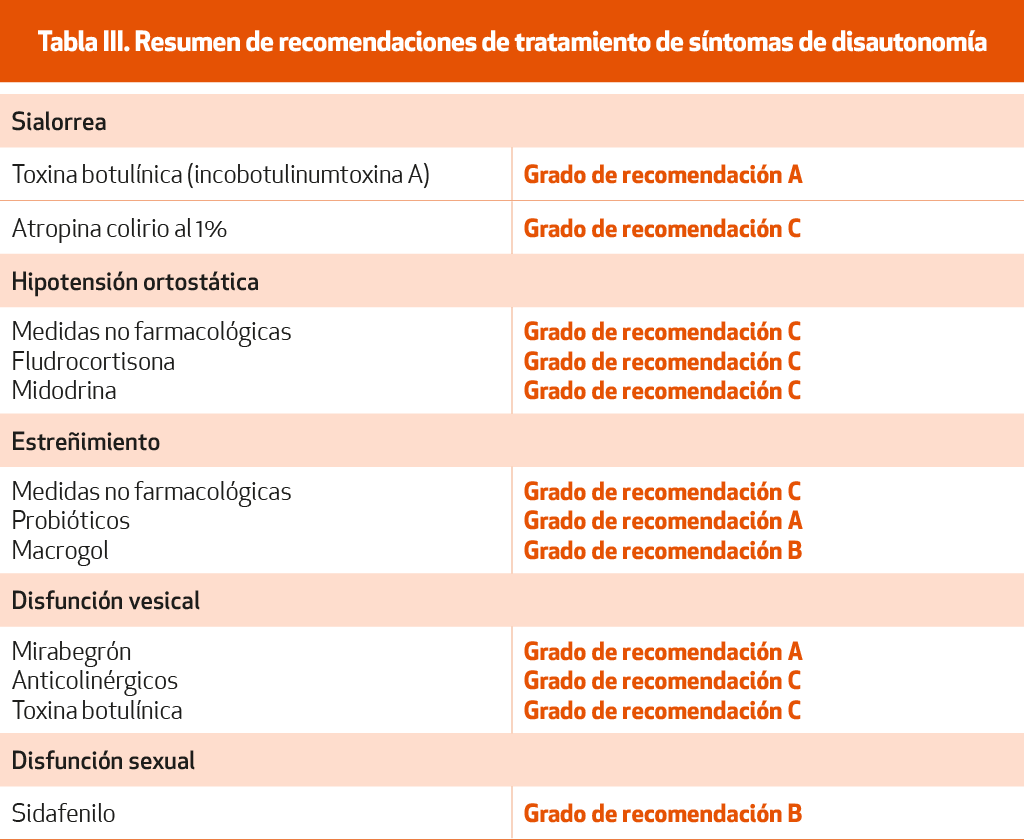
La utilización de probióticos se ha demostrado eficaz en estudios recientes102-104 (NE-I).
Hiperhidrosis
Los pacientes con EP pueden presentar tanto aumento como descenso o normalidad de la sudoración. La hiperhidrosis en forma de crisis de sudoración excesiva suele presentarse durante el off y con menos frecuencia durante el on, en el contexto de las fluctuaciones motoras, pero también puede ser una fluctuación no motora. En este caso se deberá manejar con ajuste del tratamiento para la EP. Medicamentos orales como dosis bajas de clonidina, antidepresivos tricíclicos con efectos secundarios anticolinérgicos y betabloqueantes, se han probado, pero faltan pruebas sólidas de su eficacia y justifican precaución con respecto a los efectos adversos95 (NE-I).
Bibliografía
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
80. Srivanitchapoom P, Pandey S, Hallet M. Drooling in Parkinson’s disease: A review. Parkinsonism Relat Disord. 2014;20:1109-18.
81. Kalf JG, de Swart BJ, Borm GF, et al. Prevalence and definition of drooling in Parkinson’s disease: A systematic review J Neurol. 2009;256:1391-6.
82. Arbow ME, Moving KI, Koopmann M, et al. Glycopirrolate for sialorrhea in Parkinson disease: a randomized, double-blind, crossover trial. Neurology. 2010;74:1203-7.
83. Yang CL, Huang JP, Tan YC, et al. The effectiveness and safety of botulinum toxin injections for the treatment of sialorrhea with Parkinson’s disease: a systematic review and meta-analysis. BMC Pharmacol Toxicol. 2023 Oct 12;24(1):52.
84. Jost WH, Friedman A, Michel O, et al. SIAXI: Placebo-controlled, randomized, double-blind study of incobotulinumtoxinA for sialorrhea. Neurology. 2019;92(17):e1982-e1991.
85. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf- 1837629189061
86. Veazie S, Peterson K, Ansari Y, et al. Fludrocortisone for orthostatic hypotension. Cochrane Database Syst Rev. 2021 May 17;5(5):CD012868.
87. Kaufmann H, Freeman R, Biaggioni I, et al.; NOH301 Investigators (2014). Droxidopa for neurogenic orthostatic hypotension: a randomized, placebo-controlled, phase 3 trial. Neurology. 2014 Jul 22;83(4):328-35.
88. Smith W, Wan H, Much D, et al. Clinical benefit of midodrine hydrochloride in symptomatic orthostatic hypotension: a phase 4, double-blind, placebo-controlled, randomized, tilt-table study. Clin Auton Res. 2016;26:269–277.
89. Schrag A, Sauerbier A, Chaudhuri KR. New clinical trials for non-motor manifestations of Parkinson’s disease. Mov Disord. 2015;30(11):1490-504.
90. Schreglmann SR, Büchele F, Sommerauer M, et al. Pyridostigmine bromide versus fludrocortisone in the treatment of orthostatic hypotension in Parkinson’s disease - a randomized controlled trial. Eur J Neurol. 2017 Apr;24(4):545-551.
91. Isaacson SH, Dashtipour K, Mehdirad AA, et al. Management Strategies for Comorbid Supine Hypertension in Patients with Neurogenic Orthostatic Hypotension. Curr Neurol Neurosci Rep. 2021 Mar 9;21(4):18.
92. Sakakibara R, Panicker J, Finazzi-Agro E, et al.; and The Parkinson’s Disease Subcommittee, The Neurourology Promotion Committee in The International Continence Society. A guideline for the management of bladder dysfunction in Parkinson’s disease and other gait disorders. Neurourol Uradyn. 2015;35(5):551-63.
93. Moussa M, Chakra MA, Dabboucy B, et al. The safety and effectiveness of mirabegron in Parkinson’s disease patients with overactive bladder: a randomized controlled trial. Scand J Urol. 2022;56(1):66-72.
94. Jia C, Cui X, Ou T. Efficacy of medication for overactive bladder symptoms in 70 patients with Parkinson’s disease. Transl Androl Urol. 2024 Jan 31;13(1):64-71.
95. Udow S, Fox S. Autonomic dysfunction. En: Grimes D, Fitzpatrick M, Gordon J, et al. Canadian guideline for Parkinson disease. CMAJ. 2019;191(36):E989-1004.
96. Gómez-López A, Sánchez-Sánchez A, Natera-Villalba E, et al. SURINPARK: Safinamide for Urinary Symptoms in Parkinson’s Disease. Brain Sci. 2021;11(1):57.
97. Palma JA, Kaufmann H. Treatment of autonomic dysfunction in Parkinson disease and other synucleinopathies.Mov Disord. 2018;33(3):372-90.
98. Bernard BA, Verhagen Metman L, Levine L, et al. Sildenafil in the treatment of erectile dysfunction in Parkinson’s disease. Mov Disord Clin Pract. 2016;4(3):412–415.
99. Lombardi G, Nelli F, Celso M, et al. Treating erectile dysfunction and central neurological diseases with oral phosphodiesterase type 5 inhibitors. Review of the literature. J Sex Med. 2012 Apr;9(4):970-85.
100. Albanese A, Brisinda G, Bentivoglio AR, María G. Treatment of outlet obstruction constipation in Parkinson’s disease with botulinum neurotoxin A. Am J Gastroenterol. 2003;98(6):1439-40.
101. Zangaglia R, Martignoni E, Glorioso M, et al. Macrogol for the treatment of constipation in Parkinson’s disease. A randomized placebo-controlled study. Mov Disord. 2007; 22(9):1239-1244.
102. Du Y, Li Y, Xu X, et al. Probiotics for constipation and gut microbiota in Parkinson’s disease. Parkinsonism Relat Disord. 2022;103:92-97.
103. Ibrahim A, Ali RAR, Manaf MRA, et al. Multi-strain probiotics (Hexbio) containing MCP BCMC strains improved constipation and gut motility in Parkinson’s disease: a randomised controlled trial. PLoS One. 2020;15(12):e0244680.
104. Tan AH, Lim SY, Chong KK, et al. Probiotics for constipation in Parkinson disease: a randomized placebo-controlled study. Neurology. 2021;96(5):e772-e782.
Fatiga
La fatiga en la EP se caracteriza por falta de energía o necesidad de aumentar el esfuerzo de manera desproporcionada para realizar las actividades básicas de la vida diaria, que no mejora con el descanso y que aparece impredeciblemente, sin relación con un esfuerzo excesivo o desproporcionado y se mantiene crónicamente105 (NE-IV). En ocasiones está relacionada con depresión o somnolencia diurna, y en otras es un síntoma independiente.
La fatiga es un síntoma común, que presentan alrededor del 50% de los pacientes que sufren EP, aunque a menudo es un síntoma poco reconocido. Debe identificarse si existe depresión, somnolencia u otras causas y tratarlas adecuadamente34 (NE-I). Cuando no está relacionada con ninguno de estos factores, su tratamiento es más difícil.
Existen 11 estudios aleatorizados y controlados, 9 de ellos evalúan fármacos, controlados con placebo y los otros dos evalúan el efecto del ejercicio. Los fármacos que se han evaluado son LD-carbidopa, memantina, rasagilina, cafeína, metilfenidato, modafinilo y doxepina. De todos estos fármacos, el único que ha mostrado una reducción significativa de la fatiga es la rasagilina106 (NE-II). De los dos estudios que evalúan el efecto del ejercicio, ninguno ha demostrado eficacia en reducir la intensidad de la fatiga ni su impacto en la calidad de vida.
Estudios abiertos con terapias avanzadas no evalúan el efecto sobre la fatiga sino en subdominios de escalas globales como el dominio sueño/fatiga o en el total de síntomas no motores. La LD intrayeyunal107 (NE-III) y la ECP108 (NE-II) mejoraron los síntomas no motores en conjunto y el dominio sueño/fatiga.
En resumen, actualmente no existe evidencia suficiente para recomendar un tratamiento para la fatiga en la EP. Serían necesarios más estudios que evalúen la fatiga como variable principal.
Dolor y otros trastornos sensitivos
Durante tiempo el dolor se ha considerado como parte de la reaparición de los síntomas motores (rigidez, sobre todo) en los periodos off, pero se ha visto que puede aparecer en cualquier momento de la evolución de la enfermedad, tanto precediendo al diagnóstico de la EP como asociado a complicaciones motoras en fases avanzadas, ya sea en los periodos on como off o independientemente de estas fluctuaciones. El dolor en la EP se presenta en una variedad de localizaciones y tipos (musculoesquelético, central, visceral, neuropático, etc.).
Se ha atribuido tanto a causas centrales en el procesamiento del dolor, como periféricas, relacionadas con el sistema dopaminérgico y con otros sistemas de neurotransmisión109 (NE-IV).
Se han publicado pocos estudios específicos sobre el dolor en la EP, con lo que el conocimiento de la fisiopatología y de los efectos de los diversos tratamientos aplicados en la clínica es escaso. En su tratamiento, en primer lugar, hay que identificar si el dolor se debe a otra patología concomitante, la cual debe ser tratada de modo independiente. Si el dolor está relacionado con fluctuaciones motoras o no motoras, lo primordial será optimizar el tratamiento dopaminérgico. En el análisis post-hoc del estudio RECOVER se sugiere que la rotigotina reduce significativamente el dolor110 (NE-III). La ECP también ha mostrado en varios estudios ser efectiva en aumentar el umbral del dolor en la EP y que el efecto es mantenido a 8 años111 (NE-II). Los estudios realizados con infusión enteral de LD107 y apomorfina107, que evalúan la mejoría en los síntomas no motores, no estudian el dolor por separado sino dentro del dominio miscelánea (NE-IV).
La safinamida se ha mostrado útil en dos ensayos, uno prospectivo abierto112 (NE-II) y otros analisis post-hoc113 en dosis de 100 mg en mejorar el dolor de manera mantenida. Concretamente, los pacientes mejoraron en dolor musculoesquelético, dolor relacionado con las fluctuaciones, dolor nocturno y síntomas como decoloración, edema o hinchazón y dolor radicular (NE-II).
En cuanto al tratamiento del dolor crónicono relacionado con las fluctuaciones motoras ni con las no motoras propiamente, solo existe un estudio específico de fase II aleatorizado y controlado114, que evalúa el efecto de la naloxona-oxicodona de liberación prolongada. En este estudio el objetivo principal, que era demostrar la mejoría del dolor en una escala a la semana 16, no se alcanza, pero el análisis por protocolo sí demuestra que la oxicodona prolongada es más eficaz que el placebo (NE-I). De manera empírica se han utilizado neuromoduladores y opiáceos. En este momento no existe estudios con evidencia de clase I en el manejo del dolor en la EP.
Los pacientes con EP pueden presentar otros trastornos sensoriales como alteraciones visuales, disfunción olfatoria y del gusto, parestesias, calambres, sensación de quemazón, dolor genital o sensación de boca quemante, que pueden llevar a intervenciones agresivas innecesarias. La mayoría de estos síntomas se relacionan también con las fluctuaciones motoras. No existen ensayos aleatorizados que evalúen el efecto de otros tratamientos en estos síntomas.
Pérdida de peso
Los pacientes con EP muestran un índice de masa corporal menor que la población general. Las causas son multifactoriales. El inicio de la pérdida de peso no se relaciona con el estadio de la enfermedad y puede incluso aparecer tanto en la fase premotora como en fases avanzadas. No existen ensayos que evalúen el tratamiento de la pérdida de peso en la EP. En ocasiones es necesario usar suplementos nutricionales115 (NE-IV).
Bibliografía
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
105. Kluger BM, Herlofson K, Chou KL, et al. Parkinson’s disease-related fatigue: A case definition and recommendations for clinical research. Mov Disord. 2016;31(5):625-31.
106. Lim TT, Kluger BM, Rodríguez RL, et al. Rasagiline for the symptomatic treatment of fatigue in Parkinson’s disease. Mov Disord. 2015;30(13):1825-30.
107. Honig H, Antonini A, Martínez-Martín P, et al. Intrajejunal levodopa infusion in Parkinson’s disease: a pilot multicenter study of effects on non-motor symptoms and quality of life. Mov Disord. 2009;24(10):1468-74.
108. Dafsari HS, Reddy P, Herchenbach C, et al.; IPMDS Non-Motor Symptoms Study Group. Beneficial effects of bilateral subthalamic stimulation on non-motor symptoms in Parkinson’s disease. Brain Stimul. 2016;9(1):78-85.
109. Wasner G, Deuschl G. Pains in Parkinson disease: many syndromes under one umbrella. Nat Rev Neurol. 2012;8:284-94.
110. Kassubek J, Chaudhuri KR, Zesiewicz T, et al. Rotigotine transdermal system and evaluation of pain in patients with Parkinson’s disease: a post hoc analysis of the RECOVER study. BMC Neurol. 2014;14:42.
111. Jung YJ, Kim HJ, Jeon BS, et al. An 8-year follow-up on the effect of subthalamic nucleus deep brain stimulation on pain in Parkinson disease. JAMA Neurol. 2015;72(5):504-10.
112. Santos García D, Yáñez Baña R, Labandeira Guerra C, et al. Pain Improvement in Parkinson’s Disease Patients Treated with Safinamide: Results from the SAFINONMOTOR Study. J Pers Med. 2021;11(8):798.
113. Cattaneo C, Kulisevsky J, Tubazio V, et al. Long-term Efficacy of Safinamide on Parkinson’s Disease Chronic Pain. Adv Ther. 2018;35(4):515-522.
114. Trenkwalder C, Chaudhuri KR, Martínez-Martín P, et al. Prolonged-release oxycodone– naloxone for treatment of severe pain in patients with Parkinson’s disease (PANDA): a double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2015;(14)1161-70.
115. Ma K, Xiong N, Shen Y, et al. Weight Loss and Malnutrition in Patients with Parkinson’s Disease: Current Knowledge and Future Prospects. Front Aging Neurosci. 2018 Jan 19;10:1.
Los trastornos cognitivos en la EP son frecuentes y ocasionan un fuerte impacto en pacientes y cuidadores, por lo que su detección, diagnóstico y tratamiento es esencial para un buen manejo de la enfermedad. Actualmente existen dos entidades nosológicas en referencia a los trastornos cognitivos asociados a la EP: la demencia (D-EP) y el deterioro cognitivo leve (DCL-EP).
Demencia-enfermedad de Parkinson
Se define como una alteración cognitiva progresiva, en más de un dominio, que se desarrolla en el contexto de una EP establecida y que se asocia a ella, y que es lo suficientemente grave como para producir alteraciones funcionales en las actividades instrumentales de la vida diaria de forma significativa. Existen unos criterios específicos116 (NE-IV) y una guía sistematizada para su diagnóstico117 (NE-IV) (Tablas IV y V).
Su prevalencia es de aproximadamente un 30% y su incidencia es cercana al 10% al año. La prevalencia acumulativa es muy alta, alcanzando el 75-80% a los 10-20 años de enfermedad. El riesgo de demencia en la EP es 4-6 veces superior al de la población general, aunque puede ser inferior en los primeros años de la enfermedad. Los factores de riesgo para el desarrollo de demencia asociada a la EP más consistentes son la edad, la presencia de deterioro cognitivo leve (DCL) o alucinaciones visuales, y parkinsonismo grave, especialmente si se presenta inestabilidad postural y trastorno de la marcha. Los estudios clínico-patológicos asocian la D-EP con la acumulación de cuerpos de Lewy en el neocórtex y el sistema límbico. Aunque frecuentemente coexiste patología de tipo Alzheimer, normalmente no alcanza suficiente gravedad como para hacer un diagnóstico de ambas enfermedades. Por otra parte, hay una fuerte evidencia de disfunción colinérgica en los trastornos cognitivos asociados a la EP.
A nivel farmacológico, la rivastigmina, en varias revisiones sistemáticas y metaanálisis, ha evidenciado la eficacia en la mejoría, además de la cognición, de los síntomas conductuales, alucinaciones, las actividades de la vida diaria, la carga del cuidador y la impresión global118,119 (NE-I). La rivastigmina es asimismo un fármaco seguro. Dos estudios que han analizado el efecto de la memantina en la EP con demencia no han encontrado mejorías en la función cognitiva global ni en los dominios cognitivos más específicos120,121 (NE-II). El tratamiento con donepezilo, mantenido durante 52 semanas, mostró una mejoría modesta, aunque significativa en el Mini-Examen del Estado Mental (Mini-Mental S tate E xamination [MMSE]), el NPI y las fluctuaciones de la cognición122 (NE-II).
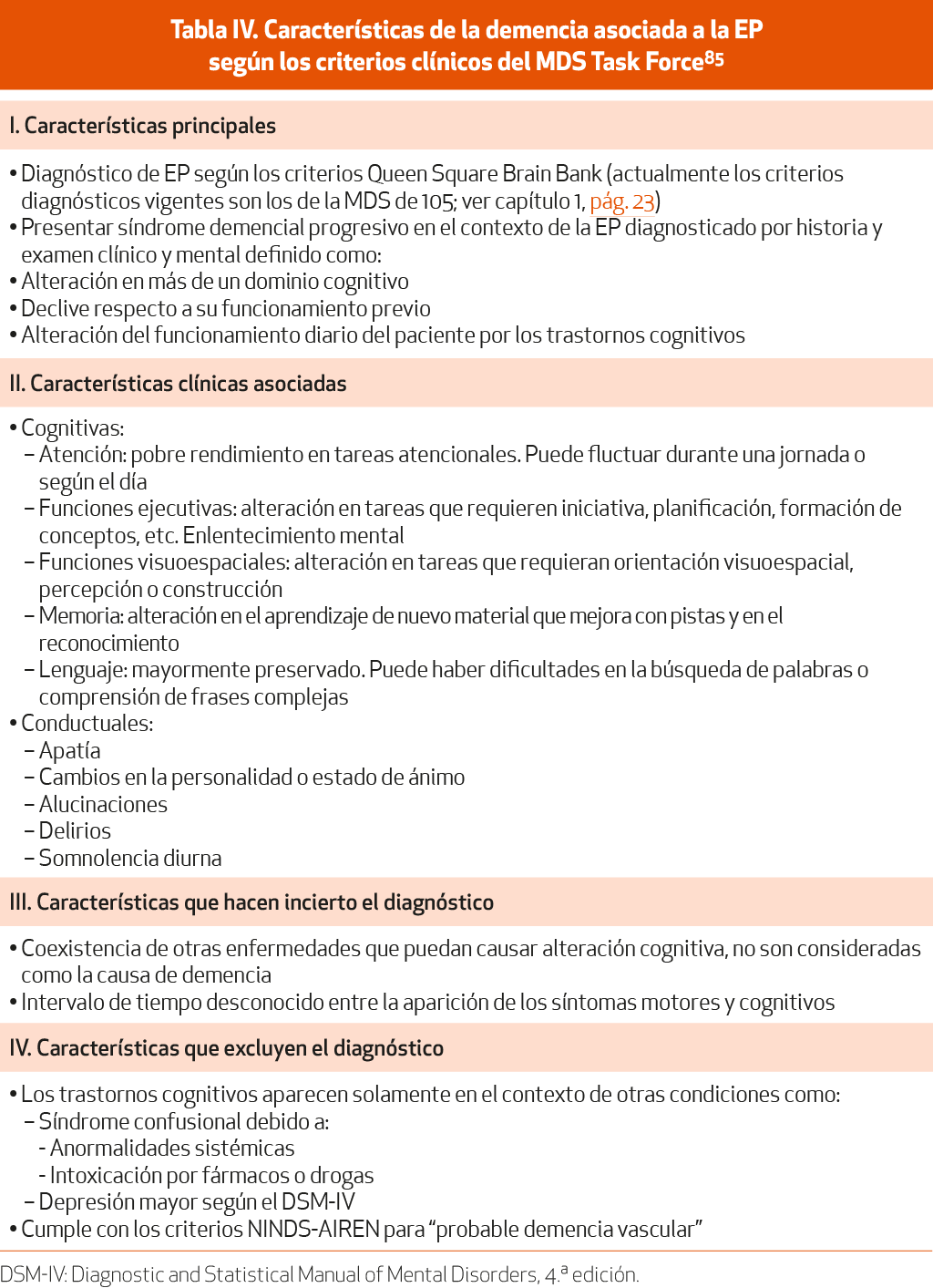
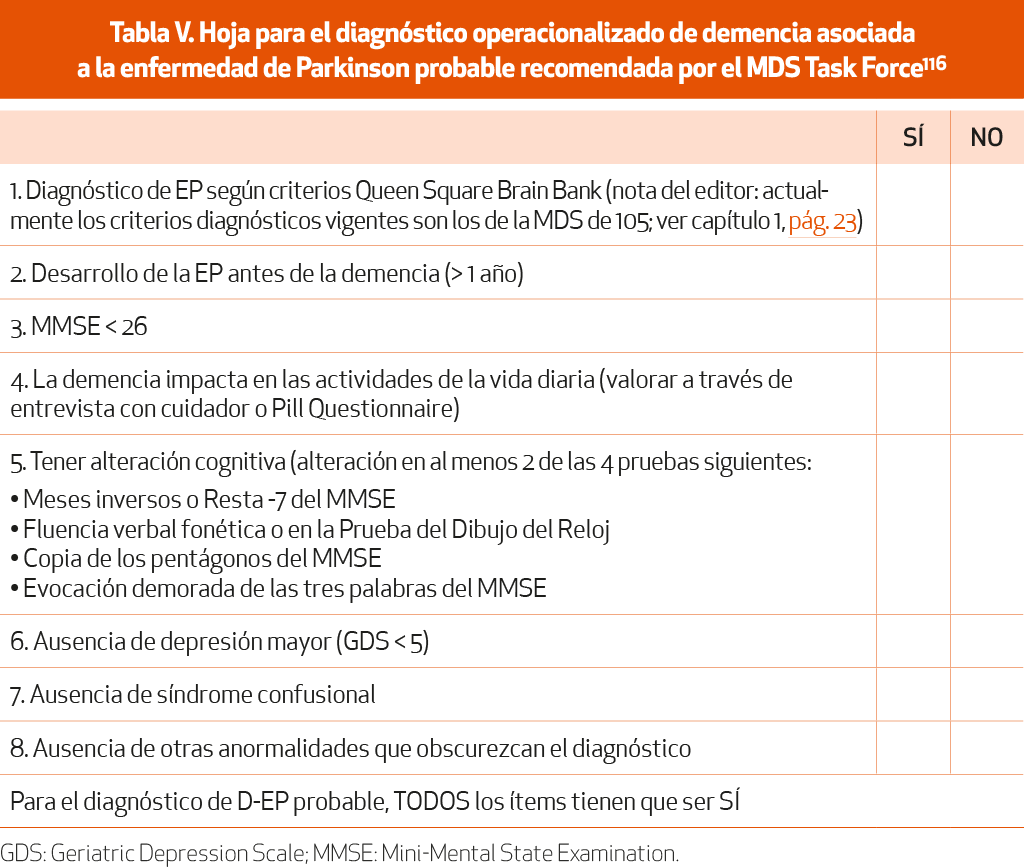
Distintas guías proponen la memantina si los inhibidores de la acetilcolinesterasa no son bien tolerados, están contraindicados o falta de eficacia de los mismos35,85 (NE-III).
Deterioro cognitivo leve-enfermedad de Parkinson
Se define como un declive del rendimiento cognitivo que aparece en el contexto de una EP establecida y que se asocia a ella, pero que no es suficientemente grave como para interferir de forma significativa en el desarrollo de las actividades instrumentales de la vida diaria. Los estudios sugieren que el DCL-EP es un factor de riesgo para el desarrollo de demencia y puede representar un estadio intermedio entre la normalidad y la demencia, por lo que detectar el DCL en la EP podría tener múltiples ventajas con relación al manejo clínico y pronóstico de los pacientes. Es por ello por lo que se están realizando esfuerzos para caracterizar el DCL-EP y desarrollar estrategias terapéuticas. En 2012 se publicaron los criterios específicos de DCL-EP123 (NE-IV), que han permitido avanzar mucho en este sentido (Tabla VI). Sin embargo, cabe señalar que los criterios diagnósticos de DCL-EP están todavía pendientes de una validación completa. Los datos actuales indican que los trastornos cognitivos en la EP son heterogéneos y los estudios longitudinales en marcha intentan caracterizar la existencia de perfiles de riesgo acorde a los subdominios afectados. Un estudio longitudinal ha mostrado cómo los déficits de características frontosubcorticales pueden permanecer durante años estables mientras que las alteraciones más corticales posteriores (déficits en memoria, fluencia verbal semántica, funciones visuoespaciales y visuoconstructivas) sí se han relacionado con un mayor riesgo de desarrollar D-EP124 (NE-II).
Algunos estudios muestran la dificultad de definir subgrupos de riesgo acorde a los criterios de subdominios afectados, ya que la mayoría de los pacientes con DCL-EP presentan una afectación de múltiples dominios124 (NE-II).
La prevalencia de DCL-EP en estudios transversales se sitúa alrededor de un 30% de los pacientes. Un estudio longitudinal reciente mostró que la mayoría de los pacientes diagnosticados de DCL-EP progresaron hacia D-EP en 6 años124 (NE-II).
Con relación al tratamiento farmacológico, a pesar de que en los últimos años se han llevado a cabo diversos estudios con agentes colinérgicos, dopaminérgicos y noradrenérgicos, no hay una evidencia clara de beneficio de ninguno de los tratamientos ensayados125. Los IMAO, como la rasagilina o la safinamida, los agonistas dopaminérgicos o la LD, pueden mejorar las funciones ejecutivas y la atención125 (NE-I). Un estudio controlado doble ciego reciente, con rivastigmina en parches de 9,5 mg/día, administrados durante 24 semanas, no ha mostrado cambios significativos126 (NE-I). Puesto que las alteraciones en el estado de ánimo afectan el rendimiento cognitivo, deberá valorarse individualmente el posible uso de antidepresivos y ansiolíticos.
Con relación a las terapias no farmacológicas, actualmente todavía existen pocos estudios de calidad que evalúen la eficacia de dichas intervenciones en los trastornos cognitivos asociados a la EP. Sin embargo, varias terapias se han mostrado prometedoras y existe evidencia creciente de su efecto positivo en la cognición de personas afectadas por la EP. Los datos actuales indican que el ejercicio físico (ver capítulo 12 sobre ejercicio físico en la enfermedad de Parkinson, pag. 307), especialmente el aeróbico, es un gran inductor de neuroplasticidad y tiene efectos beneficiosos en el funcionamiento cerebral y sobre la cognición127-132 (NE-I). Existen todavía pocos ensayos aleatorizados que demuestren una mejora de la cognición en personas con EP132 (NE-I). Un metaanálisis reciente ha mostrado que las intervenciones con ejercicio físico aeróbico tienen un efecto positivo en la función cognitiva de pacientes con demencia, independientemente del diagnóstico clínico y la frecuencia de la intervención127 (NE-I).

Respecto a las intervenciones mediante entrenamiento cognitivo basadas en la repetición de unas tareas estandarizadas133 (NE-I), un metaanálisis ha concluido que, aunque todavía hay pocos ensayos controlados y aleatorizados, el entrenamiento cognitivo es seguro y moderadamente efectivo para mejorar la cognición de pacientes con EP leve y moderada134 (NE-I).
Un estudio exploratorio reciente de baja calidad evaluó la capacidad cognitiva con rehabilitación para mejorar el deterioro cognitivo en pacientes con EP que recibieron entrenamiento cognitivo por ordenador. Se observaron algunos efectos significativos. Debido al carácter exploratorio del estudio y al pequeño tamaño de la muestra, no se pueden hacer recomendaciones a este respecto135 (NE-IV).
También recientemente se ha publicado un estudio con estimulación transcraneal de corriente directa (t-DCS) en la corteza prefrontal dorsolateral izquierda versus t-DCS simulada con el objetivo de evaluar el posible beneficio en el deterioro cognitivo leve en la EP en pacientes que reciben entrenamiento cognitivo por ordenador136,137 (NE-I). Aunque tuvo efectos positivos, al ser un estudio de baja calidad no se pueden obtener conclusiones para recomendaciones.

Bibliografía
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
85. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf- 1837629189061
116. Emre M, Aarsland D, Brown R, et al. Clinical diagnostic criteria for dementia associated with Parkinson’s disease. Mov Disord. 2007;22(12):1689-707.
117. Dubois B, Burn D, Goetz C, et al. Diagnostic procedures for Parkinson’s disease dementia: recommendations from the movement disorder society task force. Mov Disord. 2007;22(16):2314-24.
118. Pagano G, Rengo G, Pasqualetti G, et al. Cholinesterase inhibitors for Parkinson’s disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry.2015;86(7):767-73.
119. Wang HF, Yu JT, Tang SW, et al. Efficacy and safety of cholinesterase inhibitors and memantine in cognitive impairment in Parkinson’s disease, Parkinson’s disease dementia, and dementia with Lewy bodies: systematic review with meta-analysis and trial sequential analysis. J Neurol Neurosurg Psychiatry. 2015;86(2):135-43.
120. Stubendorff K, Larsson V, Ballard C, et al. Treatment effect of memantine on survival in dementia with Lewy bodies and Parkinson’s disease with dementia: a prospective study. BMJ Open. 2014;4(7):e005158.
121. Wesnes KA, Aarsland D, Ballard C, et al. Memantine improves attention and episodic memory in Parkinson’s disease dementia and dementia with Lewy bodies. Int J Geriatr Psychiatry. 2015;30(1):46-54.
122. Ikeda M, Mori E, Kosaka K, et al.; Donepezil-DLB Study Investigators. Long-term safety and efficacy of donepezil in patients with dementia with Lewy bodies: results from a 52-week, open-label, multicenter extension study. Dement Geriatr Cogn Disord. 2013;36(3-4):229-41.
123. Litvan I, Goldman JG, Tröster AI, et al. Diagnostic criteria for mild cognitive impairment in Parkinson’s disease: Movement Disorder Society Task Force guidelines. Mov Disord. 2012;27(3):349-56.
124. Williams-Gray CH, Evans JR, Goris A, et al. The distinct cognitive syndromes of Parkinson’s disease: 5 year follow-up of the CamPaIGN cohort. Brain. 2009;132(Pt 11):2958-69.
125. Pigott K, Rick J, Xie SX, et al. Longitudinal study of normal cognition in Parkinson disease. Neurology. 2015;85(15):1276-82.
126. Frakey L, Friedman J. The effects of rasagiline on cognition in mild to moderate stage Parkinson’s disease, a double-blind placebo controlled study. Arch Clin Neuropsychol. 2014;6:514.
127. Mamikonyan E, Xie SX, Melvin E, et al. Rivastigmine for mild cognitive impairment in Parkinson disease: a placebo-controlled study. Mov Disord. 2015;30:912-8.
128. Groot C, Hooghiemstra AM, Raijmakers PG, et al. The effect of physical activity on cognitive function in patients with dementia: A meta-analysis of randomized control trials. Ageing Res Rev. 2016;25:13-23.
129. Szuhany KL, Bugatti M, Otto MW. A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor. J Psychiatr Res. 2015;60:56-64.
130. Wang C, Yu JT, Wang HF, et al. Non-pharmacological interventions for patients with mild cognitive impairment: a meta-analysis of randomized controlled trials of cognition-based and exercise interventions. J Alzheimers Dis. 2014;42(2):663-78.
131. Erickson KI, Leckie RL, Weinstein AM. Physical activity, fitness, and gray matter volume. Neurobiol Aging. 2014;35 Suppl 2:S20-8.
132. Kelly ME, Loughrey D, Lawlor BA, et al. The impact of exercise on the cognitive functioning of healthy older adults: a systematic review and meta-analysis. Ageing Res Rev. 2014;16:12-31.
133. Kalron A, Zeilig G. Efficacy of exercise intervention programs on cognition in people suffering from multiple sclerosis, stroke and Parkinson’s disease: A systematic review and meta-analysis of current evidence. NeuroRehabilitation. 2015;37(2):273-89.
134. Peña J, Ibarretxe-Bilbao N, García-Gorostiaga I, et al. Improving functional disability and cognition in Parkinson disease: randomized controlled trial. Neurology. 2014;83(23):2167-74.
135. Leung IH, Walton CC, Hallock H, et al. Cognitive training in Parkinson disease: A systematic review and meta-analysis. Neurology. 2015;85(21):1843-51.
136. Cerasa A, Gioia MC, Salsone M, et al. Neurofunctional correlates of attention rehabilitation in Parkinson’s disease: an explorative study. Neurological Sci 2014;35:1173-1180
137. Biundo R, Weis L, Fiorenzato E, et al. Double-blind randomized trial of tDCS versus sham in Parkinson patients with mild cognitive impairment receiving cognitive training. Brain Stim 2015;8:1223-1225.
Este capítulo se centra en ciertas manifestaciones de la EP que no suelen tener una respuesta tan predecible a los tratamientos habituales. Revisaremos en primer lugar, por su importancia, las alteraciones del equilibrio y de la marcha. Prestaremos especial atención a los bloqueos en la misma. Después evaluaremos la evidencia sobre los tratamientos para las alteraciones posturales, finalizando con manifestaciones con mucho impacto en la calidad de vida y en otros ámbitos del paciente, como son la disartria y la disfagia.
Bloqueos de la marcha
Los bloqueos en la marcha (FOG, freezing of gait) son uno de los retos terapéuticos más importantes en la EP.
Los bloqueos en la marcha se definen como episodios repentinos de breve duración de incapacidad para dar pasos hacia delante de forma efectiva, a pesar de la intención de caminar1. Aparecen típicamente al inicio de la marcha o en los giros, aunque pueden desencadenarse por estrés, distracciones o espacios estrechos. La aparición de FOG se asocia a trastorno de la marcha, caídas y disfunción ejecutiva frontal en estadios avanzados de la enfermedad2. Puede aparecer con menos frecuencia en fases iniciales, pero cuando es uno de los síntomas de presentación, debe descartarse un parkinsonismo atípico como la PSP (ver capítulo 1, pag. 23).
Cuando se utilizan cuestionarios específicos para FOG, la prevalencia ponderada global es del 50,6% de los pacientes con EP, es del 37,9% en pacientes iniciales (≤ 5 años) y del 64,6% en estadios avanzados (≥ 9 años)3.
Ante la naturaleza impredecible del FOG, se han desarrollado instrumentos que facilitan su identificación objetiva y cuantificación4. La puntuación visual del paciente por evaluadores independientes se considera el gold standard para valorar la gravedad del FOG. Se han utilizado maniobras de provocación de FOG como giros de 360°, tareas duales, caminar con obstáculos o realidad virtual que facilitan la observación del FOG en un entorno controlado, pero al ser tareas dirigidas y menos automáticas, pueden ser menos sensibles al FOG. El FOG-Score es una herramienta clínica que puntúa el FOG en 4 tareas de provocación: inicio de la marcha, giros en sentido horario y antihorario y cruce de una puerta. Este método, que mide de forma objetiva la grave- dad, aunque no la duración del FOG, es sensible a los estados on y off medicación y se correlaciona con la autoevaluación del FOG por el paciente. El Time Up-Go Test se puede utilizar para cuantificar el tiempo de FOG con una elevada fiabilidad interobservador, aunque no valora la situación del paciente fuera del entorno hospitalario y no es un test específico para FOG. Para una cuantificación más objetiva, se han desarrollado índices basados en datos de acelerómetros, laboratorios de marcha, EMG, dispositivos inteligentes o combinación de varios, así como dispositivos portátiles en domicilio. Los cuestionarios específicos más comúnmente utilizados son el Freezing of Gait Questionnaire (FOG-Q) y el New Freezing of Gait Questionnaire (NFOG-Q), que incluye un vídeo demostrativo para facilitar el reconocimiento del FOG. Ambos son cuestionarios autoadministrados, fáciles de usar y que evalúan el FOG en distintos entornos, pero pueden no detectar un efecto de pequeño tamaño, y no se correlacionan con la frecuencia o la duración del FOG observado2,5 (NE-IV).
Los bloqueos pueden aparecer en off y responder al tratamiento dopaminérgico, pueden ser parcial o totalmente resistentes a la terapia dopaminérgica y también pueden ser originados por el tratamiento, tanto médico como quirúrgico, de la EP. En la Tabla I se revisan diferentes estrategias para tratar los bloqueos de la marcha en función del contexto en el cual aparecen. Los estudios no incluidos en alguna de las categorías no han diferenciado entre tipos de bloqueos.
Los IMAO, tanto la rasagilina como la selegilina, redujeron el riesgo de padecer bloqueos en la marcha en dos ensayos clínicos2. Este beneficio se observó tanto en pacientes sin tratamiento como en pacientes tratados con fármacos dopaminérgicos, si bien en ninguno de los estudios era el objetivo principal, por lo que no puede descartarse que se trate de un hallazgo incidental (NE-II).
La LD oral ha mostrado una reducción en el riesgo de aparición de FOG respecto a los agonistas dopaminérgicos en un ensayo clínico que comparó eficacia de la LD oral con ropinirol en monoterapia2. Se trata de un hallazgo incidental, que algunos autores relacionan con el hecho de que los pacientes con agonistas dopaminérgicos estaban posiblemente tratados de forma subóptima dado que la potencia de la LD como antiparkinsoniano es mayor que la del ropinirol2 (NE-II).
Finalmente, un estudio abierto, multicéntrico, aleatorizado, en 52 pacientes con FOG y depresión que fueron tratados con dosis de paroxetina de 20-25 mg, escitalopram 10 mg o duloxetina 40 mg, mostró mejoría del FOG medido por FOG-Q, así como de la depresión, a las 3 y 6 semanas de tratamiento5 (NE-IV).
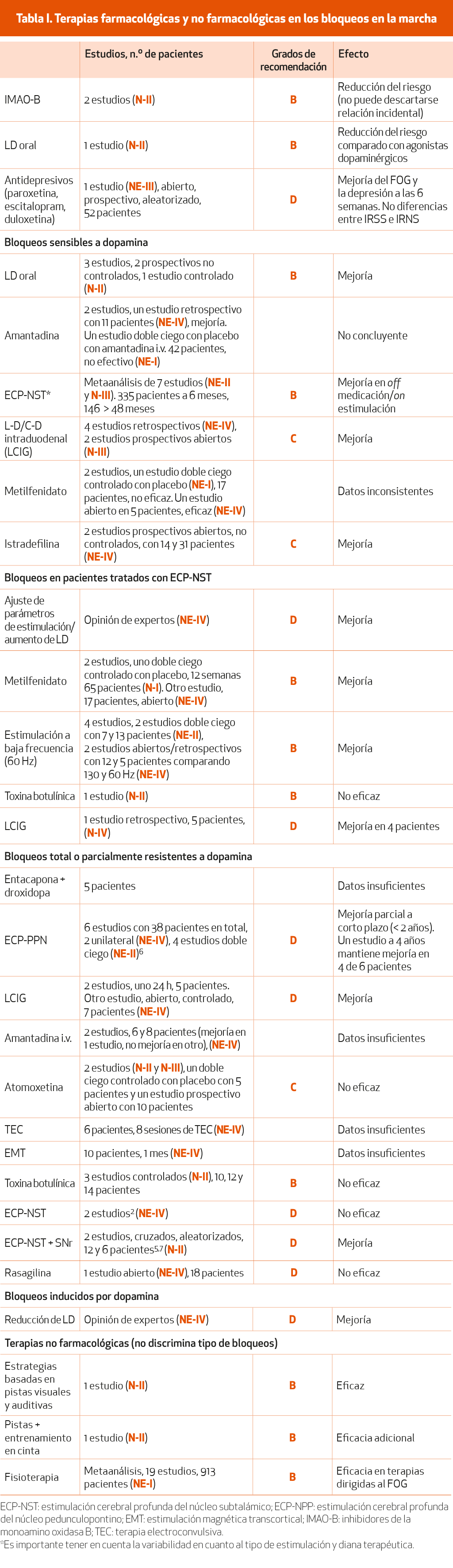
Bloqueos sensibles a dopamina
Es el tipo de bloqueos más frecuente. Suelen ser más intensos y prolongados en off. El tratamiento de elección es la LD.
Los agonistas dopaminérgicos pueden mejorar todos los síntomas parkinsonianos, incluyendo el FOG. No obstante, en opinión de algunos expertos2 (NE-IV), los agonistas pueden inducir bloqueos en la marcha que no tienen por qué reaparecer cuando se introduce en su lugar la LD.
Por lo tanto, ante un paciente parkinsoniano en fases iniciales tratado con agonistas dopaminérgicos que comienza con FOG, la primera recomendación sería aumentar la dosis de LD o añadirla si no la estaba tomando previamente, pero se puede valorar también aumentar la dosis de agonistas dopaminérgicos si esta es baja2. Si, a pesar de la mejoría de las fluctuaciones motoras, persiste el FOG, debe valorarse reducir o suspender el agonista2 (NE-IV).
Algunos estudios indican que en algunos pacientes el FOG puede ser un síntoma más resistente al tratamiento con LD que otros síntomas parkinsonianos8 (NE-I). Se puede dar la situación de que encontremos a un paciente en aparente on y persistencia del FOG, condición que puede ser interpretada como FOG resistente o FOG en on y que se ha denominado también pseudo on-FOG. El FOG resistente es indiferente a los cambios en la medicación dopaminérgica mientras que el pseudo on-FOG se observa durante un estado on aparentemente óptimo, pero que, sin embargo, mejora con una estimulación dopaminérgica más intensa9. Ambos son diferentes del on-FOG, que como se ha comentado anteriormente, es inducido por la medicación dopaminérgica. En los pacientes con pseudo on-FOG puede ser necesario aumentar la dosis de medicación dopaminérgica para que el FOG remita por completo, aun a expensas de producir discinesias.
Hay que considerar que en algunos casos los pacientes pueden presentar más FOG cuando aumentan las discinesias por LD. En estos casos la recomendación es reducir la dosis de LD2 (NE-IV).
Los resultados de la amantadina no son concluyentes. Un estudio mostró menor riesgo de bloqueos en la marcha en pacientes tratados crónicamente con amantadina, a diferencia de los pacientes tratados con agonistas dopaminérgicos, que presenta- ban mayor riesgo10 (NE-II), mientras que en otras series de pacientes no se observó el mismo efecto. En un estudio retrospectivo en 11 pacientes tratados con amantadina por bloqueos en la marcha se observó un efecto beneficioso, pero en algunos pacientes transitorio2,5 (NE-IV). Un estudio doble ciego con amantadina i.v., en el que se incluyeron pacientes con FOG en on y en off, no fue efectivo5 (NE-IV).
La infusión intraduodenal de LD/carbidopa (LCIG) ha demostrado mejorías significativas del FOG5 en 4 estudios retrospectivos y 4 estudios prospectivos (NE-III). Un estudio retrospectivo que incluyó 65 pacientes con EP avanzada mostró una incidencia de FOG del 22% a 1 año de seguimiento respecto al 46% pretratamiento2. Otro estudio retrospectivo con 91 pacientes mostró mejoría de los trastornos de la marcha (FOG, festinación, inestabilidad postural) en el 61,4% de los pacientes a 18 meses de trata- miento2. Dos estudios prospectivos han demostrado mejoría del FOG medido por la escala FOGQ en 17 pacientes a 2 años de tratamiento, y en 25 pacientes a los 6 meses5 (NE-III). Dos estudios piloto, con escaso número de pacientes, han mostrado también mejorías de los bloqueos parcialmente resistentes a LD (NE-IV) (Tabla I).
No hay estudios con apomorfina en infusión continua.
El tratamiento con ECP-STN ha demostrado mejorías consistentes hasta 4 años en los bloqueos en la marcha sensibles a LD en la situación de off-medicación/on-estimulación11 (NE-I). Un metaanálisis sobre 6 estudios que estudiaron específicamente el efecto de la ECP-NST sobre los bloqueos en la marcha ha mostrado un efecto beneficioso y persistente de la estimulación en la condición de off-medicación/on-estimulación respecto a la situación precirugía. El estudio recoge los resultados en 335 pacientes seguidos 6-15 meses, y 146 pacientes seguidos 48 meses11. No se observaron mejorías en la condición de on-estimulación/on-medicación.
Bloqueos en pacientes tratados con ECP
Una situación particular es la de los bloqueos que aparecen en pacientes tratados ECP-NST. En este subgrupo de pacientes, la administración de metilfenidato a dosis de 1 mg/kg/ día ha mostrado efectos beneficiosos en un estudio controlado doble ciego (NE-I)12. No obstante, el metilfenidato no es efectivo para los bloqueos en la marcha en pacientes parkinsonianos no tratados con ECP-NST, basándose en un estudio doble ciego controlado con placebo en 23 pacientes8 (NE-I).
En los bloqueos en pacientes tratados con ECP-NST se recomienda ajustar los parámetros de estimulación: reducir voltajes, reducir frecuencia a 60 Hz, minimizar las diferencias izquierda-derecha en los electrodos, o aumentar la dosis de LD13 (NE-IV).
Un primer estudio doble ciego realizado en 2008 en 13 pacientes parkinsonianos tratados con ECP-NSTque desarrollaron bloqueos 2,5 años después de la cirugía, mostró que la frecuencia baja de 60 Hz producía menos bloqueos en la marcha13. En el seguimiento a 8 meses, 11 pacientes mantenían la mejoría, aunque precisaron aumentar la dosis de LD, y dos pacientes volvieron a la frecuencia de 130 Hz por incapacidad para controlar los síntomas segmentarios a pesar del incremento de LD. Un estudio posterior realizado en 11 pacientes con una frecuencia de 80 Hz mostró una mejoría inmediata de la marcha por la prueba de Sit-Walk-Sit (SWS), que se perdió en el seguimiento a los 1, 5 y 15 meses; tres pacientes volvieron a los parámetros de 130 Hz por mal control de los síntomas motores13 (NE-IV).
En un estudio reciente, doble ciego, realizado en siete pacientes parkinsonianos tratados con ECP-NST a baja frecuencia que presentaban síntomas axiales y bloqueos en la marcha, estos mejoraron significativamente en la escala de FOG y en SWS respecto a la estimulación con 130 Hz y a la situación de desconexión del estimulador13 (NE-I). La mejoría se mantuvo en el seguimiento a 3-8 semanas en todos los pacientes excepto en uno, que volvió a la frecuencia anterior por aumento del temblor. La estimulación a baja frecuencia parece ser efectiva en los bloqueos asociados a ECP-NST, si bien son necesarios más estudios para evaluar la respuesta a largo plazo y sopesar el efecto de la estimulación a baja frecuencia sobre los restantes síntomas parkinsonianos.
Un estudio retrospectivo en 5 pacientes tratados con ECP que desarrollaron FOG resistente, ha mostrado mejorías en 4 pacientes, a los 12 meses de instaurar tratamiento con LCIG5 (NE-IV).
Bloqueos resistentes a dopamina
No hay estudios aleatorizados ni metaanálisis sobre tratamientos no dopaminérgicos en bloqueos parcial o totalmente resistentes a LD.
Se ha utilizado la combinación de droxidopa y entacapona para intentar corregir el déficit en los circuitos adrenérgicos que interviene en los síntomas parkinsonianos2 (NE-IV). En un pequeño estudio realizado en cinco pacientes, la administración de droxidopa junto con entacapona mejoró los bloqueos resistentes a LD2 (NE-IV).
La estimulación cerebral profunda del núcleo pedunculopontino (ECP-PPN) se ha utilizado en los últimos años para tratamiento de síntomas axiales, principalmente FOG resistente y caídas6. La evidencia derivada de 6 estudios con 5 a 8 pacientes cada uno indica que puede ser útil para el tratamiento del FOG resistente en off y en on medicación, si bien con limitaciones por el escaso número de pacientes y por las diferencias metodológicas entre los estudios. La estimulación se ha realizado sobre la zona rostral del PPN en 2 estudios y en la caudal en 4 estudios. El diseño ha sido doble ciego en 4 estudios (NE-II), uno de ellos con estimulación combinada con NST. Las mejorías del FOG han variado entre un 30% en el ítem 14 de la UPDRS-II, 39% en on medicación y 64,6% en off medicación en un análisis de marcha6. En resumen, la ECP-PPN mejoral, pero no elimina el FOG. Hay que considerar que la ECP-PPN no mejora la acinesia, la rigidez ni el temblor, por lo que no se reduce la dosis de medicación antiparkinsoniana. Los pacientes pueden necesitar otras terapias, incluida ECP-NST, para mejorar de forma global los síntomas parkinsonianos.
Dos estudios aleatorizados, cruzados, con 12 y 6 pacientes (NE-II) han demostrado mejorías del FOG resistente con la estimulación dual del NST y la substancia nigra pars reticulata (SNr) respecto a la estimulación aislada del NST5,14. En uno de los estudios la mejoría se ha mantenido hasta 3 años en 4 de 6 pacientes14.
Dos estudios con escaso número de pacientes han mostrado mejoría con LCIG. Cinco pacientes con bloqueos resistentes a dopamina mejoraron con infusión intraduodenal de LD durante 24 horas, con tasa nocturna al 50-80% de la diurna2,13 (NE-IV).
Otras terapias han mostrado resultados insuficientes, aunque prometedores: algunos pacientes tratados con estimulación magnética transcortical en un estudio y en otro con terapia electroconvulsiva mejoraron2,5.
Dos estudios con amantadina intravenosa en bloqueos resistentes a dopamina han mostrado resultados inconsistentes, con mejoría en un estudio prospectivo abierto en 10 pacientes (NE-IV) y no mejoría en un estudio doble ciego de 15 pacientes (NE-I)5.
Tratamientos como la atomoxetina, la rasagilina o la infiltración con toxina botulínica en los gemelos no han demostrado efectividad en este tipo de bloqueos5.
Bloqueos inducidos por dopamina
Los bloqueos inducidos por medicación dopaminérgica son raros (5%). Pueden producirse por LD y, más frecuentemente, por agonistas dopaminérgicos. El tratamiento de elección es la reducción de la medicación, primero de los agonistas dopaminérgicos y después de la LD; no es efectivo sustituir un agonista por otro2 (NE-IV). En casos aislados se ha observado mejoría con la ECP del NST al reducir la dosis de medicación dopaminérgica2 (NE-IV).
Terapias no farmacológicas
Las terapias basadas en estrategias de pistas visuales o auditivas son efectivas para el tratamiento de los bloqueos en la marcha. Según las recomendaciones de la European Federation of Neurological Societies (EFNS) para el tratamiento de la EP15, el entrenamiento basado en pistas es probablemente efectivo en los bloqueos en la marcha. La asociación de pistas visuales o auditivas con entrenamiento en cinta proporciona mayores beneficios.
Varios metaanálisis recientes15 han estudiado los efectos de la fisioterapia en el FOG. Se puede concluir que diversas intervenciones de fisioterapia son útiles en el FOG autopercibido, medido por FOG-Q, cuando la fisioterapia está dirigida a desencadenantes específicos o mecanismos subyacentes del FOG. Entre las terapias que han mostrado beneficio en el FOG se encuentran: entrenamiento con pistas, entrenamiento de acción-observación, ejercicios de prevención de caídas, entrenamiento en cinta, entrenamiento cognitivo, resistencia, marcha nórdica, entrenamiento acuático con obstáculos, marcha en trayectoria curva o entrenamiento con cinta de equilibrio16. La fisioterapia no específica no ha demostrado mejorías del FOG, aunque pueda ser útil para otros aspectos de la EP16. Respecto a la duración del efecto, existen dudas sobre si se mantiene o no en el tiempo tras suspender el tratamiento16.
La evidencia del tratamiento del FOG con fisioterapia específica está limitada por la escasez de estudios doble ciego, la variabilidad de intervenciones y las diferencias en el número y duración en las mismas de unos estudios a otros. A pesar de ello, los numerosos estudios publicados tienen NE-III y alguno NE-II. Remitimos al lector al capítulo 12 sobre ejercicio físico y fisioterapia para profundizar en estos abordajes (pag. 307).
La mejoría del FOG con pistas visuales, auditivas o vibratorias ha propiciado el desarrollo de dispositivos portátiles que permiten la implementación de estas ayudas en el entorno habitual del paciente. Estos dispositivos han evolucionado combinando tecnologías personalizadas con dispositivos comerciales como los smartphones o las gafas inteligentes (Google Glass o Epson BT200)17. Se han observado mejorías del número y duración del FOG en on y off utilizando zapatos con láser, mejoría del porcentaje de off durante la marcha con vibración pulsada, y mejoría de la frecuencia de FOG durante la marcha con giros de 360° utilizando 3 tipos de pistas (auditiva, visual y vibratoria) con Google Glass5,17. Los resultados son prometedores, pero necesitan ser evaluados en series más amplias de paciente. Se ha realizado recientemente una revisión de estos y otros dispositivos inteligentes que pueden ser de ayuda para el tratamiento de los bloqueos de la marcha por parte del Grupo de Estudio de Trastornos del Movimiento y del Comité ad hoc de Nuevas Tecnologías de la SEN y se puede consultar en enlace en el Anexo II (Pág. 374) en caso de querer profundizar en el estado de estas soluciones que de forma genérica tienen un NE-IV.

Acinesia de la marcha
La acinesia de la marcha es uno de los principales síntomas de la EP, y un importante determinante de la calidad de vida en estadios iniciales y moderados. El control de la cadencia se mantiene a lo largo de la enfermedad, por lo que el trastorno de la marcha se atribuye a la incapacidad interna para generar pasos suficientemente amplios.
La última revisión basada en la evidencia de la MDS sobre los tratamientos para trastornos de la marcha en la EP18 (NE-IV) considera la rivastigmina probablemente eficaz en los trastornos de la marcha y caídas en pacientes parkinsonianos, basándose en un estudio con un objetivo primario de mejoría de la variabilidad del paso y un objetivo secundario de reducción de caídas, sin problemas de seguridad.
El donepezilo, el metilfenidato y la memantina se han considerado en investigación en el tratamiento de los trastornos de la marcha18 (NE-IV). El metilfenidato se considera de evidencia insuficiente debido a resultados conflictivos en varios estudios.
Entre los sistemas más utilizados en los últimos años para la mejoría de la marcha destacan el entrenamiento en cinta y los dispositivos con descarga de peso. Este sistema de entrenamiento de la marcha consiste en una suspensión con arnés, que reduce un porcentaje del peso de forma simétrica sobre ambas extremidades, mientras se camina en una cinta.
Una revisión reciente del efecto del entrenamiento con cinta con o sin descarga de peso en pacientes parkinsonianos incluyó 8 estudios con un total de 203 pacientes en estadios leve-moderado19 (NE-I). De ellos, en 7 estudios controlados con un total de 153 pacientes se observaron mejorías en la velocidad de la marcha; 5 estudios con un total de 95 pacientes observaron mejoría en la longitud del paso; 2 estudios con un total de 41 pacientes observaron aumento de la distancia recorrida, y 4 estudios con 78 pacientes no apreciaron mejoría de la cadencia. En ninguno de los estudios se detectaron efectos adversos. Las técnicas de entrenamiento con cinta son útiles para aumentar la velocidad de la marcha, la longitud del paso y la distancia recorrida en la acinesia de la marcha en los pacientes parkinsonianos en estadios I-III, si bien el número de estudios controlados es pequeño. Está por determinar su efecto a largo plazo y la duración de los efectos beneficiosos una vez terminado el tratamiento. No obstante, dada la seguridad del procedimiento, parece razonable recomendarlo como tratamiento adyuvante en pacientes en estadios I-III con acinesia de la marcha. Remitimos nuevamente al lector al capítulo 12 en caso de querer profundizar en las terapias no farmacológicas basadas en ejercicio físico y la fisioterapia (pag. 307).

Caídas
Las caídas en la EP se asocian a peor pronóstico, mayor riesgo de inmovilización y fracturas y mortalidad elevada20. El origen de las caídas es multifactorial; no solo están relacionadas con síntomas de la enfermedad (bloqueos, inestabilidad, hipotensión ortostática, disfunción cognitiva, rigidez axial, discinesias), sino con otros factores como son edad, sexo, presencia de déficit visual, ingesta de fármacos sedantes, ingesta de alcohol, artrosis o sedentarismo. Es recomendable identificar y corregir los factores causales para prevenir su aparición, ya que una vez establecida es difícil de tratar.
Dentro de los factores causales de caídas en la EP, se ha destacado el papel de la situación cognitiva en los pacientes. Un estudio de fase II, doble ciego y controlado con placebo ha puesto de manifiesto una reducción significativa en la frecuencia de caídas en pacientes con EP sin demencia tratados con rivastigmina20 (NE-I). Otro estudio doble ciego ha mostrado mejoría del donepezilo en las caídas respecto a placebo, pero con baja calidad de evidencia18(NE-IV).
Las evidencias más recientes indican que los IACE pueden reducir un 50% las caídas en pacientes con EP, basándose en los datos de 3 estudios con 229 pacientes, con moderada evidencia21 (NE-II). Dicho esto, es incierto si tienen efecto en el número de pacientes parkinsonianos que experimentan caídas21 y también hasta qué punto los cambios en la función cognitiva pueden influir en la respuesta sobre la marcha.
El ejercicio físico reduce probablemente el número de caídas en un 35% y el número de pacientes que experimentan caídas en un 10%, en pacientes con EP leve a moderada según los datos extraídos de 13 estudios controlados con 1652 pacientes con moderada evidencia21 (NE-II). Entre los ejercicios que han demostrado mejorías en ensayos controlados están: entrenamiento del equilibrio, movilidad funcional, fuerza o taichí. Los estudios que combinan actividades duales, motoras y cognitivas, obtienen mejores resultados para las caídas, casi-caídas y riesgo de caídas que la fisioterapia regular21.
No se ha observado superioridad de un tipo de ejercicio sobre otro. Los ejercicios con supervisión completa son más efectivos para reducir caídas que los ejercicios con supervisión parcial o independientes21 (NE-II).
Terapias no farmacológicas
Taichí
Se conoce desde hace tiempo que esta práctica milenaria favorece el equilibrio a través de movimientos de cambio de peso, desplazamiento del centro de gravedad en los límites del equilibrio y movimientos de pasos en dirección anteroposterior y lateral.
La recomendación de la práctica del taichí en la EP se ha generalizado tras publicarse los resultados de un ensayo clínico en el que participaron 176 pacientes con EP, comparando el taichí con entrenamiento con resistencia y con estiramientos de baja intensidad22 (NE-I). El taichí demostró superioridad respecto al entrenamiento con resistencia y a los estiramientos de baja intensidad: menos caídas, más longitud del paso y velocidad de la marcha y mejores parámetros de equilibrio. Los beneficios se mantuvieron 3 meses después de terminar el estudio.
Desde entonces, varias revisiones y metaanálisis han intentado evaluar los resultados reales del taichí en la EP. En el último metaanálisis publicado en 201423 (NE-I) se incluyeron 7 estudios aleatorizados y controlados, y un estudio no controlado, llegando a la conclusión de que el taichí es efectivo en pacientes parkinsonianos para mejorar el equilibrio (Escala de Equilibrio de Berg), función motora (UPDRS-III) y movilidad funcional (Timed Up and Go Test) en pacientes con EP. Comparado con otras terapias activas, el taichí aporta mejores resultados únicamente sobre el equilibrio. No hay evidencia suficiente para confirmar o refutar el efecto de taichí sobre la velocidad y resistencia de la marcha o la longitud del paso. Los resultados a largo plazo deben ser evaluados en más estudios, ya que la evidencia actual es insuficiente.
En resumen, las evidencias indican que la práctica del taichí puede recomendarse para mejorar el equilibrio y la función motora en pacientes parkinsonianos, y, en especial, que es superior a otras terapias activas en la mejoría del equilibrio.
Terapias basadas en la música
La música rítmica proporciona pistas externas auditivas, incorpora movimientos de stepping, cambio de peso y rotación, y permite y facilita la sincronización precisa de los movimientos. La música además induce respuestas emocionales y mejora el cumplimiento con tratamientos prolongados. Moverse al ritmo de la música libera endorfinas y puede promover patrones de satisfacción que distraigan de la fatiga.
En el metaanálisis publicado en 2014 sobre el efecto del baile en pacientes parkinsonianos24 (NE-I) se analizaron los resultados de cinco estudios controlados en los que el baile se comparaba con otro tipo de ejercicio o con la no intervención. Los resultados indican mejorías significativas a corto plazo en la UPDRS-III, la Escala de Equilibrio de Berg y la velocidad en la marcha, en comparación con la no intervención. Cuando se compara con otros tipos de ejercicio físico, se observan mejorías significativas en el equilibrio y la calidad de vida. Las limitaciones son de nuevo el escaso número de pacientes y la efectividad de las terapias a largo plazo.
Basándose en dos estudios con 100 pacientes, la terapia con baile mejora más la función motora medida por la UPDRS respecto a la no intervención, y no muestra diferencias respecto al ejercicio físico24. En el equilibrio medido por la Escala de Equilibrio de Berg, y basándose en dos estudios con 43 pacientes, a los 3 meses el baile es efectivo respecto a la no intervención, y es más efectivo comparando con el ejercicio físico. Respecto a los bloqueos en la marcha, no se observaron mejorías24.
Un metaanálisis posterior25 evaluó el efecto de diferentes tipos de baile sobre el equilibrio en 612 pacientes parkinsonianos distribuidos en 14 estudios con grupo control, confirmando el efecto beneficioso del baile sobre el equilibrio, en especial en las intervenciones de más de 12 semanas. Este estudio no encontró diferencias entre sesiones de 60 o de 90 minutos, ni entre diferentes bailes, pero la representación de unos y otros tipos de baile era desigual25.
En resumen, la evidencia acumulada indica que el baile contribuye a mejorar la función motora de forma comparable al ejercicio físico y muestra eficacia para mejorar el equilibrio24,25, en especial si la duración es mayor de 12 semanas25, aunque no mejora los bloqueos de la marcha24. No obstante, son necesarios ensayos controlados de mayor calidad para establecer definitivamente los efectos de diferentes tipos de baile y su efecto a largo plazo.

Bibliografía
1. Nutt JG, Bloem BR, Giladi N, et al. Freezing of gait: moving forward on a mysterious clinical phenomenon. Lancet Neurol. 2011;10:734-744.
2. Nonnekes J, Snijders AH, Nutt JG, et al. Freezing of gait: a practical approach to management. Lancet Neurol. 2015;14:768-78.
3. Zhang WS, Gao C, Tan YY, et al. Prevalence of freezing of gait in Parkinson’s disease: a systematic review and meta-analysis. J Neurol. 2021 Nov;268(11):4138-4150.
4. Cui CK, Lewis SJG. Future Therapeutic Strategies for Freezing of Gait in Parkinson’s Disease. Front Hum Neurosci. 2021 Nov 2;15:741918.
5. Gao C, Liu J, Tan Y, et al. Freezing of gait in Parkinson’s disease: pathophysiology, risk factors and treatments. Transl Neurodegener. 2020 Apr 15;9:12.
6. Thevathasan W, Debu B, Aziz T, et al. Pedunculopontine nucleus deep brain stimulation in Parkinson’s disease: a clinical review. Mov Disord. 2018;33(1):10-20.
7. Cao S, Cui Y, Jin J, et al. Prevalence of axial postural abnormalities and their subtypes in Parkinson’s disease: a systematic review and meta-analysis. J Neurol. 2023 Jan;270(1):139-151.
8. Espay AJ, Dwivedi AK, Payne M, et al. Methylphenidate for gait impairment in Parkinson disease: a randomized clinical trial. Neurology. 2011;76:1256-62.
9. Giladi N, Treves TA, Simon ES, et al. Freezing of gait in patients with advanced Parkinson’s disease. J Neural Transm. 2001;108:53-61.
10. Espay AJ, Fasano A, van Nuenen BF, et al. “On” state freezing of gait in Parkinson disease: a paradoxical levodopa-induced complication. Neurology. 2012 Feb 14;78(7):454-7.
11. Schlenstedt C, Shalash A, Muthuraman M, et al. Effect of high-frequency subthalamic neurostimulation on gait and freezing of gait in Parkinson’s disease: a systematic review and meta-analysis. Eur J Neurol. 2017;24(1):18-26.
12. Moreau C, Delval A, Defebvre L, et al.; Parkgait-II study group. Methylphenidate for gait hypokinesia and freezing in patients with Parkinson’s disease undergoing subthalamic stimulation: a multicentre, parallel, randomised, placebo-controlled trial. Lancet Neurol. 2012 Jul;11(7):589-96.
13. Xie T, Padmanaban M, Bloom L, et al. Effect of low versus high frequency stimulation on freezing of gait and other axial symptoms in Parkinson patients with bilateral STN DBS: a mini-review. Transl Neurodegener. 2017;6:13.
14. Valldeoriola F, Munoz E, Rumia J, et al. Simultaneous low-frequency deep brain stimulation of the substantia nigra pars reticulata and high-frequency stimulation of the subthalamic nucleus to treat levodopa unresponsive freezing of gait in Parkinson’s disease: a pilot study. Parkinsonism Relat Disord. 2019;60:153-7.
15. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
16. Gilat M, Ginis P, Zoetewei D, et al. A systematic review on exercise and training-based interventions for freezing of gait in Parkinson’s disease. NPJ Parkinsons Dis. 2021 Sep 10;7(1):81.
17. Sweeney D, Quinlan LR, Browne P, et al. A technological review of wearable cueing devices addressing freezing of gait in Parkinson’s disease. Sensors (Basel). 2019;19(6).
18. Fox SH, Katzenschlager R, Lim SY, et al.; Movement Disorder Society Evidence-Based Medicine Committee. International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson’s disease. Mov Disord. 2018 Aug;33(8):1248-1266.
19. Mehrholz J, Friis R, Kugler J, et al. Treadmill training for patients with Parkinson’s disease. Cochrane Database Syst Rev. 2010;1:CD007830.
20. Henderson EJ, Lord SR, Brodie MA, et al. Rivastigmine for gait stability in patients with Parkinson’s disease (ReSPonD): a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Neurol. 2016 Mar;15(3):249-58.
21. Camicioli R, Morris ME, Pieruccini-Faria F, et al. Prevention of Falls in Parkinson’s Disease: Guidelines and Gaps. Mov Disord Clin Pract. 2023 Sep 2;10(10):1459-1469.
22. Li F, Harmer P, Fitzgerald K, et al. Tai chi and postural stability in patients with Parkinson’s disease. N Engl J Med. 2012;366(6):511-9.
23. Yang Y, Li XY, Gong L, et al. Tai chi for improvement of motor function, balance and gait in Parkinson’s disease: a systematic review and meta-analysis. PLoS ONE. 2014;9(7):e102942.
24. Sharp K, Hewitt J. Dance as an intervention for people with Parkinson’s disease: A systematic review and meta-analysis. Neurosci Biobehav Rev. 2014;47:445-56.
25. Simpkins C, Yang F. Do dance style and intervention duration matter in improving balance among people with Parkinson’s disease? A systematic review with meta-analysis. Parkinsonism Relat Disord. 2023 Jan;106:105231.
Antecolis
El antecolis en la EP se define como la flexión anterior de la cabeza y cuello de al menos 45°, con posible corrección transitoria voluntaria completa o casi completa o con capacidad de ejercer fuerza con los músculos extensores del cuello ante un examinador26 (NE-IV). Aparece en el 8% de los pacientes. De inicio subagudo y curso progresivo, es más frecuente su aparición a lo largo del curso de la enfermedad, pero puede aparecer de forma aguda tras el inicio del tratamiento con agonistas dopaminérgicos y amantadina. Los pacientes con antecolis pueden presentar dolor cervical, disfagia, sialorrea, alteración visual y pérdida de equilibrio. En la exploración puede aparecer hipertrofia de la musculatura extensora y flexora, espasmos de la musculatura flexora, debilidad de músculos extensores, rigidez cervical y no mejora con gesto antagonista26.
Fisiopatológicamente se barajan dos hipótesis: 1) en los pacientes con hipertrofia muscular, con algún grado de torticolis o laterocolis y sin debilidad, se sugiere una etiología distónica, y 2) en los pacientes con debilidad de los extensores y leve atrofia de los flexores, hay que considerar una miopatía. En todos los casos puede haber rigidez asociada. En los casos en los que la postura no se corrige hay que descartar una patología ortopédica subyacente27(NE-IV).
Antes de iniciar un tratamiento se debe realizar una prueba de imagen cervical y un electromiograma (EMG). En los casos en que haya datos de miopatía inflamatoria en el EMG se puede plantear una biopsia muscular25 (NE-IV).
En cuanto a su manejo, en los casos en que predomina la distonía se puede realizar:
- Tratamiento no farmacológico: se puede valorar el empleo de corsés y terapias de rehabilitación28 (NE-IV).
- Tratamiento farmacológico:
— Ajustar el tratamiento dopaminérgico si existe modificación de la postura en función de las fluctuaciones motoras del paciente. Retirar los agonistas si ha existido relación temporal con el inicio de agonistas dopaminérgicos29 (NE-II).
— Toxina botulínica: no hay evidencias de resultados con toxina botulínica en la musculatura flexora superficial del cuello. Se puede utilizar una guía con EMG y ecografía para inyectar la musculatura flexora profunda del cuello30 (NE-II).
- Tratamiento quirúrgico con ECP: no hay evidencia para el tratamiento de antecolis de pacientes con EP con ECP de forma aislada, a no ser que se considere como parte del tratamiento de otros síntomas.
En los casos en que predomina la miopatía se puede intentar tratamiento con corticoides o inmunosupresores en los pacientes en los que hay datos de miopatía inflamatoria31 (NE-IV, grado de recomendación D).

Camptocormia
Se define como una flexión anormal (lumbar > 30° y torácica > 45°) de la región toracolumbar mientras el paciente está sentado o caminando y que desaparece casi por completo en decúbito supino. Se puede clasificar en camptocormia superior, cuando la flexión del tronco se produce entre la zona torácica baja y lumbar alta (implica bilateralmente a los músculos oblicuos externos e internos, así como rectos abdominales), y camptocormia inferior, cuando la flexión es a nivel de la cadera (implica al iliopsoas y rectos abdominales). La prevalencia de este síndrome es del 10%7 (NE-I). Los pacientes con EP que desarrollan camptocormia suelen ser mujeres de edad avanzada con una EP más grave y con más síntomas no motores. Los pacientes presentan inestabilidad y tensión de la musculatura abdominal. En la exploración asocian rigidez axial importante, espasmo de rectos abdominales y dolor de espalda32 (NE-IV).
La camptocormia en la EP se produce por varios factores: progresión de la enfermedad, distonía asociada a la EP y miopatía secundaria a la propia enfermedad o concurrente con los fármacos usados en su tratamiento (agonistas dopaminérgicos o neurolépticos). El diagnóstico diferencial hay que plantearlo principalmente con problemas espondiloartrósicos (aplastamientos vertebrales, osteoporosis, fracturas); en este caso, la falta de corrección de la postura en decúbito supino es el principal factor diferenciador33 (NE-IV).
Se recomienda realizar pruebas de imagen para descartar anomalías óseas subyacentes. También se puede valorar la realización de un EMG para el estudio de la musculatura hiperactiva. El manejo de la camptocormia consiste en:
- Tratamiento no farmacológico: se puede valorar el empleo de corsés y terapias de rehabilitación28 (NE-IV).
- Tratamiento farmacológico:
— La camptocormia se considera un signo que no responde a LD, pero se puede ajustar el tratamiento dopaminérgico si se observa fluctuación de la postura según el estado motor. En algunos casos, cuando haya sospecha de su relación con inicio o modificación de dosis de agonistas dopaminérgicos, valorar la retirada de estos. En casos seleccionados y jóvenes en los que puede predominar el cuadro distónico, se puede intentar el tratamiento con anticolinérgicos34 (NE-IV).
—Toxina botulínica: no hay estudios con resultados positivos. Se recomienda inyectar los músculos oblicuos externos, en los casos en que no se encuentre beneficio inyectado solo los rectos anteriores o ileopsoas35 (NE-IV). ̖
— Inyección de lidocaína en los músculos oblicuos externos36 (NE-IV).
- Tratamiento quirúrgico:
— ECP: los estudios realizados con ECP tanto en el NST como en el globo pálido interno en series pequeñas de casos han mostrado resultados variables37 (NE-III). En otro metaanálisis38 (NE-I) se ha confirmado que la ECP es un tratamiento eficaz para la camptocormia en la EP con un grado de mejoría de hasta el 68%. Los pacientes en la fase inicial de la camptocormia con un ángulo de flexión más significativo pueden beneficiarse más de la ECP. La indicación de ECP en camptocormia asociada a EP no debe considerarse aislada, sino dentro de la valoración global de la indicación de esta técnica, por sus complicaciones motoras (NE-III, grado de recomendación C).
— Cirugía ortopédica: se debe considerar la corrección de deformidades solo en casos graves seleccionados, así como cirugía local descompresiva en pacientes con fracturas o aplastamientos vertebrales que condicionen radiculopatía o mielopatía asociada39 (NE-IV).

Síndrome de Pisa o inclinación lateral del tronco
Se define como la inclinación lateral del tronco (10°) que se corrige de forma pasiva o en decúbito supino. Hay que diferenciarla de la escoliosis, que es un término ortopédico con rotación vertebral. El síndrome de Pisa puede tener o no asociada una escoliosis. La prevalencia en la EP es del 10% y puede estar presente en otros parkinsonismos como la atrofia multisistémica. La fisiopatología es compleja y multifactorial: se ha relacionado con fármacos (neurolépticos e inhibidores de la acetilcolinesterasa), distonía y, sobre todo, con un desequilibrio en el funcionamiento de los ganglios basales y una alteración de la integración sensitivo-motora que favorecerían la postura anormal. En la mayoría de los pacientes con EP, la curvatura suele ser hacia el lado contralateral al inicio de los síntomas40 (NE-IV). El inicio es crónico y el curso progresivo. Los pacientes pueden tener desequilibrio, disnea y dolor.
Se recomienda realizar pruebas de imagen para descartar anomalías óseas subyacentes. También se puede valorar la realización de un EMG para el estudio de la musculatura hiperactiva.
El manejo del síndrome de Pisa se basa en:
-
Tratamiento no farmacológico41: ortesis y rehabilitación (NE-IV).
-
Tratamiento farmacológico:
— Se debe comprobar si se ha añadido algún fármaco, como agonistas dopaminérgicos o IACE, que pueda causar el síndrome y retirarlo. Ajustar el tratamiento dopaminérgico si se observa cambio de la postura según la situación motora del Se pueden usar clozapina y anticolinérgicos42 (NE-IV).
— Toxina botulínica: inyectar en la musculatura paravertebral, cuadrado lumbar e iliopsoas43 (NE-IV).
-
Tratamiento quirúrgico:
— ECP: en un reciente metaanálisis44, el 94,9% de los pacientes se sometió a ECP-STN 5,1% tenía GPi como zona diana de ECP. Se informó de un resultado positivo en el síndrome de Pisa del 72,2%. La menor edad y el menor UPDRS-III preoperatorio (on/off) se consideraron factores predictivos positivos para un efecto positivo de la ECP (NE-I).
— Cirugía ortopédica: se debe considerar la corrección de deformidades solo en casos graves seleccionados, así como la cirugía local descompresiva en pacientes con fracturas o aplastamientos vertebrales que condicionen radiculopatía y/o mielopatía asociada45 (NE-IV).

Bibliografía
7. Cao S, Cui Y, Jin J, et al. Prevalence of axial postural abnormalities and their subtypes in Parkinson’s disease: a systematic review and meta-analysis. J Neurol. 2023 Jan;270(1):139-151.
25. Simpkins C, Yang F. Do dance style and intervention duration matter in improving balance among people with Parkinson’s disease? A systematic review with meta-analysis. Parkinsonism Relat Disord. 2023 Jan;106:105231.
26. Tinazzi M, Geroin C, Bhidayasiri R, et al.; International Parkinson and Movement Disorders Society Task Force on Postural Abnormalities. Task Force Consensus on Nosology and Cut-Off Values for Axial Postural Abnormalities in Parkinsonism. Mov Disord Clin Pract. 2022;9(5):594-603.
27. Doherty KM, Van de Warrenburg BP, Peralta MC, et al. Postural deformities in Parkinson’s disease. Lancet Neurol. 2011;10:538-49.
28. Jo G, Park J, Yoon J, et al. Effect of spinal kypho-orthosis to gait and forward flexion in Parkinson disease. J Phys Ther Sci. 2018;30:988-992.
29. Benninger F, Khlebtovsky A, Roditi Y, et al. Beneficial effect of levodopa therapy on stooped posture in Parkinson’s disease. Gait Posture. 2015;42:263-268.
30. Revuelta GJ, Montilla J, Benatar M, et al. An 18F-FDG PET study of cervical muscle in parkinsonian anterocollis. J Neurol Sci. 2014;340(1-2):174-7.
31. Savica R, Kumar N, Ahlskog JE, et al. Parkinsonism and dropped head: dystonia, myopathy, ¿or both? Parkinsonism Relat Disord. 2012;18(1):30-4.
32. Srivanitchapoom P, Hallett M. Camptocormia in Parkinson’s disease: definition, epidemiology, pathogenesis and treatment modalities. J Neurol Neurosurg Psychiatry. 2016;87(1):75-85.
33. Artusi CA, Geroin C, Nonnekes J, et al.; International Parkinson and Movement Disorders Society Task Force on Postural Abnormalities. Predictors and Pathophysiology of Axial Postural Abnormalities in Parkinsonism: A Scoping Review. Mov Disord Clin Pract. 2023;10(11):1585-1596.
34. Gerton BK, Theeler B, Samii A. Backpack treatment for camptocormia. Mov Disord. 2010;25:247-248.
35. Wijemanne S, Jiménez-Shahed J. Improvement in dystonic camptocormia following botulinum toxin injection to the external oblique muscle. Parkinsonism Relat Disord. 2014;20(10):1106-7.
36. Furusawa Y, Mukai Y, Kawazoe T, et al. Long-term effect of repeated lidocaine-injections into the external oblique for upper camptocormia in Parkinson’s disease. Parkinsonism Relat Disord. 2013;19(3):350-4.
37. Umemura A, Oka Y, Ohkita K, et al. Effect of subthalamic deep brain stimulation on postural abnormality in Parkinson disease. J Neurosurg. 2010;112:1283-8.
38. Spindler P, Alzoobi Y, Kühn AA, et al. Deep brain stimulation for Parkinson’s disease-related postural abnormalities: a systematic review and meta-analysis. Neurosurg Rev. 2022 Oct;45(5):3083-3092.
39. Koller H, Acosta F, Zenner J, et al. Spinal surgery in patients with Parkinson’s disease: experiences with the challenges posed by sagittal imbalance and the Parkinson’s spine. Eur Spine J. 2010;19:1785-1794.
40. Castrioto A, Piscicelli C, Perennou D, et al. The pathogenesis of Pisa syndrome in Parkinson’s disease. Mov Disord. 2014;29(9):1100-7.
41. Bloem BR, De Vries NM, Ebersbach G. Non pharmacological treatments for patients with Parkinson’s disease. Mov Disord. 2015;30:1504-20.
42. Bhattacharya KF, Giannakikou I, Munroe N, et al. Primary anticholinergic-responsive Pisa syndrome. Mov Disord. 2000;15:1285-1287.
43. Dupeyron A, Viollet E, Coroian F, et al. Botulinum Toxin-A for treatment of Pisa syndrome: A new target muscle. Parkinsonism Relat Disord. 2015;21(6):669-70.
44. Gandolfi M, Geroin C, Imbalzano G, et al. Treatment of axial postural abnormalities in parkinsonism disorders: A systematic review of pharmacological, rehabilitative and surgical interventions. Clin Park Relat Disord. 2024 Mar 12;10:100240.
45. Abat LB, McLain RF, Bingaman W, et al. Spinal surgery in patients with Parkinson’s disease: construct failure and progressive deformity. Spine. 2004;29:2006-2012.
Disartria
En la EP son frecuentes los trastornos de la voz y del habla, más aún con la progresión de la enfermedad, y pueden llegar a ser muy limitantes y mermar de forma muy significativa la calidad de vida. Ocurren en hasta un 89% de los pacientes46. Los más frecuentes son: bajo volumen (hipofonía) y monotonía en el tono de la voz (disprosodia), articulación imprecisa, repetición de palabras, aceleración del ritmo (palilalia, taquilalia), voz entrecortada y temblor vocal. Algunos de ellos pueden deberse a la hipocinesia y a la rigidez (y por ello pueden mejorar con la terapia dopaminérgica). También existe una mala coordinación entre habla y respiración, así como alteraciones en la autopercepción acústica.
A nivel farmacológico, para mejorar los problemas del habla se debe optimizar la medicación dopaminérgica, aunque la respuesta sea parcial. Pueden ocurrir mejorías tanto con aumento como con el descenso en la medicación dopaminérgica47 (NE-IV). El tratamiento mediante estimulación subtalámica en ocasiones provoca empeoramiento en la articulación (aunque también se han descrito mejorías en pacientes disártricos)44 (NE-IV). El empeoramiento posquirúrgico puede ser reversible y se ha hipotetizado que puede variar por los cambios en la medicación o de los parámetros eléctricos de estimulación.
La logopedia emplea ejercicios respiratorios, de fonación, articulación, prosodia y entonación. Hay dispositivos de retroalimentación auditiva retardada (RAR) que, por ejemplo, emiten una vibración cuando la señal acústica es menor que un umbral fijado de forma individual. En fases avanzadas de la enfermedad, puede ser necesario emplear aparatos de comunicación (amplificadores de voz, tableros alfabeto, sistemas de salida de voz digitalizada, mensajes de voz grabados).
Existen dos revisiones sistemáticas de la literatura médica sobre tratamiento de la disartrofonía en la EP realizadas por el movimiento Cochrane en 201243,48 (NE-I). Valoran estudios realizados en un total de 159 pacientes. Concluyen que el Lee Silverman Voice Treatment (LSVT) mejora más que los ejercicios respiratorios en diversos parámetros objetivos (nivel de presión sonora y variabilidad de frecuencia en lectura y en monólogo, comunicación y volumen del habla) (NE-I).
El LSVT es un método en el que se instruye al paciente a incrementar el volumen y la inteligibilidad. Es el que, según los estudios publicados, es más eficaz en la EP. Al comparar distintas modalidades de LSVT, en la EP es más eficaz el LSVT-LOUD (el centrado en voz, en el componente respiratorio y laríngeo) que el LSVT-ARTIC (el centrado en articulación y región orofacial)49. El LSVT-LOUD es mejor en inteligibilidad del habla y nivel de presión sonora de lectura. El LSTV-LOUD incluye ejercicios de intensidad de voz, entonación y movilidad facial que mejoran las funciones respiratorias, laríngeas y articulatorias; se aplican 16 sesiones de 60 minutos durante 1 mes. Se ha observado que en ocasiones la mejoría puede mantenerse hasta 2 años46. Emplea un sonómetro para calibrar el nivel de volumen de la voz y hacer reconocer que deben aumentarlo para ser entendido (retroalimentación visual). Es un tratamiento también eficaz en la disfagia. Al comparar la aplicación de la terapia LSTV-LOUD de manera presencial con el modo online no hay diferencias significativas, salvo la presión y la aspereza en la fonación vocal sostenida a favor de la modalidad presencial. En un ensayo aleatorizado en 64 pacientes con EP se corroboró que el LSVT LOUD durante 1 mes produjo más mejoría que el LSTV-ARTIC y que en los pacientes no tratados y que esta mejoría se mantenía a los 7 meses49 (NE-I).
Tras una revisión sistemática y un metaanálisis de todos los estudios publicados con LSTV en EP, se incluyeron finalmente 10 ensayos y se concluyó que era más eficaz que la terapia respiratoria convencional. El resultado clínicamente más relevante sería la inteligibilidad, pero casi ningún resultado en estos estudios es estadísticamente significativo50 (NE-I).
Al comparar la eficacia de la RAR frente a la terapia tradicional, hay parte de resultados a favor de la RAR (articulación y tasa de conversación en lectura) y otros a favor de la terapia tradicional (inteligibilidad de lectura51).
No se encuentran publicaciones que traten de la repercusión sobre las actividades de la vida o calidad de vida, el impacto en el cuidador ni estudios sobre el impacto económico.
Los pacientes deben ser derivados a terapeutas entrenados en los métodos más beneficiosos en la EP.
Muchos individuos mejoran los parámetros de la voz y el habla justo tras completar la terapia y debe recomendarse insistentemente que los continúen en domicilio para mantener esa mejoría. Pueden beneficiarse de evaluaciones periódicas y talleres de recuerdo.

Bibliografía
43. Dupeyron A, Viollet E, Coroian F, et al. Botulinum Toxin-A for treatment of Pisa syndrome: A new target muscle. Parkinsonism Relat Disord. 2015;21(6):669-70.
44. Gandolfi M, Geroin C, Imbalzano G, et al. Treatment of axial postural abnormalities in parkinsonism disorders: A systematic review of pharmacological, rehabilitative and surgical interventions. Clin Park Relat Disord. 2024 Mar 12;10:100240.
45. Abat LB, McLain RF, Bingaman W, et al. Spinal surgery in patients with Parkinson’s disease: construct failure and progressive deformity. Spine. 2004;29:2006-2012.
46. Herd CP, Tomlinson CL, Deane KH, et al. Comparison of speech and language therapy techniques for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002814.
47. Atalar MS, Oguz O, Genc G. Hypokinetic Dysarthria in Parkinson’s Disease: A Narrative Review. Sisli Etfal Hastan Tip Bul. 2023 Jun 20;57(2):163-170.
48. Herd CP, Tomlinson CL, Deane KH, et al. Speech and language therapy versus placebo or no intervention for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002812.
49. Ramig L, Halpern A, Spielman J, et al. Speech treatment in Parkinson’s disease: Randomized controlled trial (RCT). Mov Disord. 2018;33:1777.
47. Atalar MS, Oguz O, Genc G. Hypokinetic Dysarthria in Parkinson’s Disease: A Narrative Review. Sisli Etfal Hastan Tip Bul. 2023 Jun 20;57(2):163-170.
48. Herd CP, Tomlinson CL, Deane KH, et al. Speech and language therapy versus placebo or no intervention for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002812.
49. Ramig L, Halpern A, Spielman J, et al. Speech treatment in Parkinson’s disease: Randomized controlled trial (RCT). Mov Disord. 2018;33:1777.
50. Pu T, Huang M, Kong X, et al. Lee Silverman Voice Treatment to Improve Speech in Parkinson’s Disease: A Systemic Review and Meta-Analysis. Parkinsons Dis. 2021;2021:3366870.
51. Cosentino G, Avenali M, Schindler A, et al. A multinational consensus on dysphagia in Parkinson’s disease: screening, diagnosis, and prognostic value. J Neurol. 2022;269:1335.
Los trastornos de la deglución son un problema muy relevante en la EP, aunque muchas veces infradiagnosticados y muchas veces inadvertidos por los pacientes. Incluso en fases iniciales de la enfermedad, si se realizan estudios instrumentales, se evidencian alteraciones hasta en un 80% de los pacientes48. La edad, el tiempo de evolución de la enfermedad y la demencia son factores que de forma independiente incrementan el riesgo de disfagia. Es más frecuente en pacientes que requieren más LD y en el subtipo caracterizado por alteraciones de la marcha y el equilibrio precoces. Puede variar con las fluctuaciones y contribuir a la sialorrea. En fases avanzadas puede provocar dificultades en la administración del tratamiento oral, limitar las actividades sociales y aumenta el riesgo de desnutrición y deshidratación, así como de asfixias, neumonía por aspiración y muerte. La disfagia es el principal factor pronóstico de fallecimiento en las fases avanzadas de la enfermedad52.
En la EP se pueden afectar todas las fases de la deglución: elaboración del bolo, interferencias por movimientos anormales de la lengua (lingual pumping, lingual rocking), acúmulos de comida en la valécula y el seno piriforme, alteración de la relajación y menor apertura cricofaríngea, poca elevación del complejo hiolaríngeo, retraso en el cierre glótico, hipoestesia en estructuras laríngeas con menos reflejos protectores o alteraciones de la peristalsis esofágica. El reflejo tusígeno es muchas veces débil o incluso ausente53 (NE-II).
Su fisiopatología es compleja, relacionándose tanto con mecanismos dopaminérgicos como no dopaminérgicos (por ejemplo, asociados a la degeneración de núcleos colinérgicos del tronco). En estudios necrópsicos en enfermos con disfagia se han demostrado depósitos de α-sinucleína en axones sensitivos en la mucosa del tracto digestivo alto, así como en el nervio vago y en las uniones neuromusculares en los músculos faríngeos. También se han observado alteraciones en la musculatura lisa, de control autonómico52 (NE-II).
Un grupo de 38 expertos internacionales elaboraron en 2022 un consenso sobre el screening, el diagnóstico y el impacto de la disfagia en la EP en el pronóstico y en la calidad de vida52 (NE-IV). Realizaron una revisión sistemática de la literatura científica, tras la que se seleccionaron 85 publicaciones, la mayoría estudios tienen NE-IV.
Concluyeron que los datos en la historia que indican que debe realizarse un screening son aumento de la duración de las comidas, sensación de comida pegada, tos tras la ingesta, cambios en la voz tas deglutir (gorgoteo), atragantamiento, pérdida de peso, infecciones respiratorias frecuentes y babeo (estudios NE-I, III y IV y opinión de expertos)52 (NE-I). En esos casos debe realizarse un test de screening. En base a los estudios de clase III y IV y opinión de expertos se recomienda aplicar el test autoadministrado Swallowing Disturbance Questionnaire (SDQ), aunque hay otros que pueden ser considerados52 (NE-III).
Si el test de screening es positivo debería ser evaluado por un logofoniatra y realizarse pruebas instrumentales (estudios clase II, III y IV y opinión de expertos)52 (NE-II). El Water Swallow Test es fácil para detectar riesgo de aspiración, pero requiere que esté preservada la sensibilidad faríngea y el reflejo tusígeno.
Son dos las pruebas instrumentales que habitualmente se emplean para confirmar y analizar el diagnóstico de disfagia:
-
Fibroendoscopia de la deglución (FEES): permite la visualización directa de toda la superficie mucosa de la faringe y vestíbulo laríngeo, objetivando el posible residuo de secreciones o de alimentos y el riesgo de penetración/aspiración. No provoca radiación, pero no permite la valoración de la fase oral.
-
Videofluoroscopia (VFS): proporciona un registro funcional de todas las fases de la deglución. Es más Se utiliza material de contraste en diferentes volúmenes y consistencia.
Ambas detectan aspiración, penetración y residuo con similar sensibilidad y especificidad (NE-I, II, III y IV y opinión de expertos)52 (NE-I). Permiten valorar la eficacia de las modificaciones compensatorias de la dieta, posturas y maniobras deglutorias.
La gravedad de la disfagia se suele valorar con la escala Penetration-Aspiration Scale (PAS) que se puntúa desde 1 (no paso a vía aérea) a 8 (entra en la vía área, penetra bajo las cuerdas vocales y no se producen esfuerzos para expulsar el material).
En caso de síntomas esofágicos debe recomendarse la valoración por un gastroenterólogo52 (NE-IV).
Debe tenerse en cuenta el estado motor del paciente en el momento de aplicación de las pruebas, para poder interpretar adecuadamente los resultados. En general debe realizarse en on, salvo si hay discinesias axiales u oromandibulares52 (NE-IV).
La disfagia afecta la calidad de vida de los pacientes, condiciona restricciones dietéticas, interfiere con las relaciones sociales, asocia malestar, depresión, pérdida de autonomía y dificultad la para ingerir la medicación, con lo que eso conlleva.
En cuanto al tratamiento de la disfagia, a nivel farmacológico se debe optimizar la medicación dopaminérgica, aunque la respuesta sea parcial. La LD, la apomorfina y la rotigotina han demostrado su eficacia en algunos pacientes55 (NE-IV). Infiltraciones con toxina botulínica en el musculo cricofaríngeo pueden ser eficaces si hay un déficit de relajación del esfínter esofágico superior56 (NE-IV). En pacientes con EP avanzada es un síntoma que empeora durante los periodos off y que puede mejorar con optimización de medicación dopaminérgica. Se recomienda entonces en pacientes fluctuantes con este problema, realizar la ingesta durante los periodos on57.
Un grupo de expertos internacionales publicaron un consenso en 2021 sobre el tratamiento de la disfagia en la EP58. Realizaron una revisión de la literatura médica y finalmente analizaron 64 publicaciones de estudios principalmente (NE-IV).
El diseño del plan de tratamiento debe ser individualizado, en función de las alteraciones objetivadas en las pruebas, de los hábitos alimenticios, de la presencia o no de deterioro cognitivo y del soporte familiar.
Las terapias compensadoras para realizar una deglución más segura y eficiente (modificación del bolo, postura (por ejemplo, mentón hacía abajo), maniobras de deglución y estimulación sensitiva) tienen una eficacia inmediata58. La prueba de volumen-viscosidad determina la consistencia segura de los alimentos a ingerir y se debe perseguir también una palatabilidad adecuada.
Se ha constatado que espesar los líquidos reduce el riesgo de aspiración58 (NE-III), aunque no hay evidencia de que reduzca la incidencia de neumonía o muerte cuando se compara con la postura de bajar el mentón. El uso de la postura de bajar la barbilla hacia el pecho con líquidos poco espesos es menos eficaz en la prevención de la aspiración en comparación con utilizar líquidos espesos solos y no reduce eficazmente la incidencia de neumonía en las poblaciones con EP y demencia58. Respecto a la modificación de consistencias del bolo se necesita más investigación sobre el uso de espesantes de líquidos en relación con su efectividad en algunos tipos de disfagia.
Hay que hacer conocer al paciente y a la familia normas para una adecuada deglución: realizar la ingesta de los alimentos en situación on como comentábamos anteriormente, no forzarla y realizarla de modo atento, sin distractores, comer lentamente y en pequeñas cantidades, y asegurarse de vaciar la boca antes de ingerir de nuevo. Valorar y asesorar sobre la importancia de un buen estado nutricional.
Las terapias rehabilitadoras intentan modificar la fisiología y producir cambios a largo plazo. Requieren que el paciente no sufra demencia y sea colaborador. Hay pocas evidencias de que las terapias convencionales mejoren la disfagia en la EP (ejercicios de motricidad oral, ejercicios para potenciar la musculatura espiratoria…). Las evidencias de eficacia son muy discretas en el entrenamiento con biofeedback, entrenamiento de musculatura espiratoria, LSVT, neuroestimulación magnética y eléctrica transcutánea. Una nueva revisión sistemática y metaanálisis sobre los tratamientos de la disfagia en la EP ha sido publicado en 202357. Los autores concluyen que, pese a la escasez de estudios de alta calidad, los tratamientos estimuladores muestran beneficios significativos y a largo plazo (NE-I).
En ocasiones puede ser requerida la sonda nasogástrica provisional no solo para asegurar la nutrición sino para permitir la administración de fármacos. En fases avanzadas, cuando la disfagia es grave, se debe recomendar la gastrostomía. En caso de demencia no está indicada59 (NE-IV). Se debe tener en cuenta siempre la autonomía del paciente y fomentar la toma de decisiones previas, como la redacción de las voluntades anticipadas, antes de que se instaure un problema importante de comunicación o demencia que le impida formular sus decisiones. Se debe informar de las consecuencias negativas que tiene la no realización de la gastrostomía para alimentación, aunque no hay estudios sobre cambio de pronóstico o de calidad de vida60.

Bibliografía
48. Herd CP, Tomlinson CL, Deane KH, et al. Speech and language therapy versus placebo or no intervention for speech problems in Parkinson’s disease. Cochrane Database Syst Rev. 2012;8:CD002812.
52. Miller N. Swallowing in Parkinson’s disease: clinical issues and management. Neurodegener Dis Manag. 2017 Jun;7(3):205-217.
53. Kim YH, Oh BM, Jung IY, et al. Spatiotemporal characteristics of swallowing in Parkinson’s disease. Laryngoscope. 2015;125(2):389-95.
54. Suttrup I, Warnecke T. Dysphagia in Parkinson’s disease. Dysphagia 2016;31(1):24-32.
55. Mu L, Sobotka S, Chen J, et al. Arizona Parkinson’s Disease Consortium. Alpha-synuclein pathology and axonal degeneration of the peripheral motor nerves innervating pharyngeal muscles in Parkinson disease. J Neuropathol Exp Neurol. 2013;72(2):119-29.
56. Mu L, Chen J, Sobotka S, et al. Arizona Parkinson’s Disease Consortium. Alpha-Synuclein Pathology in Sensory Nerve Terminals of the Upper Aerodigestive Tract of Parkinson’s Disease Patients. Dysphagia. 2015;30(4):404-17.
57. Warnecke T, Suttrup I, Schröder JB, et al. Levodopa responsiveness of dysphagia in advanced Parkinson’s disease and reliability testing of the FEES-Levodopa-test. Parkinsonism Relat Disord. 2016 Jul;28:100-6.
58. Chang MC, Park JS, Lee BJ, et al. Effectiveness of pharmacologic treatment for dysphagia in Parkinson’s disease: a narrative review. Neurol Sci. 2021 Feb;42(2):513-519.
59. Schindler A, Pizzorni N, Cereda E, et al. Consensus on the treatment of dysphagia in Parkinson’s disease. J Neurol Sci. 2021;430:120008.
60. Cheng I, Sasegbon A, Hamdy S. Dysphagia treatments in Parkinson’s disease: a systematic review and meta-analysis. Neurogastroenterol Motil. 2023;35(8):e14517.
Frecuentación de los servicios de Urgencias
Las cinco principales causas de hospitalización de los pacientes con EP reflejadas en revisiones sistemáticas y en un estudio multicéntrico internacional fueron la cirugía electiva, caídas o fracturas, infecciones, trastornos psiquiátricos y neumonía aspirativa1,2 (NE-IV). En general, una limitación destacable son los escasos estudios sobre estos aspectos en los que se haya especificado cuáles fueron los criterios diagnósticos de inclusión utilizados en relación con la EP3 (NE-III) y escasos los que analizan separadamente los sexos; otros se centran en pacientes jóvenes con la EP, incluyen aspectos de impacto económico o carecen del grupo control que permita diferenciar lo atribuible a la edad de lo propio de la EP. En el estudio COPPADIS se ha visto que las caídas son un factor independiente predictor de ingreso hospitalario urgente4 (NE-II).
En los estudios con pacientes con EP y controles se observa un patrón de mayor frecuentación de los servicios de Urgencias, estimándose que el 16-45% de estos enfermos acuden al menos una vez al año3 (NE-III). También se observa un incremento de admisiones hospitalarias, en un rango de frecuencia de hospitalización entre el 7% y el 28% por año, entre 1,2 a 1,45 veces por encima de los controles. Por último, en la población de EP de edad avanzada se aprecia una prolongación de días de estancia, que se estima en torno a 2-14 días más de estancia, o unas 1,19-1,20 veces más que los controles3,5 (NE-III), reseñándose que los pacientes con EP tienen casi el doble de probabilidades de permanecer en el hospital más de tres meses (ratio 1,90; IC 95: 1,83, 1,97). Sin embargo, otros estudios no han mostrado diferencias entre las estancias hospitalarias6,7 (NE-III-IV) y discrepan entre las tasas de mortalidad7 (NE-IV). Las comorbilidades no agudas parecen contribuir a estas cifras; las causas más comúnmente implicadas son la patología de ojos y oídos (89%), psiquiátricas (68%), musculoesqueléticas (64%), gastrointestinales bajas (62%), respiratorias (60,5%), gastrointestinales altas (59,2%) y genitourinarias (53,9%). Respecto a la polifarmacia, hay una relación entre frecuentación de Urgencias y pacientes con EP mayores de 65 años consumidores de más de cinco fármacos5-7.
Este perfil de utilización de servicios sanitarios es multifactorial: se debe a factores propios de la enfermedad, a la comorbilidad o a los efectos directos del tratamiento antipsicótico y de la medicación dopaminérgica. Pero también por la falta de familiaridad con la EP entre el personal sanitario de Urgencias y en las salas de hospitalización no neurológica, o por los problemas relacionados con la medicación, que acontecen entre el 39 y el 89,9% de los pacientes con EP, fundamentalmente en los 2 primeros días1,2. En el área de Urgencias-Hospitalización se ha descrito tanto la interrupción de la medicación (5%) como cambios en la medicación parkinsoniana (29%), fallos en su administración (34%) que suponen que los pacientes no lleguen a recibir el 10% de las dosis prescritas1 (NE-IV), o un 3% de autoadministración; carencia de stock en Farmacia; horarios de prescripción alterados (61-79%), así como altas tasas de prescripción (7-40%) y administración (21-23%) de medicamentos antidopaminérgicos3,8 (NE-III), lo que supone el principal factor de riesgo para el deterioro de la función motora y la causa de la prolongación de las estancias hospitalarias.
Durante la primera visita al servicio de Urgencias o la primera hospitalización entre el 5% y el 21% de los pacientes con EP fueron diagnosticados como tales. Pero en el 80% de los casos el motivo de admisión al servicio de Urgencias no fue originado por el cuadro motor/no motor primario, sino por una comorbilidad no específica de la enfermedad6 (NE-III), aunque la psicosis sí fue la principal razón para las repetidas readmisiones1 (NE-IV). En relación con el género, en ambos sexos eran más frecuentes las infecciones, principalmente respiratorias, mientras que el traumatismo era significativamente mayor en varones6. En relación con la edad, en los pacientes menores de 40 años los motivos de admisión no diferían de los recogidos en los de edad avanzada, observándose también en este subgrupo que tanto la duración de la hospitalización como el número de diagnósticos al alta fueron mayores que en los controles. La mitad de los pacientes presentaron una complicación y un tercio más de una durante su ingreso, principalmente confusión seguida de infecciones. En cuanto a las especialidades más consultadas, fueron Cirugía (24%), Medicina Interna (22%), Traumatología (15%), Urología (13%) y Cardiología (11%)8 (NE-III).
Comorbilidad
Las comorbilidades agudas no específicas de la enfermedad representan el 80% de las causas de ingreso6. Entre ellas destacan:
-
Infecciones pulmonares y genitourinarias. La neumonía representa entre el 6 y el 14% de las causas de admisión y es la principal causa de muerte en pacientes con EP; se trata generalmente, salvo en pacientes institucionalizados previamente, de una neumonía de la Las infecciones pulmonares se ven favorecidas por la alteración de los mecanismos de la tos y por la enfermedad restrictiva pulmonar, condicionadas por la rigidez muscular y en ocasiones por alteraciones posturales, la medicación y la progresión de la propia enfermedad. También la disfunción orofaríngea y la laríngea incrementan el riesgo de neumonía aspirativa, que se produce entre el 2,4% y el 3,6% de los pacientes con EP frente al 1,0% de los controles, aconsejándose para prevenirlas medidas activas de fisioterapia pulmonar. Las infecciones genitourinarias originan entre el 9% y el 33% de las causas de admisión y muy frecuentemente se acompañan de delirio. Si se añaden otros problemas urológicos como hiperreflexia del detrusor, presente en el 70-90% de los pacientes, irritabilidad y obstrucción vesical, con prevalencia del 27-39%, o prostatitis, originan hasta el 20% de las admisiones en hombres6 (NE-III). Algunos pacientes perciben que los antibióticos en general pueden empeorar su movilidad, pero ninguno en particular ha sido específicamente implicado.
-
Síndrome confusional, delirio y encefalopatía. Se han descrito como motivo para la hospitalización la encefalopatía (7%) y el delirio (5-7%), aunque estas cifras varían según la ubicación geográfica de los centros, ya que en un estudio multinacional eran notificadas en el 6% de los centros estadounidenses frente al 38% en otros países1 (NE-IV). También la presencia de agitación, confusión e hipertermia fue observada en un 28% de los casos durante la hospitalización, interpretándose que era originada entre otras razones por la propia hospitalización, la infección intercurrente, los cambios de tratamiento, los efectos de la anestesia o en el contexto de una demencia preexistente. Los cuadros de encefalopatía en el contexto de un parkinsonismo hiperpirexia y el síndrome discinesia hiperpirexia se revisan en secciones posteriores de este capítulo.
-
Síncope e hipotensión. Representan el 4% de las causas de admisión, mientras que la hipotensión ortostática, que es muy común en la EP, se observa en aproximadamente el 11% de los pacientes durante la hospitalización5 (NE-IV).
-
Alteraciones gastrointestinales. Originan entre el 11 y el 15% de las razones de ingreso, destacando la oclusión intestinal (11%) sobre otras causas como disfagia (6%), hemorragia digestiva alta (3%), diarrea o vómitos (2%) o estreñimiento (2%)5 (NE-IV).
-
Urgencias cardiovasculares. Se han descrito como causa de ingreso en el 12% y son fundamentalmente por angina (6%), insuficiencia cardiaca (6%) e infarto de miocardio (2%), ictus o isquemia cerebral transitoria (2-4%), arritmia cardiaca (2%) y trombosis venosa profunda (1%)5 (NE-IV).
-
Comorbilidades relacionadas directamente con la EP. Solo representan entre el 15 y el 25% de las causas de ingreso3 (NE-III), y no solo corresponden a las complicaciones motoras, sino también a los síntomas psiquiátricos y sensoriales, disfunción autonómica, trastornos del sueño y efectos secundarios de los fármacos antiparkinsonianos. En general son debidas a complicaciones de las últimas etapas de la EP o a los propios tratamientos. Durante la hospitalización, entre una quinta parte y el 38% de todos los pacientes experimentan deterioro de síntomas motores de la EP, y se observa un empeoramiento de la rigidez (12%), temblor (9%), problemas de equilibrio (3%), bradicinesia (3%) y discinesias (8%), de tal forma que se ha descrito que al alta la función motora puede ser peor hasta en el 28% de los pacientes, con un incremento medio de más de 5 puntos en la UPDRS-III8 (NE-III). Dos de las grandes causas de ingreso relacionadas directamente con la EP son los trastornos neuropsiquiátricos y las caídas. De los trastornos neuropsiquiátricos cabe destacar que los cuadros psicóticos son el origen de ingreso en el 8-23% de los pacientes, aumentando hasta el 25% en pacientes jóvenes7 (NE-IV). La depresión, con una prevalencia del 30 al 40% en la EP, o la ansiedad, del 40%, pueden también requerir hospitalización. Todos los trastornos psíquicos descritos contribuyen a los síntomas motores de la EP, a las complicaciones motoras, a las dificultades de la marcha, a los episodios de congelación, a las fluctuaciones on-off, al deterioro cognitivo y a la discapacidad. En cuanto a las caídas, el 61% (35-90%) de pacientes incluidos en una revisión sistemática reciente sufrían al menos una caída, siendo recurrentes en al menos un 39% (18-65%). Las caídas representan en las distintas series un 13-14% de los motivos de consulta en Urgencias, mientras que la fractura de cadera es motivo de ingreso (aproximadamente el 4%) y se presenta con una frecuencia cuatro veces superior a lo esperable, particularmente en el estadio III de la clasificación de Hoehn y Yahr. El riesgo de caídas está aumentado en comparación con los controles debido a la inestabilidad postural, festinación de la marcha, freezing, debilidad de la musculatura de las piernas, alteración cognitiva e hipotensión ortostática8 (NE-III). Mientras que en las mujeres con EP la fractura es la principal causa de hospitalización, en los hombres, frente a controles, solo lo es el trauma en Las dos principales complicaciones a las que se enfrentan además estos pacientes durante la hospitalización son la neumonía y el delirio.
-
Uso de medicación concomitante en Urgencias. Con cierta frecuencia en los servicios de Urgencias se emplean fármacos que pueden empeorar el parkinsonismo. En general se trata de fármacos antidopaminérgicos que tienen otras indicaciones, como vómitos (metoclopramida) o vértigo (sulpirida), y cuyo uso debe evitarse al máximo en estos pacientes.

Bibliografía
1. Chou KL, Zamudio J, Schmidt P, et al. Hospitalization in Parkinson disease: a survey of National Parkinson Foundation Centers. Parkinsonism Relat Disord. 2011;17:440-5.
2. Skelly R, Brown L, Fakis A, et al. Hospitalization in Parkinson’s disease: a survey of UK neurologists, geriatricians and Parkinson’s disease nurse specialists. Parkinsonism Relat Disord. 2015; 21(3):277-81.
3. Oliver HH, Gerlach OH, Winogrodzka A, et al. Clinical problems in the hospitalized Parkinson’s disease patient: systematic review. Mov Disord. 2011;26:197-208.
4. Santos García D, de Deus Fonticoba T, Cores C, et al.; COPPADIS Study Group. Falls Predict Acute Hospitalization in Parkinson’s Disease. J Parkinsons Dis. 2023;13:105-124.
5. Woodford H, Walker R. Emergency hospital admissions in idiopathic Parkinson’s disease. Mov Disord. 2005;20:1104-8.
6. Braga M, Pederzoli M, Antonini A, et al. Reasons for hospitalization in Parkinson’s disease: a case-control study. Parkinsonism Relat Disord. 2014;20:488-92.
7. Aminoff MJ, Christine CW, Friedman JH, et al. Management of the hospitalized patient with Parkinson’s disease: Current state of the field and need for guidelines. Parkinsonism Relat Disord 2011;17:139-45.
8. Gerlach OH, Broen MP, van Domburg PH, et al. Deterioration of Parkinson’s disease during hospitalization: survey of 684 patients. BMC Neurol. 2012;12:13.
La principal causa de parkinsonismo de rápida instauración es la exposición a fármacos bloqueantes dopaminérgicos. La situación más extrema tras la exposición a los mismos es el síndrome neuroléptico maligno (SNM), pero también han de tenerse en cuenta otros síndromes importantes inducidos por fármacos como el síndrome parkinsonismo-hiperpirexia, el síndrome discinesia-hiperpirexia, el síndrome serotoninérgico y otras causas de parkinsonismo agudo9,10 (NE-IV).
Síndrome neuroléptico maligno (SMN)
El SNM es una complicación grave del tratamiento con neurolépticos que puede surgir hasta en el 0,2% de los pacientes que los toman, independientemente de la dosis usada, ya que se trata de un problema idiosincrásico11,12 (NE-IV). Aunque la mayoría de los casos son provocados por neurolépticos, también se ha descrito con el uso de otros fármacos bloqueantes o deplecionadores dopaminérgicos (metoclopramida, prometazina).
Los factores de riesgo para su aparición son deshidratación, cansancio o agotamiento, agitación, escalado abrupto de la dosis del fármaco causante, uso de formulaciones depot, sexo masculino, pacientes jóvenes, uso concomitante de litio e inhibidores de la recaptación de serotonina (ISRS), altas temperaturas, presencia de síndromes parkinsonianos y el haber tenido previamente SNM. Puede prevenirse su aparición instaurando los tratamientos antidopaminérgicos de forma paulatina, con incrementos de dosis escalonados11,12.
Suele iniciarse en torno a la semana (3-10 días) de haber instaurado o incrementado la dosis del fármaco causal, la clínica se desarrolla en horas, con un incremento en la gravedad a lo largo de los 2-3 primeros días y permanece durante 1-2 semanas. El cuadro clínico consiste en fiebre, rigidez, alteración del estado mental, disfunción autonómica y otros trastornos del movimiento como temblor, distonía y mioclonías. Además, se acompaña de alteraciones de laboratorio que incluyen leucocitosis, aumento de creatina cinasa (CK), alteración de las pruebas de función hepática y renal y de la coagulación, acidosis metabólica y alteraciones electrolíticas; por otra parte, los reactantes de fase aguda pueden estar disminuidos11,12 (NE-IV).
El cuadro clínico puede verse complicado, a veces de forma irreversible, con la presencia de fracaso renal debido a la rabdomiólisis, el fallo respiratorio o la neumonía por aspiración, así como por otras complicaciones secundarias a la inmovilidad, como la trombosis venosa profunda, el tromboembolismo pulmonar o las úlceras por presión. Todo ello condiciona una situación de gravedad con una mortalidad que puede llegar al 20-30%11,12 (NE-IV).
Existen unos criterios diagnósticos mayores (fiebre, rigidez y aumento de CK) y unos menores (taquicardia, presión arterial anómala, taquipnea, alteración del nivel de consciencia, diaforesis y leucocitosis). La presencia de los tres criterios mayores, o dos mayores y cuatro menores permite establecer con una alta probabilidad el diagnóstico de SNM en el contexto clínico apropiado11,12 (NE-IV). El diagnóstico diferencial más importante debe realizarse con el síndrome serotoninérgico, la hipertermia maligna y la catatonía11,12 (NE-IV).
No existen ensayos clínicos prospectivos aleatorizados respecto al tratamiento del SNM. El tratamiento consiste en la supresión inmediata del agente causal, el uso de medidas de soporte vital, fármacos dopaminérgicos y relajantes musculares, así como el manejo de las complicaciones. Clásicamente se ha usado bromocriptina (habitualmente 2,5 mg/8 horas, máximo 60 mg/día), si bien cualquier agente dopaminérgico puede ser eficaz. Por otra parte, el dantroleno (entre 2-3 mg/kg/8 horas hasta un máximo de 10 mg/kg/día), un relajante muscular inespecífico, puede usarse para disminuir la rigidez muscular y minimizar la rabdomiólisis en los casos más graves o que no respondan bien al agente dopaminérgico. Este tratamiento debe mantenerse al menos 7-10 días, teniendo en cuenta la vida media del agente causal, y debe esperarse al menos 2 semanas desde la resolución del cuadro para reintroducir, siempre de forma lenta, el tratamiento neuroléptico11,12 (NE-IV).
Síndrome parkinsonismo-hiperpirexia
Se trata de un síndrome prácticamente indistinguible del SNM, salvo por que ocurre en pacientes ya diagnosticados de parkinsonismo. Tiene lugar cuando a estos pacientes se les retira o reduce de forma abrupta la medicación dopaminérgica. Clásicamente ocurría cuando se realizaban vacaciones de LD, y si bien actualmente esta situación ya no se da, sí se puede observar este síndrome en el contexto de cambios terapéuticos agresivos en relación con cirugía de estimulación cerebral profunda (ECP) en pacientes con EP, en caso de falta de cumplimiento terapéutico o en relación con ingresos hospitalarios por otras patologías cuando no se respeta la pauta dopaminérgica previa. Igualmente se han comunicado casos tras disfunción de estimuladores cerebrales profundos o agotamientos de la batería de estos. Es posible que el SNM, el parkinsonismo-hiperpirexia y la crisis acinética y la acinesia aguda sean el espectro de un mismo síndrome13 (NE-IV).
Puede verse precipitado por la presencia de factores como deshidratación, infecciones y alteraciones metabólicas. Cursa con hipertermia, disautonomía, alteración del nivel de consciencia, rigidez intensa y aumento de CK, y puede complicarse con los mismos procesos que el SNM (trombosis venosa, tromboembolismo pulmonar, neumonía por aspiración, fallo renal)13 (NE-IV).
El tratamiento consiste en medidas de soporte; es fundamental la hidratación, junto con la restitución del tratamiento dopaminérgico. Puede usarse dantroleno en caso necesario. En un pequeño ensayo aleatorizado encontraron que el uso de dosis altas de metilprednisolona intravenosa era eficaz como tratamiento complementario para reducir el tiempo de recuperación9 (NE-IV).
Síndrome discinesia-hiperpirexia
Se caracteriza por la aparición de discinesias graves que llevan al agotamiento muscular, rabdomiólisis, hipertermia y confusión mental en pacientes parkinsonianos9,10 (NE-IV).
Comparte ciertas características con el síndrome parkinsonismo-hiperpirexia, salvo que predominan las discinesias frente a la rigidez y el tratamiento consiste en la reducción cautelosa de fármacos dopaminérgicos en vez del aumento necesario en el síndrome parkinsonismo-hiperpirexia. Este cuadro puede favorecerse por las altas temperaturas y hay algún reporte anecdótico de su prevención con estimulación dopaminérgica continua14 (NE-IV).
Síndrome serotoninérgico
Se trata de un síndrome ocasionado por un incremento rápido en la actividad biológica de la serotonina, usualmente causado por cualquier fármaco que incremente la transmisión serotoninérgica. Actualmente aparece en pacientes que toman dos o más fármacos con esta acción (Tabla I), habitualmente a dosis terapéuticas. El síndrome serotoninérgico se debe a una toxicidad farmacológica, no es un fenómeno idiosincrásico12,15 (NE-IV).
Muchas de sus manifestaciones clínicas se solapan con las del SNM; sin embargo, el síndrome serotoninérgico presenta como características clínicas diferenciales mioclonías, hiperreflexia, crisis y alteraciones del estado de ánimo en forma de inquietud o ánimo exaltado. El inicio del cuadro suele ser agudo, tras la introducción o aumento del agente causal, aunque a veces hay casos de curso insidioso o recurrentes, con aparición de cambios sutiles en el rendimiento cognitivo, trastornos de conducta y temblor que duran de días a semanas antes de la aparición del cuadro florido.

Diferenciar entre síndrome serotoninérgico y SNM puede resultar dificultoso: aunque a priori los agentes causales son diferentes, en la práctica clínica los pacientes con frecuencia pueden estar en tratamiento con ambas familias de fármacos. Los hallazgos clínicos más importantes para realizar esta diferenciación son la hiperreflexia, frecuentemente en forma de clonías de predominio en miembros inferiores, el clono ocular y el temblor en el síndrome serotoninérgico, mientras que en el SNM el hallazgo es la presencia de un síndrome bradicinético-rígido con hiporreflexia12,15 (NE-IV).
El tratamiento consiste en la supresión del agente causal, medidas de soporte y, en casos graves, ciproheptadina. La ciproheptadina es un antihistamínico y un antagonista de la serotonina que debe pautarse en dosis divididas hasta un máximo de 32 mg/ día. Por otra parte, es necesario tratar algunas manifestaciones clínicas y complicaciones (crisis, arritmias, coagulopatía, hipertermia, etc.). El pronóstico puede ir desde una resolución rápida y completa hasta ser potencialmente fatal (rango de mortalidad entre el 2,4% y el 12%)12,15 (NE-IV).
Parkinsonismo agudo
La aparición de forma aguda o subaguda de un cuadro parkinsoniano entraña un amplio diagnóstico diferencial (Tabla II)9,10 (NE-IV). Cuando este se desarrolla en cuestión de días o incluso semanas siempre debe considerarse la posibilidad de una causa secundaria, entre las que merece especial atención la lista de fármacos.
El empeoramiento agudo de los síntomas motores en la EP no relacionado con la progresión de la enfermedad habitualmente tiene lugar por una enfermedad intercurrente, típicamente una infección del tracto urinario o respiratorio, o por alteraciones metabólicas o neurológicas añadidas.
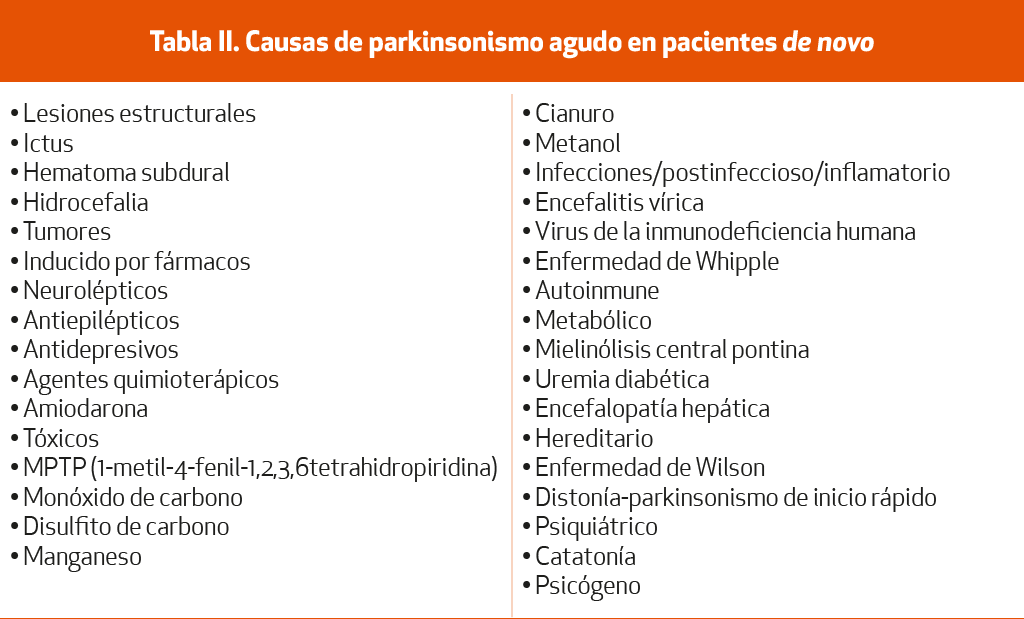
El tratamiento debe ir encaminado a la causa responsable. En todo caso los agentes dopaminérgicos son de elección, y en caso de alteración de la deglución se usarán vías alternativas a la oral como la transdérmica (rotigotina) o subcutánea (apomorfina)9,10 (NE-IV). Existe algún reporte anecdótico del uso de perfusiones intravenosas de fármacos dopaminérgicos para pacientes que no pueden tolerar medicación oral16 (NE-IV).
Bibliografía
9. Robottom BJ, Weiner WJ, Factor SA. Movement disorders emergencies. Part 1: Hypokinetic disorders. Arch Neurol. 2011;68:567-72.
10. Munhoz RP, Scorr LM, Factor SA. Movement disorders emergencies. Curr Opin Neurol. 2015;28:406-12.
11. Tse L, Barr AM, Scarapicchia V, et al. Neuroleptic Malignant Syndrome: A review from clinically oriented perspective. Curr Neuropharmacol. 2015;13:395-406.
12. Perry PJ, Wilborn CA. Serotonin syndrome vs neuroleptic malignant syndrome: a contrast of causes, diagnosis, and management. Ann Clin Psychiatry. 2012;24:155-62.
13. Onofrj M, Thomas A. Acute akinesia in Parkinson disease. Neurology. 2005;64:1162-9.
14. Herreros-Rodríguez J, Sánchez-Ferro Á. Summertime Dyskinesia-Hyperpyrexia Syndrome: The “Dual Heat” Hypothesis. Clin Neuropharmacol. 2016;39(4):210-1.
15. Boyer EW, Shannon M. The serotonin syndrome. N Engl J Med. 2005 Mar 17;352(11):1112- 20. Erratum in: N Engl J Med. 2007 Jun 7;356(23):2437. Erratum in: N Engl J Med. 2009 Oct 22;361(17):1714.
16. Mizuno J, Kato S, Watada M, Morita S. [Perioperative management of a patient with Parkinson’s disease with intravenous infusion of levodopa]. Masui. 2009;58(10):1286-9.
Urgencias relacionadas con el procedimiento quirúrgico
-
Hemorragias (intraventricular, subdural, epidural, subaracnoidea, intracerebral). La frecuencia es del 0,6-3,3%. Se deben al daño de vasos sanguíneos por el microrregistro (MER) o por los electrodos El diagnóstico se realiza mediante TC craneal. En cuanto al tratamiento, requiere el ingreso en la UCI y medidas conservadoras de soporte vital en la mayoría de los casos17 (NE-IV).
-
Infarto venoso. Debido al daño de venas corticales en el contexto de edema y hemorragia que condiciona estasis venosa e hipertensión17 (NE-IV).
-
Edema perielectrodo de características idiopáticas. Puede ocurrir en 1 o en los 2 electrodos, e interferir en los efectos de la estimulación, modificando el volumen de activación, sobre todo en los primeros días tras el encendido del generador de pulsos. En ocasiones, sobre todo cuando es sintomático, requiere la administración de corticoides intravenosos u orales y, habitualmente, se retrasa el inicio de la terapia17 (NE-IV).
-
Tormenta discinética. Ocurre sobre todo en pacientes con graves discinesias en el periodo Se debe al MER, la localización de la cánula o la localización del electrodo en la porción sensitivo-motora del núcleo subtalámico (NST). Su aparición indica buen pronóstico. Solo en casos muy extremos con presencia de discinesias y rabdomiólisis puede requerir sedación con propofol intravenoso17 (NE-IV).
-
Alteración comportamental y trastornos cognitivos en el posoperatorio precoz. La incidencia de confusión es del 5%. Estas urgencias están relacionadas sobre todo con la cirugía del núcleo subtalámico, el tratamiento con anticolinérgicos (para la EP o la incontinencia urinaria) y la edad. Se debe siempre hacer un cribado de las posibles causas tratables (infección del tracto urinario, hemorragia, fármacos). La alteración cursa con alucinaciones y delirios. Se debe manejar como una emergencia, con cribado de las posibles causas orgánicas (TC craneal, bioquímica completa) y el tratamiento será el de la causa responsable y/o neurolépticos atípicos (quetiapina/clozapina)17,18 (NE-IV).
-
Intento de suicidio. No queda del todo claro si la ECP aumenta el riesgo de suicidio o este es equivalente al que presentan los pacientes con EP. Se ha visto asociado a la existencia de intentos de suicidio previos, presencia de trastornos del control de impulsos, desregulación dopaminérgica, depresión y apatía posoperatorias y pacientes Por tanto, es muy importante la evaluación neuropsicológica y psiquiátrica preoperatoria. Los pacientes deben ser ingresados para recibir un abordaje multidisciplinar (terapia cognitivo-conductual, terapia psicológica, ajuste del estimulador y tratamiento médico)17 (NE-IV).
-
Infarto agudo de miocardio. Es importante la revisión preoperatoria de la comorbilidad médica. Los pacientes en tratamiento con antidepresivos tricíclicos tienen mayor riesgo con la anestesia general. La incidencia de angina y arritmias tras la ECP es del 0,3%17,18 (NE-IV).
-
Embolismo aéreo. Su incidencia es del 3%. Se debe a la entrada de aire al sistema venoso; por ello deben cubrirse con cera los bordes del trépano e irrigarse bien el campo quirúrgico durante todo el procedimiento17,18 (NE-IV).
Urgencias relacionadas con el hardware
-
Infección. La incidencia de infección y erosión es del 0,15-2%. El tratamiento puede requerir la retirada urgente del sistema y el cultivo del aspirado del bolsillo del generador de impulsos Es muy importante la prevención prequirúrgica y posquirúrgica con tratamiento antibiótico. También se puede realizar instilación local con tratamiento antibiótico antiestafilocócico (neomicina o polimixina) sobre la herida quirúrgica. Según la afectación, se valorará el tratamiento conservador frente a la retirada del hardware, y dependiendo de si el electrodo está afectado o no se procederá a la retirada parcial (solo el generador) o total (generador, extensión y electrodo). Habrá que esperar 6-8 semanas como mínimo para valorar el reimplante17-20 (NE-IV).
-
Malfuncionamiento. La pérdida repentina de funcionamiento puede ser debida a fractura de electrodo, rotura de la extensión, fallo del generador o manipulación del generador por parte del paciente. Se debe hacer una medición de impedancias y examinar el sistema mediante imagen de cráneo y cuello en dos proyecciones, y de no encontrar solución de continuidad se han de medir impedancias en el quirófano17 (NE-IV).
-
Migración del electrodo. Se debe al malfuncionamiento de los dispositivos de anclaje, al crecimiento del cráneo o a movimientos vigorosos cefálicos. Ante la sospecha de migración del electrodo se ha de realizar una prueba de imagen, probar a cambiar los contactos activos y revisión quirúrgica si precisa. Se debe tener cuidado con la posibilidad de extensión de la corriente a áreas vecinas y los consiguientes posibles efectos secundarios, que en algunos casos pueden mejorar con el ajuste de la programación de modo temporal18 (NE-IV).
-
Mala localización del electrodo. Se debe al fallo del sistema que asegura el electrodo, el desplazamiento cerebral intraoperatorio (por pérdida de líquido cefalorraquídeo) o error en la planificación. Ante una baja relación efecto terapéutico/ efectos adversos se ha de realizar prueba de imagen posoperatoria para verificar la localización del electrodo17 (NE-IV).
Urgencias relacionadas con la estimulación 21-23
-
Síntomas motores. Pueden aparecer discinesias, corea, balismo, trastorno de la marcha, disartria e hipofonía. La mayoría mejoran con estrategias de reprogramación21 (NE-IV).
-
Síntomas no motores. Incluyen parestesias, alteración del comportamiento, problemas cognitivos, síntomas pseudobulbares, depresión y manía. Se deben a la irradiación de corriente a áreas asociativas y límbicas. Requieren estrategias de reprogramación o ajustes de medicación. En casos graves (sobre todo ante depresión y manía) pueden requerir ingreso hospitalario con verificación de la localización del electrodo, reprogramación o ajuste de la medicación. Siempre se debe adoptar un abordaje multidisciplinar22 (NE-IV).
-
Apagado accidental del sistema. Puede ocurrir en presencia de determinados detonantes ambientales (congelador magnético, cajas fuertes muy potentes). Con el propio controlador del paciente se puede revisar la condición de estimulación y revertir a modo on. Se deben evitar campos magnéticos potentes21 (NE-IV).
-
Rebote de sintomatología preoperatoria o síndrome de retirada de la estimulación. Puede ocurrir al finalizar la batería del generador. La posibilidad de que ocurra rebote es mayor cuanto más beneficiosa haya sido la terapia, mayor la edad del paciente y los años de evolución de la enfermedad. Se puede producir rebote o empeoramiento rápido de síntomas motores y no motores. Son muy importantes las revisiones periódicas del generador así como el recambio de este previo a su completa finalización, ya que puede llegar a suponer en algunos casos una urgencia vital, al no responder a dosis mayores de LD21,22 (NE-IV).
Otras urgencias: tormenta distónica
Se suele desencadenar por infecciones, traumatismos o intervenciones quirúrgicas. La primera medida es el tratamiento oral (pimozida, risperidona, olanzapina, haloperidol, tetrabenacina, trihexifenidilo). De no ser eficaz, se debe pasar a formulación intravenosa, intratecal y sedación (midazolam, propofol)21 (NE-IV).
El paciente ha de ser ingresado en la UCI para vigilar el compromiso respiratorio, la hipertermia, la deshidratación, la rabdomiólisis y la insuficiencia renal. De no conseguir mejoría sintomática con las medidas anteriores, se ha de considerar la cirugía mediante ECP del globo pálido interno tras la persistencia de los síntomas durante semanas o meses21-24 (NE-IV).
El nivel de evidencia científica disponible relacionado con las urgencias relacionadas con el procedimiento quirúrgico es NE-IV, siendo por tanto D el grado de recomendación ofrecida.
Bibliografía
17. Morishita T, Foote KD, Burdick AP, et al. Identification and management of deep brain stimulation intra and postoperative urgencies and emergencies. Parkinsonism Relat Disord. 2010;16:153-62.
18. Bronstein JM, Tagliati M, Alterman RL, et al. Deep brain stimulation for Parkinson disease: an expert consensus and review of key issues. Arch Neurol. 2011;68:165-71.
19. Sillay KA, Larson PS, Starr PA. Deep brain stimulator hardware-related infections: incidence and management in a large series. Neurosurgery. 2008;62:360-6; discussion: 366-7.
20. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
21. Grimaldi S, Eusebio A, Carron R, et al. Deep Brain Stimulation-Withdrawal Syndrome in Parkinson’s Disease: Risk Factors and Pathophysiological Hypotheses of a Life-Threatening Emergency. Neuromodulation. 2023;26(2):424–34.
22. Simonet C, Tolosa E, Camara A, et al. Emergencies and critical issues in Parkinson’s disease. Pract Neurol. 2020;20(1):15-25.
23. Cossu G, Sensi M. Deep Brain Stimulation Emergencies: How the New Technologies Could Modify the Current Scenario. Curr Neurol Neurosci Rep. 2017;17(7):51.
24. Allen NM, Lin JP, Lynch T, et al. Status dystonicus: a practice guide. Develop Med Child Neurol. 2014;56:105-12.
Urgencias relacionadas con las perfusiones intestinales de levodopa
El porcentaje de complicaciones por el tratamiento con perfusión intestinal de LD (LD / carbidopa o LD / carbidopa / entacapona intestinal en gel) es alto en las distintas series22,25-27 (NE-I), aunque la mayoría de las complicaciones son leves y tienen una incidencia especialmente alta la primera semana tras el inicio del tratamiento. Además, la mayoría de las complicaciones y las más graves están relacionadas fundamentalmente con el procedimiento endoscópico.
Urgencias relacionadas con el procedimiento quirúrgico
El tratamiento con perfusión intestinal de LD conlleva la realización de gastrostomía endoscópica percutánea para la colocación de una sonda interna a nivel duodenal y una sonda externa que conecte con la bomba de perfusión. Dicho procedimiento es el que ocasiona las complicaciones y por tanto los motivos de consulta a Urgencias más graves relacionados con este tipo de terapia. Entre ellos cabe destacar neumoperitoneo (7%), peritonitis (1%) y neumonía aspirativa (2%)25-27 (NE-I). En general, se suelen solventar con medidas conservadoras y antibioterapia y rara vez suelen conllevar la retirada del dispositivo.
Otras complicaciones dentro de este grupo más banales y que no suelen ser motivo frecuente de consulta en Urgencias son el dolor abdominal, dolor orofaríngeo, estreñimiento, flatulencia y enrojecimiento a nivel del estoma. Aunque tienen una alta incidencia en las distintas series26,27 (NE-I), suelen ser leves y autolimitadas.
Urgencias relacionadas con el sistema de perfusión
Los motivos de urgencias vinculados al propio sistema de perfusión suelen incluir la obstrucción de la sonda interna (9%), la migración de la misma, especialmente hacia el estómago (17%), la rotura de las conexiones o de la propia sonda interna (5%) y el fallo en la bomba de perfusión (6%). Si alguna de estas complicaciones sucede es aconsejable parar la bomba de perfusión y reintroducir tratamiento dopaminérgico oral a la espera de poder resolverse26,27 (NE-I).
Uno de los motivos más frecuentes de consulta urgente en pacientes con perfusión intestinal de LD lo constituyen las infecciones periestomales, las cuales suelen ser locales y leves y rara vez provocan celulitis extensa o abscesos a nivel de la pared abdominal28 (NE-II). Ante la sospecha de infección periestomal, debe tratarse de entrada con antibioterapia empírica, realizándose cultivo y antibiograma del exudado simultáneamente para conocer el germen patógeno responsable y la adecuada sensibilidad del mismo a los distintos antibióticos. De esta manera se garantiza la resolución de la infección o se modifica la pauta antibiótica de inicio si fuera necesario. Dado que esta terapia conlleva de forma permanente la colocación de una sonda externa, no es infrecuente la colonización e infección del sistema por Pseudomonas28 (NE-II). Para la prevención de infecciones periestomales es fundamental la adecuada higiene y limpieza de la piel y de la estoma.
También los granulomas a nivel del estoma suponen un motivo de consulta en Urgencias28, dado que suelen sangrar espontáneamente o con el roce, y esto constituye un motivo de alarma para los pacientes. No obstante, los granulomas a nivel del estoma no suponen una urgencia en sí misma y deben tratarse con la aplicación de nitrato de plata una vez al día hasta su resolución. Es frecuente la recidiva (NE-IV).
Urgencias relacionadas con la medicación dopaminérgica
Este grupo de urgencias son las propias de cualquier paciente con EP que se encuentre en tratamiento con LD. Aunque la forma de administración de la LD a través de la perfusión intestinal continua a modo de gel aumenta claramente la biodisponibilidad del fármaco, la incidencia de este tipo de complicaciones es similar a la observada en pacientes que se encuentran en tratamiento con LD oral22,25 (NE-II).
Dentro de los motivos de consulta a Urgencias en este grupo cabe destacar los siguientes: discinesias, psicosis, alucinaciones e hipotensión ortostática20,23. Este tipo de complicaciones suelen conllevar el ajuste individualizado del tratamiento dopaminérgico. Se han documentado casos esporádicos de polineuropatía aguda en pacientes en tratamiento con perfusión intestinal de LD, aunque se desconoce el posible papel del tratamiento en la fisiopatología del cuadro clínico28 (NE-II).
Urgencias relacionadas con la perfusión subcutánea de apomorfina
Los motivos de consulta a Urgencias en pacientes con EP en tratamiento con perfusión subcutánea de apomorfina están relacionados especialmente con los efectos secundarios que pueda ocasionar el fármaco en sí mismo y no con la vía de administración22,29 (NE-IV). Dentro de estos se incluirían los siguientes:
-
Hipotensión, que suele ser leve y rara vez constituye motivo de consulta a Urgencias. Suele ser manejada con medidas no farmacológicas, tales como aumento en la ingesta de sal y líquidos, medias compresivas, etc. En ocasiones es necesario ajustes de otras terapias como antihipertensivos, controlar la dosis del fármaco o incluso utilizar medicaciones que ayuden a elevar la tensión arterial como la midodrina, la piridostigmina o la fludrocortisona, entre otras.
-
Los síntomas neuropsiquiátricos como psicosis, alucinaciones o confusión suelen ser leves e infrecuentes, pero hasta en un 10% de los casos pueden ser graves y por tanto constituir motivo de consulta a Urgencias29 (NE-IV). Otros síntomas neuropsiquiátricos como el trastorno del control de impulsos, el punding o el síndrome de desregulación dopaminérgica pueden ocurrir como con cualquier otro agonista dopaminérgico.
-
Las náuseas intensas que constituyan un motivo de consulta a Urgencias son infrecuentes y puede controlarse con domperidona o trimetobenzamida antes del inicio del tratamiento con perfusión subcutánea de apomorfina29.
-
La anemia hemolítica constituye un proceso potencialmente grave e idiosincrático en pacientes en tratamiento con Aunque su incidencia es baja, menor al 1%, es preciso conocerlo por su gravedad29 (NE-IV).
-
El síndrome eosinofílico es también una complicación muy infrecuente y rara vez suele ocasionar manifestaciones graves como daño hepático o cardiaco. Su aparición conlleva la retirada del tratamiento con apomorfina29 (NE-IV).
Dentro de las complicaciones propias de la vía de administración de la apomorfina, se encuentra la aparición de nódulos subcutáneos en los puntos de perfusión. Esta complicación no suele constituir un motivo de consulta a Urgencias, a pesar de tener alta incidencia en pacientes en tratamiento con perfusión de apomorfina. Su manejo y resolución representan la clave para poder mantener el tratamiento a largo plazo. Es fundamental prevenir su aparición con medidas conservadoras, tales como rotación en el punto de perfusión, adecuada higiene de la piel, uso de parches de silicona, agujas de Teflon®, etc. Una vez que aparecen los nódulos, la aplicación de ultrasonidos constituye el único tratamiento efectivo29 (NE-IV). Los nódulos subcutáneos no van a ser una causa de visita a urgencias, sin embargo, sí puede serlo la celulitis, que podría requerir un tratamiento antibiótico urgente.
Urgencias relacionadas con la perfusión de pLD/pCD
Las perfusiones de pLD/pCD se han introducido recientemente y la experiencia es limitada. Ambos compuestos de la solución se trasforman en LD y carbidopa respectivamente, los efectos adversos están relacionados con los propios de la LD, y no es esperable que los pacientes acudan a Urgencias. Las salvedades serían los síndromes confusionales y trastornos neuropsiquiátricos, ya comentados anteriormente. El manejo sería rebajar las dosis de LD perfundida, ajustar las horas de perfusión, o ambas. Es imprescindible que lo realice un neurólogo experto30 (NE-IV).
La otra posible complicación, al igual que con la perfusión de apomorfina, la aparición de nódulos subcutáneos hasta en un cuarto de los pacientes. El manejo sería el mismo que para la apomorfina30 (NE-IV).
Bibliografía
20. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20:5-15.
22. Simonet C, Tolosa E, Camara A, et al. Emergencies and critical issues in Parkinson’s disease. Pract Neurol. 2020;20(1):15-25.
23. Cossu G, Sensi M. Deep Brain Stimulation Emergencies: How the New Technologies Could Modify the Current Scenario. Curr Neurol Neurosci Rep. 2017;17(7):51.
24. Allen NM, Lin JP, Lynch T, et al. Status dystonicus: a practice guide. Develop Med Child Neurol. 2014;56:105-12.
25. Slevin JT, Fernández HH, Zadikoff C, et al. Long-term safety and maintenance of blind pivotal study in advanced Parkinson’s disease patients. J Parkinsons Dis. 2015;5:165-74.
26. Olanow CW, Kieburtz K, Odin P, et al. Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson’s disease: a randomised, controlled, double-blind, doble-dummy study. Lancet Neurol. 2014;13:141-9.
27. Fernández HH, Standaert DG, Hauser RA, et al. Levodopa-Carbidopa intestinal gel in advanced Parkinson’s disease: final 12 month, open-label results. Mov Disord. 2015;30:500-9.
28. Nyholm D. Duodopa treatment for advanced Parkinson’s disease: a review of efficacy and safety. Parkinsonism Relat Dis. 2012;18:916-29.
29. Trenkwalder C, Chaudhuri KR, García Ruiz PJ, et al. Expert consensus group report on the use of apomorphine in the treatment of Parkinson´s disease Clinical practice recommendations. Parkinsonism Relat Dis. 2015;21:1023-30.
30. Fung VSC, Aldred J, Arroyo MP, et al. Continuous subcutaneous foslevodopa/foscarbidopa infusion for the treatment of motor fluctuations in Parkinson’s disease: Considerations for initiation and maintenance. Clin Park Relat Disord. 2024;10:100239.
Se debe destacar en primer lugar que los pacientes con EP deben ser sometidos a cirugía si está indicada. Esta aseveración se da por sentada en casos de cirugía urgente, pero también debe ser evidente en las cirugías electivas. Sin embargo, es frecuente que en diferentes ámbitos quirúrgicos se rechace a los candidatos con EP, porque pese más el temor a las posibles complicaciones que la obtención de beneficio del paciente. Es innegable que la EP es compleja y su abordaje perioperatorio debe tener en cuenta todos sus síntomas, motores y no motores, así como las posibles interacciones farmacológicas. Con una planificación adecuada y un abordaje multidisciplinar (equipos de Cirugía, Neurología, Enfermería, Nutrición y Fisioterapia) se pueden anticipar las complicaciones, prevenir la morbimortalidad nosocomial, disminuir los tiempos de ingreso y mejorar la tasa de éxito quirúrgico. El objetivo de este apartado es dar unas pautas claras para el manejo del paciente con EP antes, durante y después de la cirugía31.
Manejo preoperatorio
-
Si el paciente estuviera tomando un IMAO-B como selegilina, rasagilina o safinamida, este se debe suspender 2-3 semanas antes de la intervención por su posible interacción con algunos opioides31 (NE-IV).
-
Si el paciente está tomando un anticolinérgico (trihexifenidilo), también se debe suspender por su posible interacción con otros fármacos y precipitación de un síndrome confusional31 (NE-IV).
-
Si el paciente presenta sialorrea, se puede infiltrar con toxina botulínica en las glándulas parótidas para disminuir la salivación y así reducir el riesgo de broncoaspiración perioperatoria32 (NE-IV).
-
Desde el momento del ingreso se debe continuar con la medicación habitual (salvo el IMAO suspendido) según el régimen que el paciente tomaba en Esta directriz, aparentemente tan sencilla, es muy difícil de cumplir en el ambiente hospitalario. En los estudios de manejo prequirúrgico, los errores de tratamiento reportados oscilan entre el 30% y el 71%33 (NE-I). Los errores más frecuentes son de prescripción (por ejemplo, cambio de horario), el retraso de las tomas e incluso la omisión de alguna. Se debe concienciar a todo el equipo médico y de enfermería de la importancia del seguimiento estricto del tratamiento pautado, respetando su horario, ya que se ha demostrado que los errores de tratamiento prolongan de forma significativa la estancia hospitalaria33. Por tanto, la recomendación es realizar todas las tomas de medicación, hasta las 6 horas habituales de ayunas antes de la cirugía. Si el paciente está en tratamiento con LD (vida media de 1,5 horas), dependiendo de la gravedad de su enfermedad se pueden administrar 100-250 mg de LD (con una cucharada de agua o gelatina) con la premedicación 1 hora antes de la cirugía (NE-IV).
-
Si el paciente tiene una enfermedad muy avanzada y requiere tomas de LD frecuentes o va a estar a dieta absoluta durante más de 12-24 horas, se deben considerar tratamientos alternativos a la vía No solo porque el cese abrupto del tratamiento antiparkinsoniano durante más de 24 horas puede ser potencialmente mortal, ya que se puede desencadenar un síndrome de parkinsonismo-hiperpirexia, como se ha descrito previamente (sus síntomas principales son fiebre, disautonomía, alteración del nivel de consciencia o confusión, acinesia, rigidez y elevación de CK), sino para permitir la mejor movilidad y comodidad del paciente. Si el paciente tiene una enfermedad leve-moderada, la mejor opción es la rotigotina, un agonista dopaminérgico que tiene un formato de parche transdérmico de 24 horas de duración. Se debe calcular la dosis que precisa el paciente según las equivalencias conocidas33 (ver calculadora de equivalentes de LD en Pág. 375). Se debe vigilar la aparición de efectos secundarios frecuentes como el eccema cutáneo en la región del parche, náuseas y somnolencia33 (NE-IV).
-
Si el paciente tiene una enfermedad más avanzada, requiere altas dosis de LD (más de 1000 mg) o va a precisar dieta absoluta de forma prolongada, se puede considerar un tratamiento alternativo con apomorfina en perfusión continua. Este agonista dopaminérgico tiene un perfil de actividad similar a la LD (actúa sobre los receptores D1/D2) y puede pautarse en forma de perfusión subcutánea calculando las dosis (ver calculadora de equivalentes de LD en Pág. 375). Este cambio se debe prever con tiempo, ya que la apomorfina puede causar náuseas y vómitos que son evitables con premedicación (domperidona a dosis de 10 mg en desayuno, comida y cena desde 3 días antes). Se debe hacer el cambio de la medicación oral a la perfusión subcutánea la semana previa a la cirugía para optimizar el control de los síntomas y vigilar la posible aparición de hipotensión, somnolencia o ataques de sueño33 (NE-IV).
Manejo intraoperatorio31,32 (NE-IV)
-
El propofol es el fármaco de elección. Puede mejorar el parkinsonismo, pero también inducir discinesias.
-
Se debe evitar la ketamina porque puede provocar una respuesta simpática Se debe evitar el tiopental porque puede reducir la liberación de dopamina a nivel estriatal.
-
Se debe evitar el halotano porque puede interaccionar con la LD y aumentar la sensibilidad cardiaca a las catecolaminas.
-
Los relajantes musculares no despolarizantes son seguros y el rocuronio es de elección.
-
Se deben evitar fármacos con efectos serotoninérgicos en pacientes que toman IMAO (si no se han podido suspender en las semanas previas), ya que la interacción puede producir agitación, rigidez, diaforesis, hiperpirexia e incluso un síndrome serotoninérgico y de manera infrecuente la Algunos opioides con actividad inhibitoria sobre la recaptación de serotonina son la meperidina y en menor medida el tramadol, la metadona, el dextrometorfano y el propoxifeno. Los opioides más seguros son la morfina a dosis bajas, la codeína, la oxicodona y la buprenorfina. A su vez, los IMAO inhiben el metabolismo hepático de los narcóticos, por lo cual se debe ajustar la dosis.
-
En el manejo del dolor, los opioides, y en particular el fentanilo, pueden empeorar la Si el origen del dolor es la rigidez parkinsoniana el mejor tratamiento será el propio de la enfermedad.
-
Los neurolépticos como las fenotiacinas, las butirofenonas y la metoclopramida pueden empeorar la EP y por tanto no deben emplearse nunca en estos pacientes.
-
La indicación de intubación es más frecuente en pacientes con EP que en la población de edad similar porque la disfagia y la bradicinesia de la musculatura respiratoria les hace especialmente vulnerables a sufrir neumonías por broncoaspiración.
-
Si el paciente fuera portador de un neuroestimulador, es recomendable apagar el estimulador durante el procedimiento quirúrgico porque puede interferir con el bisturí eléctrico. Si se debe electrocauterizar, se recomienda la cauterización bipolar.
Manejo posoperatorio
-
La mayoría de las complicaciones perioperatorias de los pacientes con EP ocurren durante el posoperatorio. Por su enfermedad basal, estos pacientes tienen mayor riesgo de presentar alteraciones motoras, disautonómicas y cognitivas. Los problemas posquirúrgicos más frecuentes son las infecciones (del tracto urinario, de la herida quirúrgica o pulmonares), el síndrome confusional, la hipotensión, las caídas y el mal control de la EP. Se deben anticipar estas complicaciones y considerar aspectos particulares del enfermo parkinsoniano para su mejor manejo (Tabla III)32 (NE-IV).
-
Como se ha señalado con anterioridad, es prioritario que el paciente reciba su medicación antiparkinsoniana lo antes posible tras la cirugía. Para ello, se debe evaluar periódicamente su nivel de consciencia y su capacidad de ingesta oral. Si la vía oral no es posible en las primeras horas del posoperatorio, se debe valorar el poner una sonda nasogástrica para medicación o administrar la medicación antiparkinsoniana por vía transdérmica o subcutánea31 (NE-IV).
-
Se debe comenzar la fisioterapia respiratoria de forma precoz para evitar infecciones respiratorias, la inmovilidad, las contracturas, las trombosis y el estreñimiento31 (NE-IV).
-
El síndrome confusional es frecuente, incluso en pacientes sin deterioro cognitivo previo, y puede ocurrir de forma diferida tras 36 horas de la cirugía en hasta un 70% de los pacientes33. Generalmente se trata de un cuadro de alteración del ritmo sueño-vigilia, acompañado de alucinaciones o delirio y agitación. Como en todo paciente, se debe hacer un estudio para detectar la posible causa (alteraciones metabólicas, infecciones intercurrentes o interacciones medicamentosas). En su manejo son importantes las medidas no farmacológicas (entrada de luz natural, reloj visible, acompañamiento de familiares) y se deben evitar los neurolépticos típicos (haloperidol) y la mayoría de los atípicos (risperidona, olanzapina, aripriprazol, ziprasidona). El uso de estos fármacos empeora el pronóstico de estos pacientes30. En la práctica general, el neuroléptico más utilizado es la quetiapina, porque tiene poco efecto sobre el receptor D2 y por tanto no agrava el parkinsonismo y no precisa monitorización. Sin embargo, si pese a dosis altas (200 mg) no se controla el cuadro confusional, se debe recurrir a la clozapina, ya que es el único fármaco que verdaderamente ha demostrado eficacia en el control de los síntomas psicóticos34 (NE-IV). La agranulocitosis como posible efecto secundario es muy poco frecuente (0,38%) y en el contexto hospitalario la realización de hemogramas seriados semanales las primeras 18 semanas y mensuales después es relativamente En el uso de ambos fármacos se deben tener en cuenta sus posibles efectos secundarios, fundamentalmente la hipotensión y la somnolencia. Se pueden utilizar benzodiacepinas para el insomnio a dosis bajas teniendo en cuenta la posibilidad de depresión respiratoria secundaria31 (NE-IV).
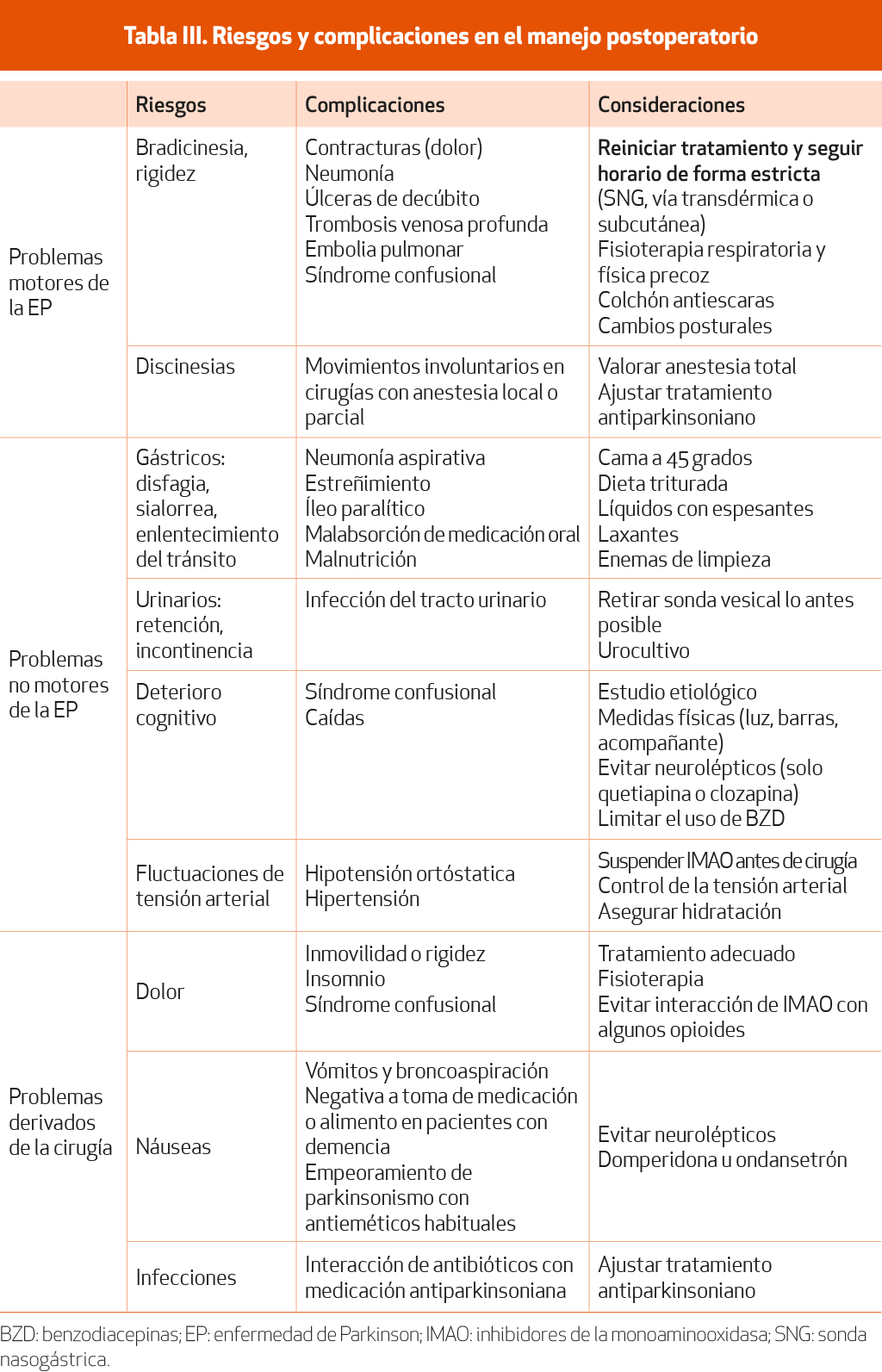

Bibliografía
30. Fung VSC, Aldred J, Arroyo MP, et al. Continuous subcutaneous foslevodopa/foscarbidopa infusion for the treatment of motor fluctuations in Parkinson’s disease: Considerations for initiation and maintenance. Clin Park Relat Disord. 2024;10:100239.
31. Mariscal A, Medrano IH, Alonso-Cánovas A, et al. Manejo perioperatorio de la enfermedad de Parkinson. Neurologia. 2012;27:46-50.
32. Katus L, Shtilbans A. Perioperative management of patients with Parkinson’s disease. Am J Med. 2014;127:275-80.
33. Gerlach OH, Winogrodzka A, Weber WE. Clinical problems in the hospitalized Parkinson’s disease patient: systematic review. Mov Disord. 2011;26:197-208.
34. Seppi K, Weintraub D, Coelho M, et al. The Movement Disorder Society Evidence-Based Medicine Review Update: Treatments for the non-motor symptoms of Parkinson’s disease. Mov Disord. 2011;26 Suppl 3:S42-80.
En las tres últimas décadas el ejercicio físico (EF) ha ganado progresivamente relevancia como estrategia terapéutica y preventiva en la EP. Sus beneficios generales, motores y no motores, y su potencial efecto positivo sobre la progresión de la enfermedad ha ido permeando las decisiones clínicas. En la actualidad, se considera el ejercicio físico una parte fundamental del tratamiento integral de la EP1-4 (NE-III).
Algunos de los mecanismos de acción potenciales del EF y en especial del ejercicio aeróbico (EA) han sido estudiados tanto en animales de experimentación como en humanos e incluyen la liberación de hormonas neurotróficas, especialmente el factor neurotrófico derivado del cerebro (BDNF), la potenciación de diversos mecanismos de neuroplasticidad y la protección frente a neurotoxinas. Además, el EF practicado de forma regular en edades medias de la vida se asocia con mayor volumen del córtex e hipocampo, menor patología de sustancia blanca y menor riesgo de desarrollar EP1,3 (NE-III).
Hay numerosos metaanálisis (MA) y revisiones sistemáticas (RS) que concluyen que la mayoría de los tipos de EF son beneficiosos: disminuyen la gravedad de los síntomas motores (SM) y mejoran el equilibrio, la movilidad y la calidad de vida (CV)5-9 (NE-I). Sin embargo, el uso de terminología diferente que intercambia con frecuencia conceptos como EF, fisioterapia (FT) y actividad física (AF) junto con la heterogeneidad de las intervenciones en cuanto a frecuencia, intensidad, tipo y duración (FITT) hace difícil generar recomendaciones concretas sobre la prescripción en la práctica clínica habitual basándose en un nivel alto de evidencia10 (NE-IV).
Bibliografía
1. Ahlskog JE. Aeróbic Exercise: Evidence for a Direct Brain Effect to Slow Parkinson Disease Progression. Mayo Clin Proc. 2018;93(3):360-372.
2. Alberts JL, Rosenfeldt AB. The Universal Prescription for Parkinson’s Disease: Exercise. J Parkinsons Dis. 2020;10(s1):S21-7.
3. García Ruiz PJ, Luquin Piudo R, Martínez Castrillo JC. On Disease Modifying and Neuroprotective Treatments for Parkinson’s Disease: Physical Exercise. Front Neurol. 2022;13:938686.
4. Corcos DM, Lamotte G, Luthra NS, et al. Advice to People with Parkinson’s in My Clinic: Exercise. J Parkinsons Dis. 2024;14(3):609-617.
5. Radder DLM, Lígia Silva de Lima A, et al. Physiotherapy in Parkinson’s Disease: A Meta-Analysis of Present Treatment Modalities. Neurorehabil Neural Repair. 2020;34(10):871-880.
6. Padilha C, Souza R, Grossl FS, et al. Physical exercise and its effects on people with Parkinson’s disease: Umbrella review. PLoS One. 2023;18(11):e0293826.
7. Ernst M, Folkerts AK, Gollan R, et al. Physical exercise for people with Parkinson’s disease: a systematic review and network meta-analysis. Cochrane Database Syst Rev. 2023;1(1):CD013856.
8. Li H, Cao C, Li Y. Self-directed physical activity interventions for motor symptoms and quality of life in early and mid-stage Parkinson’s disease: A systematic review and meta-analysis. Arch Gerontol Geriatr. 2024;116:105159.
9. Lorenzo-García P, Núñez de Arenas-Arroyo S, Cavero-Redondo I, et al. Physical Exercise Interventions on Quality of Life in Parkinson Disease: A Network Meta-analysis. J Neurol Phys Ther. 2023;47(2):64-74.
10. Bouça-Machado R, Rosário A, Caldeira D, et al. Physical Activity, Exercise, and Physiotherapy in Parkinson’s Disease: Defining the Concepts. Mov Disord Clin Pract. 2019;7(1):7-15.
El EF se define como “la subcategoría de la actividad física que es planeada, estructurada y realizada de forma repetitiva con el propósito primario de mejorar o mantener la forma física, el rendimiento físico o la salud”. La FT es “una intervención terapéutica no farmacológica que usa una aproximación centrada en el paciente con el propósito de restaurar y maximizar la cualidad del movimiento y la independencia funcional”. El EF es un componente fundamental en los programas de FT10. A continuación, se revisan las principales modalidades de EF y FT que han demostrado beneficio en la EP.
Ejercicio aeróbico
El EA se considera en la actualidad un componente fundamental en la prescripción especialmente estadios precoces. El EA de intensidad moderada-alta (moderada se considera alcanzar 60-75% de la frecuencia cardiaca máxima [FCM] y alta el 75-85% de la FCM), mejora el consumo de oxígeno, reduce la gravedad de los SM y mejora diversos parámetros funcionales como la marcha, el equilibrio y algunas actividades de la vida diaria (AVD)5,6,11 (NE-I). 2 rigurosos ensayos de fase 2, controlados y aleatorizados (RCT), compararon el efecto de la intervención durante 6 meses de un grupo activo que practicó EA de moderada-alta intensidad, como correr en cinta o bicicleta estática, con un grupo de control. Ambos estudios analizaron los pacientes en estadio temprano y calcularon su puntuación en la escala MDS-UPRS III en off. Los dos estudios encontraron un menor incremento de la subescala motora en el grupo que practicó el EA con respecto al grupo de control, sugiriendo una diferencia en la progresión de la EP12,13 (NE-I). Uno de los estudios observó mejoría en la conectividad funcional del putamen anterior con el córtex sensitivo-motor y menor grado de atrofia cerebral global; esto sugiere un potencial efecto modificador del EA sobre los mecanismos de neurodegeneración subyacentes14 (NE-I). Hay 2 RCT de fase 3 en marcha para determinar los efectos a largo plazo del EA de moderada-alta intensidad en el enlentecimiento de la progresión de la EP en estadios leves-moderados15,16 (NE-I).
Ejercicio de resistencia progresiva
Mientras que el EA se asocia un efecto modificador de la EP, el ejercicio de resistencia (ER) se relaciona con el mantenimiento de la movilidad a través del incremento de la fuerza y potencia muscular y con una mejoría de la capacidad funcional, del equilibrio y de la calidad de vida11,17,18 (NE-I).
Ejercicios de flexibilidad
Los ejercicios de flexibilidad mejoran el rango de movilidad articular y ayudan a potenciar la estabilidad postural y equilibrio, en particular cuando se combina con el ER. En la terapia física se ha utilizado como parte del entrenamiento multimodal o como intervención en los grupos control de los RCT10,11 (NE-IV).
Ejercicios neuromotores (ENM) o multimodales
Se incluyen aquellos ejercicios que entrenan distintas habilidades motoras, como el equilibrio, la coordinación, la marcha, la agilidad y la propiocepción. Incluye actividades como taichí, pilates, yoga, qigong, baile, entrenamiento acuático, tenis de mesa, marcha nórdica, el ejercicio guiado por videojuegos (exergaming) y la realidad virtual. Se han observado efectos positivos en la función motora, la prevención de caídas, la movilidad, la marcha, la flexibilidad y, sobre todo, el equilibrio5,6,9 (NE-I).
El taichí incluye el cambio de peso rítmico, movimientos controlados hasta los límites de estabilidad, pasos armonizados y giros. Un MA reportó sus beneficios a corto plazo sobre SM, el equilibrio, la marcha y la movilidad19 (NE-I). Un estudio de cohortes reciente, con seguimiento durante 3 años y medio a 145 participantes que practicaron una rutina regular de taichí (60 minutos, 2 veces por semana) y 187 controles, encontró mejorías en el grupo activo en cuanto a puntuaciones en la escala UPDRS-III, el equilibrio, la velocidad de la marcha (ver capítulo 10, pag. 251) y una menor dosis equivalente de LD20 (NE-II) En la actualidad, el taichí es uno de los ejercicios de referencia para mejorar y prevenir el déficit de equilibrio.
La terapia basada en baile ha sido ampliamente investigada por sus potenciales beneficios físicos y cognitivos. El estilo más estudiado ha sido el tango, donde se han comunicado beneficios en el equilibrio, la marcha (ver capítulo 10, pag. 251), puntuaciones en la escala UPDRS-III y CV21,22 (NE-I).
La marcha nórdica (MN) es una modalidad de ejercicio asequible, segura, relativamente fácil de aprender y que ha demostrado una alta adherencia en personas con enfermedades crónicas. Varios estudios en EP han demostrado sus efectos positivos sobre SM y SNM, movilidad funcional, CV, equilibrio y marcha. Además, parece ser superior a la marcha libre (ML) en parámetros de locomoción y CV. Sin embargo, un MA que incluyó 12 estudios concluyó que ninguno de los beneficios observados en los mismos fue clínicamente significativo, exceptuando la capacidad para caminar. Los autores inciden en que su superioridad sobre la ML es incierta y que no está exenta de efectos adversos en pacientes con EP, por lo que recomiendan cautela en su prescripción. Hay en marcha un RCT en el que se compararán los dos grupos de marcha y se analizarán sus efectos sobre la asimetría y amplitud del braceo y otros ítems como medidas temporoespaciales, movilidad funcional y CV23,24(NE-I).
Ejercicios de equilibrio y marcha
Los entrenamientos de equilibrio multimodal han demostrado reducir la frecuencia de caídas, la tasa de sujetos que sufren una o más caídas, y las lesiones asociadas a estas hasta 12 meses después de la intervención25,26 (NE-I).
En otro MA donde se analizaron los beneficios de distintas intervenciones en la mejoría del equilibrio postural, se concluyó que las tres modalidades superiores fueron el exergaming, el baile y el entrenamiento del equilibrio con estímulos auditivos rítmicos27 (NE-I).
Los entrenamientos de marcha con cinta o asistidos por robot han resultado eficaces en diversos parámetros como la velocidad, la longitud del paso y la capacidad de la marcha (ver capítulo 10, pag. 251)28,29 (NE-I).
Los trastornos de la marcha y el equilibrio en la EP se exacerban en situaciones que requieren condiciones de doble tarea (ejecución simultánea de una tarea motora y cognitiva), que incluye múltiples AVD. Los entrenamientos con doble tarea pueden mejorar el equilibro y la marcha30 (NE-I).
Se han ensayado diversas estrategias de FT para el bloqueo de la marcha (FOG). Los programas de FT prolongados (> 4 meses), centrados en el entrenamiento del equilibrio y la marcha con claves externas podrían ser eficaces31 (NE-I). Un RCT que analizó como clave externa el efecto de la música no alcanzó significación estadística en el FOG32 (NE-I). El mayor problema con el entrenamiento y los trucos para el FOG es que requieren un proceso constante con una atención mantenida, y esto no siempre es posible.
La eficacia de las nuevas tecnologías sobre equilibrio, marcha y FOG, como el exergaming con gafas de realidad aumentada requieren investigación adicional28,33 (NE-IV). Se puede revisar el tratamiento farmacológico del FoG en el Capítulo 10 (pág. 251).
Eficacia del EF sobre síntomas no motores
Dos RS concluyeron que el EF es eficaz en mejorar la cognición global, y en menor medida las funciones ejecutivas. El protocolo óptimo no está estandarizado, pero la evidencia acumulada infiere como más beneficiosas las sesiones de 60 minutos, al menos 3 veces por semana, de programas de ejercicio combinado, incluido un componente aeróbico34,35 (NE-I). Se ha asociado también el EF con la reducción de sintomatología depresiva, con la mejoría en la calidad del sueño y la fatiga36-38 (NE-I).
Prescripción del ejercicio en la consulta
A falta de estudios más específicos para determinar los parámetros FITT, en pacientes con EP en estadios precoces sin fragilidad ni problemas de equilibrio debería sugerirse una combinación de EA de alta intensidad combinado con ER y ENM. Es importante mantener un nivel de intensidad moderado-alto, que puede monitorizarse mediante la FCM (60-85%). En pacientes más ancianos o con signos de fragilidad, el énfasis debería hacerse en ER, combinados con menor frecuencia con EA y ENM; para aquellos pacientes con problemas de equilibrio y riesgo alto de caídas, debería predominar el ENM junto con FT. La duración recomendada es un mínimo de 150 minutos por semana, con una duración mínima de cada sesión de 30 minutos4 (NE-IV).
El uso de nuevas tecnologías también puede ser de gran ayuda. Las aplicaciones de salud y los sensores de los teléfonos móviles o de los relojes inteligentes permiten aumentar la motivación y mejorar la adherencia, controlar el tiempo de actividad, planificar objetivos y permitir una monitorización remota39 (NE-IV).
También es recomendable contar con fisioterapeuta de apoyo que pueda responder a cuestiones online, y programar a distancia los ejercicios de un grupo de pacientes (NE-IV).

Bibliografía
4. Corcos DM, Lamotte G, Luthra NS, et al. Advice to People with Parkinson’s in My Clinic: Exercise. J Parkinsons Dis. 2024;14(3):609-617.
5. Radder DLM, Lígia Silva de Lima A, et al. Physiotherapy in Parkinson’s Disease: A Meta-Analysis of Present Treatment Modalities. Neurorehabil Neural Repair. 2020;34(10):871-880.
6. Padilha C, Souza R, Grossl FS, et al. Physical exercise and its effects on people with Parkinson’s disease: Umbrella review. PLoS One. 2023;18(11):e0293826.
9. Lorenzo-García P, Núñez de Arenas-Arroyo S, Cavero-Redondo I, et al. Physical Exercise Interventions on Quality of Life in Parkinson Disease: A Network Meta-analysis. J Neurol Phys Ther. 2023;47(2):64-74.
10. Bouça-Machado R, Rosário A, Caldeira D, et al. Physical Activity, Exercise, and Physiotherapy in Parkinson’s Disease: Defining the Concepts. Mov Disord Clin Pract. 2019;7(1):7-15.
11. Osborne JA, Botkin R, Colon-Semenza C, et al. Physical Therapist Management of Parkinson Disease: A Clinical Practice Guideline From the American Physical Therapy Association. Phys Ther. 2022;102(4):pzab302. Erratum in: Phys Ther. 2022 Aug 1;102(8).
12. Van der Kolk NM, de Vries NM, Kessels RPC, et al. Effectiveness of home-based and remotely supervised aeróbic exercise in Parkinson’s disease: a double-blind, randomised controlled trial. Lancet Neurol. 2019;18(11):998-1008.
13. Schenkman M, Moore CG, Kohrt WM, et al. Effect of High-Intensity Treadmill Exercise on Motor Symptoms in Patients With De Novo Parkinson Disease: A Phase 2 Randomized Clinical Trial. JAMA Neurol. 2018;75(2):219-226.
14. Johansson ME, Cameron IGM, Van der Kolk NM, et al. Aeróbic Exercise Alters Brain Function and Structure in Parkinson’s Disease: A Randomized Controlled Trial. Ann Neurol. 2022;91(2):203-216.
15. Alberts JL, Rosenfeldt AB, López-Lennon C, et al. Effectiveness of a Long-Term, Home-Based Aeróbic Exercise Intervention on Slowing the Progression of Parkinson Disease: Design of the Cyclical Lower Extremity Exercise for Parkinson Disease II (CYCLE-II) Study. Phys Ther. 2021;101(11):pzab191.
16. Patterson CG, Joslin E, Gil AB, et al; SPARX3-PSG Investigators. Study in Parkinson’s disease of exercise phase 3 (SPARX3): study protocol for a randomized controlled trial. Trials. 2022;23(1):855.
17. Gamborg M, Hvid LG, Dalgas U, et al. Parkinson’s disease and intensive exercise therapy - An updated systematic review and meta-analysis. Acta Neurol Scand. 2022;145(5):504-528.
18. Lorenzo-García P, Cavero-Redondo I, Núñez de Arenas-Arroyo S, et al. Effects of physical exercise interventions on balance, postural stability and general mobility in Parkinson’s disease: a network meta-analysis. J Rehabil Med. 2024;56:jrm10329.
19. Ni X, Liu S, Lu F, Shi X, et al. Efficacy and safety of Tai Chi for Parkinson’s disease: a systematic review and meta-analysis of randomized controlled trials. PLoS One. 2014;9(6):e99377.
20. Li G, Huang P, Cui S, et al. Effect of long-term Tai Chi training on Parkinson’s disease: a 3.5-year follow-up cohort study. J Neurol Neurosurg Psychiatry. 2024;95(3):222-228.
21. Tang L, Fang Y, Yin J. The effects of exercise interventions on Parkinson’s disease: A Bayesian network meta-analysis. J Clin Neurosci. 2019;70:47-54.
22. Carapellotti AM, Stevenson R, Doumas M. The efficacy of dance for improving motor impairments, non-motor symptoms, and quality of life in Parkinson’s disease: A systematic review and meta-analysis. PLoS One. 2020;15(8):e0236820.
23. Salse-Batán J, Sánchez-Lastra MA, Suárez-Iglesias D, et al. Effects of Nordic walking in people with Parkinson’s disease: A systematic review and meta-analysis. Health Soc Care Community. 2022;30(5):e1505-e1520.
24. Espinoza-Araneda J, Caparros-Manosalva C, da Cunha M, et al. Nordic walking and arm swing asymmetry in people with Parkinson’s disease: protocol for a randomised clinical trial. BMJ Open Sport Exerc Med. 2024 May 27;10(2):e002029.
25. Allen NE, Canning CG, Almeida LRS, et al. Interventions for preventing falls in Parkinson’s disease. Cochrane Database Syst Rev. 2022;6(6):CD011574.
26. Wong-Yu ISK, Mak MKY. Multisystem Balance Training Reduces Injurious Fall Risk in Parkinson Disease: A Randomized Trial. Am J Phys Med Rehabil. 2019;98(3):239-244.
27. Wang D, Cui WJ, Hou ZH, et al. Effectiveness of different exercises in improving postural balance among Parkinson’s disease patients: a systematic review and network meta-analysis. Front Aging Neurosci. 2023;15:1215495.
28. Mak MK, Wong-Yu IS, Shen X, et al. Long-term effects of exercise and physical therapy in people with Parkinson disease. Nat Rev Neurol. 2017;13(11):689-703.
29. Alwardat M, Etoom M, Al Dajah S, et al. Effectiveness of robot-assisted gait training on motor impairments in people with Parkinson’s disease: a systematic review and meta-analysis. Int J Rehabil Res. 2018;41(4):287-296.
30. García-López H, de los Ángeles Castillo-Pintor M, Castro-Sánchez AM, et al. Efficacy of Dual-Task Training in Patients with Parkinson’s Disease: A Systematic Review with Meta-Analysis. Mov Disord Clin Pract. 2023;10(9):1268-1284.
31. Cosentino C, Baccini M, Putzolu M, et al. Effectiveness of Physiotherapy on Freezing of Gait in Parkinson’s Disease: A Systematic Review and Meta-Analyses. Mov Disord. 2020;35(4):523-536.
32. Li KP, Zhang ZQ, Zhou ZL, et al. Effect of music-based movement therapy on the freezing of gait in patients with Parkinson’s disease: A randomized controlled trial. Front Aging Neurosci. 2022;14:924784.
33. Hardeman LES, Geerse DJ, Hoogendoorn EM, et al. Remotely prescribed and monitored home-based gait-and-balance therapeutic exergaming using augmented reality (AR) glasses: protocol for a clinical feasibility study in people with Parkinson’s disease. Pilot Feasibility Stud. 2024;10(1):54.
34. Kim R, Lee TL, Lee H, et al. Effects of physical exercise interventions on cognitive function in Parkinson’s disease: An updated systematic review and meta-analysis of randomized controlled trials. Parkinsonism Relat Disord. 2023;117:105908.
35. Da Silva FC, Iop RDR, de Oliveira LC, et al. Effects of physical exercise programs on cognitive function in Parkinson’s disease patients: A systematic review of randomized controlled trials of the last 10 years. PLoS One. 2018;13(2):e0193113.
36. Feller D, Fox I, Gozzer P, et al. Exercise for Depressive Symptoms in Parkinson Disease: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Arch Phys Med Rehabil. 2023;104(2):331-339.
37. Cristini J, Weiss M, de las Heras B, et al. The effects of exercise on sleep quality in persons with Parkinson’s disease: A systematic review with meta-analysis. Sleep Med Rev. 2021;55:101384.
38. Folkerts AK, Nielsen J, Gollan R, et al. Physical Exercise as a Potential Treatment for Fatigue in Parkinson’s Disease? A Systematic Review and Meta-Analysis of Pharmacological and Non-Pharmacological Interventions. J Parkinsons Dis. 2023;13(5):659-679.
39. Schootemeijer S, van der Kolk NM, Ellis T, et al. Barriers and Motivators to Engage in Exercise for Persons with Parkinson’s Disease. J
La terapia ocupacional (TO) es una disciplina en el ámbito sanitario que, a través de actividades individualizadas, previene la enfermedad, favorece la recuperación funcional y, en los casos en los que esto no sea posible, trata de lograr la mayor independencia del individuo con las dificultades que tenga. Con frecuencia es una actividad integrada en programas de rehabilitación multidisciplinar, por lo que resulta complejo su análisis individualizado. En el caso concreto de la EP, su objetivo principal es lograr la mayor independencia del individuo en las actividades de la vida diaria1 (NE-IV).
Es importante remarcar que es difícil extraer recomendaciones de tratamiento a partir de los estudios, EC y MA actuales. Existe una amplia variedad en el enfoque de las intervenciones, una gran heterogeneidad de estas en cuanto a la frecuencia, la dosis y la duración.
La terapia ocupacional ha demostrado tener un impacto en la calidad de vida a corto y medio plazo en pacientes con EP2 (NE-I). Integrada en un programa de rehabilitación intensivo multidisciplinario, mejora las actividades de la vida diaria (AVD) y el rendimiento en el sueño3 (NE-I). El impacto de la TO sobre la calidad de vida de los pacientes con EP es menor si se realiza de forma ambulatoria3 y las evidencias son débiles cuando se realiza en el ámbito domiciliario, ya que, en este caso, depende en mayor medida de la capacidad de adaptar el protocolo a la persona, del entorno y de las competencias profesionales del terapeuta3. Recientemente se está desarrollando el uso de la telemedicina, que en el ámbito de la TO ya ha demostrado ser un sistema válido para evaluar el estado de las AVD y la función de la mano. Dos estudios recientes han mostrado utilidad del uso de videojuegos y de la realidad virtual4 (NE-I) para mejorar distintas funcionalidades de la mano más afecta, como son: el alcance y agarre, la función sensorial discriminatoria, la propiocepción de la muñeca, la destreza manual grosera y la destreza manual fina5 (NE-IV).
En 2021 Foster et al.6 realizaron una revisión sistemática de intervenciones dentro de la TO y su implicación en las AVD en pacientes con EP. Se analizaron 22 estudios (9 con un NE-I, 9 con un NE-II y 4 con un NE-III). Se compararon 4 tipos diferentes de intervención: la actividad física, la intervención específica en actividades instrumentales (en concreto la escritura y la adherencia a la medicación), la rehabilitación cognitiva y la terapia ocupacional individualizada. El beneficio de estas intervenciones fue superior para la terapia centrada en actividad física y para tareas instrumentales específicas como la escritura; moderado para la adherencia a la medicación y bajo para la rehabilitación cognitiva (NE-I). Recientemente, otra revisión sistemática de 18 estudios mostró un efecto positivo pequeño en cuanto a la mejora en la destreza de la mano con baja evidencia de efectos sobre la escritura8 (NE-I).
En cuanto a la modalidad de terapia, existe una gran heterogeneidad en las formas de intervención que incluyen fundamentalmente: diversos tipos de actividad física y el uso de estímulos o dispositivos específicos para AVD4 (NE-I).
A nivel de actividad física, la revisión sistemática realizada por Foster et al.7 (NE-I) de 55 trabajos (42 con NE-II y 13 con NE-III) sugiere que el entrenamiento motor simple (entrenamiento motor sin estímulos o ayudas externas y sin finalidades concretas) mejora las funciones motoras, con escasa evidencia de que el ejercicio intenso aporte un beneficio adicional a corto plazo. Existe también un beneficio de los programas motores sobre el control postural y equilibrio, si bien la duración de este impacto es dudosa. Por otra parte, la terapia motora con actividades complejas y de carácter instrumental, como la higiene o ingestas, podría tener un beneficio sobre las AVD.
En cuanto al uso de estímulos sensoriales, se ha demostrado que el uso de estímulos auditivos rítmicos mejora la ejecución de tareas motoras simples y que la implementación de señales externas en el domicilio puede tener un beneficio en el control motor, si bien se desconoce cuánto tiempo puede mantenerse el efecto de estas intervenciones6,7.
Con respecto a las estrategias cognitivo-conductuales implementadas con la finalidad de estimular cambios en el estilo de vida, que puedan repercutir favorablemente en el enfermo de EP, se han publicado resultados poco concluyentes7 (NE-III). La rehabilitación cognitiva mediante telemedicina también se ha intentado implementar, tanto mediante el uso de aplicaciones como de reuniones en línea, con mejoras en cognición; si bien en muchas ocasiones la alfabetización digital limitada supone una barrera para la implementación de estas terapias5 (NE-IV).

Bibliografía
1. Carrión Pérez F, Pérez Ureña MB. Tratamiento rehabilitador. En: Escamilla Sevilla F, Olivares Romero J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SEN). Barcelona: Editorial Glosa, S.L.; 2022. p. 227-29.
2. Tofani M, Ranieri A, Fabbrini G, et al. Efficacy of occupational therapy interventions on quality of life in patients with Parkinson’s disease: a systematic review and meta analysis. Mov Disord Clin Pract. 2020;7(8):891-901.
3. Doucet BM, Franc I, Hunter EG. Interventions within the scope of occupational therapy to improve activities of daily living, rest, and sleep in people with Parkinson’s disease: a systematic review. Am J Occup Ther. 2021;75(3):7503190020.
4. Rodríguez-Mansilla J, Bedmar-Vargas C, Garrido-Ardila EM, et al. Effects of Virtual Reality in the Rehabilitation of Parkinson’s Disease: A Systematic Review. J Clin Med. 2023 Jul 26;12(15):4896.
5. Duncan RP, Earhart GM. Remote Delivery of Allied Health Therapies in Parkinson’s Disease. J Parkinsons Dis. 2024;14(s1):S219-S226.
6. Foster ER, Carson LG, Archer J, et al. Occupational therapy interventions for instrumental activities of daily living for adults with Parkinson’s disease: a systematic review. Am J Occup Ther. 2021;75(3):7503190030p1-7503190030p24.
7. Foster ER, Bedekar M, Tickle-Degnen L. Systematic review of the effectiveness of occupational therapy-related interventions for people with Parkinson’s disease. Am J Occup ther. 2014;68 (1):39-49.
8. Proud EL, Miller KJ, Morris ME, et al. Effects of Upper Limb Exercise or Training on Hand Dexterity and Function in People With Parkinson Disease: A Systematic Review and Meta-analysis. Arch Phys Med Rehabil. 2023 Nov 30:S0003-9993(23)00663-9.
En cuanto a la logopedia, la intervención de esta disciplina se centra en la discapacidad de la voz, motivada por la disartria hipocinética y la hipofonía, así como las alteraciones en la deglución. La disartria producida por la EP se revisa en el capítulo 10 (pag. 251).
Discapacidad en la voz
Dos MA10,11 (NE-I) han demostrado la eficacia del tratamiento de logopedia para mejorar tanto la hipofonía como la disartria hipocinética. Estos resultados suponen, de forma global, una mejora significativa en la comunicación funcional de los pacientes con EP, que se mantiene durante al menos 12 meses tras finalizar la terapia11 (NE-I).
En cuanto a los distintos métodos, el tratamiento para la voz de Lee Silverman (LSVT, del inglés Lee Silverman Voice Treatment) es el que ha demostrado mejores resultados, sin diferencias significativas en cuanto a su implementación presencial u online5,12 (NE-I).
Las artes escénicas también han mostrado una probable eficacia en el habla y comunicación funcional, con otros beneficios adicionales en calidad de vida, función motora y cognición, si bien no hay evidencias para recomendar unas sobre otras13 (estudios con NE-IV).

Disfagia
La disfagia es un problema altamente prevalente en pacientes con EP que, además de afectar a la calidad de vida, supone una importante causa de morbimortalidad y de complicaciones graves, como la neumonía por aspiración. Cuando aparece este problema, una de las primeras medidas a implementar es entrenar a los pacientes a que realicen las ingestas en situación de on, ya que se ha comprobado que el estímulo dopaminérgico mejora la deglución14,15 (NE-I).
En cuanto al tratamiento específico, existen dos estrategias complementarias16,17 (NE-I). La primera consiste en la rehabilitación del proceso de deglución mediante la intervención sobre el componente motor y sensitivo de este reflejo. En segundo lugar, existen pautas de compensación que consisten en la incorporación de pautas de alimentación (postura en flexión cervical, cubiertos pequeños…), junto con la modificación de la consistencia de los alimentos. La eficacia sobre la seguridad en la deglución de estas modificaciones ha sido corroborada mediante el uso de videofluoroscopia18 (NE-I). Para una revisión más detallada de la disfagia en la EP se puede consultar el capítulo 10 (pag. 251).

Bibliografía
5. Duncan RP, Earhart GM. Remote Delivery of Allied Health Therapies in Parkinson’s Disease. J Parkinsons Dis. 2024;14(s1):S219-S226.
10. Muñoz-Vigueras N, Prados-Román E, Valenza MC, et al. Speech and language therapy treatment on hypokinetic dysarthria in Parkinson disea se: systematic review and meta- analysis. Clin Rehabil. 2021;35(5):639-55.
11. Xu H, Bao Z, Liang D, et al. Speech and language therapy for voice problems in Parkinson’s disease: a meta-analysis. J Neuropsychiatry Clin Neurosci. 2020;32(4):344-51.
12. Yuan F, Guo X, Wei X, et al. Lee Silverman Voice Treatment for dysarthria in patients with Parkinson’s disease: a systematic review and meta-analysis. Eur J Neurol. 2020;27(10):1957-70.
13. Barnish MS, Barran SM. A systematic review of active group-based dance, singing, music therapy and theatrical interventions for quality of life, functional communication, speech, motor function and cognitive status in people with Parkinson’s disease. BMC Neurol. 2020;20(1):371.
14. Gandhi P, Steele CM. Effectiveness of interventions for dysphagia in Parkinson disease: a systematic review. Am J Speech Lang Pathol. 2022;31(1):463-85.
15. Schindler A, Pizzorni N, Cereda E, et al. Consensus on the treatment of dysphagia in Parkinson’s disease. J Neurol Sci. 2021;430:120008.
16. Grimes D, Fitzpatrick M, Gordon J, et al. Canadian guideline for Parkinson disease. CMAJ. 2019;191(36):E989-1004.
17. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. Londres: National Institute for Health and Care Excellence (NICE); 2017. Disponible en: https://www. nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf-1837629189061
18. Van Hooren MRA, Baijens LWJ, Voskuilen S, et al. Treatment effects for dysphagia in Parkinson’s disease: a systematic review. Parkinsonism Relat Disord. 2014;20(8):800-7.
La OMS define los cuidados paliativos (CP) como un conjunto de medidas de prevención y alivio del sufrimiento para mejorar la calidad de vida de los pacientes y cuidadores que se enfrentan a problemas asociados a enfermedades que amenazan la vida. Estas medidas se implementan por medio de la identificación temprana, la correcta evaluación y tratamiento tanto de los problemas físicos como de los psicosociales y espirituales1,2.
El objetivo fundamental de los CP es mejorar la calidad de vida de los pacientes; para ello la OMS establece una serie de principios1,2 (NE-IV):
-
Aliviar el dolor y otros síntomas mediante el tratamiento adecuado.
-
Ayudar a la aceptación del proceso de la enfermedad y la muerte, sin acelerarla ni posponerla. El objetivo es el bienestar y la calidad de vida, no la duración de esta.
-
Fomentar la autonomía del paciente y apoyarlo para vivir tan activamente como le sea posible.
-
Aliviar el sufrimiento entendido de forma integral, atendiendo a las necesidades físicas, psíquicas, sociales y espirituales del enfermo y su familia, para lo que es necesario un equipo multidisciplinario.
-
Informar de una manera gradual, completa y verdadera, respetando el derecho a no ser informado.
-
Garantizar que no sea tratado en contra de su voluntad y respetar el derecho a la participación en la toma de decisiones.
-
No deben implicar la renuncia a tratamientos curativos y se debe posibilitar la atención en el domicilio como lugar idóneo para los CP si el paciente lo desea.
Existe una creciente necesidad de CP conforme avanza en gravedad la EP, especialmente si se considera: el deterioro funcional progresivo del paciente, la limitada eficacia del tratamiento sobre los síntomas no motores y la sintomatología axial, la incertidumbre que sufre el paciente y cuidadores en torno al pronóstico de la enfermedad, la complejidad de la toma de decisiones, la sobrecarga de los cuidadores y la alta demanda de atención sanitaria en la fase final de la vida3.
Los CP no solo mejoran la calidad de vida de los pacientes con EP, sino que su integración temprana es crucial para el control sintomático y el alivio de la carga del cuidador4,5 (NE-II). Pese a ello, los CP en la EP todavía no están ampliamente implementados en la práctica clínica, debido, en parte, a la ausencia de protocolos específicos y a la escasa formación del neurólogo en los CP3,6 (NE-II).
En este tema se revisamos el concepto de CP y CP avanzados, el acceso a los servicios de CP, las directrices sobre la información a lo largo de la enfermedad, la identificación de necesidades específicas de CP, el manejo de los síntomas principales, cómo realizar y consultar la declaración de voluntades vitales anticipadas (DVVA) o instrucciones previas. En algunas comunidades también puede efectuarse una planificación anticipada de cuidados (PAC)7.
En noviembre de 2024, un grupo de expertos nacionales ha publicado una serie de recomendaciones para el abordaje de los cuidados paliativos en la enfermedad de Parkinson que animamos al lector a consultar de forma complementaria a este capítulo8.
Bibliografía
1. Ruiz Fernández E, Aguirre Clavero E, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, González Torres V, Moya Molina MÁ (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson 2022. Grupo Andaluz de Trastornos del Movimiento (GATM), Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa; 2022. p. 269-86. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2022/11/gpc_619_recomendaciones_practica_clinica_parkinson_compl.pdf
2. 67.ª Asamblea Mundial de la Salud. Fortalecimiento de los cuidados paliativos como parte del tratamiento integral a lo largo de la vida. En: Organización Mundial de la Salud [Internet]. Disponible en: https://apps.who.int/gb/ebwha/pdf_files/WHA67-REC1/ A67_2014_REC1-sp.pdf?ua=1&ua=1#page=60
3. Álvarez Saúco M, García-Ramos R, Legarda Ramírez I, et al. Palliative care management in patients with Parkinson’s disease and other movement disorders in Spain. National survey of neurologists. Neurologia (Engl Ed). 2024 Jun;39(5):417-425.
4. Kluger BM, Miyasaki J, Katz M, et al. Comparison of Integrated Outpatient Palliative Care With Standard Care in Patients With Parkinson Disease and Related Disorders. JAMA Neurol. 2020 May 1;77(5):551.
5. Veronese S, Gallo G, Valle A, et al. Specialist palliative care improves the quality of life in advanced neurodegenerative disorders: NE-PAL, a pilot randomised controlled study. BMJ Support Palliat Care. 2017 Jun;7(2):164-72.
6. Gutiérrez Zúñiga R, Ródenas Iruela R, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, Olivares Romero J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos del Movimiento (GATM). Sociedad Andaluza de Neurología. Barcelona: Editorial Glosa; 2017. p. 205-216. Disponible en: https://portal.guiasalud.es/wp-content/ uploads/2018/12/GPC_561_Enfermedad_Parkinson.pdf
7. Martín-Rosselló M, Fernández-López A, Sanz-Amores R, et al. Instrumento diagnóstico de la complejidad en cuidados paliativos. Documento de apoyo al PAI Cuidados Paliativos. Sevilla: Consejería de Igualdad, Salud y Políticas Sociales; 2014. Disponible en: https://www.redpal.es/wp-content/uploads/2018/12/IDC-Pal-2014-Complejidad.pdf
8. Álvarez Saúco M, García-Ramos R, Legarda Ramírez I, Carrillo García F, Fernández Bueno J, Martí Martínez S, et al. Cuidados paliativos en enfermedad de Parkinson y otros trastornos del movimiento. Recomendaciones y protocolo de un grupo multidisciplinar de expertos. Neurologia. 2024 Jun;39(5):417-425.
Los CP en la EP deberían comenzar en la fase diagnóstica simultáneamente con los tratamientos curativos, pero adquieren mayor relevancia en las fases finales de la enfermedad. A lo largo de los años de seguimiento neurológico del paciente se realiza una transición gradual hacia los CP, basándose en las necesidades individuales de cada uno1,6.
En general, se podrían establecer una serie de puntos clave en el proceso de CP en la EP1 (NE-IV):
-
En las primeras etapas, se debe ofrecer información gradual sobre la enfermedad y el pronóstico, las opciones terapéuticas y el impacto global de la De forma individualizada, se podría dar a conocer la posibilidad de hacer una planificación anticipada de los cuidados (PAC).
-
Durante la evolución se puede informar sobre la posibilidad de realizar una DVVA y sobre los distintos aspectos del final de la vida, antes de que exista un deterioro cognitivo que dificulte o imposibilite la toma de decisiones.
-
Es necesario identificar los hitos que definen el comienzo de la fase final de la enfermedad y tratar precozmente los síntomas con mayor impacto, incluyendo el sufrimiento psicológico y el cuidado del cuidador.
-
En la fase final, se aplicarán las medidas recogidas en el PAC o DVVA si las hubiere, así como las consensuadas con el paciente capaz o con sus cuidadores y familiares, con una adecuación terapéutica personalizada que no omita la atención al duelo de los
Es fundamental en todas las etapas conocer los deseos y preferencias del paciente y mantener su autonomía y dignidad mediante la toma de decisiones compartida9.
Se consideran recursos convencionales aquellos de Atención Primaria y atención hospitalaria que den respuesta a los CP básicos. Ambos deben disponer de competencias transversales en la atención al final de la vida y son los encargados de detectar la necesidad de CP. Existen herramientas para identificar pacientes con necesidad de atención paliativa como el instrumento NECPAL CCOMS-ICO©. Se trata de una serie de 14 preguntas de respuesta dicotómica (“sí/no”); la primera de ellas (“¿le sorprendería que este paciente muriese a lo largo del próximo año?”) ha de ser negativa y, al menos, otra respuesta ha de ser positiva (de los dominios 2, 3 o 4) para identificar al enfermo que requiere medidas paliativas mediante esta estrategia10,11.
Los recursos convencionales, habitualmente la Atención Primaria y el neurólogo referente, son los encargados de hacer una valoración holística del paciente (incluida su situación clínica, funcional, cognitiva y sociofamiliar), determinar la situación de fase terminal y establecer un plan de actuación inicial (problemas detectados, objetivos e intervenciones previstas), que debe quedar registrado en la historia clínica y ser revisado de forma periódica9 (Tabla I) (NE-IV).
Se consideran recursos avanzados los equipos multidisciplinares, integrados por profesionales que dan respuesta a las diferentes situaciones de alta complejidad, los cuales deben disponer de competencias específicas en CP. Para calcular el nivel de complejidad existen herramientas como IDC-Pal que determinará el recurso necesario para la atención paliativa del paciente, siendo necesaria la intervención de los “recursos avanzados” en situaciones altamente complejas y, puntualmente, en situaciones complejas12.

Bibliografía
1. Ruiz Fernández E, Aguirre Clavero E, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, González Torres V, Moya Molina MÁ (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson 2022. Grupo Andaluz de Trastornos del Movimiento (GATM), Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa; 2022. p. 269-86. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2022/11/gpc_619_recomendaciones_practica_clinica_parkinson_compl.pdf
6. Gutiérrez Zúñiga R, Ródenas Iruela R, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, Olivares Romero J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos del Movimiento (GATM). Sociedad Andaluza de Neurología. Barcelona: Editorial Glosa; 2017. p. 205-216. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_561_Enfermedad_Parkinson.pdf
9. Taylor LP, Besbris JM, Graf WD, et al. Clinical Guidance in Neuropalliative Care. Neurology. 2022 Mar 8;98(10):409-16.
10. Gómez-Batiste X, Amblàs J, Costa X, et al. Recomendaciones para la atención integral e integrada de personas con enfermedades o condiciones crónicas avanzadas y pronóstico de vida limitado en servicios de salud y sociales: NEPCAL CCOMS-ICO© 3.1. En: Institut Català d’Oncologia [Internet]. Disponible en: https://ico.gencat.cat/web/.content/minisite/ico/professionals/documents/qualy/arxius/INSTRUMENTO-NECPAL-3.1-2017-ESP_Completo-Final.pdf
11. Gómez-Batiste X, Martínez-Muñoz M, Blay C, et al. Identifying patients with chronic conditions in need of palliative care in the general population: development of the NECPAL tool and preliminary prevalence rates in Catalonia. BMJ Support Palliat Care. 2013 Sep;3(3):300-8.
12. Fernández López A, Bergara de la Fuente M, Boceta Osuna J, et al. Cuidados paliativos. Proceso asistencial integrado. Sevilla: Consejería de Salud y Familias; 2019. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2019/07/pa_9_cuidados_paliativos.pdf
La comunicación del diagnóstico, la evolución y el pronóstico debe realizarse de manera personalizada, de un modo empático, buscando proactivamente las ocasiones en las que el paciente esté preparado para recibir esta información. Dialogar en una etapa temprana de la enfermedad sobre las expectativas e incertidumbres puede influir en las decisiones y mejorar la calidad de vida a medida que la enfermedad avanza13 (NE-IV) (Tabla II). Para ello, es necesario que el neurólogo esté capacitado en distintas habilidades comunicativas, que incluyen dar malas noticias, informar y ayudar en el proceso de toma de decisiones, explicar el pronóstico o establecer límites cuando se planteen procedimientos fútiles. Incluso cuando el pronóstico es incierto para el neurólogo, los pacientes valoran positivamente que se les comunique y se discutan estas incertidumbres11 NE-III).

Un problema común es la dificultad que puede encontrar el paciente para gestionar la información, formular preguntas y entender los distintos escenarios que se puedan presentar, tanto en el diagnóstico como a lo largo de la progresión de la enfermedad. Algunos autores proponen seguir una hoja de ruta que guíe el proceso de información para cubrir los distintos dominios que pueden verse vulnerados en la enfermedad (físicos, psicológicos, sociales, espirituales, culturales, éticos y legales)13 (NE-IV) (Tabla III). Otra estrategia consiste en describir los distintos escenarios y sus implicaciones pronósticas más probables para explorar la aceptación de cada uno de estos por parte del paciente y ayudar en la toma de decisiones9 (NE-IV). Es importante atender las necesidades de información del cuidador, así como vigilar la aparición de síntomas relacionados con el agotamiento (burn-out), especialmente, en los últimos momentos de la enfermedad11 (NE-III). Los cuidadores de pacientes tratados en unidades multidisciplinarias de CP sienten menos agotamiento y ansiedad4,6 (NE-II).
Planificación anticipada de cuidados (PAC)
La PAC consiste en el registro en la historia clínica del paciente por parte del profesional sanitario responsable de las preferencias, los valores y deseos del paciente ante ciertas situaciones del final de la vida. Deberá ser un proceso voluntario de comunicación y de toma de decisiones con la persona y se realizará, siempre que esta lo permita, en presencia de una persona de su confianza que vaya a ejercer como su representante12 (NE-IV).

A nivel estatal en la mayoría de las comunidades autónomas existe la opción del registro de DVVA donde el paciente puede registrar de forma oficial sus preferencias respecto a estos aspectos. En función de cada comunidad, existe la opción de que solo pueda ser consultado por el médico que atiende al paciente siempre que este no pueda expresarse por sí mismo.
Bibliografía
4. Kluger BM, Miyasaki J, Katz M, et al. Comparison of Integrated Outpatient Palliative Care With Standard Care in Patients With Parkinson Disease and Related Disorders. JAMA Neurol. 2020 May 1;77(5):551.
6. Gutiérrez Zúñiga R, Ródenas Iruela R, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, Olivares Romero J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos del Movimiento (GATM). Sociedad Andaluza de Neurología. Barcelona: Editorial Glosa; 2017. p. 205-216. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_561_Enfermedad_Parkinson.pdf.
9. Taylor LP, Besbris JM, Graf WD, et al. Clinical Guidance in Neuropalliative Care. Neurology. 2022 Mar 8;98(10):409-16.
11. Gómez-Batiste X, Martínez-Muñoz M, Blay C, et al. Identifying patients with chronic conditions in need of palliative care in the general population: development of the NECPAL tool and preliminary prevalence rates in Catalonia. BMJ Support Palliat Care. 2013 Sep;3(3):300-8.
12. Fernández López A, Bergara de la Fuente M, Boceta Osuna J, et al. Cuidados paliativos. Proceso asistencial integrado. Sevilla: Consejería de Salud y Familias; 2019. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2019/07/pa_9_cuidados_paliativos.pdf
13. Jordan SR, Kluger B, Ayele R, et al. Optimizing future planning in Parkinson disease: suggestions for a comprehensive roadmap from patients and care partners. Ann Palliat Med. 2020 Feb;9(S1):S63-74.
Es importante considerar en todo momento el abordaje paliativo en la EP, incluso, si es necesario en el momento del diagnóstico, siempre desde una perspectiva dinámica, adaptada a las necesidades del paciente en cada etapa de la enfermedad, y adquiriendo mayor protagonismo en fases avanzadas4,5,12 (NE-II). Se considera estar en dicha fase cuando la discapacidad asociada a los síntomas motores no puede controlarse satisfactoriamente con el mejor tratamiento médico o quirúrgico, cuando la gravedad de los síntomas no motores sobrepasa a la de los síntomas motores, o cuando el tratamiento de los síntomas motores se ve comprometido debido a la aparición de síntomas cognitivos o disautonómicos14
Los pacientes y sus familiares serán valorados y seguidos en Atención Primaria u hospitalaria según sean sus necesidades en cada momento, y en caso de mayor complejidad, serán atendidos por unidades de CP de manera multidisciplinaria.
Aunque puedan aplicarse CP en las distintas fases de la EP, los CP protagonizan la etapa de la EP avanzada (EPA) con síntomas refractarios a tratamiento, habitualmente demencia con/sin comorbilidades graves, es decir, pacientes sin autonomía6.
Se ha diseñado una escala específica para la EP (indicadores de la necesidad de cuidados paliativos en la EP de Radboud Indicators for Palliative Care Needs in Parkinson’s Disease [Radboud o RADPAC-PD]) que identifica a los pacientes que necesitan planificar o iniciar CP avanzados e identificar la fase final de la enfermedad15 (NE-IV) (Tabla IV). Esta fase podría predecirse en pacientes con EP por la presencia de cuatro datos clínicos clave: alucinaciones visuales, caídas frecuentes, demencia y el ingreso en una residencia6,16 (NE-III).
La figura del cuidador es clave en su identificación y evaluación de forma precoz. Se han desarrollado escalas específicas, como la escala de resultados paliativos para los síntomas de la enfermedad de Parkinson (Palliative Outcome Scale-Symptons/Parkinson Disease [POS-S/PD])17 (NE-III). Es una adaptación para la EP de la escala de resultados paliativos (Palliative Outcome Scale [POS]), que recoge 20 síntomas, destacando por su relevancia: los problemas para caminar o usar las manos, el dolor, la dificultad para comunicarse, la fatiga, la salivación excesiva, el estreñimiento, el insomnio y las caídas. Otra escala usada con el mismo propósito es la escala para la evaluación de síntomas de Edmonton para la enfermedad de Parkinson (Edmonton Symptom Assessment System Scale for Parkinson Disease [ESAS-PD]), cuya puntuación en la EPA se asemeja a la de los pacientes con cáncer metastásico18 (NE-III).

Bibliografía
4. Kluger BM, Miyasaki J, Katz M, et al. Comparison of Integrated Outpatient Palliative Care With Standard Care in Patients With Parkinson Disease and Related Disorders. JAMA Neurol. 2020 May 1;77(5):551.
5. Veronese S, Gallo G, Valle A, et al. Specialist palliative care improves the quality of life in advanced neurodegenerative disorders: NE-PAL, a pilot randomised controlled study. BMJ Support Palliat Care. 2017 Jun;7(2):164-72.
6. Gutiérrez Zúñiga R, Ródenas Iruela R, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, Olivares Romero J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos del Movimiento (GATM). Sociedad Andaluza de Neurología. Barcelona: Editorial Glosa; 2017. p. 205-216. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_561_Enfermedad_Parkinson.pdf
12. Fernández López A, Bergara de la Fuente M, Boceta Osuna J, et al. Cuidados paliativos. Proceso asistencial integrado. Sevilla: Consejería de Salud y Familias; 2019. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2019/07/pa_9_cuidados_paliativos.pdf
14. Miyasaki JM. Parkinson’s Disease and Related Disorders. En: Neuropalliative Care. Cham: Springer International Publishing; 2019. p. 59-72.
15. Lennaerts-Kats H, van der Steen JT, Vijftigschild Z, et al. RADPAC-PD: A tool to support healthcare professionals in timely identifying palliative care needs of people with Parkinson’s disease. PLoS One. 2020 Apr 21;15(4):e0230611.
16. Kempster PA, O’Sullivan SS, Holton JL, et al. Relationships between age and late progression of Parkinson’s disease: a clinico-pathological study. Brain. 2010 Jun 1;133(6):1755-62.
17. Saleem TZ, Higginson IJ, Chaudhuri KR, et al. Symptom prevalence, severity and palliative care needs assessment using the Palliative Outcome Scale: A cross-sectional study of patients with Parkinson’s disease and related neurological conditions. Palliat Med. 2013 Sep 3;27(8):722-31.
18. Miyasaki JM, Long J, Mancini D, et al. Palliative care for advanced Parkinson disease: An interdisciplinary clinic and new scale, the ESAS-PD. Parkinsonism Relat Disord. 2012 Dec;18:S6-9.
Se denomina fase terminal a la presencia de una enfermedad avanzada, progresiva e incurable, sin posibilidades razonables de respuesta al tratamiento específico y con un pronóstico de vida limitado. En esta situación terminal concurren síntomas multifactoriales, cambiantes y de intensidad variable, que causan gran impacto emocional en pacientes y familiares, con demanda de atención. En el caso de una enfermedad no oncológica como la EP, vendrá definida también por la presencia de fracaso orgánico y deterioro progresivo irreversible1. En este sentido, el pronóstico vital y la definición de situación terminal en la EP es muy difícil de establecer, y se puede acompañar de gran incertidumbre. Ello es debido a diversos factores, entre los que se encuentran1,19:
-
Ausencia de modelos predictivos para el pronóstico vital de enfermedades crónicas no oncológicas.
-
Oscilaciones en la gravedad clínica, que dificultan establecer el inicio de la fase eminentemente paliativa y la información sobre el final de la vida.
-
Que la atención corre a cargo de múltiples profesionales, con poca formación en el abordaje de la atención paliativa o de la propia EP.
-
Carencia de recursos y circuitos adecuados para los CP en esta enfermedad, a diferencia de lo que ocurre en los pacientes oncológicos.
-
Ubicación variada de los pacientes susceptibles: domicilios, residencias, hospitales, centros de larga estancia o sociosanitarios, etc.
Existe un proyecto multicéntrico europeo PD-Pal para profesionales, pacientes y cuidadores para poder ofrecer CP domiciliarios centrados en el paciente basados en el PAC20.
¿Cómo se deben tratar los principales síntomas de la enfermedad de Parkinson en fase terminal? 6,21
Se recomienda simplificar y optimizar el tratamiento dopaminérgico, reduciendo o suprimiendo los fármacos antiparkinsonianos adyuvantes a la LD, buscando idealmente el uso de LD en monoterapia, ya que es el medicamento con menor riesgo de inducir efectos adversos en relación con su eficacia sobre el control motor. Se recomienda comenzar por la retirada de fármacos anticolinérgicos, para seguir con la amantadina, los IMAO y, posteriormente, se retirarían los agonistas dopaminérgicos (AD) y los ICOMT. Si, pese a ello, persisten las complicaciones con influencia medicamentosa o yatrogénicas (alucinaciones, delirios, disautonomía o hipersomnia), se intentará reducir la dosis de LD en la medida de lo posible14,19 (NE-IV).
Por otro lado, es imprescindible un correcto manejo de la demencia, de otros síntomas refractarios (por ejemplo, disfagia) y de trastornos intercurrentes (Tabla IV). La atención en unidades de CP multidisciplinarias mejora la sobrecarga del cuidador y la calidad de vida de pacientes con síntomas refractarios: deterioro cognitivo, manifestaciones neuropsiquiátricas incluidos la ansiedad, el dolor, la somnolencia, la disautonomía, el estreñimiento e, incluso, los bloqueos de la marcha4,18 (NE-II).
Tratamiento del dolor
Es el síntoma principal en CP y también uno de los problemas más relevantes en la EP6. Sus causas son diversas, incluidas aquellas no relacionadas con la enfermedad, aunque la más común es la musculoesquelética, de los miembros superiores, por rigidez, inmovilización o posturas anómalas22. Su evaluación es compleja en pacientes con problemas para comunicarse y, a veces, las causas pueden pasar inadvertidas (por ejemplo, el dolor abdominal por estreñimiento o retención urinaria en situaciones de inmovilización). La figura del cuidador principal es crucial para saber interpretar las muestras de dolor del paciente.
Se deberá tratar el dolor independientemente de la causa, y es necesario identificar el tipo (agudo o crónico, nociceptivo o neuropático) y evaluar su intensidad mediante escalas sencillas como la escala visual analógica (EVA). Además de considerar medidas físicas, hay que elegir el tratamiento farmacológico más idóneo siguiendo la escalera analgésica de la OMS23 (NE-IV) según su intensidad:
-
Primer escalón (EVA: 1-4). Analgésicos no opioides: paracetamol, metamizol o anti-inflamatorios no esteroideos (AINE).
-
Segundo escalón (EVA: 4-6). Opioides débiles: tramadol o codeína.
-
Tercer escalón (EVA: 7-10). Opioides potentes: morfina, fentanilo o La dosificación se realiza según el efecto y la tolerancia. El uso de morfina (por vía oral o por vía subcutánea) es de elección en el dolor grave o la disnea. En general, son fármacos bien tolerados y muy eficaces si se utilizan adecuadamente.
Para el dolor neuropático, pueden considerarse la gabapentina, la pregabalina, benzodiacepinas, antidepresivos, etc. El tratamiento deberá reevaluarse periódicamente en función de la respuesta y la tolerancia.
Además del tratamiento farmacológico, la fisioterapia puede mejorar el dolor, al modular sus vías inhibidoras24 (NE-IV).

Manejo de la disfagia
La disfagia requiere un abordaje interdisciplinar que incluye a familiares y cuidadores e idealmente valoración por foniatría y logopedia, así como de nutricionistas. A medida que progresa, el equipo asistencial abordará las modificaciones de la dieta y la vía de alimentación, pudiendo considerarse la indicación de alimentación y nutrición artificial. No existen recomendaciones específicas sobre la colocación de sonda nasogástrica o realización de gastrostomía endoscópica percutánea (percutaneous endoscopic gastrostomy [PEG]) en la fase terminal de la EP. En general, se recomienda no mantener una sonda nasogástrica enteral más de tres o cuatro semanas; si la necesidad excede ese tiempo, en casos seleccionados, se puede plantear la realización de una PEG. Previamente es necesario establecer con el paciente y su familia unos objetivos coherentes (hidratación, administración de medicación para el confort, etc.), teniendo en cuenta que, en determinados contextos (demencia y edad avanzada), la implantación de una sonda nasogástrica o la PEG no aumentan la supervivencia, pues no evitan las broncoaspiraciones ni mejoran los parámetros nutricionales1,6 (NE-IV).
Los pacientes con la capacidad de toma de decisiones preservada, que hayan dejado constancia en registros (PAC o DVVA), o por medio de decisiones subrogadas (a través de familiares cercanos), pueden rechazar o interrumpir las intervenciones de soporte vital (como la nutrición e hidratación artificiales, la ventilación mecánica, o cualquier tratamiento no paliativo) bajo el principio ético de respeto a la autonomía, permitiendo una muerte natural. En todo caso, debe asegurarse que dicha decisión se toma con pleno conocimiento de sus consecuencias1,9 (NE-IV).
Manejo del deterioro cognitivo / demencia
Es frecuente que muchos pacientes en esta fase tengan pautados tratamientos anticolinesterásicos como la rivastigmina14, en ocasiones con intención de control de la sintomatología psicótica, por lo que se recomienda no retirarlos, excepto en situación de fallecimiento inminente14 (NE-IV).
Manejo de síntomas psicóticos
En primer lugar, se recomienda descartar factores precipitantes como procesos infecciosos (habitualmente, infección del tracto urinario o de las vías respiratorias) o causas metabólicas (típicamente, alteraciones electrolíticas, aunque también déficit de vitamina B12 o hipotiroidismo). Posteriormente se debe revisar la pauta de medicación en busca de fármacos que puedan agravar estos síntomas, así como comprobar la adherencia y cumplimiento del tratamiento. Si es preciso iniciar tratamiento con fármacos neurolépticos, se recomiendan aquellos fármacos con menor efecto parkinsonizante, como son la quetiapina, la clozapina (no es recomendable utilizar inicialmente otros neurolépticos en la EP) e, incluso, la pimavanserina, agonista inverso de los receptores 5-HT2A, que aún no está aprobado en España14. No existen neurolépticos parenterales óptimos para los enfermos de Parkinson. En casos excepcionales y ante síntomas incontrolables se puede utilizar la ziprasidona IM25 (NE-IV).
Tratamiento de la inmovilidad
La inmovilidad mantenida puede provocar dolor, favorecer la rigidez y las úlceras por presión. Si el paciente no deambula y está confinado en una cama o sillón, es necesario buscar posiciones adecuadas, se recomienda realizar cambios posturales frecuentes y seguir un programa de fisioterapia adecuado. En pacientes encamados y muy rígidos, son útiles los colchones antiescaras. En contracturas extremas, puede plantearse el tratamiento con toxina botulínica o, incluso, las tenotomías para permitir la higiene6 (NE-IV).
Bibliografía
1. Ruiz Fernández E, Aguirre Clavero E, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, González Torres V, Moya Molina MÁ (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson 2022. Grupo Andaluz de Trastornos del Movimiento (GATM), Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa; 2022. p. 269-86. Disponible en: https://portal.guiasalud.es/wp-content/ uploads/2022/11/gpc_619_recomendaciones_practica_clinica_parkinson_compl.pdf
4. Kluger BM, Miyasaki J, Katz M, et al. Comparison of Integrated Outpatient Palliative Care With Standard Care in Patients With Parkinson Disease and Related Disorders. JAMA Neurol. 2020 May 1;77(5):551.
6. Gutiérrez Zúñiga R, Ródenas Iruela R, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, Olivares Romero J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos del Movimiento (GATM). Sociedad Andaluza de Neurología. Barcelona: Editorial Glosa; 2017. p. 205-216. Disponible en: https://portal.guiasalud.es/wp-content/ uploads/2018/12/GPC_561_Enfermedad_Parkinson.pdf
9. Taylor LP, Besbris JM, Graf WD, et al. Clinical Guidance in Neuropalliative Care. Neurology. 2022 Mar 8;98(10):409-16.
14. Miyasaki JM. Parkinson’s Disease and Related Disorders. En: Neuropalliative Care. Cham: Springer International Publishing; 2019. p. 59-72.
18. Miyasaki JM, Long J, Mancini D, et al. Palliative care for advanced Parkinson disease: An interdisciplinary clinic and new scale, the ESAS-PD. Parkinsonism Relat Disord. 2012 Dec;18:S6-9.
19. Fernández Rodríguez R, Giménez Muñoz A, Más Sesé G, et al. La identificación del paciente en fase paliativa en distintos procesos neurológicos. En: Guijarro Castro C, García-Ramos García R, Escamilla Sevilla F (eds.). Manual básico de la SEN sobre el final de la vida y la ley de la eutanasia. San Sebastián de los Reyes (Madrid): Ediciones SEN; 2021. p. 7190.
20. Lennaerts-Kats H, Ebenau A, Kanters S, et al. The Effect of a Multidisciplinary Blended Learning Program on Palliative Care Knowledge for Health Care Professionals Involved in the Care for People with Parkinson’s Disease. J Parkinsons Dis. 2022;12(8):2575-84.
21. Alegre Herrera J. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, Mínguez Castellanos A (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson Grupo Andaluz de Trastornos del Movimiento (GATM) Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa; 2012. p. 145-52.
22. Wolff M, Fuentes dos Santos A, Amaral EC, et al. Characterization of pain in patients with Parkinson’s disease: a descriptive cross-sectional study. Research, Society and Development. 2020 Oct 10;9(10):e6069109057.
23. Cancer pain relief. En: Organización Mundial de la Salud [Internet]. Disponible en: https:// iris.who.int/handle/10665/43944
24. Qureshi AR, Jamal MK, Rahman E, et al. Non‐pharmacological therapies for pain management in Parkinson’s disease: A systematic review. Acta Neurol Scand. 2021 Aug 13;144(2):115-31.
25. Oechsner M, Korchhounov A. Parenteral ziprasidone: a new atypical neuroleptic for emergency treatment of psychosis in Parkinson’s disease? Hum Psychopharmacol. 2005 Apr;20(3):203-5.
En los últimos momentos, aparece un importante y rápido deterioro del estado general, caracterizado por una mínima o nula ingesta, astenia extrema, bajo nivel de consciencia, aparición de estertores y signos de mala perfusión tisular. La neumonía aspirativa es la principal causa de muerte (45%)6 (NE-III). Otras causas de fallecimiento son la malnutrición, la embolia pulmonar, la enfermedad cerebrovascular o los eventos cardiovasculares6.
Es clave haber planificado con el paciente y la familia el lugar donde tendrá lugar la defunción. A diferencia de otras enfermedades crónicas con un sufrimiento similar, un porcentaje elevado (40-80%) de pacientes con EP fallecen en ámbito hospitalario1,26. En un estudio realizado al respecto, un 47% de los participantes habían fallecido en el hospital; un 23,7%, en su domicilio; y un 25%, en una residencia. Entre los fallecidos en el hospital apenas se habían mantenido conversaciones acerca de la preferencia sobre el lugar del fallecimiento, y solo un 13,6% fueron remitidos a una unidad de CP6,27 (NE-III). Y, al contrario, una PAC y un adecuado reconocimiento de la muerte inminente están asociados a una muerte no hospitalaria28 (NE-IV). El objetivo de los CP en la fase de final de la vida es garantizar la muerte digna y el apoyo a los familiares. Deben retirarse aquellos fármacos innecesarios y se empleará preferentemente la vía subcutánea si la situación clínica lo permite. Si la atención domiciliaria no es posible en condiciones adecuadas, o por claudicación familiar, puede ser necesario el ingreso hospitalario. En cualquier caso, se deben evitar desplazamientos en situación de muerte inminente6,13 (NE-IV).
En ocasiones, puede ser necesaria la sedación paliativa. La sedación paliativa es la disminución intencionada del nivel de consciencia del enfermo mediante la administración de los fármacos adecuados, con el objetivo de evitar sufrimiento intenso causado por uno o más síntomas refractarios. Puede ser continua o intermitente, y su profundidad se gradúa buscando el nivel de sedación mínimo que logre el alivio sintomático. En los últimos días u horas de vida, la sedación se realizará de forma continua y tan profunda como sea necesario para aliviar el sufrimiento. Es recomendable que se lleve a cabo en el lugar en que está siendo atendido el paciente, ya sea en el hospital o en el domicilio, y que sea aplicada por su médico1,29 (NE-IV).
Los fármacos necesarios para un adecuado control de síntomas, así como las medidas de prevención para evitar complicaciones en la fase de agonía, deben mantenerse hasta el final, simplificando al máximo el tratamiento como se ha referido. Son de elección (Tabla VI), por este orden, las benzodiacepinas (midazolam), los neurolépticos sedativos (clorpromazina o levomepromazina), los anticonvulsivos (fenobarbital) y los anestésicos (propofol). El midazolam es siempre la primera opción, excepto si el síntoma refractario es el delirio, siendo en este caso de elección la levomepromazina. La vía de administración de elección es la subcutánea, sobre todo si la venosa no es fácilmente canalizable o si el paciente se encuentra en el domicilio. Puede ser necesaria la administración de otros fármacos: anticolinérgicos (como antisecretores bronquiales) y los opioides, que no deben ser retirados durante la sedación, aunque puede reducirse su dosis1,29 (NE-IV).
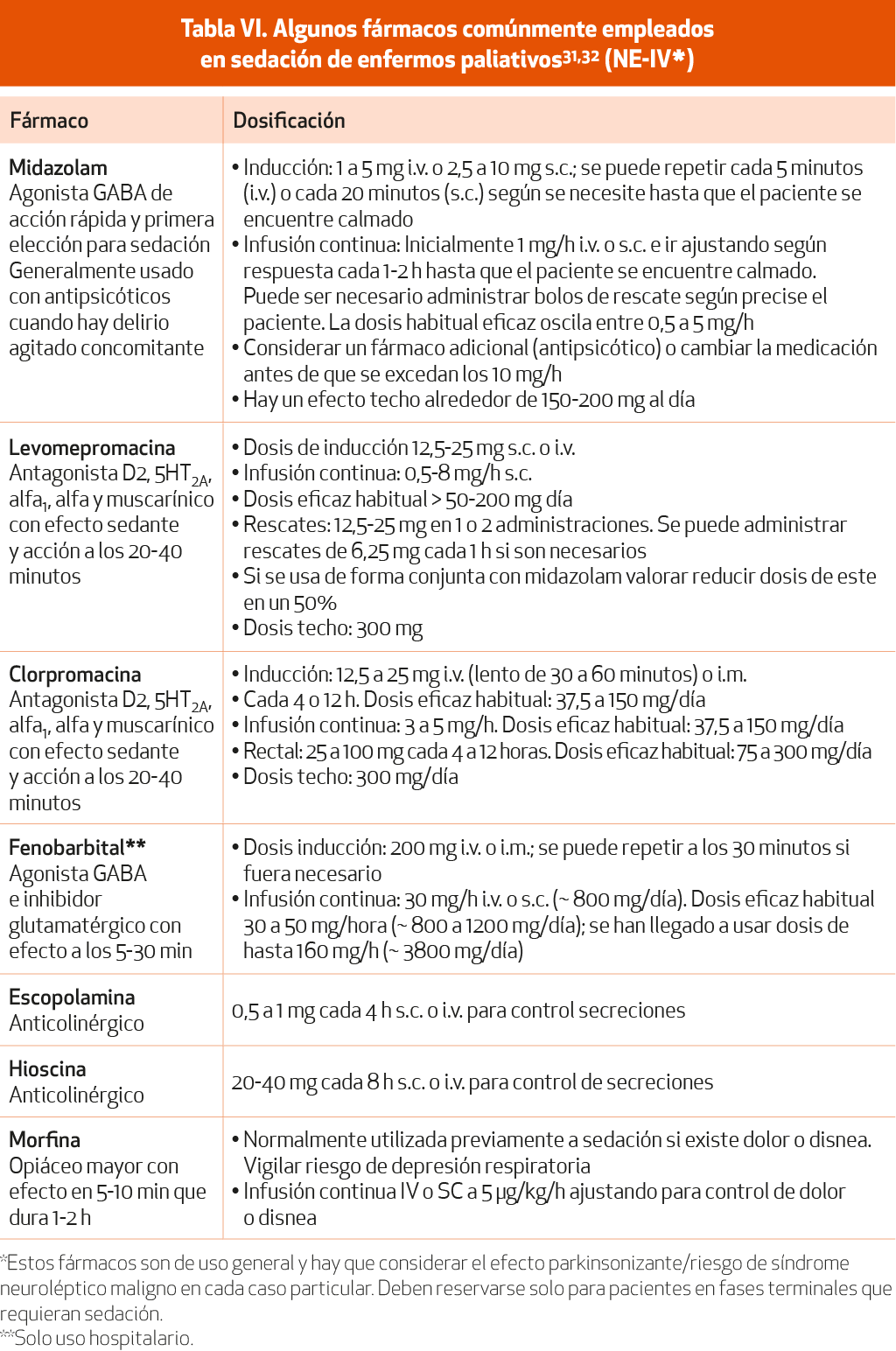
Como con cualquier otro tratamiento, se debe realizar una evaluación continua del nivel de sedación en el que se encuentra y necesita el paciente. Se recomienda para este fin la escala de Ramsay30 (Tabla VII). En la historia clínica y en las hojas de evolución, deberán registrarse con el detalle necesario los datos relativos al ajuste de las dosis de los fármacos utilizados, a la evolución clínica de la sedación en la agonía y a los cuidados básicos administrados29.

Bibliografía
1. Ruiz Fernández E, Aguirre Clavero E, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, González Torres V, Moya Molina MÁ (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson 2022. Grupo Andaluz de Trastornos del Movimiento (GATM), Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa; 2022. p. 269-86. Disponible en: https://portal.guiasalud.es/wp-content/ uploads/2022/11/gpc_619_recomendaciones_practica_clinica_parkinson_compl.pdf
6. Gutiérrez Zúñiga R, Ródenas Iruela R, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, Olivares Romero J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos del Movimiento (GATM). Sociedad Andaluza de Neurología. Barcelona: Editorial Glosa; 2017. p. 205-216. Disponible en: https://portal.guiasalud.es/wp-content/ uploads/2018/12/GPC_561_Enfermedad_Parkinson.pdf
13. Jordan SR, Kluger B, Ayele R, et al. Optimizing future planning in Parkinson disease: suggestions for a comprehensive roadmap from patients and care partners. Ann Palliat Med. 2020 Feb;9(S1):S63-74.
26. Nicholas R, Nicholas E, Hannides M, et al. Influence of individual, illness and environmental factors on place of death among people with neurodegenerative diseases: a retrospective, observational, comparative cohort study. BMJ Support Palliat Care. 2024 May;14(e1):e1032-40.
27. Walker RW, Churm D, Dewhurst F, et al. Palliative care in people with idiopathic Parkinson’s disease who die in hospital: Table 1. BMJ Support Palliat Care. 2014 Mar;4(1):64-7.
28. Nicholas R, Nicholas E, Hannides M, et al. Influence of individual, illness and environmental factors on place of death among people with neurodegenerative diseases: a retrospective, observational, comparative cohort study. BMJ Support Palliat Care. 2024 May;14(e1):e1032–40.
29. Grupo de trabajo de la Guía de Práctica Clínica sobre atención paliativa al adulto en situación de últimos días. Guía de Práctica Clínica sobre atención paliativa al adulto en situación de últimos días. Madrid: Ministerio de Sanidad, Santiago de Compostela: Agencia de Conocimiento en Salud (ACIS). Unidad de Asesoramiento Científico-técnico, Avalia-t; 2021.
30. Ramsay MAE, Savege TM, Simpson BRJ, et al. Controlled sedation with alphaxalone-alphadolone. Br Med J. 1974 Jun 22;2(5920):656–9.
31. OMC, SECPAL. Guía de sedación paliativa. En: Organización Médica Colegial de España [Internet]. Disponible en: https://www.cgcom.es/sites/main/files/mig/guia_sedaccion_ paliativa.pdf
32. Nathan Cherny. Palliative Sedation. En: UpToDate [internet]. Disponible en: https:// www.uptodate.com/contents/palliative-sedation
El 24 de marzo de 2021 se publicó en el Boletín Oficial del Estado la ley orgánica que regula la Eutanasia en España33 y cuyo objeto literalmente es:
El objeto de esta Ley es regular el derecho que corresponde a toda persona que cumpla las condiciones exigidas a solicitar y recibir la ayuda necesaria para morir, el procedimiento que ha de seguirse y las garantías que han de observarse. Asimismo, determina los deberes del personal sanitario que atienda a esas personas, definiendo su marco de actuación, y regula las obligaciones de las administraciones e instituciones concernidas para asegurar el correcto ejercicio del derecho reconocido en esta Ley”.
Los requisitos literales para poder solicitar la ayuda a morir según la ley son:
1. Para poder recibir la prestación de ayuda para morir será necesario que la persona cumpla todos los siguientes requisitos:
-
Tener la nacionalidad española o residencia legal en España o certificado de empadronamiento que acredite un tiempo de permanencia en territorio español superior a doce meses, tener mayoría de edad y ser capaz y consciente en el momento de la solicitud.
-
Disponer por escrito de la información que exista sobre su proceso médico, las diferentes alternativas y posibilidades de actuación, incluida la de acceder a cuidados paliativos integrales comprendidos en la cartera común de servicios y a las prestaciones que tuviera derecho de conformidad a la normativa de atención a la dependencia.
-
Haber formulado dos solicitudes de manera voluntaria y por escrito, o por otro medio que permita dejar constancia, y que no sea el resultado de ninguna presión externa, dejando una separación de al menos quince días naturales entre ambas.
Si el médico responsable considera que la pérdida de la capacidad de la persona solicitante para otorgar el consentimiento informado es inminente, podrá aceptar cualquier periodo menor que considere apropiado en función de las circunstancias clínicas concurrentes, de las que deberá dejar constancia en la historia clínica.
-
Sufrir una enfermedad grave e incurable o un padecimiento grave, crónico e imposibilitante en los términos establecidos en esta Ley, certificada por el médico responsable.
-
Prestar consentimiento informado previamente a recibir la prestación de ayuda para morir. Dicho consentimiento se incorporará a la historia clínica del paciente.
2. No será de aplicación lo previsto en las letras b), c) y e) del apartado anterior en aquellos casos en los que el médico responsable certifique que el paciente no se encuentra en el pleno uso de sus facultades ni puede prestar su conformidad libre, voluntaria y consciente para realizar las solicitudes, cumpla lo previsto en el apartado d), y haya suscrito con anterioridad un documento de instrucciones previas, testamento vital, voluntades anticipadas o documentos equivalentes legalmente reconocidos, en cuyo caso se podrá facilitar la prestación de ayuda para morir conforme a lo dispuesto en dicho documento. En el caso de haber nombrado representante en ese documento será el interlocutor válido para el médico responsable.
La valoración de la situación de incapacidad de hecho por el médico responsable se hará conforme a los protocolos de actuación que se determinen por el Consejo Interterritorial del Sistema Nacional de Salud.
Es posible por tanto que en algunos supuestos las personas con EP en fases terminales o de situación de irreversibilidad de síntomas incapacitantes, como se recoge en el apartado 1d de dicha ley, puedan demandar esta ayuda. Remitimos al lector a los recursos específicos en cada Comunidad Autónoma para profundizar en este importante aspecto relativo a decisiones del final de la vida, así como índoles de aspecto práctico de cómo implementarlo. Es importante también resaltar que el profesional sanitario tiene derecho a la objeción de conciencia existiendo un registro específico para ello privado y confidencial.

Bibliografía
1. Ruiz Fernández E, Aguirre Clavero E, Escamilla Sevilla F. Cuidados paliativos en la enfermedad de Parkinson. En: Escamilla Sevilla F, González Torres V, Moya Molina MÁ (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson 2022. Grupo Andaluz de Trastornos del Movimiento (GATM), Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa; 2022. p. 269-86. Disponible en: https://portal.guiasalud.es/wp-content/ uploads/2022/11/gpc_619_recomendaciones_practica_clinica_parkinson_compl.pdf
33. Ley Orgánica 3/2021, de 24 de marzo, de regulación de la eutanasia. En: Boletín Oficial del Estado [Internet]. Disponible en: https://www.boe.es/eli/es/lo/2021/03/24/3
La designación de terapias alternativas y complementarias es un término genérico que incluye terapias heterogéneas que se consideran diferentes o fuera de la medicina convencional en el momento presente (definición del National Center for Complementary and Alternative Medicine)1. El término “terapia complementaria” implica ser adyuvante a la medicina convencional, mientras que el término “terapia alternativa” se refiere a la sustitución de la medicina convencional por la misma. La medicina integrativa permite combinar tratamientos convencionales y complementarios2.
Bajo este epígrafe se incluyen abordajes muy heterogéneos, desde sistemas médicos completos (Tabla I) hasta suplementos dietéticos o actividades artísticas2-4. Globalmente estas terapias son poco estudiadas y reconocidas por la medicina occidental, que se restringe a tratamientos basados en la evidencia científica (medicina basada en la evidencia), con sus propios sesgos y limitaciones (Figura 1). Por su naturaleza, las terapias alternativas y complementarias son difíciles de testar en ensayos aleatorizados y ciegos, presentan problemas de financiación por parte del sistema sanitario, suscitan escaso interés de los profesionales y la industria farmacéutica, adolecen de dificultades para el enmascaramiento y comparativa con grupos “control” en los estudios que las evalúan, y representan un grupo heterogéneo de terapias con diferencias en su dosificación que hacen difícil la estandarización de su uso. Estas limitaciones pueden mantenerlas fuera del abanico de las estrategias terapéuticas recomendadas en consulta. A continuación, expondremos la evidencia creciente que avala a muchas terapias consideradas, hasta ahora, terapias alternativas y complementarias y que apoyan la apertura de nuestros enfoques tradicionales a utilizarlas o cuándo menos conocerlas. De hecho, estrategias actualmente respaldadas por la medicina basada en la evidencia, en un pasado no muy lejano, fueron consideradas terapias alternativas y complementarias, por lo que la designación de un tratamiento como medicina basada en la evidencia o terapia alternativas y complementarias es algo dinámico.
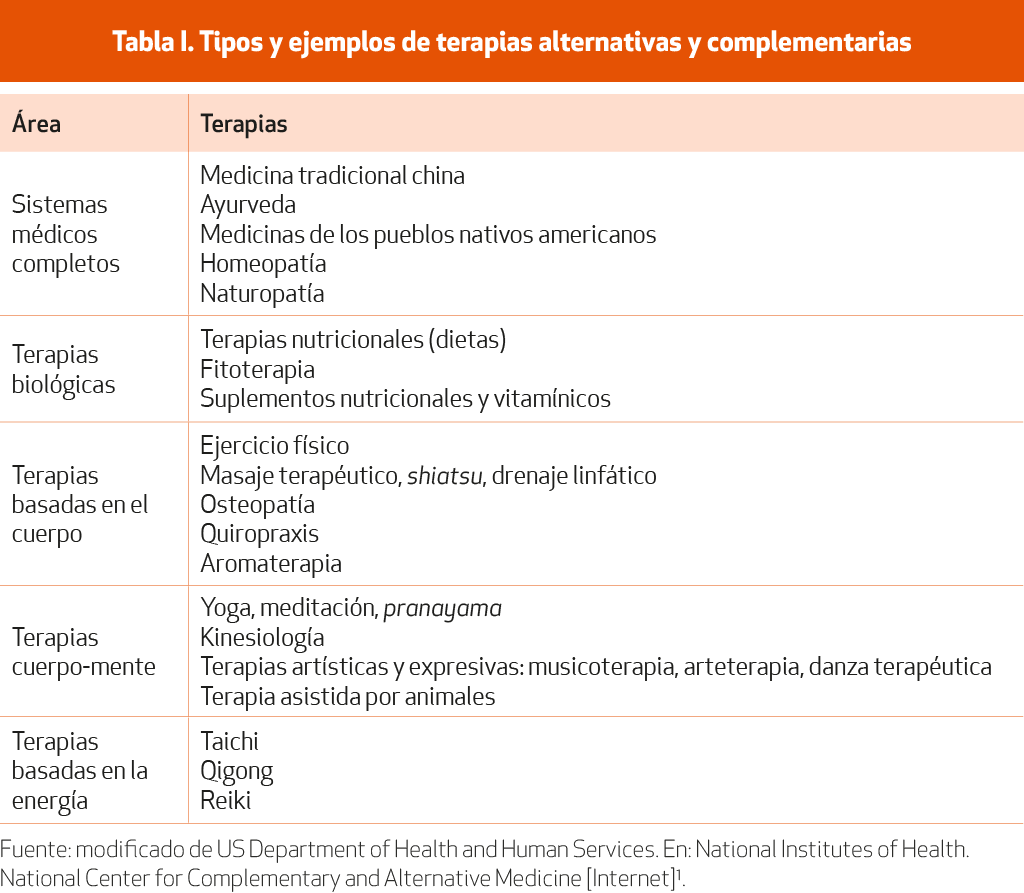
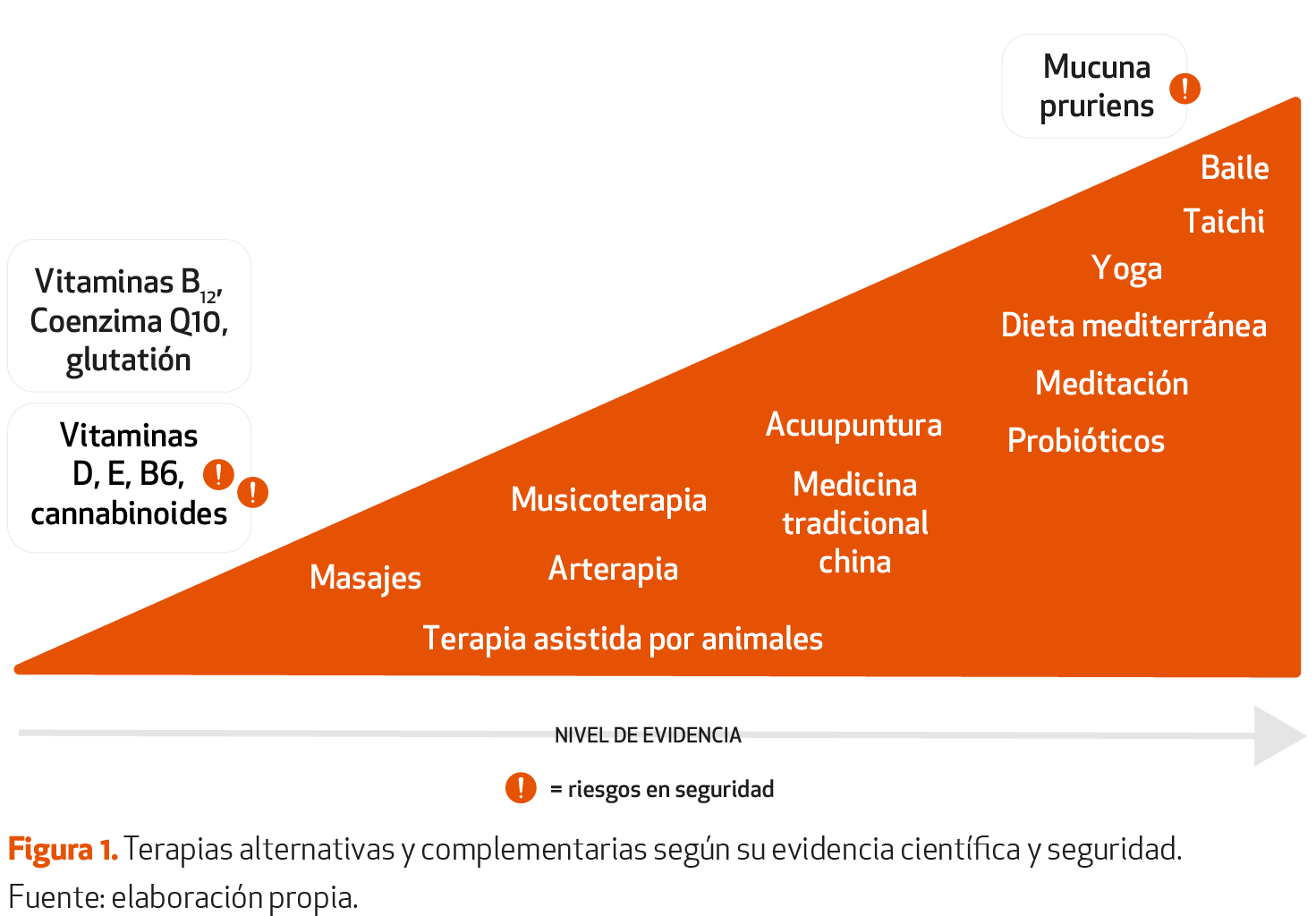
Tanto a nivel poblacional como en las personas con la enfermedad de Parkinson (EP), las terapias alternativas y complementarias suscitan un creciente interés3,5-7. Entre el 40 y el 80% de la población mundial emplea en algún momento terapias alternativas y complementarias, especialmente en Asia, pero también en países occidentales, sobre todo como tratamiento de enfermedades crónicas. Los estudios en personas con EP en Europa y Norteamérica arrojan cifras en torno al 40-60%5. En gran parte del mundo, los tratamientos considerados alternativos desde la perspectiva occidental son la medicina predominante (por ejemplo, medicinas tradicionales orientales), con profundas raíces históricas y culturales, sus propios sistemas de formación, cobertura sanitaria por los seguros médicos y regulación propia. Muchas veces son la única medicina o la más accesible y económica para la población2,3.
Los beneficios potenciales de las terapias alternativas y complementarias son diversos. Muchas promueven un enfoque más holístico, integral, y un papel activo de la persona en el manejo de sus síntomas, así como un énfasis en la prevención y bienestar global. Específicamente, muchas se orientan a aliviar el estrés, que tiene un impacto fundamental, tanto en desenmascarar como agravar los síntomas de la EP8. Cuando se desarrollan en grupos de afectados, pueden promover la aceptación de la enfermedad, la conexión social y evitar el aislamiento y la soledad, tan deletéreas para el estado de salud global2. Pueden ser útiles, tener sentido y significado para las personas con EP, e incorporarlas puede potenciar su autonomía, la promoción de la salud y una medicina personalizada9.
Como neurólogos, el conocimiento sobre las terapias alternativas y complementarias es muy relevante en nuestra práctica clínica diaria. Debemos contar con información actualizada para poder aconsejar adecuadamente a las personas con EP y prevenir el fraude, la adopción de terapias que puedan poner en riesgo su seguridad, o hacerles incurrir en gastos no justificados, así como retrasar el inicio de una terapia adecuada y necesaria. Se estima que la mayoría de las personas con EP no comparte con sus médicos la toma de suplementos o fármacos considerados como terapias alternativas y complementarias, lo que puede producir interacciones con la medicación pautada, o producir efectos adversos inesperados y difíciles de interpretar7. Un diálogo abierto sobre las terapias alternativas y complementarias, cuando son de interés personal para el paciente, promueve una relación de confianza, y facilita la información completa de todas las partes.
Bibliografía
1. US Department of Health and Human Services. En: National Institutes of Health. National Center for Complementary and Alternative Medicine [Internet]. Disponible en: https://www.nccih.nih.gov/
2. Kola S, Subramanian I. Updates in Parkinson’s Disease Integrative Therapies: an Evidence- Based Review. Curr Neurol Neurosci Rep. 2023; 23(11):717-26.
3. Subramanian I. Complementary and Alternative Medicine and Exercise in Nonmotor Symptoms of Parkinson’s Disease. Int Rev Neurobiol. 2017;134:1163-88.
4. Bega D, Zadikoff C. Complementary & alternative management of Parkinson’s disease: an evidence-based review of eastern influenced practices. J Mov Disord. 2014;7(2):57- 66.
5. Soto-Lara M, Silva-Loredo M, Monroy-Córdoba JR, et al. Alternative medicine therapies in neurological disorders: Prevalence, reasons and associated factors. A systematic review. Complement Ther Med. 2023;73:102932.
6. Scorza FA, Fiorini AC, Scorza CA, et al. Complementary Medicine in Parkinson Disease: Once Again, Surprisingly Effective. Arch Phys Med Rehabil. 2018;99(7):1438-9.
7. Lökk J, Nilsson M. Frequency, type and factors associated with the use of complementary and alternative medicine in patients with Parkinson’s disease at a neurological outpatient clinic. Parkinsonism Relat Disord. 2010;16(8):540-4.
8. Van der Heide A, Trenkwalder C, Bloem BR, et al. The Last Straw: How Stress Can Unmask Parkinson’s Disease. J Parkinsons Dis. 2024;14(4):889-93.
9. Nijhuis FAP, van den Heuvel L, Bloem BR, et al. The Patient’s Perspective on Shared Decision- Making in Advanced Parkinson’s Disease: A Cross-Sectional Survey Study. Front Neurol. 2019;10:896.
Ayurveda
La medicina ayurvédica cuenta con milenios de antigüedad y es empleada por el 80% de la población de India y Nepal. Su enfoque se centra en el análisis del individuo, de su composición (doshas) y puntos de desequilibrio. Las medidas terapéuticas se basan en cambios en el estilo de vida, medidas dietéticas, ejercicios espirituales, remedios derivados de las plantas y masajes, así como ejercicios respiratorios (ej. pranayama, que se discutirá en una sección posterior)2,10. Uno de sus productos estrella, la mucuna pruriens, es una planta leguminosa cuya semilla contiene levodopa en elevada concentración y se emplea para el tratamiento de la EP. Ampliamente distribuida en países tropicales y subtropicales, las semillas se adquieren en mercados locales y no requieren procesamiento para su consumo, lo que las hace el tratamiento más accesible y económico para la EP en estas áreas10. La dosis equivalente a 100 mg de levodopa ronda en torno a 400 mg de mucuna según un estudio de eficacia11. Dos estudios aleatorizados, con diseño y metodología robustos, pero con seguimiento muy corto, han demostrado la no inferioridad de la mucuna pruriens con respecto a levodopa asociada a un inhibidor de la dopadecarboxilasa (NE-II); en uno de ellos la tolerabilidad fue mejor, el inicio del efecto más rápido y las discinesias menos graves para la mucuna, mientras que en el otro hubo problemas de tolerancia con el cambio rápido de levodopa convencional a mucuna11,12. En nuestro medio, el uso de mucuna está limitado por su precio elevado (aunque hay gran variabilidad) y su comercialización como suplemento dietético. Como tal, está sometida a regulaciones limitadas, lo cual genera una gran variabilidad de tipos y formatos de mucuna (en polvo, en cápsulas) y un contenido real frente al etiquetado altamente variable (del 6 al 143%)13. Por tanto, en la práctica clínica, es difícil iniciar un tratamiento con mucuna por el riesgo de sobre o infra dosificación. La toma en combinación con levodopa convencional, especialmente si no se informa de ella en consulta, puede complicar la eficacia y seguridad del esquema de tratamiento.
Medicina tradicional china
La medicina tradicional china es un sistema complejo de milenios de antigüedad, que actualmente sigue empleando al menos el 75% de la población China2. El concepto central es la energía (Qi), que fluye por canales (meridianos) por nuestro cuerpo; cuando el flujo se altera, el desequilibrio se manifiesta en el cuerpo con la enfermedad perceptible. El objetivo de los tratamientos es restablecer el flujo normal de energía, basándose en fármacos derivados de productos naturales (más de 60 preparados de combinaciones de hierbas), la acupuntura, y los ejercicios corporales (incluyendo el taichi y el qigong, que se discutirán en una sección posterior y también el taichi en el capítulo 12, sobre ejercicio físico en la enfermedad de Parkinson, pag. 307 y en el capítulo 10, sobre tratamiento de las manifestaciones motoras refractarias, pag. 251)2-4.
Es complicado estudiar los tratamientos farmacológicos de la medicina tradicional china, ya que la composición y la posología se personalizan para cada individuo y su dolencia concreta y son por tanto muy heterogéneos. Algunos productos pueden aportar beneficio en la EP por su actividad biológica natural, como es el caso del Banisteriopsis caapi, que es un inhibidor de la monoaminoxidasa, y el Qingxinhuatan tang (compuesto por 9 plantas y raíces) que ha demostrado actividad antiinflamatoria y antioxidante en modelos preclínicos3,4. Los estudios adolecen de escasa uniformidad metodológica, pocos son aleatorizados o ciegos, y las variables de eficacia son muy heterogéneas. En la EP, en conjunto han reportado mejorías motoras, pero sobre todo no motoras en síntomas como la depresión (Zishen Pingchan), la ansiedad, la disautonomía, la composición de la microbiota (Zhichan) y la calidad de vida (Pingchan); sin problemas de seguridad. Un metaanálisis de 2023 concluyó que estos productos ofrecen un efecto positivo en combinación con el tratamiento occidental de levodopa2,14,15 (NE-II).
La acupuntura es otra de las grandes ramas de la medicina tradicional china y se basa en la inserción de agujas a lo largo de puntos concretos de los meridianos energéticos, con el fin de restablecer el equilibrio y la salud. Se ha propuesto que la acupuntura puede actuar contra el estrés oxidativo, tener propiedades antiapoptóticas, e influir en la liberación de neurotransmisores2,4. Hasta la fecha, la investigación científica de la acupuntura presenta también limitaciones importantes: no hay estudios aleatorizados y controlados, la terapia es difícil enmascarar, los estudios publicados son de calidad subóptima y muchos se han publicado únicamente en chino, existen potenciales sesgos, y las medidas de eficacia seleccionadas son heterogéneas3. Los mayores beneficios potenciales parecen encontrarse en la esfera no motora, así como en potenciar los efectos del tratamiento convencional. Un metaanálisis de 17 ensayos clínicos (831 suje- tos con EP), seleccionados por su calidad, concluyó que la combinación de acupuntura con levodopa/benserazida fue más efectiva que el fármaco aislado (RR = 1,28, IC 95%: 1,18-1,38, p < 0,001) para la mejoría de las actividades de la vida diaria, la tolerabilidad gastrointestinal y neuropsiquiátrica de la levodopa y para las fluctuaciones; y no redujo significativamente las discinesias (NE-II)2,4,16,17.
Bibliografía
2. Kola S, Subramanian I. Updates in Parkinson’s Disease Integrative Therapies: an Evidence- Based Review. Curr Neurol Neurosci Rep. 2023; 23(11):717-26.
3. Subramanian I. Complementary and Alternative Medicine and Exercise in Nonmotor Symptoms of Parkinson’s Disease. Int Rev Neurobiol. 2017;134:1163-88.
4. Bega D, Zadikoff C. Complementary & alternative management of Parkinson’s disease: an evidence-based review of eastern influenced practices. J Mov Disord. 2014;7(2):57- 66.
10. Pathak-Gandhi N, Vaidya AD. Management of Parkinson’s disease in Ayurveda: Medicinal plants and adjuvant measures. J Ethnopharmacol. 2017;197:46-51.
11. Cilia R, Laguna J, Cassani E, et al. Mucuna pruriens in Parkinson disease: A double-blind, randomized, controlled, crossover study. Neurology. 2017;89(5):432-8.
12. Cilia R, Laguna J, Cassani E, et al. Daily intake of Mucuna pruriens in advanced Parkinson’s disease: A 16-week, noninferiority, randomized, crossover, pilot study. Parkinsonism Relat Disord. 2018;49:60-6.
13. Soumyanath A, Denne T, Hiller A, et al. Analysis of Levodopa Content in Commercial Mucuna pruriens Products Using High-Performance Liquid Chromatography with Fluorescence Detection. J Altern Complement Med. 2018 Feb;24(2):182-6.
14. Huang L, Hong J, Wang Y. Traditional Chinese Medicine for non-motor symptoms in Parkinson disease: A systematic review and meta-analysis of RCTs. Medicine (Baltimore). 2023 Jul 28;102(30):e34425.
15. Gu SC, Shi R, Gaoag C, et al. Traditional Chinese medicine Pingchan granule for motor symptoms and functions in Parkinson’s disease: A multicenter, randomized, double- blind, placebo-controlled study. Phytomedicine. 2023;108:154497.
16. Xia X, Dong X, Li K, et al. Treatment of Parkinson disease by acupuncture combined with medicine based on syndrome differentiation from the perspective of modern medicine: A review. Medicine (Baltimore). 2023;102:e34278.
17. Liu H, Chen L, Zhang Z, et al. Effectiveness and safety of acupuncture combined with Madopar for Parkinson’s disease: a systematic review with meta-analysis. Acupunct Med. 2017;35:404-12.
Dieta mediterránea y dieta basada en plantas
Los beneficios de la dieta mediterránea han ido consolidándose a lo largo de los últimos años gracias a estudios epidemiológicos, controlados y prospectivos, si bien este tipo de intervenciones son siempre complicadas de demostrar2,18-20. Además de la mejoría del riesgo vascular y del control de la hipertensión, la diabetes, la dislipemia y la patología vascular que pueden relacionarse con el riesgo de padecer EP, se han demostrado beneficios a nivel de prevención de deterioro cognitivo y la mejoría de los trastornos afectivos (depresión), los problemas de sueño e incluso los procesos oncológicos. Sus beneficios se deben tanto a la composición de macronutrientes como de micronutrientes y especialmente a la proporción de plantas y semillas, con sus variados fitoquímicos y contenido en fibra, aumento de omega 3 entre otras grasas saludables (aceite de oliva)2,18,19. Otras posibles aportaciones de esta dieta son la limitación del consumo de alimentos derivados de carne roja, la moderación en el consumo de lácteos, la reducción de la ingesta de grasas saturadas perjudiciales para la salud y probablemente las mejoras en la composición de la microbiota, así como el efecto sinérgico en distintos sistemas del organismo.
La adherencia a la dieta mediterránea se ha asociado con un menor riesgo de EP y una evolución más lenta de la enfermedad18-20. En estudios controlados en personas con EP, se ha demostrado su beneficio a nivel cognitivo, encontrándose mejorías en varios dominios (atención, funciones ejecutivas y lenguaje) y a nivel motor, con la reducción de las puntuaciones de la escala motora de la UPDRS18-20 (NE-II). Hay estudios en curso sobre su efecto en síntomas gastrointestinales y estreñimiento. Las dietas dietary approaches to stop hypertension (DASH) y mediterranean-DASH intervention for neurodegenerative delay (MIND) por sus acrónimos en inglés, son variantes de la dieta mediterránea orientadas al riesgo vascular y prevención de deterioro cognitivo respectivamente. También se ha observado menor incidencia de EP en estudios epidemiológicos relacionada con un consumo reducido de lácteos, aumento de consumo de café y té verde, y seguimiento de dietas basadas en plantas2.
Dieta cetogénica/ayuno intermitente
La dieta cetogénica y el ayuno intermitente o prolongado tienen como objetivo modificar la fuente de energía de los hidratos de carbono a las grasas (cuerpos cetónicos). Un ayuno por encima de las 12-14 horas consigue este efecto metabólico, y los beneficios para la salud son multidimensionales y prometedores, incluyendo la reducción del riesgo y tratamiento de la diabetes mellitus tipo 2, el mejor control de la hipertensión, mejoras en patología vascular, pérdida de peso, mejoras en la composición corporal, composición de la microbiota, regulación del sueño, y aumento de capacidad antioxidante y regulación de procesos de oncogénesis21. Hay evidencia preclínica de propiedades neuroprotectoras en relación con enfermedades neurodegenerativas (NE-IV).
Por otro lado, la dieta cetogénica, bien estudiada en otras áreas de la neurología como la epilepsia, busca el mismo objetivo a base de enriquecer la dieta en grasas y reducir la ingesta de hidratos de carbono, lo que puede producir algunos efectos adversos como trastornos del metabolismo lipídico, falta de adherencia por ser poco palatable, y pérdida de peso que puede ser desfavorable en personas con EP2,21. La adherencia a estos patrones dietéticos puede ser difícil de mantener a medio y largo plazo, lo que complica obtener evidencia de sus efectos. El ayuno intermitente no se ha estudiado formalmente en la EP; mientras que hay estudios randomizados de seguimiento corto de dieta cetogénica, con beneficios en escalas motoras y no motoras2,21 (NE-III).
Suplementos, vitaminas, cannabinoides, probióticos
La evidencia sobre el beneficio de los suplementos dietéticos es mucho menor2,22. A pesar de lo atractivo y sencillo de incorporarlos, es improbable que añadir un suplemento a una dieta no optimizada vaya a producir cambios profundos, y parece que nuestro organismo tiene una capacidad mayor de extraer las sustancias beneficiosas de los alimentos que de los suplementos. El interés por estos productos es elevado entre personas con EP, y es importante indagar en su uso por los riesgos que entrañan algunos de ellos. Además, los suplementos dietéticos están exentos de la aprobación de agencias reguladoras como la FDA desde 1984, al igual que los productos de homeopatía (desde 1938)23.
En primer lugar, conviene destacar aquellos cuya ineficacia se ha probado en ensayos controlados multicéntricos de buena calidad: suplementos de glutatión, creatina, vitamina E, suplementos vitamínicos grupo B, fólico y coenzima Q10 entre otros24-27. También aquellos que conllevan riesgo de intoxicación: vitamina D y E (por ser liposolubles), vitamina B6 (piridoxina, que puede producir polineuropatía), suplementos minerales (el manganeso, por ejemplo, puede producir un cuadro de distonía parkinsonismo por depósito de metales cerebral)28 (NE-I para no efectividad).
Los suplementos de cannabis y otros productos derivados se han estudiado en ensayos controlados, sin demostrar eficacia, a pesar de los resultados de ensayos abiertos y su tremenda popularidad. Es más, conllevan riesgo de psicosis y efectos adversos cognitivos, lo que se debería advertir a las personas que quieran probarlos29-30 (NE-I para no efectividad).
Mención aparte merecen los probióticos. El fundamento de su uso es mejorar la composición de la microbiota, ya que se ha demostrado disbiosis en personas con Parkinson, que se ha relacionado a nivel teórico con una peor absorción de los fármacos, complicaciones motoras y clínica gastrointestinal2. La evidencia se va acumulando, orientando a un beneficio modesto, pero significativo, con un perfil de seguridad adecuado y buena tolerabilidad. Los beneficios se han observado en áreas motoras, ánimo, cognición y sueño, pero sobre todo a nivel digestivo: estudios controlados con placebo demuestran mejoría del estreñimiento (frecuencia y consistencia de deposiciones) y tránsito digestivo, además de calidad de vida global2,31 (NE-I). El mayor inconveniente radica en su precio, ya que estos productos no están financiados por el sistema nacional de salud. Su uso no sustituye a la composición saludable y adecuada de la dieta, especialmente en contenido en fibra, frutas y verduras.
Bibliografía
2. Kola S, Subramanian I. Updates in Parkinson’s Disease Integrative Therapies: an Evidence- Based Review. Curr Neurol Neurosci Rep. 2023; 23(11):717-26.
18. Bisaglia M. Mediterranean Diet and Parkinson’s Disease. Int J Mol Sci. 2022;24:42.
19. Van der Berg I, Schootemeijer S, Overbeek K, et al. Dietary Interventions in Parkinson’s Disease. J Parkinsons Dis. 2024;14(1):1-16.
20. Tresserra-Rimbau A, Thompson AS, Bondonno N, et al. Plant-Based Dietary Patterns and Parkinson’s Disease: A Prospective Analysis of the UK Biobank. Mov Disord. 2023;38(11):1994-2004.
21. de Cabo R, Mattson MP. Effects of Intermittent Fasting on Health, Aging, and Disease. N Engl J Med. 2019;381(26):2541-51.
22. Wu L, Chu L, Pang Y, et al. Effects of dietary supplements, foods, and dietary patterns in Parkinson’s disease: meta-analysis and systematic review of randomized and crossover studies. Eur J Clin Nutr. 2024;78(5):365-75.
23. Angell M, Kassirer JP. Alternative medicine - the risks of untested and unregulated remedies. N Engl J Med. 1998;339(12):839-41.
24. Zhu ZG, Sun MX, Zhang WL, et al. The efficacy and safety of coenzyme Q10 in Parkinson’s disease: a meta-analysis of randomized controlled trials. Neurol Sci. 2017;38(2):215-24.
25. Shoulson I. DATATOP: a decade of neuroprotective inquiry. Parkinson Study Group. Deprenyl And Tocopherol Antioxidative Therapy Of Parkinsonism. Ann Neurol. 1998;44(3 Suppl 1):S160-6.
26. Vrolijk MF, Opperhuizen A, Jansen EHJM, et al. The vitamin B6 paradox: Supplementation with high concentrations of pyridoxine leads to decreased vitamin B6 function. Toxicol In Vitro. 2017;44:206-12.
27. Flores-Torres MH, Christine CW, Bjornevik K, et al. Long-Term Intake of Folate, Vitamin B6, and Vitamin B12 and the Incidence of Parkinson’s Disease in a Sample of U.S. Women and Men. Mov Disord. 2023;38(5):866-79.
28. Sönmez D, Hocaoğlu Ç. Manganese Intoxication Presenting with Depressive Symptoms: A Case Report. Noro Psikiyatr Ars. 2023;60(3):288-91.
29. Varshney K, Patel A, Ansari S, et al. Cannabinoids in Treating Parkinson’s Disease Symptoms: A Systematic Review of Clinical Studies. Cannabis Cannabinoid Res. 2023;8(5):716-30.
30. Domen CH, Sillau S, Liu Y, et al. Cognitive Safety Data from a Randomized, Double-Blind, Parallel-Group, Placebo-Controlled Phase IIb Study of the Effects of a Cannabidiol and Δ9-Tetrahydrocannabinol Drug on Parkinson’s Disease-Related Motor Symptoms. Mov Disord. 2023;38(7):1341-6.
31. Hor JW, Toh TS, Lim SY, et al. Advice to People with Parkinson’s in My Clinic: Probiotics and Prebiotics. J Parkinsons Dis. 2024:10.3233/JPD-240172.
Ejercicio físico
Afortunadamente, el cuerpo científico que apoya los efectos holísticos del ejercicio físico ha promovido su inclusión en las terapias basadas en la evidencia, lo que supone un poderoso ejemplo de transición de complementario/alternativo a acreditarse como tratamiento efectivo (ver capítulo 12 de esta guía)32,33 (NE-I). Es el ejercicio aeróbico, probablemente por ser el más sencillo de homogeneizar y comparar en términos de intensidad, duración y frecuencia, el que aglutina más estudios. El entrenamiento de fuerza, de alta intensidad a intervalos, resistencia, así como los ejercicios de flexibilidad y equilibrio siguen su estela34. En personas con Parkinson, especialmente si hay dolor o limitaciones significativas de movilidad, la supervisión de estos ejercicios por parte de un fisioterapeuta (por ejemplo, en pilates guiado por este tipo de especialistas) será lo más adecuado para evitar lesiones, optimizar la eficacia y proporcionar una pauta ajustada a las necesidades individuales. El ejercicio físico se revisa en más detalle en el capítulo 12 (pag. 307 ).
Otras terapias basadas en el cuerpo, pero de carácter pasivo, se encuentran en diferente situación. A pesar de su amplia difusión en nuestro medio, no existen estudios que respalden la osteopatía en personas con Parkinson. En cuanto al masaje terapéutico, un metaanálisis de estudios encontró un beneficio significativo, pero de cuantía ínfima (reducción de menos de un punto de la UPDRS motora), por lo que no hay argumentos que respalden su recomendación35 (NE-IV).
Bibliografía
32. Bloem BR, Okun MS, Klein C. Parkinson’s disease. Lancet. 2021;397(10291):2284-303.
33. Schootemeijer S, van der Kolk NM, Bloem BR, et al. Current Perspectives on Aerobic Exercise in People with Parkinson’s Disease. Neurotherapeutics. 2020;17(4):1418-33.
34. Harpham C, Gunn H, Marsden J, et al. The feasibility, safety, physiological and clinical effects of high-intensity interval training for people with Parkinson’s: a systematic review and meta-analysis. Aging Clin Exp Res. 2023; 35(3):497-523.
35. Kang Z, Xing H, Lin Q, et al. Effectiveness of therapeutic massage for improving motor symptoms in Parkinson’s disease: A systematic review and meta-analysis. Front Neurol. 2022;13:915232.
En este epígrafe encontraremos estrategias muy variadas, que tienen en común una activación tanto física como mental, promoviendo una integración cuerpo-mente. La atención plena y la respiración consciente son relevantes en muchas de ellas, así como la interacción social, al practicarse en grupo, lo que conlleva sus propios beneficios potenciales en cuanto a reducir el aislamiento, promover la aceptación de la enfermedad y la autoestima, el sentido y significado en la vida y reducir el estigma2.
Respiración y movimiento: yoga, meditación, pranayama
Los ejercicios de meditación buscan entrenarnos para focalizar la atención en un objeto, comúnmente la respiración. La forma de meditar más habitual es la meditación formal sedente: en una postura erguida, pero cómoda, con los ojos cerrados, se trata de atender a la entrada y salida del aire, y cuando las distracciones aparezcan, volver suavemente el foco de atención a la respiración, una y otra vez, repitiendo el ejercicio de forma regular y durante periodos cada vez más prolongados36. Los beneficios de la meditación se deben tanto a los cambios a nivel cerebral (promoción de funciones ejecutivas y red de la relevancia, regulación y estructuración de la red por defecto, regulación de áreas límbicas, como la ínsula y la amígdala y de la memoria, como el hipocampo) como al impacto en el sistema vegetativo, con un refuerzo del parasimpático superior (mielínico, el llamado freno vagal) y regulación a la baja de la estimulación simpática, observable en parámetros como la variabilidad de la frecuencia cardiaca (habitualmente reducida en personas con EP, y otras enfermedades crónicas)37,38. La práctica de la meditación actúa en múltiples esferas: mejoría de parámetros cardiovasculares, ansiedad, ánimo, sueño, y dolor crónico, entre otras. Los términos meditación y mindfulness se emplean a nivel práctico como sinónimos, especialmente en países occidentales. El programa Mindfulness Based Stress Reduction (MBSR), desarrollado en los años 70 por Jon Kabat-Zinn en la Universidad de Massachussets, estructura diferentes ejercicios de meditación, que incluyen también meditación en movimiento, uso de visualización mental y ejercicios de yoga, entre otros, en un esquema intensivo de 8 semanas, y se ha estudiado ampliamente en distintas aplicaciones en la salud, tanto mental como física, con beneficios significativos en estudios representativos, aleatorizados y controlados39.
Los ejercicios de respiración, o pranayama, tienen su origen en la tradición india del yoga y la medicina ayurvédica2-4,38. Se trata de practicar la respiración consciente, meditativa, siguiendo unas pautas y ritmos muy variados, que pueden buscar la relajación o la activación del sujeto. Algunos, por la intensidad de la experiencia, requieren la supervisión de un guía o maestro, pero hay muchos ejercicios sencillos (respiración alternante, respiración resonante) que pueden practicarse de forma autónoma, constituyendo actividades meditativas sencillas y accesibles a coste cero, sin problemas de seguridad o necesidad de adaptación2,3. La principal limitación de la meditación es la resistencia generalizada a permanecer inactivos y quietos, dispersando el ruido mental y focalizándose en la respiración. La adherencia y la motivación suelen ser bajas cuando se practica de forma individual, por lo que la práctica en grupo puede ser aconsejable.
Aunque en occidente se considera una forma de ejercicio físico, realmente el yoga es una filosofía de vida (o filosofías, ya que existe una gran diversidad de estilos y metodologías) que busca la integración del individuo, a través de la unión del cuerpo y la mente, del individuo con el ser y con el mundo sensible. Como tal, implica actividades de estudio, tareas meditativas, ejercicios de respiración, cambios dietéticos y de estilo de vida, cambios en la relación con los demás y el mundo, además de la práctica de asana: movimientos acoplados a la respiración, que resultan en una forma de meditación en movimiento. Esta parte del yoga (hatha yoga) se ha difundido ampliamente por todo el mundo, con gran éxito por sus beneficios físicos y mentales, que suelen ser evidentes en poco tiempo2-4.
En el contexto de la EP, en la que las limitaciones motoras conllevan rigidez, lentitud de movimiento y problemas de equilibrio, a nivel vegetativo existe una sobre activación simpática y menor flexibilidad en las transiciones; el estrés tiene un impacto global muy característico, tanto en desenmascarar como en agravar los síntomas; los problemas no motores tienen tal repercusión en la calidad de vida; parece plausible que el yoga y la meditación puedan ser de utilidad. Así lo demuestran los estudios que se han acumulado en los últimos años. Estudios aleatorizados de programas cortos (6-8 semanas) han demostrado mejorías en equilibrio, marcha, freezing de la marcha, caídas y UPDRS III, siendo también positivo un metaanálisis de 14 estudios randomizados en EP leve a moderada que demostró seguridad y mejorías a nivel motor y de equilibrio, ansiedad, depresión, y sueño2,40 (NE-I). Cuando se ha comparado el yoga con el ejercicio físico convencional o de estiramiento/resistencia, ha resultado similar en escalas motoras, pero superior a nivel de equilibrio, depresión, ansiedad, bienestar espiritual y calidad de vida, además de en el aumento de la variabilidad de la frecuencia cardiaca2,41. Los ejercicios de mindfulness y pranayama se han estudiado también en estudios no controlados (programas de 6-8 semanas), encontrándose beneficios funcionales, en percepción de estrés y ansiedad, insomnio, calidad de vida y actividades de la vida diaria. En la población general, se han realizado estudios que apuntan a cambios anatómicos cerebrales, ya que la neuroimagen muestra un aumento de la densidad de la sustancia gris hipocampal, del caudado y de la unión temporoparietal con la práctica de yoga38,42-44 (NE-I).
Terapias basadas en la energía: taichi / qigong
El taichi procede de la medicina tradicional china y comparte con el yoga el aunar respiración y movimiento de forma consciente, constituyendo de nuevo una forma de meditación y movimiento. Los ejercicios de taichi son habitualmente lentos, y la respiración profunda, lo que promueve especialmente el equilibrio y la flexibilidad2-4. Mientras que el taichi se considera un arte marcial que implica movimientos amplios y continuos; el qigong, que también implica respiración, se basa en movimientos más lentos, simétricos y estáticos. El qigong tiene la intención de potenciar el flujo energético del qi, para reforzar la salud, el bienestar y la longevidad.
El taichi se ha difundido ampliamente por el mundo y se ha estudiado extensivamente en la EP, con excelentes resultados, especialmente para la estabilidad postural, la prevención de caídas y la capacidad funcional45 (NE-I). Recientemente un estudio con un seguimiento amplio, de 3-5 años, demostró beneficios sostenidos en estas áreas, además de síntomas no motores, menor tasa de complicaciones motoras, menor dosis equivalente de levodopa y una progresión más lenta46. Se tratan los beneficios del taichi en la EP en el capítulo 12 sobre ejercicio físico (pag. 307) y en el capítulo 10 sobre manifestaciones motoras refractarias (pag. 251).
Los estudios de qigong de momento no han ofrecido beneficios motores, únicamente se ha demostrado mejoría en insomnio2.
Terapias expresivas / artísticas: baile, pintura, canto, escritura
Si bien la evidencia científica es aún limitada, las terapias expresivas y artísticas ganan peso e interés para las personas con EP en todo el mundo. El desarrollo en grupo, el disfrute de la actividad, su componente lúdico, la expresión creativa, con su impacto dopaminérgico, son probablemente claves en los beneficios observados y en la buena adherencia y satisfacción de los participantes47,49. Los estudios disponibles reflejan mayor aceptación de la enfermedad y autoestima, reducción del estigma y la sensación de soledad, todos ellos elementos cardinales en el pronóstico de la enfermedad y salud global2.
El baile, especialmente el tango, sí dispone de abundante evidencia científica de efectividad en la EP, con ensayos bien diseñados y controlados que demuestran beneficios en equilibrio y síntomas motores y no motores (incluyendo cognición), autoestima y calidad de vida50,51 (NE-I). También se han analizado ritmos de baile binarios y cuaternarios, encontrándose beneficios en equilibrio, freezing de la marcha y la UPDRS III2. Se han diseñado programas combinados de baile y fisioterapia cuyos beneficios son mayores que la fisioterapia aislada. La superioridad aparente respecto al ejercicio puede estar relacionada con las variables señaladas previamente, y también con el efecto de la música, que puede mejorar la velocidad del paso, la cadencia y la coordinación motora. Se han publicado estudios que demuestran una mayor eficacia de la marcha en cinta y libre con el acompañamiento de música o metrónomo, que caminar en silencio52,53.
En esta línea, dos estudios randomizados analizaron el efecto de la musicoterapia (tocar el tambor con un ritmo dado) encontrando mejorías en la función de la extremidad superior y la atención2. El análisis de la musicoterapia es complejo por la gran heterogeneidad de estudios, protocolos y variables de eficacia, y de momento no permite extraer conclusiones claras54 (NE-IV). Un metaanálisis enfocado en los estudios de musicoterapia para mejorar los problemas de voz solo encontró diferencias significativas en la respiración, tiempo de fonación y el rango de frecuencia vocal, pero no en la calidad de vida o la discapacidad relacionada con la voz55,56.
De modo similar, de momento existen pocos estudios sobre la biodanza o la terapia artística. En estudios abiertos, se ha observado mejoría en tareas visuo-cognitivas, procesamiento visuoespacial y función motora global (NE-IV)2,48.
Terapia asistida por animales
El ser humano tiene en general una inclinación natural a relacionarse con otros seres vivos, especialmente animales, lo que se conoce como biofilia. En nuestro medio, la convivencia con animales domésticos es común, y se ha asociado a efectos positivos, especialmente en el caso de perros: sus cuidadores gozan de mejor salud general y vascular; con mejores cifras de tensión arterial, glucemia, lipemia, menor riesgo de asma infantil, una reducción del 31% en mortalidad cardiovascular y 24% de mortalidad global, menos visitas médicas, una reducción del 27% de mortalidad tras ictus o infarto de miocardio, y una mejor recuperación de enfermedades médicas agudas57. Un estudio prospectivo reciente comprobó mejores puntuaciones cognitivas en personas mayores de 65 años que habían convivido con una mascota al menos 5 años frente a aquellos que no58. El origen de estos cambios es, con certeza, multifactorial, pero probablemente se relacione con una reducción de sentimientos de soledad, apatía, la promoción de responsabilidad y sentido en la vida, mayor actividad física, menor estrés, una mayor conexión social en la comunidad y una mejor regulación emocional57,59.
Más allá de los estudios epidemiológicos y de salud comunitaria, en las áreas de salud mental (trastornos mentales, espectro autista) y enfermedades neurodegenerativas, hay pocos estudios que permitan analizar sus efectos. Dado el escaso interés económico y las dificultades pragmáticas de llevarlos a cabo, es improbable que surjan60 (NE-IV). El grado de convivencia, de responsabilidad en los cuidados y el vínculo con el animal de compañía son complejos de estandarizar; la relación puede ser diferente con distintas especies animales, y, lógicamente, no es posible el control con placebo. Estudios observacionales (fundamentalmente con perros, algunos con caballos) han recogido mejorías en calidad de vida en varias enfermedades neurológicas (esclerosis múltiple, supervivientes de ictus). En los entornos institucionales de personas con demencias, las experiencias con perros son alentadoras, con mejorías visibles en motivación, iniciativa, comunicación, e interacción social61.
En el área de la EP, dos estudios abiertos de equinoterapia, en los que los participantes se ocupaban del cuidado, paseo, alimentación de los animales, además de ejercicios de vocalización y respiraciones, observaron una mejoría significativa en actividades de la vida diaria, calidad de vida, escala UPDRS motora y equilibrio61,62 (NE-IV). Siendo la accesibilidad a los caballos bastante limitada, se ha valorado la experiencia de los perros de terapia como asistencia a problemas de la marcha de la EP, como el freezing. Un artículo recogía la historia de una persona con EP de inicio temprano, cuya evolución negativa a pesar de sucesivos ajustes de tratamiento y terapias de segunda línea (apomorfina) cambió a raíz de comenzar a vivir con un perro, mejorando su clínica motora, no motora y su funcionalidad global63. Son este tipo de experiencias las que podemos escuchar en consulta, y que, en ausencia de ensayos reglados, pueden invitarnos a considerar la recomendación de incorporar un animal de compañía en personas con EP, si tienen sensibilidad hacia ellos y capacidad logística de asumir sus cuidados.

Bibliografía
2. Kola S, Subramanian I. Updates in Parkinson’s Disease Integrative Therapies: an Evidence- Based Review. Curr Neurol Neurosci Rep. 2023; 23(11):717-26.
3. Subramanian I. Complementary and Alternative Medicine and Exercise in Nonmotor Symptoms of Parkinson’s Disease. Int Rev Neurobiol. 2017;134:1163-88.
4. Bega D, Zadikoff C. Complementary & alternative management of Parkinson’s disease: an evidence-based review of eastern influenced practices. J Mov Disord. 2014;7(2):57- 66.
36. Diez GG, Castellanos N. Investigación de mindfulness en neurociencia cognitiva. Rev Neurol. 2022;74(5):163-9.
37. Van der Heide A, Speckens AEM, Meinders MJ, et al. Stress and mindfulness in Parkinson’s disease - a survey in 5000 patients. NPJ Parkinsons Dis. 2021;7(1):7.
38. Zaccaro A, Piarulli A, Laurino M, et al. How Breath-Control Can Change Your Life: A Systematic Review on Psycho-Physiological Correlates of Slow Breathing. Front Hum Neurosci. 2018;12:353.
39. Calderone A, Latella D, Impellizzeri F, et al. Neurobiological Changes Induced by Mindfulness and Meditation: A Systematic Review. Biomedicines. 2024;12(11):2613.
40. Kwok JYY, Kwan JCY, Auyeung M, et al. Effects of Mindfulness Yoga vs Stretching and Resistance Training Exercises on Anxiety and Depression for People With Parkinson Disease: A Randomized Clinical Trial. JAMA Neurol. 2019;76(7):755-63.
41. Kwok JYY, Choi EPH, Lee JJ, et al. Effects of Mindfulness Yoga Versus Conventional Physical Exercises on Symptom Experiences and Health-related Quality of Life in People with Parkinson’s Disease: The Potential Mediating Roles of Anxiety and Depression. Ann Behav Med. 2022;56(10):1068-81.
42. Lin HW, Tam KW, Kuan YC. Mindfulness or meditation therapy for Parkinson’s disease: A systematic review and meta-analysis of randomized controlled trials. Eur J Neurol. 2023;30(8):2250-60.
43. Van de Wetering-van Dongen VA, Kalf JG, van der Wees PJ, et al. The Effects of Respiratory Training in Parkinson’s Disease: A Systematic Review. J Parkinsons Dis. 2020;10(4):1315-33.
44. Pickut B, Vanneste S, Hirsch MA, et al. Mindfulness Training among Individuals with Parkinson’s Disease: Neurobehavioral Effects. Parkinsons Dis. 2015; 2015:816404.
45. Li F, Harmer P, Fitzgerald K, et al. Tai chi and postural stability in patients with Parkinson’s disease. N Engl J Med. 2012;366(6):511-9.
46. Li G, Huang P, Cui S, et al. Effect of long-term Tai Chi training on Parkinson’s disease: a 3.5-year follow-up cohort study. J Neurol Neurosurg Psychiatry. 2024;95(3):222-8.
47. Ettinger T, Berberian M, Acosta I, et al. Art therapy as a comprehensive complementary treatment for Parkinson’s disease. Front Hum Neurosci. 2023;17:1110531.
48. Cucca A, Di Rocco A, Acosta I, et al. Art therapy for Parkinson’s disease. Parkinsonism Relat Disord. 2021;84:148-54.
49. Carter AM, Dioso ER, Romero B, et al. Complementary Medicine and Expressive Arts Therapy: Adjuvant for Recovery Following Neurosurgical Procedures. OBM Integr Compliment Med. 2023; 8(1):10.21926/obm.icm.2301007.
50. Meulenberg CJW, Rehfeld K, Jovanović S, et al. Unleashing the potential of dance: a neuroplasticity-based approach bridging from older adults to Parkinson’s disease patients. Front Aging Neurosci. 2023;15:1188855.
51. Norton E, Hemingway A, Ellis Hill C. The meaning and impact on well-being of bespoke dancing sessions for those living with Parkinson’s. Int J Qual Stud Health Well-being. 2023;18(1):2245593.
52. Berti A, Pini M, Ferrarello F. Argentine tango in the care of Parkinson’s disease: A systematic review and analysis of the intervention. Complement Ther Med. 2020; 52:102474.
53. Feenstra W, Nonnekes J, Rahimi T, et al. Dance classes improve self-esteem and quality of life in persons with Parkinson’s disease. J Neurol. 2022;269(11):5843-7.
54. Tamplin J, Morris ME, Baker FA, et al. ParkinSong Online: protocol for a telehealth feasibility study of therapeutic group singing for people with Parkinson’s disease. BMJ Open. 2021;11(12):e058953.
55. Alqutub A, Alqutub A, Mogharbel AM, et al. Effectiveness of Singing-Based Therapy on Voice Outcomes in Parkinson’s Disease: A Systematic Review and Meta-Analysis. J Voice. 2024: S0892-1997(24)00351-5.
56. Machado Sotomayor MJ, Arufe-Giráldez V, Ruíz-Rico G, et al. Music Therapy and Parkinson’s Disease: A Systematic Review from 2015–2020. Int J Environ Res Public Health. 2021;18(21):11618.
57. McNicholas J, Gilbey A, Rennie A, et al. Pet ownership and human health: a brief review of evidence and issues. BMJ. 2005;331(7527):1252-4.
58. Applebaum JW, Shieu MM, McDonald SE, et al. The impact of sustained ownership of a pet on cognitive health: A population-based study. J Aging Health. 2023;35(3-4):230-41.
59. Martos Martínez-Caja A, De Herdt V, et al. Pet ownership, feelings of loneliness, and mood in people affected by the first COVID-19 lockdown. J Vet Behav. 2022;57:52-63.
60. Boldig CM, Butala N. Pet Therapy as a Nonpharmacological Treatment Option for Neurological Disorders: A Review of the Literature. Cureus. 2021;13(7):e16167.
61. Mittly V, Farkas-Kirov C, Zana Á, et al. The effect of animal‑assisted interventions on the course of neurological diseases: a systematic review. Syst Rev. 2023;12(1):224.
62. Berardi A, Di Napoli G, Ernesto M, et al. The Effectiveness of Equine Therapy Intervention on Activities of Daily Living, Quality of Life, Mood, Balance and Gait in Individuals with Parkinson’s Disease. Healthcare (Basel). 2022;10(3):561.
63. Zakeri N, Bain PG. Sustained improvement in a patient with young onset Parkinson’s disease after the arrival of a pet dog. J Neurol. 2010;257(8):1396-7.
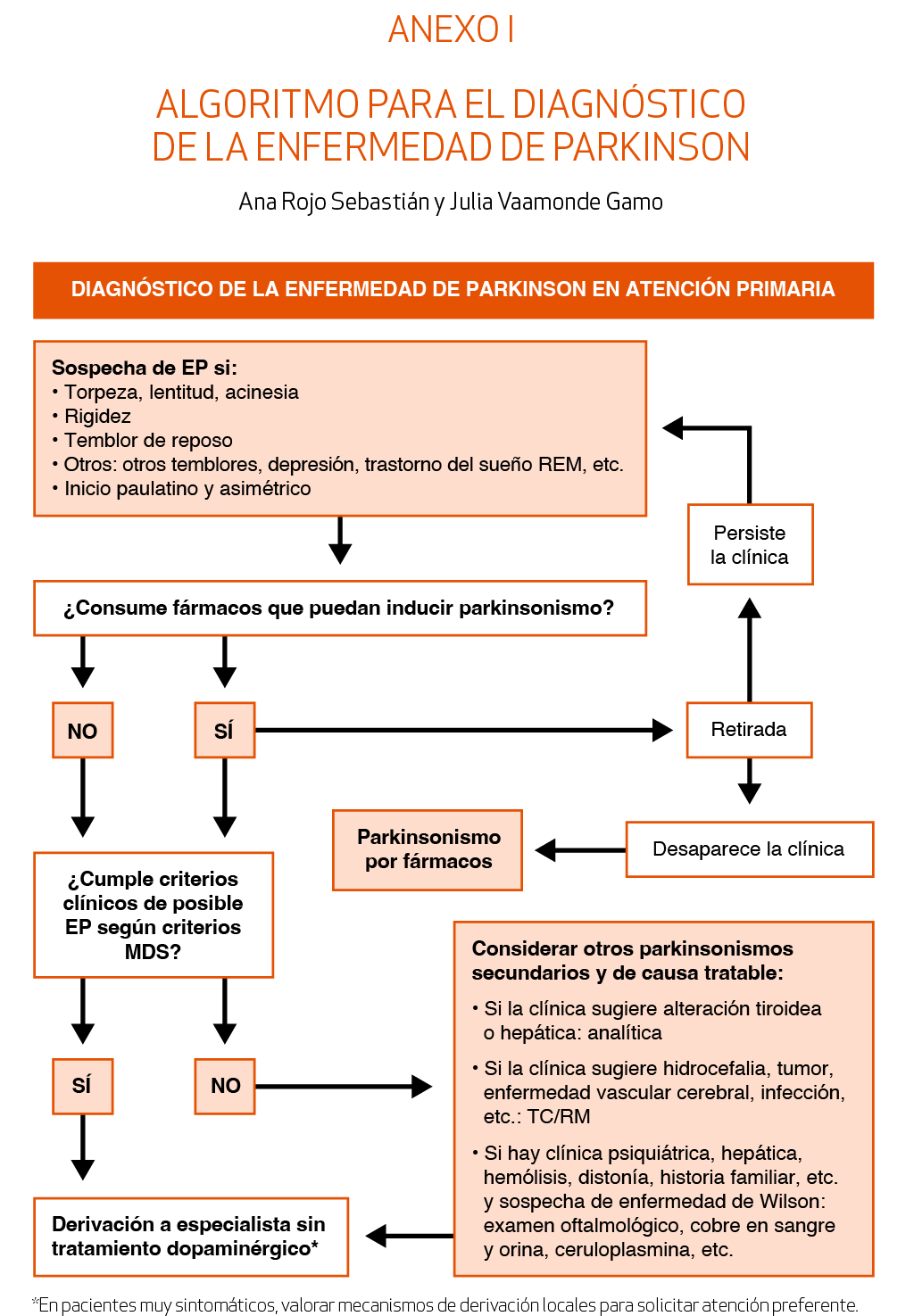
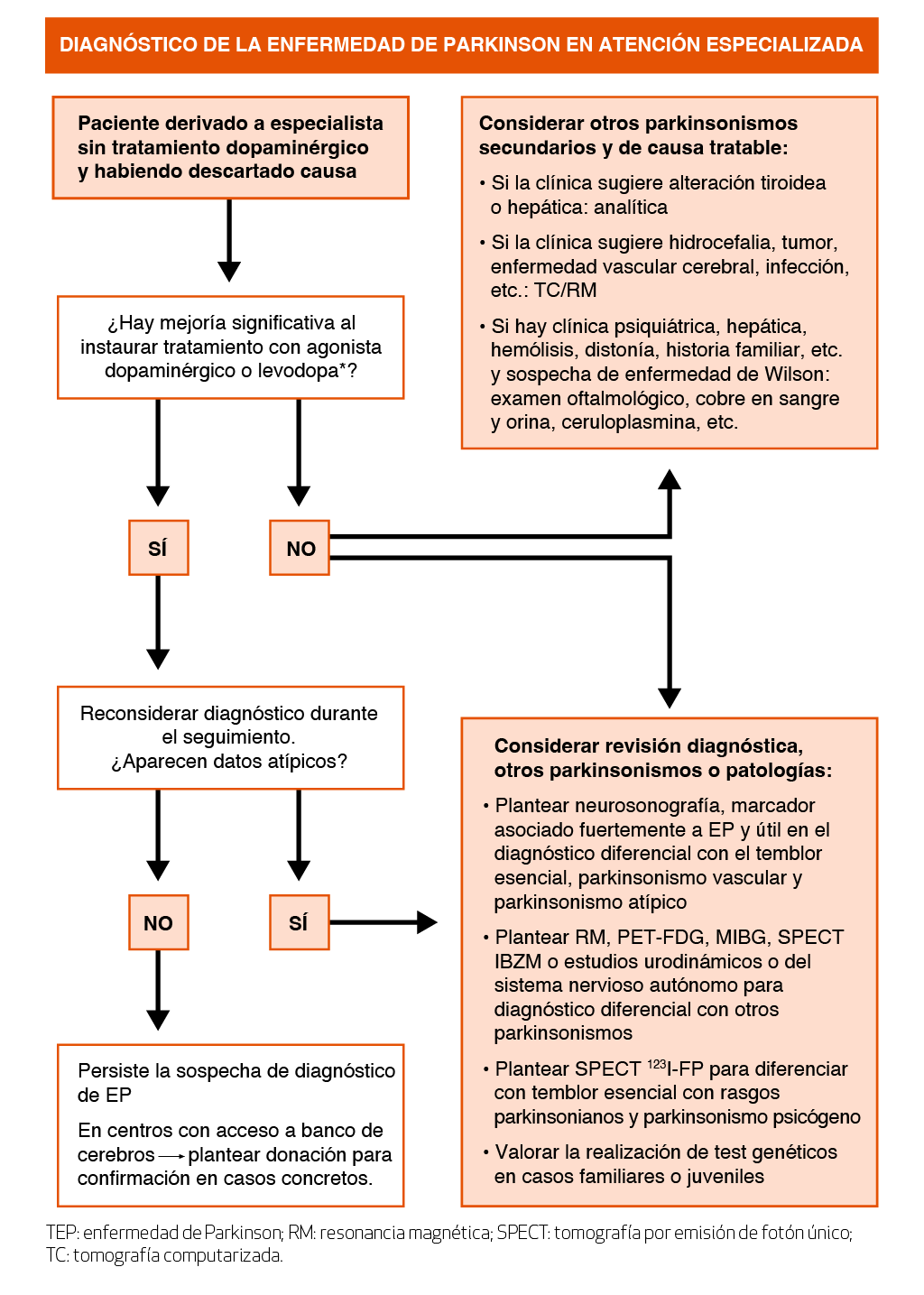
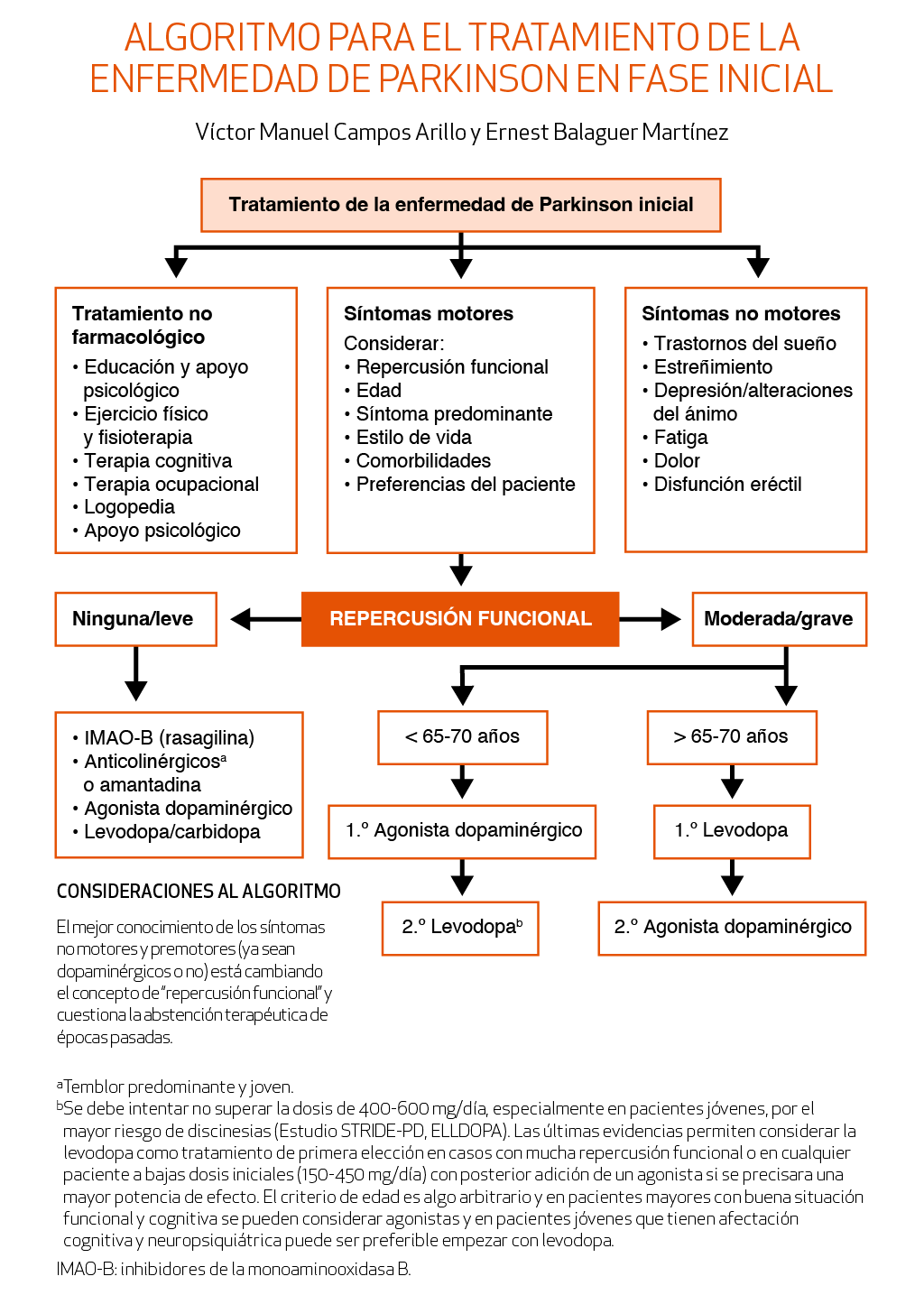
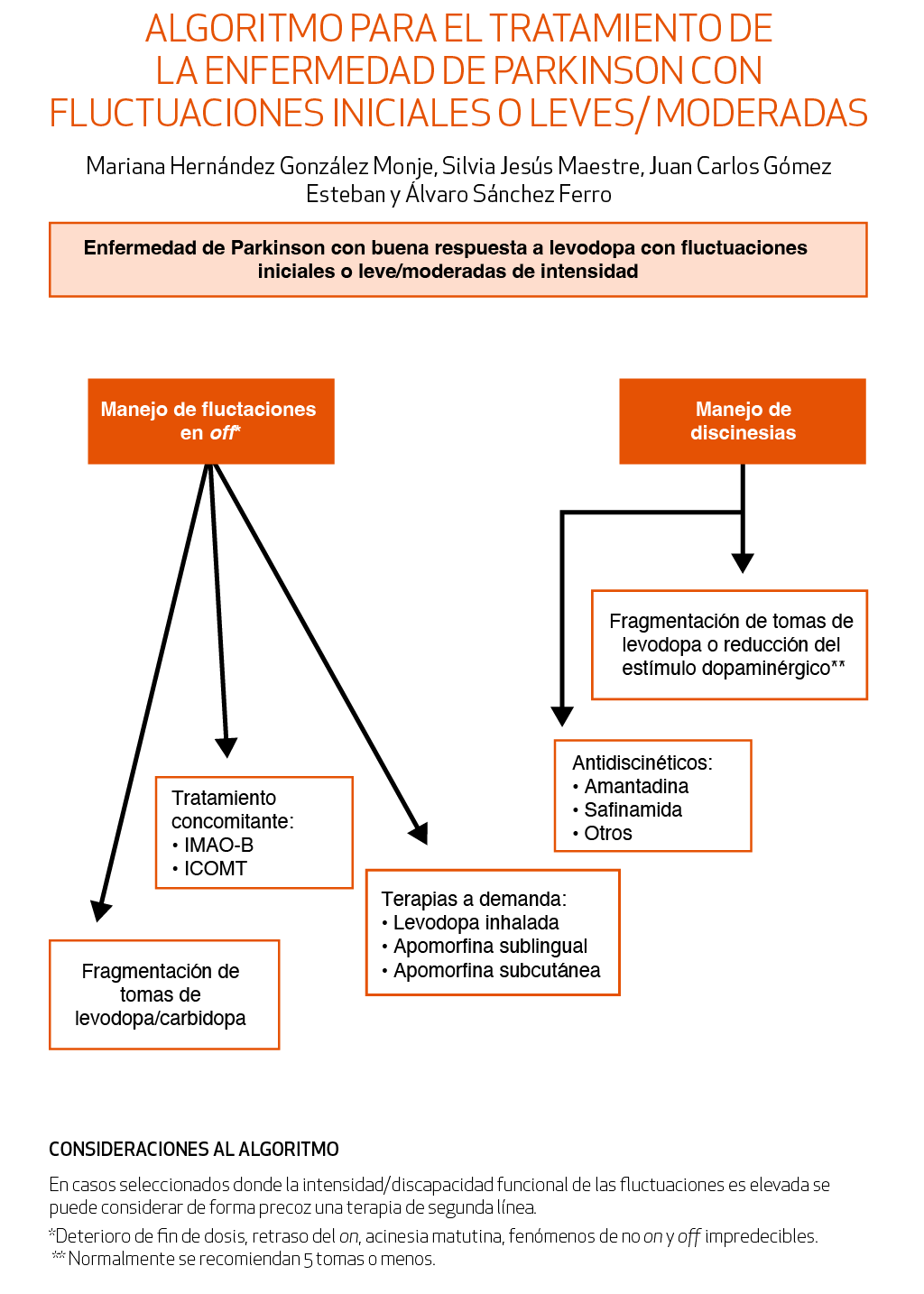
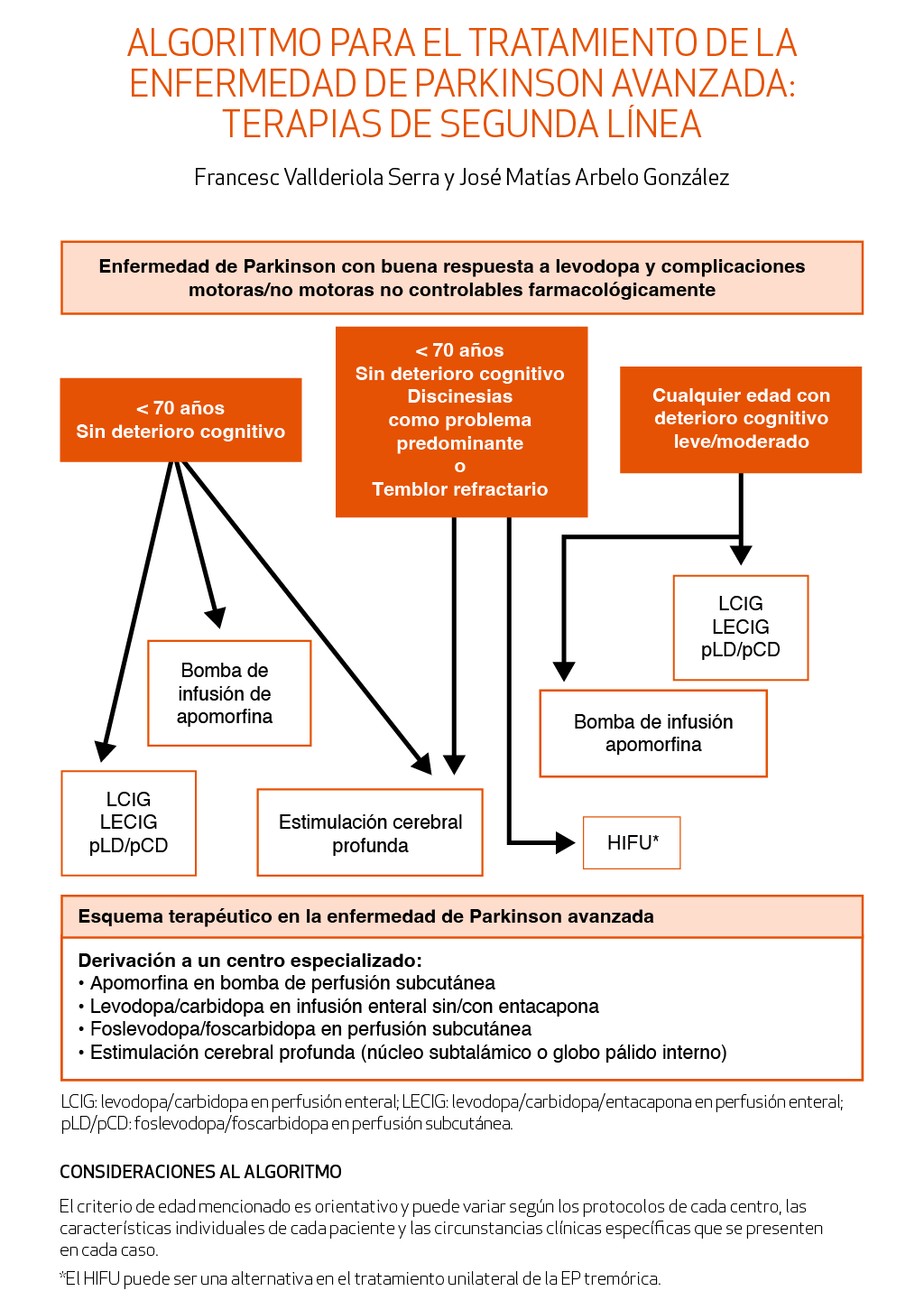
ENLACES DE INTERÉS
Enlaces de la MDS Society: https://www.movementdisorders.org/MDS/Resources/Helpful-Links.htm
Enlaces GETM: https://getm.sen.es/profesionales/servicios/enlaces
Calculadora 1: equivalentes de levodopa: https://www.parkinsonsmeasurement.org/toolBox/levodopaEquivalentDose.htm
Calculadora 2: equivalentes de levodopa: https://movementdisorders.onlinelibrary.wiley.com/doi/full/10.1002/mds.29410#:~: text=mds29410%2Dsup%2D0001%2DDataS1.xlsm
Criterios Diagnósticos de Enfermedad de Parkinson: https://www.movementdisorders.org/MDS/News/Newsroom/Position-Papers/MDS-Position-Diagnosis-of-PD.htm
Calculadora de riesgo de enfermedad Parkinson prodrómica: https://www.movementdisorders.org/Prodromal-PD-Calculator.htm
Escalas recomendadas por la MDS Society: https://www.movementdisorders.org/MDS/MDS-Clinical-Outcome-Assessment.htm#assessments