


La EP se caracteriza por manifestaciones motoras (temblor, rigidez, bradicinesia, trastornos de la marcha y del equilibrio) y múltiples síntomas no motores (trastornos cognitivos, del estado de ánimo, gastrointestinales, autonómicos, del sueño, etc.). Además, en el curso de la enfermedad pueden surgir diversas complicaciones (discinesias, fluctuaciones, psicosis) como consecuencia de la interrelación entre su progresión y los efectos del tratamiento. Todo ello deteriora gravemente el estado de salud, la autonomía y la calidad de vida del paciente.
Ante una entidad tan compleja como la EP, es necesario contar con instrumentos de evaluación que ayuden a identificar la presencia de algunas manifestaciones o complicaciones, cuantifiquen su gravedad e impacto, documenten la evolución del proceso, valoren el efecto de las intervenciones terapéuticas y faciliten el intercambio de información entre clínicos, con otros profesionales y con los propios pacientes y sus familias. Por último, estas evaluaciones pueden suponer la base para la toma de decisiones y la planificación y asignación de recursos en política sanitaria.
Tradicionalmente, la evaluación de la EP se ha centrado en los síntomas motores y en sus consecuencias directas (pérdida de capacidad funcional), así como en los resultados del tratamiento. Algunas de las escalas desarrolladas para estos fines son frecuentemente utilizadas, tales como la clasificación evolutiva de Hoehn y Yahr1 o la escala de Schwab y England (SES)2. Algunos de estos instrumentos carecen de estudios formales de validación de sus propiedades psicométricas3, aunque en los últimos años diversos estudios han paliado, al menos parcialmente, tal carencia.
La necesidad de evaluaciones multidimensionales que incluyan discapacidad, signos motores, síntomas no motores y complicaciones asociadas al tratamiento han propiciado el diseño de escalas como la UPDRS4 y las Scales for Outcomes in Parkinson’s Disease-Motor (SCOPA-M)5.
En las últimas décadas la actividad en este campo se centra en la revisión de escalas ya existentes, como la llevada a cabo por la MDS sobre la UPDRS (MDS-UPDRS)6, en el desarrollo de instrumentos para aspectos específicos de la EP (deterioro cognitivo, conductas relacionadas con control de impulsos, sueño, etc.) y para la detección y evaluación unificada de síntomas no motores, así como en las revisiones sistemáticas de estos métodos de evaluación. Diversos grupos de trabajo de la IPMDS Task Forces, por ejemplo, están llevando a cabo esta tarea desde 2003.
El desarrollo de una escala sigue una metodología que consta de diversas fases: 1) especificación de los objetivos, propósito, formato y modo de aplicación de la escala; 2) selección de los componentes del instrumento (ítems, dominios), el marco temporal, el formato y redacción de las preguntas y respuestas, y el rango de puntuación; 3) estudios piloto; 4) obtención de la versión definitiva de la escala, y 5) estudios de validación.
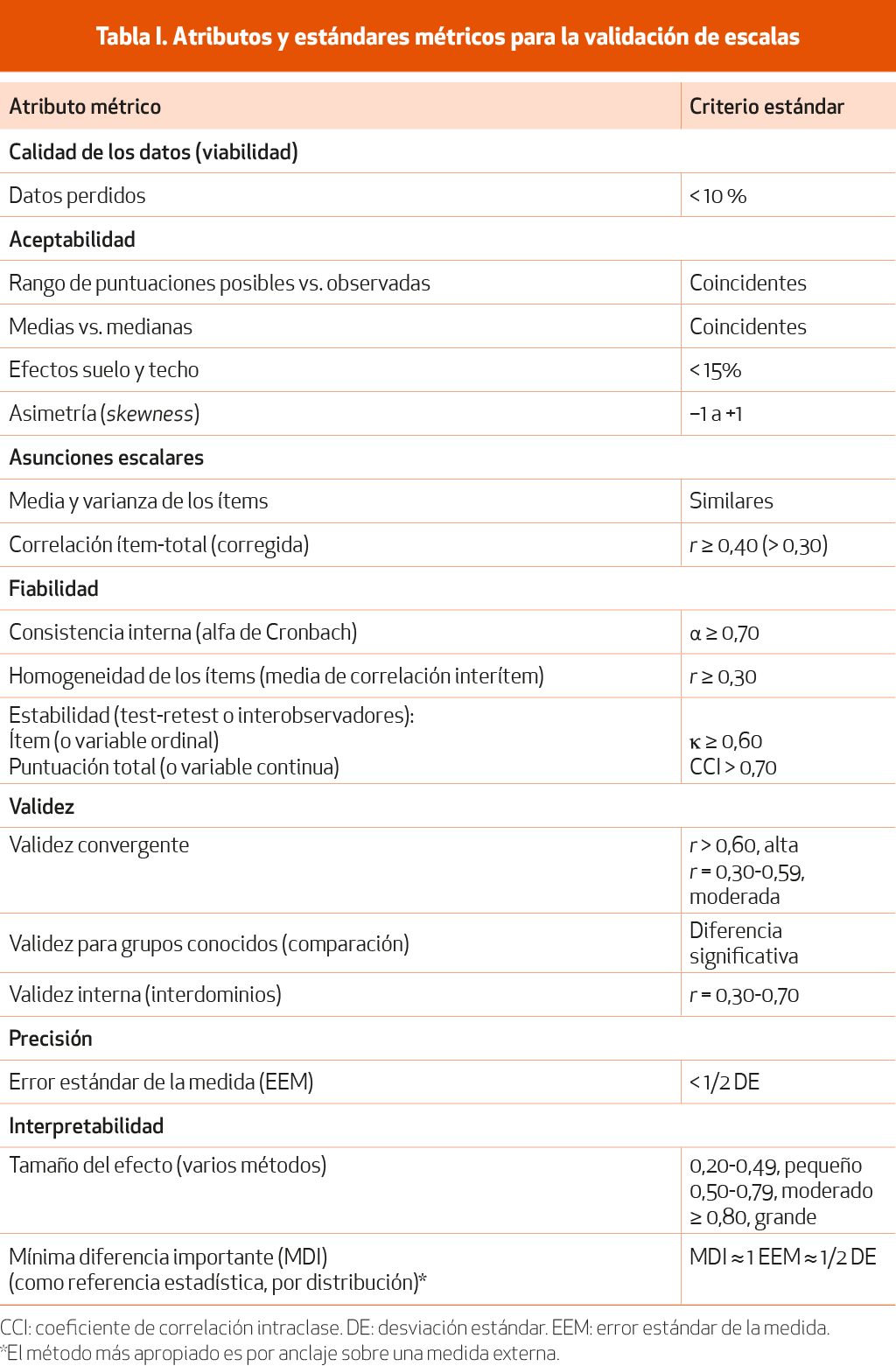
Validar una escala consiste en comprobar su calidad como instrumento de diagnóstico o medida, aplicando análisis estadísticos de diferentes atributos y siguiendo un conjunto de normas y estándares basados en métodos y teorías científicas de la medida de la salud7. Para ello, el instrumento se pone a prueba en un conjunto amplio y representativo de la población a la que va destinado (muestra) y los datos se analizan para determinar una serie de propiedades: 1) viabilidad (hasta qué punto la medida es utilizable en el contexto previsto); 2) aceptabilidad (se refiere a lo admisible que resulta el instrumento para la población diana y a la apropiada distribución de las puntuaciones de la escala); 3) asunciones escalares (agrupamiento de los ítems en la escala y posibilidad de su suma directa); 4) fiabilidad (hasta qué punto la escala está libre de error aleatorio, es decir, hasta qué punto existe una interrelación entre sus componentes y las puntuaciones son estables); 5) validez (establece si la escala mide realmente aquello para lo que fue diseñada); 6) precisión o sensibilidad (capacidad de la escala para detectar pequeñas diferencias); 7) sensibilidad al cambio (capacidad del instrumento para detectar cambios tras una intervención o a lo largo del tiempo), y 8) interpretabilidad (asignación de un significado fácilmente comprensible a las puntuaciones y a sus cambios). En la Tabla I se presentan las técnicas de análisis más frecuentemente utilizadas para estimar estos atributos, así como los criterios para establecer su calidad.
A la hora de utilizar una escala es necesario tener en cuenta, además, la carga del instrumento (conjunto de tiempo, esfuerzo y requerimientos necesarios para su uso) relacionada con la viabilidad, así como la necesidad de adaptación transcultural, en el caso de que se vaya a utilizar en un contexto cultural o en una población diferente a la original (por ejemplo, en otro país).
A continuación, se describen brevemente las escalas específicamente diseñadas para evaluación de la EP y que son recomendadas por la IPMDS siguiendo los principios de medicina basada en la evidencia que se han detallado de manera específica para este capítulo en el apartado de “Metodología” (Pág. 13). La clasificación de una escala como recomendada depende de que cumpla las siguientes condiciones: 1) que la escala haya sido utilizada en EP; 2) que se haya los desarrolladores originales; 3) que tenga estudios sobre sus propiedades psicométrica que al menos que incluyan fiabilidad, validez y sensibilidad al cambio.
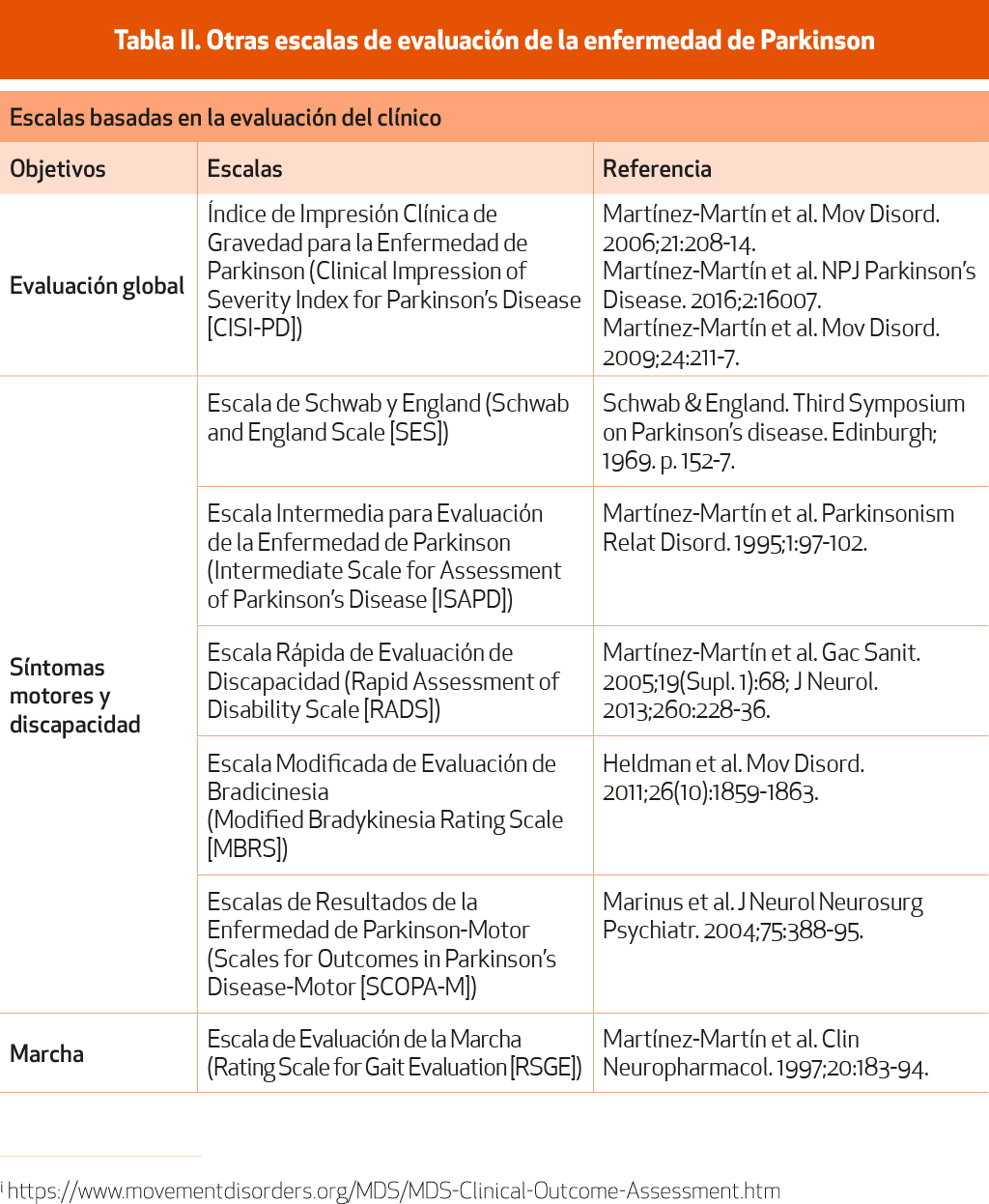
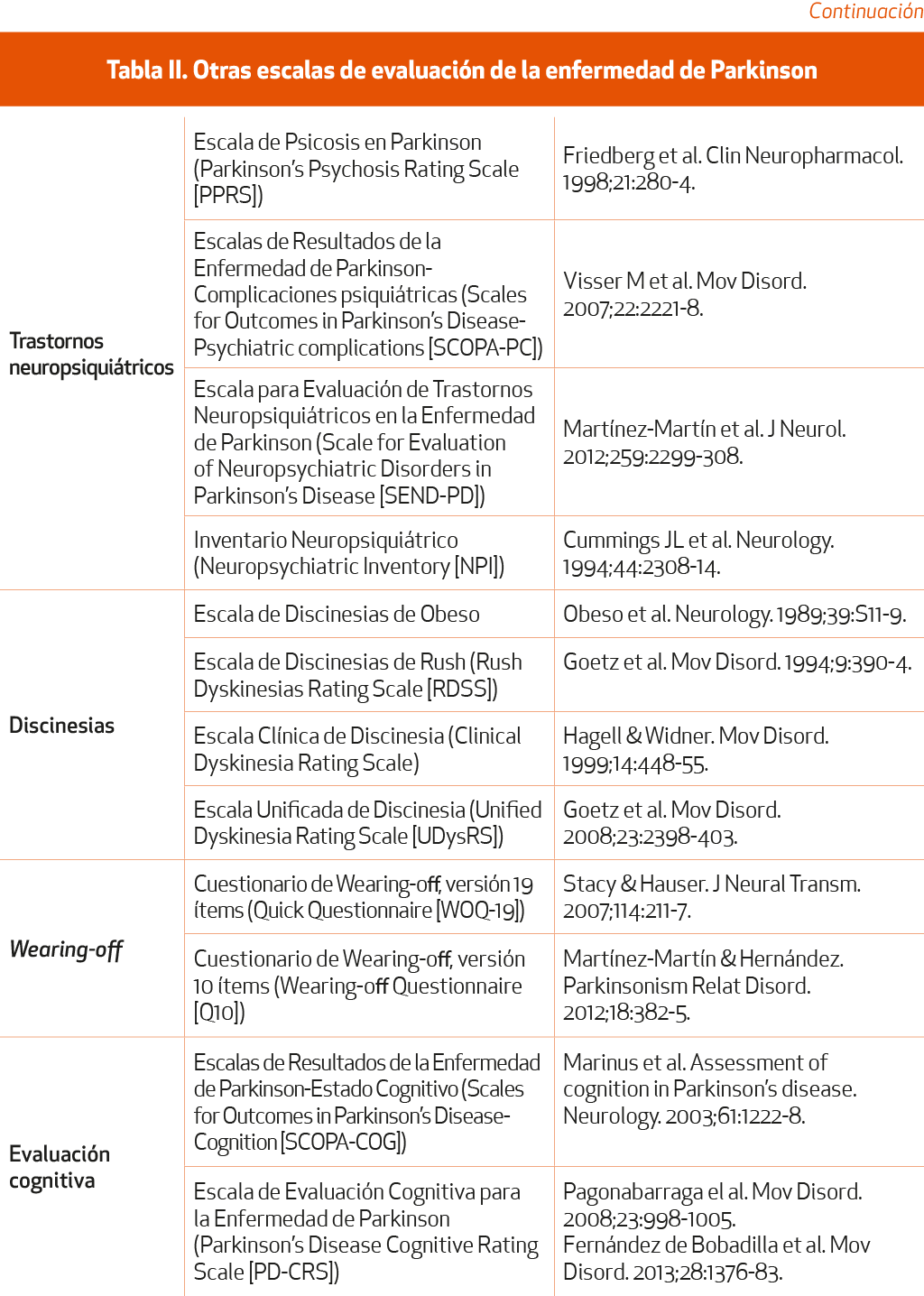
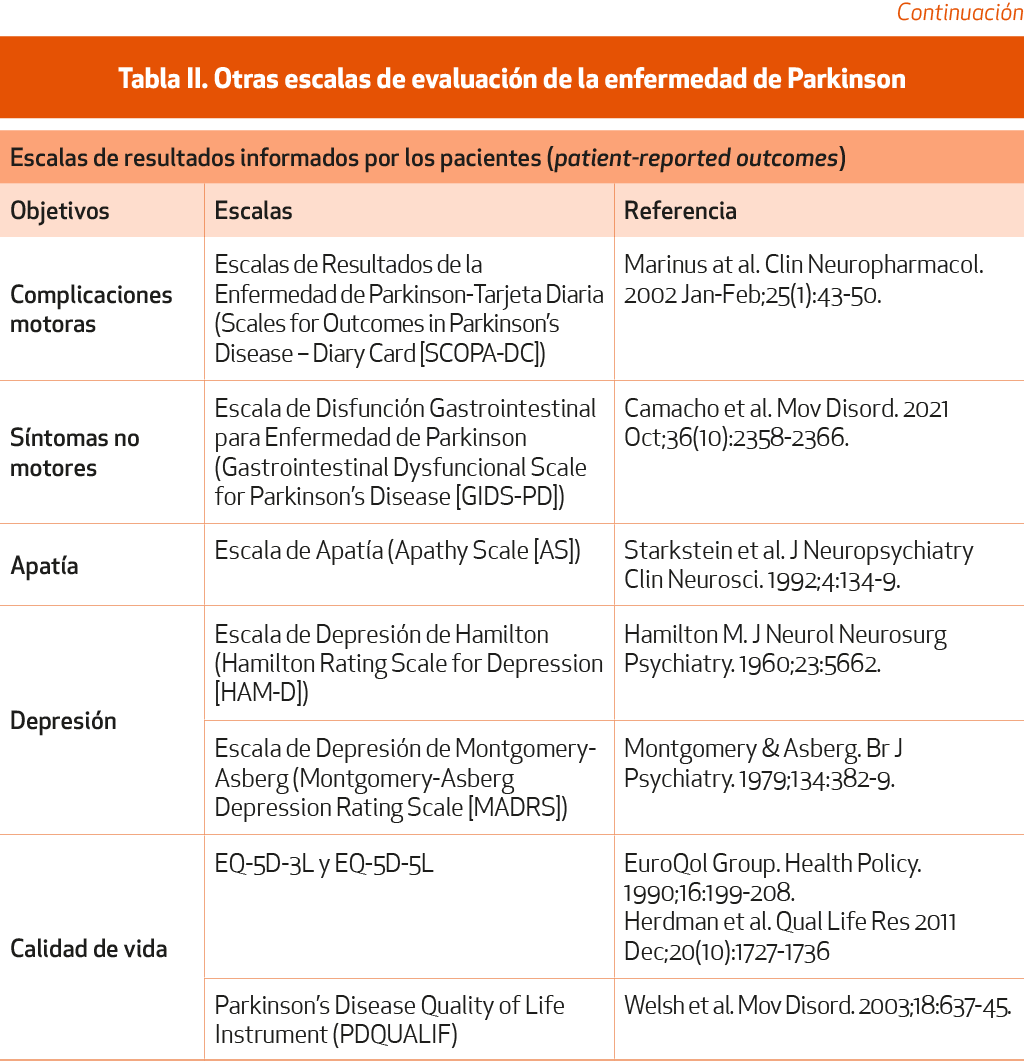
Muchas de estas escalas son propiedad de la IPMDS y su uso requiere permisoi. Otras escalas, que no cumplen las condiciones de recomendación de la IPMDS, que no son específicas de EP o que no cuentan con estudios completos de validación, se muestran en la Tabla II.
1. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology. 1967;17(5):427-442.
2. Schwab R, England A. Third Symposium for Parkinson’s Disease. Livingstone; 1969.
3. Ramaker C, Marinus J, Stiggelbout AM, et al. Systematic evaluation of rating scales for impairment and disability in Parkinson’s disease. Mov Disord. 2002;17(5):867-876.
4. Fahn S, Elton R, UPDRS program members. Unified Parkinson’s disease rating scale. En: Fahn S, Marsden C, Goldstein M, et al. (eds.). Recent Developments in Parkinson’s Disease. Vol. 2. Macmillan Healthcare Information; 1987:153-163.
5. Marinus J, Visser M, Stiggelbout AM, et al. A short scale for the assessment of motor impairments and disabilities in Parkinson’s disease: the SPES/SCOPA. J Neurol Neurosurg Psychiatr. 2004;75(3):388-395.
6. Goetz CG, Fahn S, Martínez Martín P, et al. Movement Disorder Society sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS UPDRS): Process, format, and clinimetric testing plan. Mov Disord. 2007;22(1):41-47.
7. Nunnally JC, Bernstein IH. Psychometric Theory. McGraw Hill; 1994.
La MDS-UPDRS sustituyó a la Escala Unificada de la Enfermedad de Parkinson (UPDRS)4,8 como escala de referencia en investigación y en las agencias reguladoras.
Las limitaciones de la UPDRS, principalmente la falta de instrucciones precisas para los evaluadores, la heterogeneidad de las puntuaciones, el solapamiento y redundancia de algunos ítems, la ausencia de algunos síntomas no motores importantes y el sesgo cultural en la redacción de algunos de los ítems motivaron su revisión y el desarrollo de una nueva versión, la MDS-UPDRS6.
La MDS-UPDRS, propiedad de la MDS, se compone de cuatro secciones: Parte I. Aspectos no motores de las experiencias de la vida diaria (13 ítems: 6 evaluados por el profesional, 7 por el paciente); Parte II. Aspectos motores de las experiencias de la vida diaria (13 ítems autoevaluados por el paciente); Parte III. Exploración motora (18 ítems evaluados por el profesional, que proporcionan 33 puntuaciones al considerar la distribución en diversas regiones corporales); y Parte IV. Complicaciones motoras (2 ítems para discinesias y 4 para fluctuaciones, puntuados por el evaluador)6,.
Todos los ítems tienen instrucciones para una aplicación uniforme, dirigidas al paciente, evaluador o ambos. Cada ítem presenta 5 opciones de puntuación, de 0 (normal) a 4 (intenso, grave). La puntuación total para cada sección se obtiene por la suma de las puntuaciones de los ítems correspondientes, pero no hay una puntuación total de la escala.
La MDS-UPDRS muestra unas propiedades psicométricas satisfactorias. Sus puntuaciones diferencian significativamente entre grupos de edad, duración de la enfermedad y del tratamiento y entre estadios de Hoehn y Yahr. También muestra una adecuada sensibilidad al cambio.
Existe un programa de entrenamiento para obtener la certificación de competencia en el uso de la escalaii y la escala ha sido adaptada transculturalmente y validada en diversos países, incluyendo la versión en español.
La escala de Hoehn y Yahr fue desarrollada hace más de 50 años para proporcionar una evaluación global del paciente con EP (función motora y progresión de la enfermedad) de manera simple y descriptiva1. La versión original consta de seis niveles (de estadio 0: no hay signos de enfermedad, a estadio 5: confinado en silla de ruedas o encamado si no tiene ayuda).
La escala de de Hoehn y Yahr constituye un estándar de referencia para la validación de otras escalas para EP y puede ser utilizada como anclaje externo para analizar la validez discriminativa, sensibilidad al cambio e interpretabilidad de otras escalas. Sus principales limitaciones se deben a su comportamiento no lineal en la valoración del avance de la enfermedad y a ambigüedades en la definición de los estadios, con mezcla de manifestaciones motoras y discapacidad9. Sus propiedades psicométricas han sido establecidas solo parcial e indirectamente10.
La NMSS es una escala diseñada para evaluar la carga sintomática (frecuencia e intensidad) debida a los síntomas no motores asociados a la EP11. Está formada por 30 ítems, que se agrupan en 9 dominios: cardiovascular, sueño/fatiga, estado de ánimo/apatía, problemas perceptivos/alucinaciones, atención/memoria, tracto gastrointestinal, función urinaria, función sexual y miscelánea. La intensidad del síntoma se puntúa en una escala de 0 (ninguna) a 3 (grave), y su frecuencia de 1 (raramente) a 4 (muy frecuentemente). La puntuación de cada ítem se obtiene multiplicando frecuencia por intensidad y la de los dominios y total por la suma de las puntuaciones de sus respectivos componentes. Se administra mediante entrevista con el paciente o el cuidador y el marco temporal es el último mes.
La NMSS cuenta con excelentes propiedades psicométricas, ha sido traducida y validada en diversos idiomas y está recomendada por la MDS. Facilita la valoración unificada de una amplia variedad de síntomas no motores, incluyendo aquellos que son graves pero infrecuentes y los menos graves pero persistentes, así como el seguimiento de su progresión y su respuesta al tratamiento. Tras la revisión llevada a cabo por un subcomité de la MDS se desarrolló una nueva versión (MDS-NMS).
La MDS-NMS, propiedad de la MDS, surge de la necesidad de mejorar la evaluación de los síntomas no motores en EP, a través de la revisión de la NMSS12. La MDS-NMS evalúa 13 dominios de síntomas motores, tanto relacionados con la enfermedad como con su tratamiento, que agrupan 52 ítems. Los ítems se valoran en términos de frecuencia (0 a 4) y de gravedad (0 a 4), y la puntación de cada ítem resulta de su producto (0 a 16). Además, incluye una subescala de fluctuaciones no motoras que evalúa los cambios provocados por la medicación en 8 dominios. Sus propiedades psicométricas son satisfactorias, con adecuada consistencia interna, fiabilidad interobservador y test-retest, dominios sin efecto techo y buena validez convergente y para grupos conocidos.
La versión en español de la MDS-NMS ha sido validada en una muestra multinacional, con buenos resultados psicométricos13. Además, ha sido usada en diversos estudios en diferentes países, con buen rendimiento.
1. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology. 1967;17(5):427-442.
4. Fahn S, Elton R, UPDRS program members. Unified Parkinson’s disease rating scale. En: Fahn S, Marsden C, Goldstein M, et al. (eds.). Recent Developments in Parkinson’s Disease. Vol. 2. Macmillan Healthcare Information; 1987:153-163.
6. Goetz CG, Fahn S, Martínez Martín P, et al. Movement Disorder Society sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS UPDRS): Process, format, and clinimetric testing plan. Mov Disord. 2007;22(1):41-47
8. Movement Disorder Society Task Force on Rating Scales for Parkinson’s Disease. The Unified Parkinson’s Disease Rating Scale (UPDRS): status and recommendations. Mov Disord. 2003;18(7):738-750.
9. Goetz CG, Poewe W, Rascol O, et al. Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations. Mov Disord. 2004;19(9):1020-1028.
10. Martínez Martín P, Skorvanek M, Rojo Abuin JM, et al. Validation study of the hoehn and yahr scale included in the MDS UPDRS. Mov Disord. 2018;33(4):651-652.
11. Martínez Martín P, Rodríguez Blazquez C, Abe K, et al. International study on the psychometric attributes of the non motor symptoms scale in Parkinson disease. Neurology. 2009;73(19):1584-1591.
12. Martínez Martín P, Schrag A, Weintraub D, et al. Pilot Study of the International Parkinson and Movement Disorder Society sponsored Non motor Rating Scale (MDS NMS). Mov Disord Clin Pract. 2019;6(3):227-234.
13. Cubo E, Luo S, Martínez Martín P, et al. Expanded and Independent Spanish Validation of the MDS Non Motor Rating Scale. Mov Disord Clin Pract. 2023;10(4):586-595
El NMSQuest es un cuestionario autoadministrado para la detección de síntomas no motores de la EP14 . Consta de 30 ítems, con opciones de respuesta “Sí/No”, que pueden agruparse en 9 dimensiones relativas a alteraciones digestivas, urinarias, apatía/atención/pérdida de memoria, alucinaciones/delirio, depresión/ansiedad, función sexual, alteraciones cardiovasculares, trastornos del sueño y miscelánea.
La importancia del NMSQuest reside en que constituye el primer PRO para la detección de síntomas no motores en la EP. Por su brevedad y sencillez, resulta útil para la práctica clínica y apto para su uso en diversos contextos socioculturales. Ha sido traducido y validado en varios idiomas, con buenos resultados en relación con sus propiedades psicométricas.
La PDSS es una escala de evaluación de las alteraciones del sueño nocturno (insomnio, inquietud, nocturia, etc.) y de la hipersomnia diurna, específica para pacientes con EP15. Contiene 15 ítems, cada uno de los cuales se puntúa de 0 (síntoma grave y que se sufre con frecuencia) a 10 (sin síntomas) en una escala visual analógica.
En los diferentes estudios de validación de la PDSS, la escala ha mostrado buenas propiedades psicométricas. Cubre un amplio espectro de problemas causantes de trastorno del sueño e incluye, si bien someramente representada, la hipersomnia diurna (1 ítem). Por su brevedad y sencillez, puede utilizarse tanto en investigación como en la práctica clínica. Estas razones han hecho que la PDSS sea una escala recomendada para la evaluación de problemas de sueño por la IPMDS. Sin embargo, no se ha contrastado completamente su validez frente a medidas fisiológicas del sueño y la forma de puntuación a través de escala visual analógica puede presentar sesgos culturales.
Por ello, se ha elaborado una versión modificada, la PDSS-216, que se centra exclusivamente en problemas de sueño nocturno.
La PDSS-2 consta de 15 ítems que se puntúan en una escala de 0 (nunca) a 4 (muy frecuente). La puntuación total máxima, indicativa de más problemas de sueño, es 60. La PDSS-2 ha sido traducida y validada en varios idiomas, cuenta con buenas propiedades psicométricas y muestra sensibilidad al cambio. Se han establecido valores de diferencia clínica mínimamente importante (por sus siglas en inglés, MCID) para esta escala.
La SCOPA-S es una escala de evaluación de los trastornos del sueño nocturno y de la hipersomnia diurna en la EP17 y es propiedad de la IPMDS. Consta de dos subescalas: sueño nocturno (5 ítems) e hipersomnia diurna (6 ítems). El rango de puntuaciones va de 0 (nunca) a 3 (con frecuencia). Además, incluye un ítem de evaluación de la calidad del sueño nocturno que no forma parte de la puntuación total.
En los diversos estudios de validación, los datos de calidad psicométrica de la escala han resultado satisfactorios. Se ha propuesto un punto de corte 6/7 en la subescala de sueño nocturno para distinguir entre pacientes que duermen bien y los que duermen mal17.
La escala SCOPA-S resulta de utilidad como medida fiable y válida de los trastornos de sueño y la hipersomnia diurna en los pacientes con EP. Valora la somnolencia diurna más exhaustivamente que la PDSS, aunque, a diferencia de esta, no explora posibles causas de las alteraciones del sueño en la EP y no incluye preguntas sobre algunas alteraciones del sueño frecuentes en la EP como la apnea o el síndrome de piernas inquietas. Ha sido clasificada como escala recomendada por la IPMDS.
La SCOPA-AUT, propiedad de la IPMDS, evalúa los síntomas autonómicos en la EP18 mediante 25 ítems que exploran las siguientes áreas: gastrointestinal, urinaria, cardiovascular, termorregulación, pupilomotora y disfunción sexual. Los ítems se puntúan de 0 (nunca) a 3 (con frecuencia), aunque las regiones urinaria y sexual incluyen además las opciones de respuesta “uso de catéter” y “no sexualmente activo”, respectivamente. Cuenta con diversos estudios de validación, tanto con técnicas clásicas como con análisis Rasch, que muestran propiedades psicométricas adecuadas en conjunto, aunque algunas subescalas muestran una baja consistencia interna y ausencia de correlación con pruebas electrofisiológicas de síntomas autonómicos19. Ha sido recomendada por la IPMDS para la evaluación de disautonomía en la EP.
La PFS es una escala de 16 ítems que evalúa los aspectos físicos de la fatiga en pacientes con EP y su impacto en las actividades de la vida diaria20. Los ítems se puntúan en una escala de 1 (completamente en desacuerdo) a 5 (completamente de acuerdo) y la puntuación total se obtiene mediante la suma de los ítems (rango de 16 a 80 puntos), mediante la media de los ítems o mediante la suma de las respuestas positivas (“de acuerdo”). Es una escala fiable y válida, corta y sencilla de utilizar, por lo que ha sido recomendada para su uso por parte de la IPMDS.
Para determinar la calidad de vida relacionada con la salud (CVRS) de los pacientes con EP se pueden utilizar medidas genéricas y medidas específicas.
Las primeras informan sobre aspectos de salud general, se pueden aplicar a individuos sanos y a pacientes con diferentes patologías y permiten comparaciones entre distintas enfermedades y situaciones de salud. Como desventaja, su contenido puede estar poco relacionado con las manifestaciones presentes en el paciente con EP y, por tanto, su sensibilidad al cambio puede ser baja. Estos inconvenientes no se dan en las medidas específicas, pero estas no informan sobre aspectos de salud general y no se pueden usar en poblaciones diferentes a aquella para la que fueron diseñadas.
La IPMDS ha publicado una revisión sobre los instrumentos de CVRS en EP. Las escalas de evaluación de CVRS más utilizadas en EP se exponen a continuación.
El PDQ-39 está compuesto por 39 ítems que se agrupan en 8 dimensiones: movilidad (10 ítems), actividades de la vida diaria (6 ítems), bienestar emocional (6 ítems), estigma (4 ítems), apoyo social (3 ítems), estado cognitivo (4 ítems), comunicación (3 ítems) y dolor (3 ítems)21. El PDQ-8 se compone de 8 ítems que representan cada una de las dimensiones del PDQ-3922.
En ambas versiones, el marco temporal explorado es el mes pasado y cada ítem presenta 5 opciones de respuesta (de 0, nunca, a 4, siempre o incapaz de hacerlo). La puntuación para cada dominio se calcula dividiendo la suma de las puntuaciones de los ítems por la máxima puntuación posible para esa dimensión y se expresa en porcentaje. El índice sumarial del PDQ-39 y del PDQ-821,22 se calcula como la media de las puntuaciones de las 8 dimensiones o de los 8 ítems, respectivamente.
El PDQ-39 es el más estudiado de los cuestionarios específicos para EP desde el punto de vista de características métricas y adaptación transcultural. Las dos versiones han sido aplicadas a multitud de estudios sobre el efecto de diversas terapias, mostrando sensibilidad al cambio, y están clasificadas como recomendadas por la IPMDS.
El PDQL es una escala de evaluación de la CVRS específica para EP. Consta de 37 ítems agrupados en cuatro dimensiones: síntomas parkinsonianos (14 ítems), síntomas sistémicos (7 ítems), función social (7 ítems) y función emocional (9 ítems)23. La puntuación de cada ítem varía de 1 (todo el tiempo, continuamente) a 5 (nunca). La puntuación total se obtiene sumando directamente la de los ítems. Ha demostrado poseer adecuadas propiedades psicométricas y sensibilidad al cambio, por lo que es una de las escalas recomendadas por la IPMDS.
La SCOPA-PS, propiedad de la IPMDS, está formada por 11 ítems, valorados por la persona con Parkinson sobre su función psicosocial durante el último mes24. La escala de respuesta es de 4 puntos, y la puntuación total se calcula a través de la suma de los ítems que se transforman en un porcentaje donde un valor más elevado indica peor función psicosocial. Aunque originalmente desarrollada en holandés, esta escala ha sido traducida para varios idiomas, entre los cuales el inglés y el español25, con buena aceptabilidad, consistencia interna, validez de constructo, precisión y respuesta al cambio.
14. Chaudhuri KR, Martínez Martín P, Schapira AHV, et al. International multicenter pilot study of the first comprehensive self completed nonmotor symptoms questionnaire for Parkinson’s disease: the NMSQuest study. Mov Disord. 2006;21(7):916-923.
15. Chaudhuri KR, Pal S, DiMarco A, et al. The Parkinson’s disease sleep scale: a new instrument for assessing sleep and nocturnal disability in Parkinson’s disease. J Neurol Neurosurg Psychiatr. 2002;73(6):629-635.
16. Trenkwalder C, Kohnen R, Högl B, et al. Parkinson’s disease sleep scale validation of the revised version PDSS 2. Mov Disord. 2011;26(4):644 652.
17. Marinus J, Visser M, van Hilten JJ, et al. Assessment of sleep and sleepiness in Parkinson disease. Sleep. 2003;26(8):1049-1054.
18. Visser M, Marinus J, Stiggelbout AM, et al. Assessment of autonomic dysfunction in Parkinson’s disease: the SCOPA AUT. Mov Disord. 2004;19(11):1306-1312.
19. Evatt ML, Chaudhuri KR, Chou KL, et al. Dysautonomia rating scales in Parkinson’s disease: sialorrhea, dysphagia, and constipation critique and recommendations by movement disorders task force on rating scales for Parkinson’s disease. Mov Disord. 2009;24(5):635-646.
20. Brown RG, Dittner A, Findley L, et al. The Parkinson fatigue scale. Parkinsonism Relat Disord. 2005;11(1):49-55.
21. Jenkinson C, Fitzpatrick R, Peto V, et al. The Parkinson’s Disease Questionnaire (PDQ 39): development and validation of a Parkinson’s disease summary index score. Age Ageing. 1997;26(5):353-357.
22. Jenkinson C, Fitzpatrick R, Peto V, et al. The PDQ 8: Development and validation of a short form Parkinson’s Disease Questionnaire. Psychol Health. 1997;12(6):805-814.
23. De Boer AG, Wijker W, Speelman JD, et al. Quality of life in patients with Parkinson’s disease: development of a questionnaire. J Neurol Neurosurg Psychiatr. 1996;61(1):70-74.
24. Marinus J, Visser M, Martínez Martín P, et al. A short psychosocial questionnaire for patients with Parkinson’s disease: the SCOPA PS. J Clin Epidemiol. 2003;56(1):61-67.
25. Martínez Martín P, Carroza García E, Frades Payo B, et al. Psychometric attributes of the Scales for Outcomes in Parkinson’s Disease Psychosocial (SCOPA PS): validation in Spain and review. Rev Neurol. 2009;49(1):1-7
En los últimos años, y especialmente a raíz de la pandemia de COVID-19, han ido adquiriendo cada vez más importancia la telemedicina, las tecnologías móviles y los sistemas de evaluación digitales para el diagnóstico, evaluación y seguimiento de la EP26,27 .
La telemedicina usa tecnología digital (ordenadores, smartphones, tabletas) con conexión a distancia para recoger y transmitir información y proporcionar asistencia sanitaria. Uno de los formatos más comunes son las visitas virtuales por teléfono o videoconferencia con la finalidad de evaluar e intervenir28. Otra modalidad se sirve de sensores para recoger la información, de los que los más habituales son los biosensores inerciales, que incluyen acelerómetros y giroscopios integrados en dispositivos (por ejemplo, relojes) que los pacientes pueden transportar durante todo el día. Estos biosensores se conectan con programas de ordenador y aplicaciones (app) para teléfonos móviles, las cuales en los últimos años han experimentado un espectacular crecimiento debido a su facilidad de uso, accesibilidad y bajo coste29. Se utilizan principalmente para evaluar la marcha y el movimiento y detectar síntomas motores como temblores y congelación, estados on/off y fluctuaciones motoras, lo que ofrece grandes posibilidades de aplicaciones en el ámbito de la Neurología y los trastornos del movimiento.
La IPMDS ha publicado unas directrices y recomendaciones para el desarrollo, validación e implementación de la tecnología de evaluación en EP30 y además cuenta con un repositorio de aplicaciones en su web31. También existe un informe de revisión de los dispositivos para seguimiento remoto de la EP elaborado por el NICE de Reino Unido32. En la guía de NICE se realiza una recomendación condicional a cinco de ellos: Kinesia 360, KinesiaU, PDMonitor, Personal KinetiGraph (PKG) y Stat-On.
Estos dispositivos consisten en sensores portátiles que se ajustan a la muñeca, tobillo o cintura del paciente y se conectan en remoto a un ordenador o teléfono móvil, para recoger y transmitir información sobre manifestaciones motoras y fluctuaciones. Dependiendo del tipo de sensor que lleven, pueden recoger un rango más o menos amplio de síntomas y signos de la EP. Por ejemplo, Kinesia 360 cuenta con dos sensores que se llevan en muñeca y tobillo para monitorizar de manera continua temblor, bradicinesia, discinesia, postura y marcha mientras se realizan las actividades de la vida diaria, mientras que KinesiaU se lleva únicamente en la muñeca y cuantifica la gravedad del temblor, bradicinesia y dicinesia en tareas específicas o a lo largo de todo el día33. Por su parte, PD Monitor recoge información sobre periodos en off, discinesias, bradicinesia, temblor, inestabilidad postural, inactividad, y un profundo análisis de la marcha que incluye congelaciones, cadencia (pasos/minuto), velocidad (metros/segundo) y longitud de los pasos34. Uno de los dispositivos más usados, PKG, además de evaluar bradicinesia, discinesia, temblor, fluctuaciones motoras e inmovilidad durante el día y durante el sueño, permite al paciente registrar las tomas de medicación. Con esta información proporciona puntuaciones de gravedad y del porcentaje de tiempo con discinesia y bradicinesia en relación con la toma de LD. Por último, Stat-On monitoriza diversos parámetros de la marcha (longitud del paso, congelaciones, caídas), periodos en on y off, movimientos de las extremidades y discinesia del tronco y del cuello, pero no recoge datos sobre temblor, y la bradicinesia se estima a partir de la información sobre la marcha35. Otros sistemas, como los actígrafos, permiten la monitorización de los trastornos del sueño en la vida real de una forma menos costosa e invasiva que otros métodos más tradicionales como la polisomnografía36.
Estos dispositivos cuentan con estudios de validación, mostrando en general altos niveles de correlación o concordancia con las puntuaciones de escalas tales como la UPDRS y la Abnormal Involuntary Movements Scale (AIMS)26. Además, facilitan una mejor identificación de síntomas y el manejo y ajuste del tratamiento farmacológico, lo que puede mejorar el estado de salud del paciente y su calidad de vida37-40.
Se han diseñado también diferentes aplicaciones en tabletas y teléfonos móviles para recoger información sobre diversos aspectos de la EP mediante tareas que permiten el análisis de los movimientos oculomotores (por ejemplo, movimientos de fijación, sacádicos y nistagmo) para la evaluación de la función cognitiva y la gravedad de la EP, tareas manuales (por ejemplo, finger tapping) para detectar respuesta al tratamiento, fluctuaciones y bradicinesia, monitorización de síntomas no motores como el sueño, y tareas de vocalización para facilitar el diagnóstico de la enfermedad, sin necesidad de usar dispositivos añadidos41-43. Estas aplicaciones ofrecen la ventaja de que no son invasivas, proporcionan datos de manera continua y en tiempo real y se pueden utilizar en el hogar y durante las tareas habituales del paciente, lo que mejora la evaluación y el tratamiento de los pacientes.
Otro de los desarrollos tecnológicos es la digitalización de escalas (escalas electrónicas o e-escalas). El uso de escalas electrónicas tiene muchas ventajas, como la accesibilidad, la escalabilidad, la precisión y la integridad de la recopilación de datos, una administración remota más sencilla, el seguimiento en tiempo real de los datos por parte de médicos e investigadores, y la recopilación de comentarios por parte de los pacientes y participantes del estudio44. En los últimos años se está trabajando para digitalizar las principales escalas clínicas, como la MDS-UPDRS44. Las escalas digitales son especialmente útiles en el caso de las medidas de resultados informados por los pacientes. Una de estas aplicaciones son los e-diarios, en los que los pacientes pueden registrar datos de medicación, síntomas y fluctuaciones a lo largo de todo un día, con buenos resultados de aceptabilidad, fiabilidad y validez45,46.
La evaluación digital de la EP se enfrenta a varios desafíos30. El primero de ellos es garantizar que los resultados son consistentes, fiables, válidos e interpretables, imprescindible para poder usar estas herramientas para el diagnóstico y el seguimiento de la enfermedad, para lo que deben someterse a estudios de validación. En segundo lugar, estas herramientas no permiten obtener datos sobre muchos síntomas no motores, que con frecuencia son subjetivos y difícilmente cuantificables. Existen algunas iniciativas para conseguir registrar datos de síntomas no motores, aunque se trata de un área en desarrollo47. Por último, es necesario formar y entrenar a pacientes y clínicos en alfabetización digital y en el correcto uso e interpretación de las medidas obtenidas de esta forma. Además, estas tecnologías no siempre son viables para los pacientes, debido al precio, las limitaciones en el acceso a internet y restricciones regulatorias y legislativas y pueden suscitar problemas de privacidad de los datos personales y de salud28. En el caso de las e-escalas, se debe contar con la perspectiva del paciente para garantizar su usabilidad y que la adaptación sea equivalente a la versión analógica48.
En un estudio sobre la percepción de los pacientes sobre la telemedicina, el 84% de los participantes indicó que la telemedicina no es tan buena como las visitas presenciales y el 75% mostró mayor confianza en el clínico en el caso de la visita presencial, a pesar de que los niveles de satisfacción con las consultas a distancia (por teléfono o vídeo llamada) fueron altos49. Las principales preocupaciones de los pacientes en este tipo de asistencia se centran en posibles errores diagnósticos, la ruptura de la relación médico-paciente, la falta de comunicación no verbal y cuestiones éticas.

26. Moreau C, Rouaud T, Grabli D, et al. Overview on wearable sensors for the management of Parkinson’s disease. NPJ Parkinsons Dis. 2023;9(1):153.
27. Hassan A, Mari Z, Gatto EM, et al. Global Survey on Telemedicine Utilization for Movement Disorders During the COVID 19 Pandemic. Mov Disord. 2020;35(10):1701 1711. doi:10.1002/mds.28284
28. Shalash A, Spindler M, Cubo E. Global Perspective on Telemedicine for Parkinson’s Disease. J Parkinsons Dis. 2021;11(s1):S11-S18.
29. López Blanco R, Sorrentino Rodríguez A, Cubo E, et al. Impacto de las nuevas tecnologías en la neurología en España. Revisión del Comité Ad Hoc de Nuevas Tecnologías de la Sociedad Española de Neurología. Neurologia. 2020;38(8):591-598.
30. Espay AJ, Hausdorff JM, Sánchez Ferro Á, et al. A roadmap for implementation of patient centered digital outcome measures in Parkinson’s disease obtained using mobile health technologies. Mov Disord. 2019;34(5):657-663.
31. Digital App Repository. En: International Parkinson and Movement Disorder Society [Internet]. Disponible en: https://www.movementdisorders.org/MDS/Application-Repository.htm
32. Devices for Remote Monitoring of Parkinson’s Disease. Diagnostics Guidance [DG51]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/dg51
33. Giuffrida JP, Riley DE, Maddux BN, et al. Clinically deployable Kinesia technology for automated tremor assessment. Mov Disord. 2009;24(5):723-730.
34. Gao C, Smith S, Lones M, et al. Objective assessment of bradykinesia in Parkinson’s disease using evolutionary algorithms: clinical validation. Transl Neurodegener. 2018;7:18.
35. Rodríguez Martín D, Cabestany J, Pérez López C, et al. A New Paradigm in Parkinson’s Disease Evaluation With Wearable Medical Devices: A Review of STAT ONTM. Front Neurol. 2022;13:912343.
36. Raschellà F, Scafa S, Puiatti A, et al. Actigraphy Enables Home Screening of Rapid Eye Movement Behavior Disorder in Parkinson’s Disease. Ann Neurol. 2023;93(2):317-329.
37. Joshi R, Bronstein JM, Keener A, et al. PKG Movement Recording System Use Shows Promise in Routine Clinical Care of Patients With Parkinson’s Disease. Front Neurol. 2019;10:1027.
38. Santiago A, Langston JW, Gandhy R, et al. Qualitative Evaluation of the Personal KinetiGraphTM Movement Recording System in a Parkinson’s Clinic. J Parkinsons Dis. 2019;9(1):207-219.
39. Dominey T, Kehagia AA, Gorst T, et al. Introducing the Parkinson’s KinetiGraph into Routine Parkinson’s Disease Care: A 3 Year Single Centre Experience. J Parkinsons Dis. 2020;10(4):1827-1832.
40. Farzanehfar P, Woodrow H, Horne M. Sensor Measurements Can Characterize Fluctuations and Wearing Off in Parkinson’s Disease and Guide Therapy to Improve Motor, Non motor and Quality of Life Scores. Front Aging Neurosci. 2022;14:852992.
41. Koch NA, Voss P, Cisneros Franco JM, et al. Eye movement function captured via an electronic tablet informs on cognition and disease severity in Parkinson’s disease. Sci Rep. 2024;14(1):9082.
42. Broeder S, Roussos G, De Vleeschhauwer J, et al. A smartphone based tapping task as a marker of medication response in Parkinson’s disease: a proof of concept study. J Neural Transm (Vienna). 2023;130(7):937-947.
43. Singh S, Xu W. Robust Detection of Parkinson’s Disease Using Harvested Smartphone Voice Data: A Telemedicine Approach. Telemed J E Health. 2020;26(3):327-334.
44. Monje MHG, Fuller RLM, Cubo E, et al. Toward e Scales: Digital Administration of the International Parkinson and Movement Disorder Society Rating Scales. Mov Disord Clin Pract. 2021;8(2):208-214.
45. Vizcarra JA, Sánchez Ferro Á, Maetzler W, et al. The Parkinson’s disease e diary: Developing a clinical and research tool for the digital age. Mov Disord. 2019;34(5):676-681.
46. Terroba Chambi C, Bruno V, Medina Escobar A, et al. Open Access Electronic Diary for Motor Fluctuation and Dyskinesia Evaluation in Parkinson Disease: Comparison With Paper Diary. Clin Neuropharmacol. 2018;41(1):20-22.
47. Tripathi S, Malhotra A, Qazi M, et al. Clinical Review of Smartphone Applications in Parkinson’s Disease. Neurologist. 2022;27(4):183-193.
48. Fuller RLM, Sánchez Ferro Á, Goetz CG, et al. In Support of Electronic Versions of Movement Disorder Society Rating Scales. Mov Disord. 2021;36(1):270-271.
49. Rajapakshe I, Menozzi E, Cunha I, et al. Patients’ Postjudice of Tele Neurology for Movement Disorders. Mov Disord Clin Pract. 2022;9(4):446-451.


