El tratamiento quirúrgico se contempla como opción terapéutica en pacientes seleccionados con síntomas motores que no se controlan adecuadamente con un tratamiento médico optimizado y que repercuten significativamente sobre su calidad de vida. Las técnicas ablativas unilaterales por radiofrecuencia (talamotomía, palidotomía) fueron prácticamente desplazadas a finales de los años 90 por la técnica de ECP, debido a su mejor perfil beneficio/riesgo, su capacidad para modular circuitos cerebrales de forma ajustable y reversible y, especialmente, al permitir procedimientos bilaterales69-73.
La ECP consiste en la implantación estereotáctica de electrodos, situando su extremo con los contactos activos en la diana seleccionada. En la EPA, la diana utilizada es habitualmente el núcleo subtalámico (NST) o, alternativamente, el globo pálido interno (GPi); en ambos casos nos referiremos a partir de ahora a procedimientos bilaterales.
Estos electrodos se conectan mediante cables subcutáneos a un generador de pulsos eléctricos programable, implantado también subcutáneamente en la región torácica o abdominal.
Un equipo multidisciplinar con experiencia y entrenamiento adecuado es un requerimiento fundamental para conseguir el éxito de esta terapia. Habitualmente participan, entre otras especialidades, Neurología, Neurocirugía, Neurorradiología, Neurofisiología, Neuroanestesia y Neuropsicología.
Estimulación cerebral profunda del núcleo subtalámico
Selección de pacientes y predictores
Tratándose de una terapia neuroquirúrgica, la selección del potencial candidato debe ser muy cuidadosa. Un examen médico minucioso y una evaluación neuropsicológica exhaustiva son esenciales. En general, la ECP del NST (ECP-NST) se debe considerar en aquellos pacientes con EP que cumplan los criterios expresados en la Tabla I.
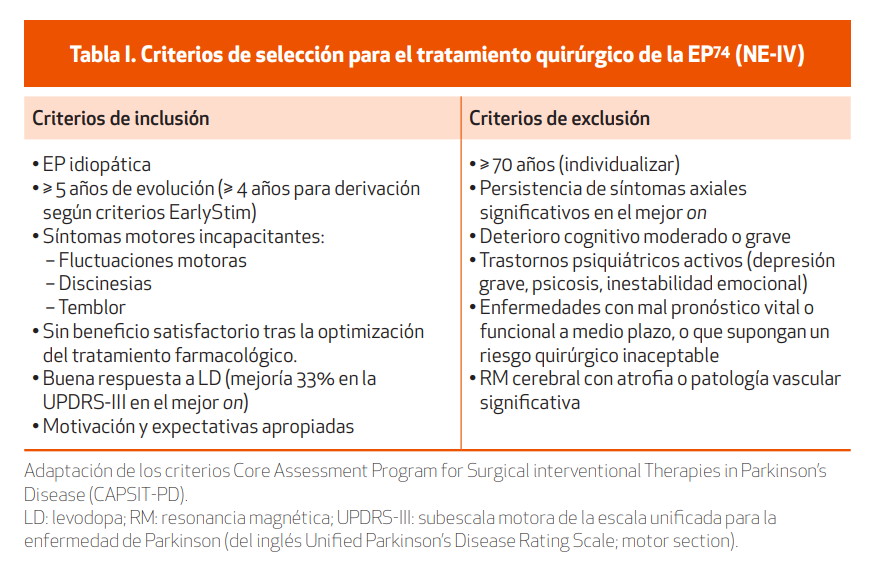
En base a varios estudios, la respuesta preoperatoria a LD en un test formal es predictiva de la mejoría obtenida tras ECP75,76 (NE-II). Generalmente, los síntomas que mejoran con LD son también los que mejoran tras ECP, mientras que los refractarios a LD, como ocurre en ocasiones con algunos trastornos axiales, serían también refractarios a la ECP. Un síntoma para considerar separadamente es el temblor, pues a menudo responde mejor a ECP que a LD77 (NE-II).
Asimismo, una menor edad y una duración más corta de la enfermedad posiblemente predicen una mejoría más notable tras la ECP-NST75 (NE-II). No se ha identificado un umbral concreto de edad a partir del cual no se deba ofrecer la terapia, pero se debe tener en cuenta que los pacientes de mayor edad tendrán con frecuencia otras contraindicaciones, y que la ganancia en calidad de vida tenderá ser menor en intensidad y duración. En un estudio, la mejoría calidad de vida tras ECP-NST fue más modesta en pacientes con ≥ 70 años (45%) respecto a aquellos con < 60 años (68%)78 (NE-III). En la práctica clínica, una edad más avanzada aumenta las probabilidades de asociar trastornos motores axiales refractarios a LD (y por lo tanto a ECP), deterioro cognitivo significativo u otras comorbilidades que puedan aumentar el riesgo quirúrgico. Se recomienda individualizar minuciosamente en cada caso.
En el proceso de selección de los candidatos se debe explicar muy claramente las expectativas de la ECP ya que, si nos son apropiadas, podrían contribuir a resultados poco satisfactorios, incluso existiendo mejoría objetiva evidente79 (NE-III).
Eficacia
Los factores que influyen en el resultado clínico de la ECP son: la correcta selección de los pacientes, la precisión en la localización de los electrodos y el manejo posoperatorio, conjugando la programación de la estimulación eléctrica y los ajustes farmacológicos.
Varios estudios aleatorizados multicéntricos han demostrado la superioridad de la ECP-NST sobre el tratamiento médico optimizado para mejorar las fluctuaciones motoras, las discinesias y la calidad de vida a los 6 meses tras la intervención80-83 (NE-I). La dosis equivalente de LD se pudo reducir en distintos estudios en un 24-40% a los 6-12 meses84-85 (NE-II). El estudio Intrepid, multicéntrico, doble ciego, con asignación aleatoria a recibir estimulación con control de corriente independiente vs. simulada, confirmó el beneficio clínico de la estimulación eléctrica a los 3 meses86 (NE-I).
En otros estudios a más largo plazo (5 y 10 años), los síntomas y signos con respuesta a LD mejoraron de forma significativa87,88 (NE-II). Se observó una mejoría media del 50% en la escala UPDRS-III comparando la situación off-medicación/on-estimulación posoperatoria con la off-medicación preoperatoria. Las discinesias se redujeron una media del 69%.
En el mencionado estudio a 5 años, sin grupo control, que comparó la escala UPDRS-III posoperatoria off-medicación/on-estimulación con la preoperatoria off-medicación, el beneficio motor obtenido al año se mantuvo al cabo de 5 años para el temblor y la rigidez. Sin embargo, la bradicinesia, aunque mejoró al año, no mantuvo el mismo grado de mejoría a los 5 años. La distonía en off desapareció en la mayoría de los pacientes. Las discinesias se redujeron un 71% en duración, y un 58% en discapacidad, al cabo de 1 año, y no variaron hasta los 5 años. La dosis equivalente de LD se redujo una media del 65% al cabo de 1 año y se mantuvo a los 5 años. Las valoraciones de la escala UPDRS-III en on-medicación demostraron un empeoramiento progresivo a lo largo de los 5 años, a expensas de los trastornos axiales, como el habla, la marcha y los reflejos posturales87 (NE-II).
En el otro estudio a 10 años, sin grupo control, pero con evaluaciones ciegas, el beneficio motor de la ECP-NST se mantuvo durante todo el seguimiento, incluyendo el temblor y la bradicinesia. También se mantuvo la mejoría sobre las fluctuaciones motoras, las discinesias, la capacidad funcional y la reducción en la dosis equivalente de LD. Sin embargo, el beneficio sobre los síntomas axiales se fue perdiendo a lo largo del tiempo88 (NE-II). Esta tendencia al empeoramiento de las manifestaciones axiales se suele atribuir a la propia evolución natural de la enfermedad, sin embargo, faltan estudios controlados para demostrarlo.
Earlystim, un estudio multicéntrico, aleatorizado, doble ciego, a 2 años, comparó la eficacia de la ECP-NST frente a un grupo control con tratamiento médico optimizado. Las características de los pacientes fueron diferentes a las de los incluidos en otros estudios controlados: más jóvenes (52 vs. 59-62 años), con menor duración de la enfermedad (7,5 vs. 12 años) y con menor tiempo de evolución de las complicaciones motoras (1,7 años). Los pacientes intervenidos obtuvieron una mejoría del 26% en la calidad de vida (cuestionario PDQ-39), mientras que el grupo control empeoró un 1%. La escala UPDRS-III en off mejoró un 53% en el grupo intervenido vs. 4% en el grupo control. La escala UPDRS-IV (complicaciones motoras) mejoró un 61% en el grupo intervenido vs. empeoramiento del 13% en el grupo control. La dosis equivalente de LD se redujo un 39% en el grupo intervenido vs. incremento del 21% en el grupo control89 (NE-I).
Respecto a las formas monogénicas de EP, un metaanálisis de 17 estudios retrospectivos sobre pacientes con mutaciones en LRRK2, PRKN o GBA, reveló que la eficacia de la ECP-NST no difiere de la descrita en la EP idiopática. No obstante, los pacientes con mutaciones en GBA redujeron menos la dosis de medicación y tuvieron una peor evolución desde el punto de vista cognitivo 2-7 años después90 (NE-I).
En relación con las manifestaciones no motoras de la EP, un estudio controlado encontró una mejoría significativa en la escala para síntomas no motores a los 3 años de la ECP-NST, sobre todo en sueño, fatiga y síntomas urinarios, en comparación con el grupo control tratado con el mejor tratamiento médico91 (NE-II).
Los resultados sobre la calidad de vida se han analizado en un estudio a 5 años, que sugiere que la ECP-NST es altamente eficaz a corto plazo tras la cirugía (1 año), mientras que a largo plazo (5 años) se produce un empeoramiento hasta niveles prequirúrgicos, excepto en algunos dominios específicos, como estigma, bienestar emocional y malestar corporal, en los que se mantiene el beneficio92 (NE-III). En un metaanálisis, la calidad de vida se mantuvo por encima de sus niveles prequirúrgicos a los 5 años93 (NE-I). Un estudio retrospectivo con seguimiento prolongado confirmó que la mejoría motora y de la calidad de vida puede mantenerse incluso hasta 15 años después94 (NE-III). Una revisión sistemática destaca la dificultad para identificar predictores para la mejoría en la calidad de vida, que no siempre es paralela a la mejoría motora, especialmente a medio y largo plazo95 (NE-I). Esta divergencia radica en la heterogeneidad de los pacientes intervenidos y de las medidas de resultado utilizadas, que no siempre capturan todos los aspectos que más inciden en la evolución de la calidad de vida.
Efectos adversos
Las complicaciones más graves están relacionadas directamente con el procedimiento quirúrgico, en general poco frecuentes, como la hemorragia cerebral (1,3%; con mayor riesgo a mayor edad). A lo largo del seguimiento pueden aparecer complicaciones relacionadas con los dispositivos implantados, como infecciones, escaras cutáneas o rotura de los electrodos que, en ocasiones, requieren intervención quirúrgica. Como consecuencia de la terapia, pueden aparecer otras complicaciones como: apraxia de la apertura ocular (1,8-30%), disartria/hipofonía (4-17%), trastorno de la marcha (14%), inestabilidad postural (12,5%), aumento de peso (8,4%) o reducción de la fluidez verbal96 (NE-II).
En una publicación se describió un riesgo incrementado de suicidio tras la ECP-NST97 (NE-II); sin embargo, un estudio controlado con asignación aleatoria en 2 fases (ECP vs. el mejor tratamiento médico y, posteriormente, ECP-NST vs. ECP-Gpi) no encontró asociación directa entre la ECP y un mayor riesgo de ideación o conductas suicidas98 (NE-I).
En un estudio controlado con asignación aleatoria a ECP-NST vs. el mejor tratamiento farmacológico, el estado cognitivo global de los pacientes no empeoró significativamente tras la ECP en la mayoría de los casos, aunque se observaron algunas disfunciones cognitivas de tipo frontal. Además, comparado con el tratamiento farmacológico, los pacientes intervenidos no empeoraron respecto a la afectividad, y mejoraron en ansiedad y calidad de vida99 (NE-I).
En cuanto a efectos adversos neuropsiquiátricos, el delirio o confusión posoperatoria son frecuentes; también puede aparecer depresión, apatía o manía/hipomanía100 (NE-I). Hay resultados contradictorios sobre algunas de estas manifestaciones, debido en parte a la variabilidad metodológica entre distintos estudios. La ansiedad y la depresión tienden a mejorar, mientras que la apatía tiende a empeorar, posiblemente más por el descenso de los fármacos dopaminérgicos, aunque faltan estudios concluyentes al respecto101-103 (NE-II). En un estudio se ha descrito estado hipomaniaco en el 4% de los pacientes tras ECP-NST, en relación con una posición ventromedial de los electrodos104 (NE-IV).
Una revisión sistemática encontró que la mejoría motora tras ECP-NST no se ve influida por el estado cognitivo (ni previo a la cirugía, ni posteriormente en pacientes que desarrollaron deterioro cognitivo postquirúrgico); por otro lado, se trata de un procedimiento seguro desde el punto de vista cognitivo, excepto por una reducción moderada de la fluidez verbal105 (NE-I).
Coste-efectividad
En España se estima que la ECP-NST implica un gasto adicional de 34.389 € por cada año de vida ajustado por calidad de vida (QALY) ganado, en comparación con el mejor tratamiento médico, lo que se considera coste-efectivo106 (NE-II). En Estados Unidos esta estimación ascendió a 49.194 $ por QALY107 (NE-II). Un análisis económico alemán concluyó que la ECP-NST resulta rentable a partir del segundo año tras la cirugía108 (NE-III). La ECP fue también considerada coste-efectiva en una revisión estructurada más reciente, siendo superior en este sentido a otras terapias basadas en dispositivos109 (NE-III).

Estimulación cerebral profunda del globo pálido interno
La palidotomía fue revitalizada en la década de los años 90 tras los trabajos de Laitinen et al., y pronto la ECP del globo pálido interno (ECP-GPi) comenzó a extenderse como alternativa a la palidotomía, con las ventajas ya mencionadas de la ECP sobre la lesión. No obstante, en aquellos años, los estudios sobre la ECP-NST emergieron con fuerza hasta el punto de ser pronto el procedimiento de elección en la mayoría de los centros, si bien no se dispuso de estudios comparativos rigurosos hasta años después.
Uno de los estudios mencionados en el apartado anterior sobre ECP-NST, que comparó la ECP vs. el mejor tratamiento médico, incluyó tanto pacientes con ECP-NST (n = 60) como con ECP-Gpi (n = 61), demostrando globalmente la superioridad de la ECP sobre la función motora, fluctuaciones y calidad de vida a los 6 meses81 (NE-I).
Otros estudios han analizado los resultados de la ECP-NST vs. ECP-Gpi110-113 (NE-I). Un estudio multicéntrico aleatorizado, que incluyó 159 pacientes seguidos durante 3 años, no mostró diferencias significativas entre ambas dianas; si bien la escala de demencia de Mattis declinó más rápido en el grupo intervenido mediante ECP-NST111 (NE-I). Por otro lado, otro estudio que incluyó 128 pacientes, seguidos también durante 3 años, encontró un mayor beneficio motor en medidas secundarias tras la ECP-NST, además de una mayor reducción de la medicación112,113NE-I). Dos metaanálisis que incluyeron todos los estudios comparativos hasta 2014 concluyeron que ambos procedimientos pueden ser igualmente eficaces para mejorar las manifestaciones motoras. Aunque la ECP-NST utiliza un menor voltaje de estimulación y permite una mayor reducción de la medicación, también podría asociarse a una peor evolución en algunas medidas de ánimo y cognición114,115 (NE-I).
Queda por dilucidar que subgrupos de pacientes se beneficiarían más con uno u otro procedimiento. Se ha sugerido que la ECP-Gpi podría ser más apropiada para aquellos pacientes con bajo umbral para desarrollar discinesias, o con mayor riesgo de deterioro anímico o cognitivo tras la cirugía116 (NE-IV).

Técnicas ablativas sin craneotomía: HIFU
En las últimas décadas se ha desarrollado una tecnología que permite administrar ultrasonidos focalizados de alta intensidad (HIFU, del inglés high-intensity focused ultrasound) en estructuras cerebrales profundas, con guía mediante RM (también denominada MRgFUS, del inglés magnetic resonance-guided focused ultrasound), para realizar de esta forma lesiones térmicas controladas, sin necesidad de cirugía convencional mediante craneotomía. También pueden lesionarse estructuras profundas aplicando radiación con extraordinaria precisión: se trata del denominado Gamma knife® o bisturí gamma; si bien, a diferencia del HIFU, sus efectos clínicos ocurren de forma diferida. Estas técnicas, a pesar de que suponen un retorno a la cirugía ablativa (irreversible, no modulable, en un principio unilateral), tienen una creciente aceptación, pues evitan la cirugía convencional y la dependencia de dispositivos implantados. Además, pueden aplicarse a determinados pacientes con contraindicaciones para ECP.
En 2016, la FDA de Estados Unidos aprobó la aplicación de HIFU para realizar talamotomías unilaterales (núcleo ventral intermedio talámico) como tratamiento sintomático del temblor esencial refractario, incluyendo a partir de 2018 el temblor asociado a la EP. En 2021 se extendió la aprobación a pacientes con EPA. En 2022 se aprobó la talamotomía bilateral en dos tiempos, con un intervalo de al menos 9 meses. En Europa el HIFU tiene el marcado CE para el tratamiento del temblor esencial refractario a medicación (uni- o bilateral) y para el tratamiento unilateral de la EP tremórica.
Eficacia
Diversos estudios abiertos, así como algunos ensayos clínicos controlados, han evaluado los efectos de la talamotomía, subtalamotomía y palidotomía unilateral mediante HIFU en pacientes con EP117
Talamotomía
Un ensayo clínico controlado con un procedimiento simulado evaluó la talamotomía unilateral por HIFU en pacientes con EP tremórica118 (NE-I). Se incluyeron 20 pacientes en el brazo tratado y 7 en el simulado, demostrando a los 3 meses una diferencia estadísticamente significativa a favor del HIFU en la escala del temblor para la mano tratada, si bien los autores señalan un destacable efecto placebo en el grupo control. En un análisis posterior se constató mejoría en la capacidad funcional y en la calidad de vida119 (NE-II).
Subtalamotomía
Varios estudios habían evaluado en el pasado la subtalamotomía por radiofrecuencia, pero la disponibilidad del HIFU, y los avances en las técnicas de localización por imagen, han motivado un renovado interés por investigar esta diana120
Un ensayo clínico controlado en pacientes con EP marcadamente asimétrica (no eran candidatos a ECP o habían rechazado este tratamiento) comparó la subtalamotomía unilateral por HIFU (27 pacientes) vs. un procedimiento simulado (13 pacientes). En comparación con el grupo control, la subtalamotomía mejoró significativamente las manifestaciones motoras contralaterales a los 4 meses121 (NE-I). Doce de los 13 pacientes del grupo control fueron tratados posteriormente. El seguimiento abierto de 32 pacientes al cabo de 3 años mostró una mejoría media en la subescala motora de la MDS-UPDRS en off del 22,9%, pero sin acompañarse de cambio favorable en el resto de subescalas, en la calidad de vida (PDQ-39), ni en la dosis de LD122 (NE-IV). Otro estudio abierto ha evaluado la subtalamotomía por HIFU en pacientes con EP temprana (< 5 años desde el diagnóstico), observando una mejoría media en la subescala motora de la MDS-UPDRS en off del 49% al año del tratamiento123 (NE-IV).
Respecto a la subtalamotomía bilateral en 2 tiempos, un estudio evaluó a 6 pacientes a los 6 meses de un segundo procedimiento contralateral (mediana del intervalo: 3,2 años). La mejoría media en la subescala motora de la MDS-UPDRS en off respecto a la basal (antes del primer procedimiento) fue del 52,6%124 (NE-IV).
Palidotomía
Un ensayo clínico controlado en pacientes con fluctuaciones motoras o discinesias comparó la palidotomía unilateral por HIFU (69 pacientes) vs. un procedimiento simulado (25 pacientes). A los 3 meses 65 y 22 pacientes, respectivamente, completaron las evaluaciones. La proporción de pacientes con mejoría predefinida (al menos 3 puntos en la subescala motora de la MDS-UPDRS en off para el lado tratado o bien en la UDysRS en on) fue significativamente mayor en el grupo tratado (69% vs. 32%)125 (NE-I). De los 39 pacientes que mejoraron y fueron evaluados al año, 30 (77%) mantenían el beneficio obtenido.
Efectos adversos
Históricamente, una de las principales consideraciones respecto a la cirugía ablativa era la posibilidad de dañar estructuras adyacentes a la diana, induciendo efectos adversos transitorios o permanentes. En este sentido, el carácter reversible y modulable de la ECP vino a aportar una mayor seguridad. Aunque los avances en la localización por imagen permiten en la actualidad una elevada precisión, en todos los estudios sobre HIFU se describe un porcentaje no desdeñable de efectos adversos relacionados con la lesión, si bien en su mayoría son de intensidad leve-moderada y con frecuencia reversibles a medio-largo plazo.
Talamotomía
En el ensayo clínico controlado antes mencionado (n = 20) se recogieron como efectos adversos, en la evaluación a los 3 meses: hemiparesia (2 casos), parestesias (5 casos) y ataxia (1 caso)118 (NE-I). No se encontraron diferencias entre grupos en cuanto a cognición, ánimo o conducta119 (NE-II).
Subtalamotomía
En el ensayo clínico controlado antes mencionado (n = 27) se recogieron, como efectos adversos en la evaluación a los 4 meses: trastorno del habla (15 casos, reversible en 12), trastorno de la marcha (13 casos, reversible en 11), discinesias (12 casos, 6 en off y 6 en on, reversible en 3 y 5 casos respectivamente), paresia de miembros (5 casos, reversible en 3) y paresia facial (3 casos, reversible en 2)121 (NE-I). En el seguimiento abierto posterior, 6 pacientes (22%) seguían presentando déficits al año del tratamiento121. A los 3 años (n = 30), 8 pacientes (27%) presentaban discinesias “pico de dosis” en el hemicuerpo tratado; otros efectos adversos fueron: torpeza de una mano (1 caso), trastorno del habla (2 casos) y aumento de peso (2 casos). No hubo cambios significativos en cognición y conducta122 (NE-IV).
Tras una segunda subtalamotomía bilateral (mediana del intervalo: 3,2 años) 4 de 6 pacientes presentaron discinesias contralaterales (resultas en 3 meses). Otros efectos adversos fueron: trastorno del habla (4 casos, resuelto antes de los 6 meses en 2) y desequilibrio/disfagia en 1 caso (resuelto en 1 semana). No hubo cambios significativos en cognición y conducta a los 6 meses124 (NE-IV).
Palidotomía
En el ensayo clínico controlado antes mencionado (n= 69) se recogieron en las primeras semanas: disartria (2 casos), trastorno de la marcha (2 casos), pérdida del gusto (2 casos), trastorno visual (1 caso) y debilidad facial (1 caso)125 (NE-I). Al año persistía únicamente disartria moderada en 1 paciente.

Bibliografía
69. The National Collaborating Centre for Chronic Conditions: Parkinson’s disease: National clinical guideline for diagnosis and management in primary and secondary care. Londres: Royal College of Physicians; 2006.
70. Pahwa R, Factor SA, Lyons KE, et al. Practice Parameter: Treatment of Parkinson disease with motor fluctuations and dyskinesia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006;66(7):983-95.
71. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease. Eur J Neurol. 2013;20(1):5-15.
72. Deuschl G, Antonini A, Costa J, et al. European Academy of Neurology/Movement Disorder Society - European Section guideline on the treatment of Parkinson’s disease: I. Invasive therapies. Eur J Neurol. 2022 Sep;29(9):2580-2595.
73. Hartmann CJ, Fliegen S, Groiss SJ, et al. An update on best practice of deep brain stimulation in Parkinson’s disease. Ther Adv Neurol Disord. 2019 Mar 28;12.
74. Mínguez Castellanos A, Muñoz Ruiz T. Terapias de segunda línea (III): tratamiento quirúrgico. En: Escamilla Sevilla F, González Torres V, Moya Molina MA (eds.). Recomendaciones de Práctica Clínica en la Enfermedad de Parkinson 2022. Grupo Andaluz de Trastornos del Movimiento. Sociedad Andaluza de Neurología. Barcelona: Glosa; 2022. pp. 213-222.
75. Welter ML, Houeto JL, Tezenas du Montcel S, et al. Clinical predictive factors of subthalamic stimulation in Parkinson’s disease. Brain. 2002;125:575-83.
76. Kleiner-Fisman G, Fisman DN, Sime E, et al. Long-term follow up of bilateral deep brain stimulation of the subthalamic nucleus in patients with advanced Parkinson disease. J Neurosurg. 2003;99:489-95.
77. Limousin P, Foltynie T. Long-term outcomes of deep brain stimulation in Parkinson disease. Nat Rev Neurol 2019;15(4):234-242.
78. Dafsari HS, Reker P, Stalinski L, et al. Quality of life outcome after subthalamic stimulation in Parkinson’s disease depends on age. Mov Disord. 2018;33:99-107.
79. Geraedts VJ, Kuijf ML, van Hilten JJ, et al. Selecting candidates for deep brain stimulation in Parkinson’s disease: the role of patients’ expectations. Parkinsonism Relat Disord. 2019;66:207-211.
80. Deuschl G, Schade-Brittinger C, Krack P, et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. The German Parkinson Study Group, Neurostimulation Section. N Engl J Med. 2006;355:896-908.
81. Weaver FM, Follett K, Stern M, et al. Bilateral deep brain stimulation vs best medical therapy for patients with advanced Parkinson disease: a randomized controlled trial. JAMA. 2009;301:63-73.
82. Williams A, Gill S, Varma T, et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomised...
83. Okun MS, Gallo BV, Mandybur G, et al. Subthalamic deep brain stimulation with a constant-current device in Parkinson’s disease: an open-label randomised controlled trial. Lancet Neurol 2012; 11(2):140–149.
84. Rodríguez-Oroz MC, Obeso JA, Lang AE, et al. Bilateral deep brain stimulation in Parkinson’s disease: a multicentre study with 4 years follow-up. Brain. 2005;128(Pt 10):2240-9.
85. Mínguez-Castellanos A, Escamilla-Sevilla F, Katati MJ, et al. Different patterns of medication change after subthalamic or pallidal stimulation for Parkinson’s disease: target related effect or selection bias? J Neurol Neurosurg Psychiatry. 2005;76:34-9.
86. Vitek J, Jain R, Chen L, et al. Subthalamic nucleus deep brain stimulation with a multiple independent constant current- controlled device in Parkinson’s disease (INTREPID): a multicentre, double-blind, randomised, sham-controlled study. Lancet Neurol 2020;19(6):491–501.
87. Krack P, Batir A, Van Blercom N, et al. Five-year follow-up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med. 2003;349:1925-34.
88. Castrioto A, Lozano AM, Poon YY, et al. Ten-year outcome of subthalamic stimulation in Parkinson disease: a blinded evaluation. Arch Neurol. 2011;68(12):1550-6.
89. Schuepbach WMM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson’s disease with early motor complications. N Engl J Med. 2013;368(7):610-22.
90. Artusi CA, Dwivedi AK, Romagnolo A, et al. Association of subthalamic deep brain stimulation with motor, functional, and pharmacologic outcomes in patients with monogenic Parkinson disease: A systematic review and meta-analysis. JAMA Netw Open. 2019;2(2):e187800.
91. Jost ST, Sauerbier A, Visser-Vandewalle V, et al. A prospective, controlled study of non-motor effects of subthalamic stimulation in Parkinson’s disease: results at the 36-month follow-up. J Neurol Neurosurg Psychiatry 2020;91(7):687–694.
92. Lezcano E, Gómez-Esteban JC, Tijero B, et al. Long-term impact on quality of life of subthalamic nucleus stimulation in Parkinson’s disease. J Neurol. 2016;263:895-905.
93. Lachenmayer ML, Murset M, Antih N, et al. Subthalamic and pallidal deep brain stimulation for Parkinson’s disease-meta-analysis of outcomes. NPJ Parkinson’s Dis 2021;7(1):77.
94. Bove F, Mulas D, Cavallieri F, Castrioto A, Chabardès S, Meoni S, et al. Long-term outcomes (15 years) after subthalamic nucleus deep brain stimulation in patients with Parkinson disease. Neurology. 2021;97(3):E254-E262.
95. Geraedts VJ, Feleus S, Marinus J, van Hilten JJ, Contarino MF. What predicts quality of life after subthalamic deep brain stimulation in Parkinson’s disease? A systematic review. Eur J Neurol. 2020 Mar;27(3):419-428.
96. Hariz MI, Rehncrona S, Quinn NP, Speelman JD, Wensing C. Multicenter study on deep brain stimulation in Parkinson’s disease: an independent assessment of reported adverse events at 4 years. Mov Disord. 2008;23(3):416-21.
97. Voon V, Krack P, Lang AE, et al. A multicentre study on suicide outcomes following subthalamic stimulation for Parkinson’s disease. Brain 2008;131:2720-28.
98. Weintraub D, Duda JE, Carlson K, et al. Suicide ideation and behaviours after STN and GPi DBS surgery for Parkinson’s disease: results from a randomised, controlled trial. J Neurol Neurosurg Psychiatry. 2013;84:1113-8.
99. Witt K, Daniels C, Reiff J, et al. Neuropsychological and psychiatric changes after deep brain stimulation for Parkinson’s disease: a randomised, multicentre study. Lancet Neurol. 2008;7:605-14.
100. Appleby BS, Duggan PS, Regenberg A, et al. Psychiatric and neuropsychiatric adverse events associated with deep brain stimulation: a metaanalysis of ten years’ experience. Mov Disord. 2007;22:1722-8.
101. Czernecki V, Pillon B, Houeto JL, et al. Does bilateral stimulation of the subthalamic nucleus aggravate apathy in Parkinson’s disease? J Neurol Neurosurg Psychiatry. 2005; 76:775-9.
102. Drapier D, Drapier S, Sauleau P, et al. Does subthalamic nucleus stimulation induce apathy in Parkinson’s disease? J Neurol. 2006;253:1083-91.
103. Castrioto A, Lhommée E, Moro E, Krack P. Mood and behavioural effects of subthalamic stimulation in Parkinson’s disease. Lancet Neurol. 2014;13:287-305.
104. Chopra A, Tye SJ, Lee KH, et al. Underlying neurobiology and clinical correlates of mania status after subthalamic nucleus deep brain stimulation in Parkinson’s disease: a review of the literature. J Neuropsychiatry Clin Neurosci 2012; 24: 102–110.
105. Sisodia V, Malekzadeh A, Verwijk E, et al. Bidirectional interplay between Deep Brain Stimulation and cognition in Parkinson’s disease: A systematic review. Mov Disord. 2024 May;39(5):910-915.
106. Valldeoriola F, Morsi O, Tolosa E, et al. Prospective comparative study on cost-effectiveness of subthalamic stimulation and best medical treatment in advanced Parkinson’s disease. Mov Disord. 2007;22:2183-91.
107. Tomaszewski KJ, Holloway RG. Deep brain stimulation in the treatment of Parkinson’s disease: a cost-effectiveness analysis. Neurology. 2001;57:663-71.
108. Meissner W, Schreiter D, Volkmann J, et al. Deep brain stimulation in late stage Parkinson’s disease: a retrospective cost analysis in Germany. J Neurol. 2005;252:218-23.
109. Smilowska K, VanWamelen DJ, Pietrzykowski T, et al. Cost-effectiveness of device-aided therapies in Parkinson’s disease: a structured review. J Parkinsons Dis. 2021;11(2):475-89.
110. Follett KA, Weaver FM, Stern M, et al. Pallidal versus subthalamic deep-brain stimulation for Parkinson’s disease. N Engl J Med 2010;362(22):2077–2091.
111. Weaver FM, Follett KA, Stern M, et al. Randomized trial of deep brain stimulation for Parkinson disease: thirty-six-month outcomes. Neurology. 2012;79(1):55-65.
112. Odekerken VJ, van Laar T, Staal MJ, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson’s disease (NSTAPS study): a randomised controlled trial. Lancet Neurol 2013;12(1):37–44.
113. Odekerken VJ, Boel JA, Schmand BA; NSTAPS study group. GPi vs STN deep brain stimulation for Parkinson disease: Three-year follow-up. Neurology. 2016;86(8):755-61.
114. Liu Y, Li W, Tan C, et al. Meta-analysis comparing deep brain stimulation of the globus pallidus and subthalamic nucleus to treat advanced Parkinson disease. J Neurosurg. 2014;121(3):709-18.
115. Sako W, Miyazaki Y, Izumi Y, Kaji R. Which target is best for patients with Parkinson’s disease? A meta-analysis of pallidal and subthalamic stimulation. J Neurol Neurosurg Psychiatry. 2014;85(9):982-6.
116. Escamilla-Sevilla F, Mínguez-Castellanos A. Deep-brain stimulation for Parkinson’s disease. N Eng J Med 2010;363(10):987; author reply 988.
117. Moosa S, Martínez-Fernández R, Elias WJ, et al. The role of high-intensity focused ultrasound as a symptomatic treatment for Parkinson’s disease. Mov Disord. 2019;34(9):1243-1251.
118. Bond AE, Shah BB, Huss DS, et al. Safety and efficacy of focused ultrasound thalamotomy for patients with medication-refractory, tremor-dominant Parkinson disease: a randomized clinical trial. JAMA Neurol. 2017;74:1412–1418.
119. Sperling SA, Shah BB, Barrett MJ, et al. Focused ultrasound thalamotomy in Parkinson disease: Nonmotor outcomes and quality of life. Neurology. 2018 Oct 2;91(14):e1275-e1284.
120. Máñez-Miró JU, Rodríguez-Rojas R, Del Álamo M, et al. Present and future of subthalamotomy in the management of Parkinson’s disease: a systematic review. Expert Rev Neurother. 2021;21(5):533-545.
121. Martínez-Fernández R, Máñez-Miró JU, Rodríguez-Rojas R et al. Randomized trial of focused ultrasound subthalamotomy for Parkinson’s disease. N Engl J Med. 2020;383(26):2501-2513.
122. Martínez-Fernández R, Natera-Villalba E, Máñez Miró JU et al. Prospective long-term follow-up of focused ultrasound unilateral subthalamotomy for Parkinson disease. Neurology. 2023;100(13):e1395-e1405.
123. Martínez Fernández R, Natera Villalba E, Rodríguez-Rojas R, et al. Unilateral focused ultrasound subthalamotomy in early Parkinson’s disease: a pilot study. J Neurol Neurosurg Psychiatry. 2024 Feb 14;95(3):206-213.
124. Martínez-Fernández R, Natera-Villalba E, Rodríguez-Rojas R, et al. Staged bilateral MRI-guided focused ultrasound subthalamotomy for Parkinson disease. JAMA Neurol. 2024;81(6):638-644.
125. Krishna V, Fishman PS, Eisenberg HM, et al. Trial of globus pallidus focused ultrasound ablation in Parkinson’s disease. N Engl J Med. 2023;388(8):683-693.



