Los trastornos afectivos son frecuentes desde las fases iniciales de la EP. Dentro de ellos debe diferenciarse la presencia de depresión, ansiedad y apatía. Si bien coexisten con frecuencia en un mismo paciente, su diferenciación implica el uso de fármacos específicos para cada problema. El desarrollo de apatía sin depresión, además, se asocia con un mayor riesgo de progresión hacia la demencia. Debe tenerse en cuenta que los trastornos de ansiedad representan el síntoma afectivo más frecuente, y se manifiestan desde fases muy iniciales de la enfermedad25,26 (NE-IV). La depresión y la ansiedad también son frecuentes en los periodos off, que ocurren en el 35% de los pacientes como parte de fluctuaciones no motoras. Las fluctuaciones no motoras pueden ser psiquiátricas, cognitivas, autonómicos o sensoriales, y pueden variar durante el transcurso del día. Distinguir los síntomas afectivos persistentes de los que ocurren en el contexto de periodos off no siempre es sencillo y algunos pacientes pueden tener ambos26 (NE-IV).
Diagnóstico
Se basa fundamentalmente en una entrevista adecuada, que reconozca los síntomas propios de cada problema. Los pacientes con trastorno depresivo manifiestan síntomas apáticos, mientras que aquellos con apatía aislada o predominante (15-25%) solo manifiestan síntomas de desmotivación. Ciertos síntomas como la anhedonia, la anergia y el enlentecimiento psicomotor son comunes a la apatía y la depresión27 (NE-IV). La ansiedad se manifiesta mediante trastorno por ansiedad generalizada, crisis de pánico e irritabilidad, fobia social o agorafobia. Hasta en el 80% coexiste con la depresión.
Una dificultad añadida en el diagnóstico de la depresión en la EP es la limitación para utilizar los criterios diagnósticos de depresión del Manual diagnóstico y estadístico de los trastornos mentales (Diagnostic and Statistical Manual of Mental Disorders [DSM]), dado el solapamiento entre síntomas físicos y cognitivos presentes tanto en la depresión primaria como en la EP28 (NE-IV). Como alternativa, varios estudios han intentado describir las notas de corte de escalas de depresión aceptadas para su uso en la EP. Teniendo en cuenta la limitación que supone que aún no se haya diseñado ninguna escala de depresión específica para la EP, el grupo de trabajo de la MDS Task Force para el diagnóstico de depresión en la EP determinó qué escalas son las más útiles en esta enfermedad29 (NE-IV). Entre las escalas aconsejadas destacan la Escala de Depresión de Montgomery-Asberg (Montgomery-Asberg Depression Rating Scale [MADRS]) y la Escala de Depresión Geriátrica (Geriatric Depression Scale [GDS]), útiles tanto para el cribado como para el seguimiento de la clínica depresiva; la subescala para la depresión de la Escala de Ansiedad y Depresión Hospitalaria (Hospital Anxiety and Depression Scale [HADS-D]) es útil para el cribado de la depresión. Las notas de corte para el diagnóstico de depresión con estas tres escalas son: MADRS ≥ 15, GDS-15 ≥ 6 y HADS-D ≥ 11. La Escala de Depresión de Hamilton (Hamilton Rating Scale for Depression [HAM-D]) y el Inventario de Depresión de Beck (Beck Depression Inventory [BDI]) son escalas muy bien validadas en la depresión primaria, pero incluyen muchos ítems somáticos que se solapan con la EP 29. Aun así, se han establecido notas de corte para el cribado de la depresión en poblaciones de EP (HAM-D ≥ 16; BDI ≥ 14), y varios estudios las han utilizado también para el seguimiento y la respuesta terapéutica 30.
Para el diagnóstico de la apatía, tres escalas han mostrado una buena validez de constructo y han sido validadas para su uso en la EP31 (NE-IV). La Escala de Apatía (Apathy Scale [AS]), con nota de corte ≥ 14, y la Escala de Apatía de Lille (Lille Apathy Rating Scale [LARS]), con nota de corte ≥ 17, son útiles para el cribado, seguimiento y respuesta al tratamiento, mientras que el ítem 7 del Inventario Neuropsiquiátrico (Neuropsychiatric Inventory [NPI]), con nota de corte ≥ 4, puede ser útil para el cribado, pero no para el seguimiento ni la valoración de cambio del síntoma en el tiempo.
Hasta el momento actual, la mayoría de los estudios que han evaluado la ansiedad en la EP han utilizado la subescala para la ansiedad de la HADS (HADS-A), la Escala de Ansiedad de Hamilton (Hamilton Anxiety Rating Scale [HAM-A]) o el Inventario de Ansiedad de Beck (Beck Anxiety Inventory [BAI]). Para estas escalas, sin embargo, no hay notas de corte para la EP y tampoco se han evaluado todas sus propiedades psicométricas en esta enfermedad32. Mejor comportamiento en la EP parece tener el Inventario de Ansiedad Geriátrica (Geriatric Anxiety Inventory [GAI]), y recientemente se ha diseñado una escala específica, la Escala de Ansiedad en Parkinson (Parkinson’s Anxiety Scale [PAS]), que parece tener mayor validez de constructo y presenta buenas propiedades psicométricas33 (NE-IV).
Tratamiento
Múltiples estudios abiertos, cruzados o doble ciego comparados con placebo han intentado comprobar cuáles son los mejores fármacos para el tratamiento de la depresión en la EP. El solapamiento con síntomas propios de la enfermedad, los factores psicosociales que acompañan a un paciente con una enfermedad degenerativa crónica y el desarrollo de depresión en diferentes momentos evolutivos de la EP dificultan dar una respuesta unívoca a esta pregunta. Basándonos en la evidencia aportada por ensayos a doble ciego, aleatorizados y comparados con placebo, así como en revisiones, guías y metaanálisis recientes26,34-36 (NE-I), los fármacos antidepresivos con mayor respaldo de la literatura científica son citalopram 10-20 mg/día, paroxetina 10-20 mg/día, venlafaxina 75-150 mg/día, nortriptilina 50 mg/día y desipramina 50-75 mg/día (NE-I). En la práctica clínica habitual, los inhibidores selectivos de la recaptación de serotonina (sertralina 50-100 mg/día, escitalopram 10-15 mg/día) y los inhibidores duales de la recaptación de serotonina y noradrenalina (duloxetina 60 mg/día) y venlafaxina (75-150 mg) son los fármacos antidepresivos más utilizados (NE-I)36.
Fármacos recientes como la vortioxetina (5-20 mg) han demostrado su utilidad en estudios prospectivos abiertos (NE-IV).
Un ensayo doble ciego y controlado con placebo también demostró la eficacia del pramipexol (2,1 mg/día) para el tratamiento de la depresión en la EP 37 (NE-I).
Los IMAO-B, como la safinamida, también han mostrado beneficios sobre los síntomas depresivos en estudios recientes38-39 (NE-IV).
Tratamientos no farmacológicos como la terapia cognitiva conductual, la estimulación magnética transcraneal sobre la corteza prefrontal dorsolateral izquierda o la terapia electroconvulsiva han demostrado su eficacia en pacientes con enfermedad de Parkinson40-43 (NE-I).
Menor evidencia existe para el tratamiento de la apatía. Este síntoma depende de diferentes sustratos neuroquímicos (déficits colinérgico y dopaminérgico). En pacientes con mayor deterioro cognitivo, el déficit colinérgico parece de mayor relevancia, mientras que, en pacientes sin demencia, el déficit dopaminérgico a nivel del estriado ventral aparece como el factor causal más importante. Aun así, y en función de los estudios publicados, la rivastigmina a 9,5 mg/día se ha mostrado igualmente eficaz para la mejoría de la clínica apática en pacientes con y sin demencia44 (NE-I) . En un estudio a doble ciego controlado con placebo, el uso de piribedil ha mostrado mejorías estadísticamente significativas45 (NE-II), y en series abiertas de pacientes el uso de pramipexol, rotigotina y safinamida también ha mostrado mejorías en la puntuación de las escalas de apatía46,47 (NE-IV).
No existen estudios específicos para el tratamiento de la ansiedad en la EP y las opciones terapéuticas aconsejadas se basan en la eficacia demostrada de las benzodiacepinas en pacientes de edad avanzada con ansiedad primaria o asociada a otras enfermedades degenerativas48. Se considera preferible el uso de benzodiacepinas de vida corta, como el alprazolam, y benzodiacepinas que se metabolicen más fácilmente, como el lorazepam48,49 (NE-III). Para el manejo a largo plazo de la ansiedad generalizada es aconsejable el uso de antidepresivos ISRS e ISRNS49 (NE-IV). Sin duda, se requieren estudios bien dirigidos y diseñados para determinar el tratamiento de la ansiedad en la EP.
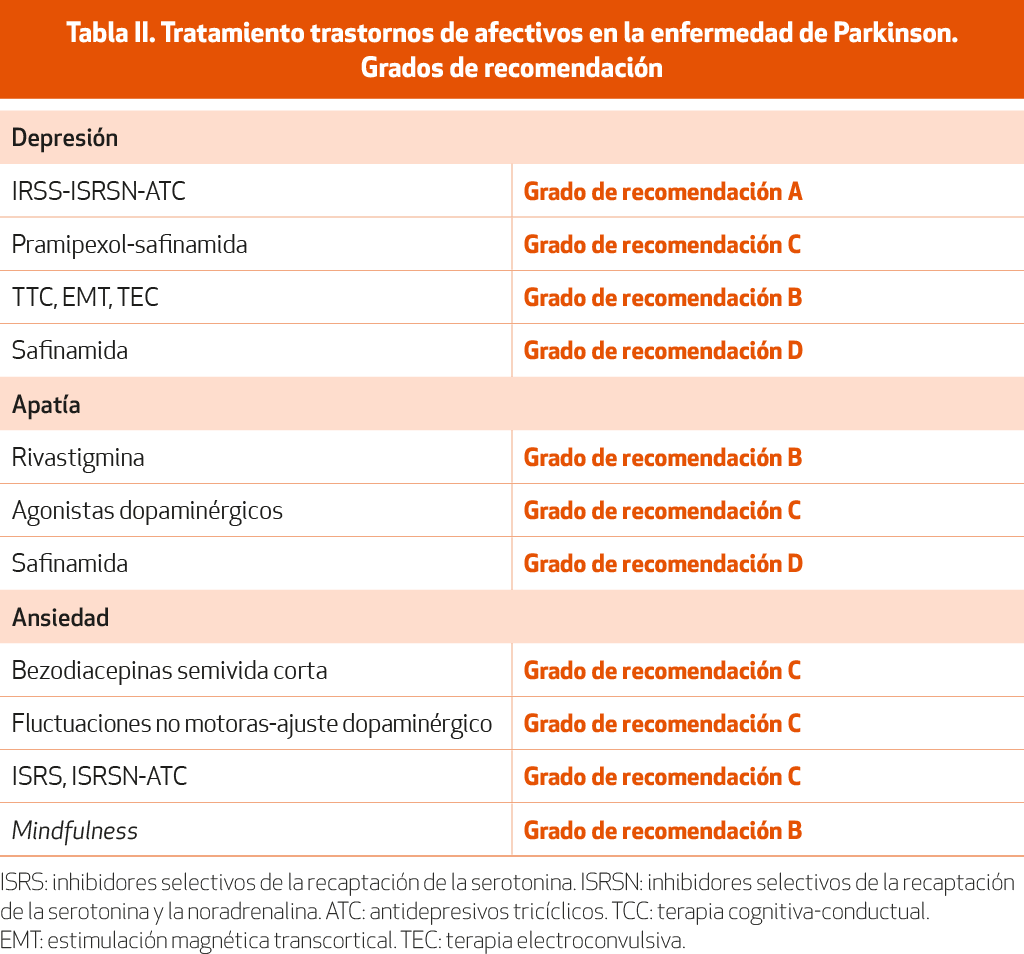
Los síntomas de ansiedad, si aparecen como fluctuaciones no motoras, se manejarán primero con ajustes en los tratamientos dopaminérgicos26,34,49 (NE-III). Se ha demostrado recientemente que el uso de la safinamida también podría tener un efecto en los trastornos del ánimo y, entre ellos, en la apatía en los pacientes con EP. El beneficio se obtenía tanto con dosis de 50 mg como con 100 mg19,47 (NE-IV).
Otros tratamientos no farmacológicos, como el mindfulness, pueden ser útiles en tratar la ansiedad y depresión en la enfermedad de Parkinson50 (NE-I) (ver capítulo 15 sobre terapias alternativas en la enfermedad de Parkinson (pag. 345).
Bibliografía
19. Bianchi MLE, Riboldazzi G, Mauri M, et al. Efficacy of safinamide on non-motor symptoms in a cohort of patients affected by idiopathic Parkinson’s disease. Neurol Sci. 2019;40(2):275-279.
25. Aarsland D, Marsh L, Schrag A. Neuropsychiatric symptoms in Parkinson’s disease. Mov Disord. 2009;24:2175-86.
26. Weintraub D, Aarsland D, Chaudhuri KR, et al. The neuropsychiatry of Parkinson’s disease: advances and challenges. Lancet Neurol. 2022;21(1):89-102.
27. Pagonabarraga J, Kulisevsky J, Strafella AP, et al. Apathy in Parkinson’s disease: clinical features, neural substrates, diagnosis, and treatment. Lancet Neurol. 2015;14:51831.
28. Marsh L, McDonald WM, Cummings J, et al.; NINDS/NIMH Work Group on Depression and Parkinson’s Disease. Provisional diagnostic criteria for depression in Parkinson’s disease: report of an NINDS/NIMH Work Group. Mov Disord. 2006;21(2):14858.
29. Schrag A, Barone P, Brown RG, et al. Depression rating scales in Parkinson’s disease: critique and recommendations. Mov Disord. 2007;22(8):1077-92.
30. Leentjens AF, Verhey FR, Lousberg R, et al. The validity of the Hamilton and Montgomery- Asberg depression rating scales as screening and diagnostic tools for depression in Parkinson’s disease. Int J Geriatr Psychiatry. 2000 Jul;15(7):644-9.
31. Leentjens AF, Dujardin K, Marsh L, et al. Apathy and anhedonia rating scales in Parkinson’s disease: critique and recommendations. Mov Disord. 2008;23:2004-14.
32. Leentjens AF, Dujardin K, Marsh L, et al. Anxiety rating scales in Parkinson’s disease: a validation study of the Hamilton anxiety rating scale, the Beck anxiety inventory, and the hospital anxiety and depression scale. Mov Disord. 2011 Feb 15;26(3):407-15.
33. Dissanayaka NN, Torbey E, Pachana NA. Anxiety rating scales in Parkinson’s disease: a critical review updating recent literature. Int Psychogeriatr. 2015;27:1777-84.
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
36. Mills KA, Greene MC, Dezube R, et al. Efficacy and tolerability of antidepressants in Parkinson’s disease: a systematic review and network meta-analysis. Int J Geriatr Psychiatry. 2018;33(4):642-51.
37. Barone P, Poewe W, Albrecht S, et al. Pramipexole for the treatment of depressive symptoms in patients with Parkinson’s disease: a randomised, double-blind, placebo- controlled trial. Lancet Neurol. 2010;9:573-80.
38. De Masi C, Liguori C, Spanetta M, et al. Non-motor symptoms burden in motor-fluctuating patients with Parkinson’s disease may be alleviated by safinamide: the VALE-SAFI study. J Neural Transm (Vienna). 2022;129(11):1331-1338.
39. Stocchi F, Antonini A, Berg D, et al. Safinamide in the treatment pathway of Parkinson’s Disease: a European Delphi Consensus. NPJ Parkinsons Dis. 2022;8(1):17.
40. Dobkin RD, Mann SL, Gara MA, et al. Telephone-based cognitive behavioral therapy for depression in Parkinson disease: a randomized controlled trial. Neurology. 2020;94(16):e1764-e1773.
41. Dobkin RD, Mann SL, Weintraub D, et al. Innovating Parkinson’s care: a randomized controlled trial of telemedicine depression treatment. Mov Disord. 2021;36(11):2549-58.
42. Li S, Jiao R, Zhou X, et al. Motor recovery and antidepressant effects of repetitive transcranial magnetic stimulation on Parkinson disease: a PRISMA-compliant meta- analysis. Medicine (Baltimore). 2020;99(18):e19642.
43. Takamiya A, Seki M, Kudo S, et al. Electroconvulsive therapy for Parkinson’s disease: a systematic review and meta-analysis. Mov Disord. 2021;36(1):50-8.
44. Devos D, Moreau C, Maltête D, et al. Rivastigmine in apathetic but dementia and depression- free patients with Parkinson’s disease: a double-blind, placebo-controlled, randomised clinical trial. J Neurol Neurosurg Psychiatry. 2014;85(6):668-74.
45. Thobois S, Lhommée E, Klinger H, et al. Parkinsonian apathy responds to dopaminergic stimulation of D2/D3 receptors with piribedil. Brain. 2013;136(Pt 5):1568-77.
46. Mele B, Van S, Holroyd-Leduc J, et al. Diagnosis, treatment and management of apathy in Parkinson’s disease: a scoping review. BMJ Open. 2020;10(9):e037632.
47. Labandeira CM, Alonso Losada MG, Yáñez Baña R, et al. Effectiveness of Safinamide over Mood in Parkinson’s Disease Patients: Secondary Analysis of the Open-label Study SAFINONMOTOR. Adv Ther. 2021;38(10):5398-5411.
48. Baldwin DS, Anderson IM, Nutt DJ, et al. Evidence-based guidelines for the pharmacological treatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. J Psychopharmacol. 2005;6:567-96.
49. Weintraub D. Management of psychiatric disorders in Parkinson’s disease: Neurotherapeutics. 2020;17(4):1511-24.
50. Lin HW, Tam KW, Kuan YC. Mindfulness or meditation therapy for Parkinson’s disease: A systematic review and meta-analysis of randomized controlled trials. Eur J Neurol. 2023;30(8):2250-2260.



