Sialorrea
El babeo, en la EP, se produce por la acumulación de saliva y alteración de su manejo dentro de la boca, producida por las dificultades de deglución que aparecen en el curso de la enfermedad, conduciendo a su caída o aspiración80.
No disponemos de criterios diagnósticos, aunque sí de múltiples herramientas que pre- tenden observarlo (UPDRS-II, SCOPA-AUT, PD-NMSQuest), por lo que en diferentes estudios la prevalencia varía entre el 10% y el 84%81.
En cuanto al tratamiento, se aconseja retirar todos los fármacos que puedan aumentarlo, como los inhibidores de la acetilcolinesterasa o los antipsicóticos, y corregir el tratamiento dopaminérgico a criterio del clínico.
Se han realizado estudios con atropina, bromuro de ipratropio, tropicamida y glicopirrolato, siendo este último el único que demostró, en un estudio aleatorizado, a doble ciego y cruzado (1 mg oral tres veces al día), un efecto beneficioso82 (NE-I), si bien no se dispone de evidencia para tratamientos de más de 1 semana de duración. El glicopirrolato oral no está disponible en nuestro país, pudiendo obtenerse para fórmulas magistrales.
La infiltración de toxina botulínica en las glándulas salivares es una medida eficaz en el tratamiento de la sialorrea83 (NE-I). Concretamente la incobotulinumtoxina A, en un estudio fase III ha demostrado ser útil infiltrando 100 u distribuidas entre parótidas y submandibulares84 (NE-I).
Otros tratamientos sin evidencia suficiente, como el colirio oftálmico de atropina al 1% sublingual, también se utilizan85 (NE-IV).
Hipotensión ortostática
Se define como la reducción en la presión arterial sistólica en más de 20 mmHg o diastólica en más de 10 mmHg tras pasar del decúbito a la bipedestación durante 3 minutos. Es, probablemente, consecuencia de la denervación simpática vascular a la que pueden contribuir otros factores como los fármacos antihipertensivos o antipsicóticos concomitantes, en su caso, o la amantadina y agonistas dopaminérgicos, así como del efecto vasodilatador, diurético e inotrópico negativo de la dopamina secundaria a la metabolización periférica de la LD. Puede estar presente en más del 52% de los pacientes con EP y con mayor frecuencia en otros parkinsonismos34 (NE-I).
Los síntomas que produce son sincopes y presíncopes al ponerse de pie, y en ocasiones sensación de dolor de cuello y hombros y fatiga.
Su manejo precisa de una primera fase en la que se reduzcan y controlen los posibles precipitantes: fragmentación de las comidas evitando las ingestas copiosas de carbohidratos, aumento del consumo de agua y sal (> 8 g/día), uso de calcetines de presión o maniobras para recuperar la tensión ante los primeros síntomas, como ponerse en cuclillas, inclinarse hacia delante o cruzar las piernas haciendo presión en los muslos y pantorrillas34-35 (NE-IV).
Cuando estas maniobras no son suficientes, se pueden emplear fármacos. No disponemos de evidencia suficiente de la eficacia de la fludrocortisona86 ni de la domperidona 10 mg/8 horas (NE-IV).
La droxidopa está aprobada por la FDA a dosis de 100-300 mg/8 horas, tiene mayor nivel de evidencia, mejorando los síntomas y el impacto de los síntomas en las actividades de la vida diaria, pero no está disponible en España87 (NE-I). Por su parte, la midodrina, un agonista de los adrenorreceptores α1 en dosis de 2,5-10 mg tres veces al día está aprobada en Europa y América88 (NE-I) y otros, como la yohimbina (antagonista adrenérgico α2) están aún bajo estudio en fase III en Estados Unidos. Un estudio parece sugerir que aumenta su acción con la administración combinada de atomoxetina, un inhibidor del transportador de norepinefrina (yohimbina 5,4 mg y atomoxetina 18,0 mg)89 (NE-IV). La piridostigmina, que aumenta la acetilcolina ganglionar en la vía eferente simpática, parece ser inferior a la fludrocortisona para el control de síntomas de hipotensión ortostática en pacientes con EP90 (NE-III).
Hay que tener cuidado y evitar la administración de estos fármacos en dosis nocturna (después de las 17:00 horas), especialmente la midodrina, ya que pueden agravar la hipertensión arterial en decúbito que presentan frecuentemente estos pacientes, que se puede tratar con medidas no farmacológicas (elevar el cabecero o tomar un pequeño snack nocturno rico en carbohidratos) o farmacológicas con IECA de vida media corta como captopril a 25 mg o ARA-II como losartán a 25-50 mg91 (NE-IV).
Disfunción vesical y sexual
Disfunción vesical
Se manifiesta clínicamente en forma de urgencia miccional, aumento de la frecuencia con más de siete micciones al día, nicturia, con más de 3-4 micciones por la noche, o urge-incontinencia. En la mayor parte de los casos, se relaciona con la hiperactividad del músculo detrusor secundaria a la alteración de los mecanismos reguladores dopaminérgicos y noradrenérgicos del SNC, así como en los centros pontinos de la micción, implicados en la inhibición parasimpática de dicho músculo. Está presente en un 30-60% de los pacientes con EP, y puede verse potenciada por otros factores como la edad.
A pesar de la frecuencia del síntoma, no disponemos de estudios cuyo diseño establezca evidencia de los tratamientos aplicados, por lo que el tratamiento92 (NE-IV) se enfoca atendiendo a los conocimientos generales. Los pacientes con disfunción vesical deben someterse a una valoración urológica antes de plantear la mejor opción terapéutica. No es infrecuente la asociación en pacientes varones de hiperplasia benigna de próstata, que facilita la hiperactividad del detrusor y cuyo tratamiento quirúrgico se asocia con mayor frecuencia que en la población general a incontinencia posterior. Se recomienda la cateterización intermitente en los pacientes con residuo miccional superior a los 100 ml. En caso de hipertonía del detrusor sin presentar residuo, puede plantearse el uso de los anticolinérgicos, preferiblemente los selectivos de los receptores muscarínicos M3, responsables de la contracción del detrusor, para reducir el riesgo de efectos secundarios cognitivos y el estreñimiento34,35,85 (NE-I). Entre ellos, la solifenacina (NE-I), la oxibutinina, que también existe en parches transdérmicos, la tolterodina, la propiverina, la fesoterodina o el cloruro de trospio (NE-III) pueden utilizarse34,35,85.
Los agonistas adrenérgicos β3 como el mirabegrón relajan el detrusor durante el llenado vesical y podrían plantearse como una opción en estos pacientes93 (NE-I). También los antagonistas α1 (tamsulosina, doxazosina) relajan el cuello vesical y facilitan la micción94 (NE-IV). Existen sugerencias de que algunos pacientes pueden mejorar tras el tratamiento con ECP. En la actualidad, la toxina botulínica se considera el tratamiento de elección en los pacientes que no responden a los tratamientos orales95 (NE-I).
La safinamida en un estudio retrospectivo ha demostrado que podría mejorar los síntomas urinarios96 (NE-II). En el estudio Surinpark se achaca el beneficio tanto al efecto dopaminérgico como al no dopaminérgico del fármaco96.
Disfunción sexual
Es más frecuente en la EP que en la población general, aunque no es fácil establecer hasta qué punto está relacionada directa y exclusivamente con la fisiopatología o clínica de la enfermedad ya que, al menos en hombres, su frecuencia es similar a otras enfermedades crónicas no neurológicas. La disfunción eréctil, en más del 60% de los pacientes, y la dificultad para eyacular y conseguir un orgasmo son frecuentes en varones, mientras la tensión vaginal, falta de lubricación, incontinencia urinaria, ansiedad e inhibición son predominantes en las mujeres. Los pacientes varones, pero no las mujeres, parecen mejorar la percepción de su vida sexual tras la ECP. Puede estar implicada la comorbilidad en forma de depresión, disautonomía o hipotestosteronemia, así como los fármacos hipotensores o antidepresivos97 (NE-IV).
La disfunción eréctil es el único aspecto de la disfunción sexual en la EP que tiene un tratamiento farmacológico basado en la evidencia, los inhibidores de la fosfodiesterasa 5 (PDE5-inh). El sildenafilo dispone de un NE-IV para su utilización en pacientes con EP98, y el vardenafilo y el tadalafilo pueden considerarse probablemente efectivos en base a los estudios disponibles99. Los PDE5-inh están contraindicados en pacientes con hipotensiones previas (90 mmHg/50 mmHg documentadas), en tratamiento con vasodilatadores derivados de la nitroglicerina (podría plantearse el cambio a su cardiólogo), con retinitis pigmentaria o historia de priapismo. En pacientes con EP, debe hacerse un mayor control de la aparición de hipotensión ortostática en pacientes que no la presentaran previamente. Con frecuencia debe recurrirse a dosis máximas (50-100 mg en sildenafilo, 20 mg en vardenafilo y tadalafilo), y el inicio del efecto puede retrasarse por los problemas de absorción, lo que debería avisarse al inicio del tratamiento.
En los casos en que no se obtuviera respuesta satisfactoria, podrían plantearse otras opciones de tratamiento, como los parches transdérmicos de testosterona, la apomorfina sublingual en dosis de 2-4 mg (inicio: 10-15 minutos)95,97 (NE-IV). La formulación referida de apomorfina sublingual es difícil de conseguir en España y habrá que ver si con las formulaciones que se comercializarán proximamente, de 10 a 30 mg, tienen evidencia para usarla en esta indicación. También se pueden considerar las las inyecciones intracavernosas de prostaglandina E1 (alprostadil), o los dispositivos de vacío tras la valoración urológica, pero no se dispone de resultados específicos de estos dos últimos tratamientos en pacientes con EP. En casos refractarios o que deseen una solución permanente, se puede optar por una prótesis quirúrgica, que tiene unos altos índices de eficacia en la población general no específicamente afecta de EP (entre el 92-100%)95 (NE-IV).
Estreñimiento
El estreñimiento en la EP es secundario a la neurodegeneración en los plexos mientéricos y centros autonómicos, pero también a la disinergia del suelo pélvico, indicación esta última para la que se utiliza la toxina botulínica en el músculo puborrectal o en el esfínter anal externo han mostrado eficacia100 (NE-IV).
Es el trastorno autonómico más frecuente entre los pacientes EP, afectando hasta al 80% de ellos. Puede preceder en años la aparición de los síntomas motores. El tratamiento debe empezar con medidas dietéticas, ejercicio físico, beber abundante agua34,35-75 (NE-IV). El macrogol, un laxante osmótico, resultó eficaz en un estudio doble ciego, aleatorizado, controlado con placebo y de grupos paralelos en el que no se describieron efectos secundarios101 (NE-I). Aunque no hay estudios específicos en la EP, se utilizan con frecuencia reguladores del tránsito intestinal, sobre todo aumentadores del volumen del bolo como metilcelulosa o Plantago ovata.
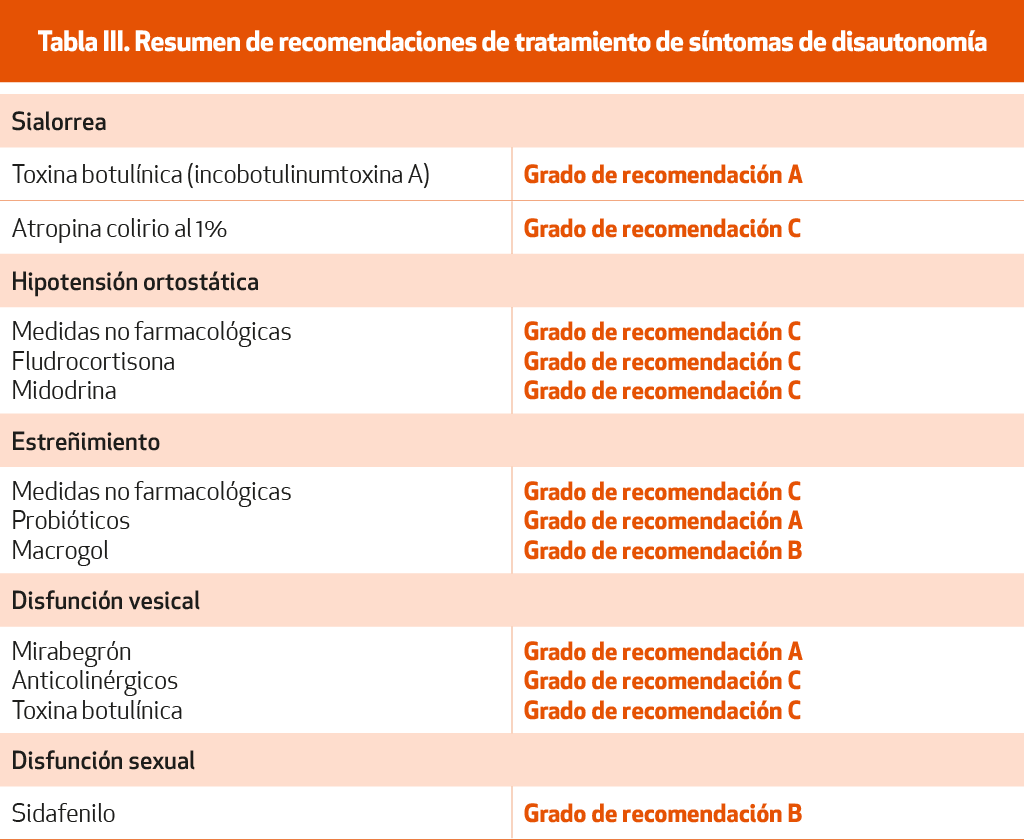
La utilización de probióticos se ha demostrado eficaz en estudios recientes102-104 (NE-I).
Hiperhidrosis
Los pacientes con EP pueden presentar tanto aumento como descenso o normalidad de la sudoración. La hiperhidrosis en forma de crisis de sudoración excesiva suele presentarse durante el off y con menos frecuencia durante el on, en el contexto de las fluctuaciones motoras, pero también puede ser una fluctuación no motora. En este caso se deberá manejar con ajuste del tratamiento para la EP. Medicamentos orales como dosis bajas de clonidina, antidepresivos tricíclicos con efectos secundarios anticolinérgicos y betabloqueantes, se han probado, pero faltan pruebas sólidas de su eficacia y justifican precaución con respecto a los efectos adversos95 (NE-I).
Bibliografía
34. Seppi K, Ray Chaudhuri K, Coelho M, et al. Update on treatments for nonmotor symptoms of Parkinson’s disease-an evidence-based medicine review [published correction appears in Mov Disord. 2019 May;34(5):765]. Mov Disord. 2019;34(2):180-198.
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
80. Srivanitchapoom P, Pandey S, Hallet M. Drooling in Parkinson’s disease: A review. Parkinsonism Relat Disord. 2014;20:1109-18.
81. Kalf JG, de Swart BJ, Borm GF, et al. Prevalence and definition of drooling in Parkinson’s disease: A systematic review J Neurol. 2009;256:1391-6.
82. Arbow ME, Moving KI, Koopmann M, et al. Glycopirrolate for sialorrhea in Parkinson disease: a randomized, double-blind, crossover trial. Neurology. 2010;74:1203-7.
83. Yang CL, Huang JP, Tan YC, et al. The effectiveness and safety of botulinum toxin injections for the treatment of sialorrhea with Parkinson’s disease: a systematic review and meta-analysis. BMC Pharmacol Toxicol. 2023 Oct 12;24(1):52.
84. Jost WH, Friedman A, Michel O, et al. SIAXI: Placebo-controlled, randomized, double-blind study of incobotulinumtoxinA for sialorrhea. Neurology. 2019;92(17):e1982-e1991.
85. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf- 1837629189061
86. Veazie S, Peterson K, Ansari Y, et al. Fludrocortisone for orthostatic hypotension. Cochrane Database Syst Rev. 2021 May 17;5(5):CD012868.
87. Kaufmann H, Freeman R, Biaggioni I, et al.; NOH301 Investigators (2014). Droxidopa for neurogenic orthostatic hypotension: a randomized, placebo-controlled, phase 3 trial. Neurology. 2014 Jul 22;83(4):328-35.
88. Smith W, Wan H, Much D, et al. Clinical benefit of midodrine hydrochloride in symptomatic orthostatic hypotension: a phase 4, double-blind, placebo-controlled, randomized, tilt-table study. Clin Auton Res. 2016;26:269–277.
89. Schrag A, Sauerbier A, Chaudhuri KR. New clinical trials for non-motor manifestations of Parkinson’s disease. Mov Disord. 2015;30(11):1490-504.
90. Schreglmann SR, Büchele F, Sommerauer M, et al. Pyridostigmine bromide versus fludrocortisone in the treatment of orthostatic hypotension in Parkinson’s disease - a randomized controlled trial. Eur J Neurol. 2017 Apr;24(4):545-551.
91. Isaacson SH, Dashtipour K, Mehdirad AA, et al. Management Strategies for Comorbid Supine Hypertension in Patients with Neurogenic Orthostatic Hypotension. Curr Neurol Neurosci Rep. 2021 Mar 9;21(4):18.
92. Sakakibara R, Panicker J, Finazzi-Agro E, et al.; and The Parkinson’s Disease Subcommittee, The Neurourology Promotion Committee in The International Continence Society. A guideline for the management of bladder dysfunction in Parkinson’s disease and other gait disorders. Neurourol Uradyn. 2015;35(5):551-63.
93. Moussa M, Chakra MA, Dabboucy B, et al. The safety and effectiveness of mirabegron in Parkinson’s disease patients with overactive bladder: a randomized controlled trial. Scand J Urol. 2022;56(1):66-72.
94. Jia C, Cui X, Ou T. Efficacy of medication for overactive bladder symptoms in 70 patients with Parkinson’s disease. Transl Androl Urol. 2024 Jan 31;13(1):64-71.
95. Udow S, Fox S. Autonomic dysfunction. En: Grimes D, Fitzpatrick M, Gordon J, et al. Canadian guideline for Parkinson disease. CMAJ. 2019;191(36):E989-1004.
96. Gómez-López A, Sánchez-Sánchez A, Natera-Villalba E, et al. SURINPARK: Safinamide for Urinary Symptoms in Parkinson’s Disease. Brain Sci. 2021;11(1):57.
97. Palma JA, Kaufmann H. Treatment of autonomic dysfunction in Parkinson disease and other synucleinopathies.Mov Disord. 2018;33(3):372-90.
98. Bernard BA, Verhagen Metman L, Levine L, et al. Sildenafil in the treatment of erectile dysfunction in Parkinson’s disease. Mov Disord Clin Pract. 2016;4(3):412–415.
99. Lombardi G, Nelli F, Celso M, et al. Treating erectile dysfunction and central neurological diseases with oral phosphodiesterase type 5 inhibitors. Review of the literature. J Sex Med. 2012 Apr;9(4):970-85.
100. Albanese A, Brisinda G, Bentivoglio AR, María G. Treatment of outlet obstruction constipation in Parkinson’s disease with botulinum neurotoxin A. Am J Gastroenterol. 2003;98(6):1439-40.
101. Zangaglia R, Martignoni E, Glorioso M, et al. Macrogol for the treatment of constipation in Parkinson’s disease. A randomized placebo-controlled study. Mov Disord. 2007; 22(9):1239-1244.
102. Du Y, Li Y, Xu X, et al. Probiotics for constipation and gut microbiota in Parkinson’s disease. Parkinsonism Relat Disord. 2022;103:92-97.
103. Ibrahim A, Ali RAR, Manaf MRA, et al. Multi-strain probiotics (Hexbio) containing MCP BCMC strains improved constipation and gut motility in Parkinson’s disease: a randomised controlled trial. PLoS One. 2020;15(12):e0244680.
104. Tan AH, Lim SY, Chong KK, et al. Probiotics for constipation in Parkinson disease: a randomized placebo-controlled study. Neurology. 2021;96(5):e772-e782.



