Los trastornos cognitivos en la EP son frecuentes y ocasionan un fuerte impacto en pacientes y cuidadores, por lo que su detección, diagnóstico y tratamiento es esencial para un buen manejo de la enfermedad. Actualmente existen dos entidades nosológicas en referencia a los trastornos cognitivos asociados a la EP: la demencia (D-EP) y el deterioro cognitivo leve (DCL-EP).
Demencia-enfermedad de Parkinson
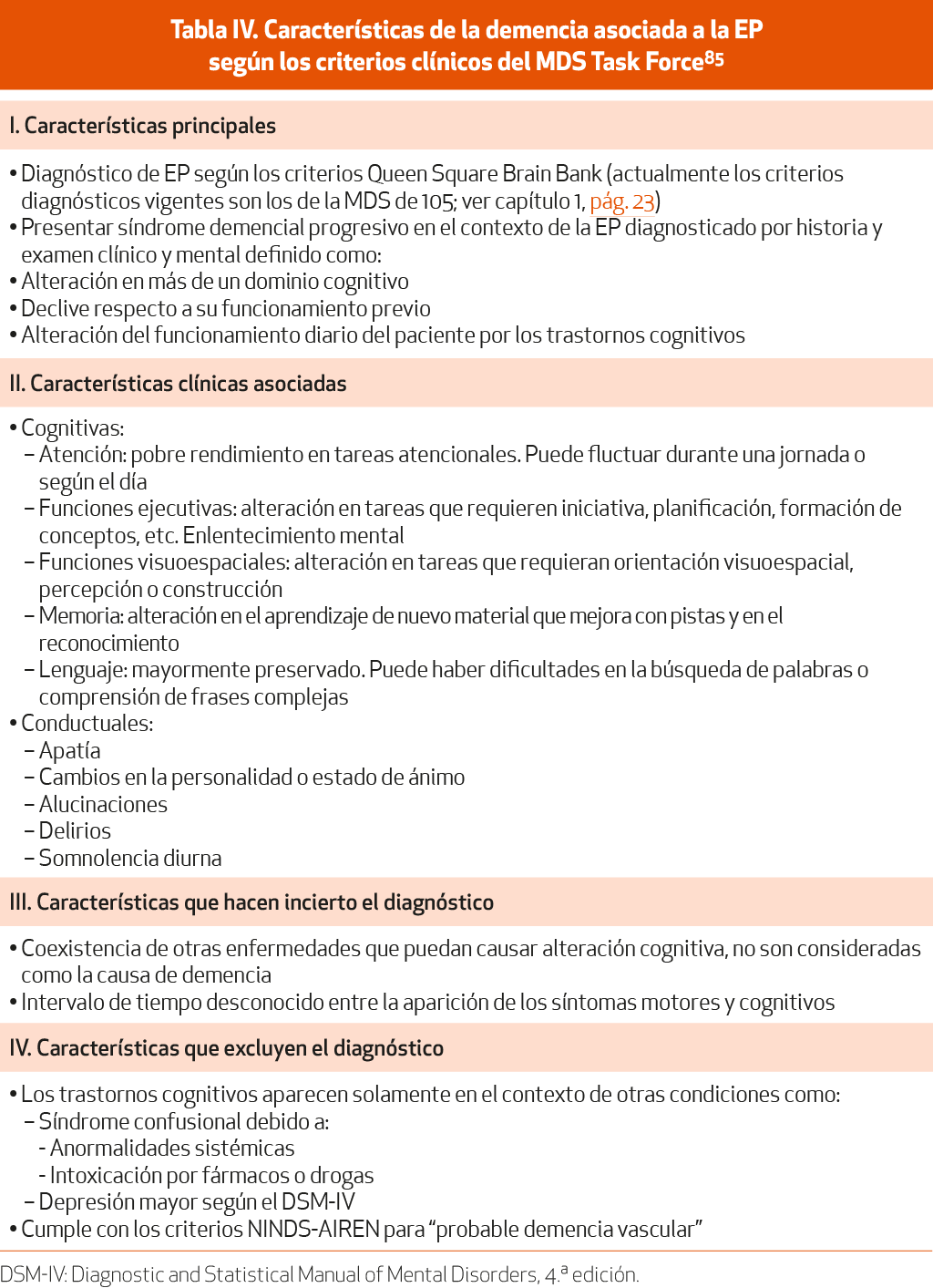
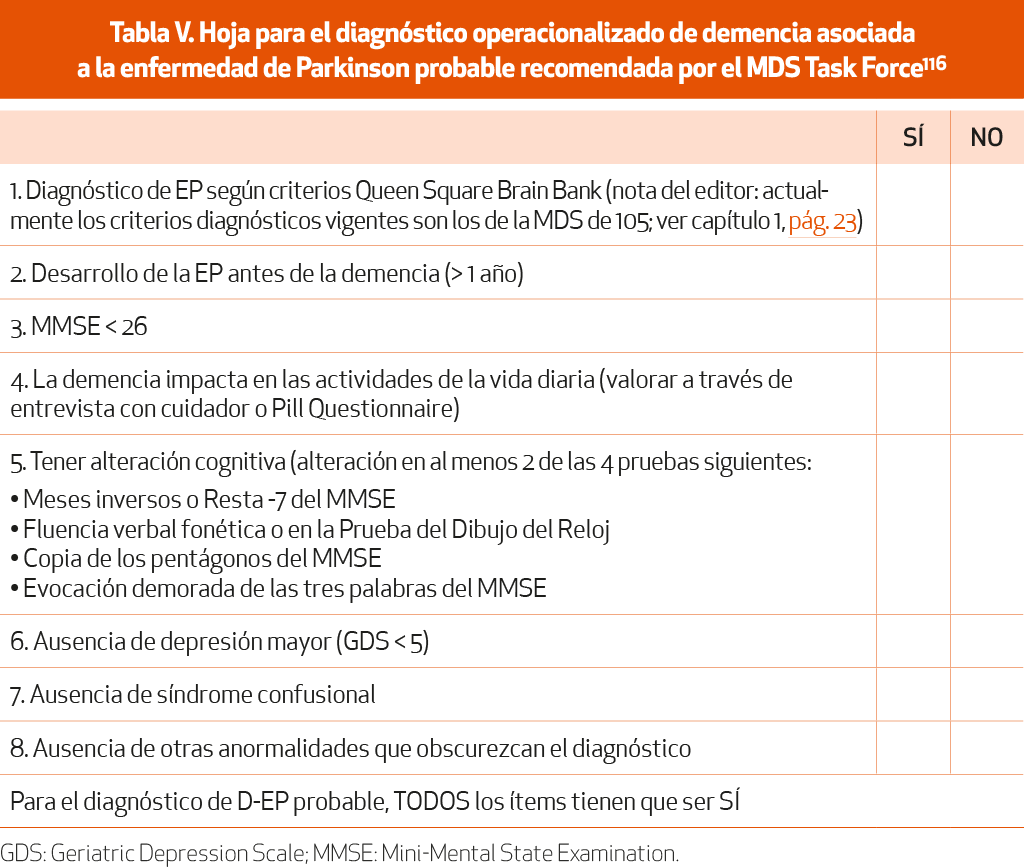
Se define como una alteración cognitiva progresiva, en más de un dominio, que se desarrolla en el contexto de una EP establecida y que se asocia a ella, y que es lo suficientemente grave como para producir alteraciones funcionales en las actividades instrumentales de la vida diaria de forma significativa. Existen unos criterios específicos116 (NE-IV) y una guía sistematizada para su diagnóstico117 (NE-IV) (Tablas IV y V).
Su prevalencia es de aproximadamente un 30% y su incidencia es cercana al 10% al año. La prevalencia acumulativa es muy alta, alcanzando el 75-80% a los 10-20 años de enfermedad. El riesgo de demencia en la EP es 4-6 veces superior al de la población general, aunque puede ser inferior en los primeros años de la enfermedad. Los factores de riesgo para el desarrollo de demencia asociada a la EP más consistentes son la edad, la presencia de deterioro cognitivo leve (DCL) o alucinaciones visuales, y parkinsonismo grave, especialmente si se presenta inestabilidad postural y trastorno de la marcha. Los estudios clínico-patológicos asocian la D-EP con la acumulación de cuerpos de Lewy en el neocórtex y el sistema límbico. Aunque frecuentemente coexiste patología de tipo Alzheimer, normalmente no alcanza suficiente gravedad como para hacer un diagnóstico de ambas enfermedades. Por otra parte, hay una fuerte evidencia de disfunción colinérgica en los trastornos cognitivos asociados a la EP.
A nivel farmacológico, la rivastigmina, en varias revisiones sistemáticas y metaanálisis, ha evidenciado la eficacia en la mejoría, además de la cognición, de los síntomas conductuales, alucinaciones, las actividades de la vida diaria, la carga del cuidador y la impresión global118,119 (NE-I). La rivastigmina es asimismo un fármaco seguro. Dos estudios que han analizado el efecto de la memantina en la EP con demencia no han encontrado mejorías en la función cognitiva global ni en los dominios cognitivos más específicos120,121 (NE-II). El tratamiento con donepezilo, mantenido durante 52 semanas, mostró una mejoría modesta, aunque significativa en el Mini-Examen del Estado Mental (Mini-Mental S tate E xamination [MMSE]), el NPI y las fluctuaciones de la cognición122 (NE-II).
Distintas guías proponen la memantina si los inhibidores de la acetilcolinesterasa no son bien tolerados, están contraindicados o falta de eficacia de los mismos35,85 (NE-III).
Deterioro cognitivo leve-enfermedad de Parkinson
Se define como un declive del rendimiento cognitivo que aparece en el contexto de una EP establecida y que se asocia a ella, pero que no es suficientemente grave como para interferir de forma significativa en el desarrollo de las actividades instrumentales de la vida diaria. Los estudios sugieren que el DCL-EP es un factor de riesgo para el desarrollo de demencia y puede representar un estadio intermedio entre la normalidad y la demencia, por lo que detectar el DCL en la EP podría tener múltiples ventajas con relación al manejo clínico y pronóstico de los pacientes. Es por ello por lo que se están realizando esfuerzos para caracterizar el DCL-EP y desarrollar estrategias terapéuticas. En 2012 se publicaron los criterios específicos de DCL-EP123 (NE-IV), que han permitido avanzar mucho en este sentido (Tabla VI). Sin embargo, cabe señalar que los criterios diagnósticos de DCL-EP están todavía pendientes de una validación completa. Los datos actuales indican que los trastornos cognitivos en la EP son heterogéneos y los estudios longitudinales en marcha intentan caracterizar la existencia de perfiles de riesgo acorde a los subdominios afectados. Un estudio longitudinal ha mostrado cómo los déficits de características frontosubcorticales pueden permanecer durante años estables mientras que las alteraciones más corticales posteriores (déficits en memoria, fluencia verbal semántica, funciones visuoespaciales y visuoconstructivas) sí se han relacionado con un mayor riesgo de desarrollar D-EP124 (NE-II).
Algunos estudios muestran la dificultad de definir subgrupos de riesgo acorde a los criterios de subdominios afectados, ya que la mayoría de los pacientes con DCL-EP presentan una afectación de múltiples dominios124 (NE-II).
La prevalencia de DCL-EP en estudios transversales se sitúa alrededor de un 30% de los pacientes. Un estudio longitudinal reciente mostró que la mayoría de los pacientes diagnosticados de DCL-EP progresaron hacia D-EP en 6 años124 (NE-II).
Con relación al tratamiento farmacológico, a pesar de que en los últimos años se han llevado a cabo diversos estudios con agentes colinérgicos, dopaminérgicos y noradrenérgicos, no hay una evidencia clara de beneficio de ninguno de los tratamientos ensayados125. Los IMAO, como la rasagilina o la safinamida, los agonistas dopaminérgicos o la LD, pueden mejorar las funciones ejecutivas y la atención125 (NE-I). Un estudio controlado doble ciego reciente, con rivastigmina en parches de 9,5 mg/día, administrados durante 24 semanas, no ha mostrado cambios significativos126 (NE-I). Puesto que las alteraciones en el estado de ánimo afectan el rendimiento cognitivo, deberá valorarse individualmente el posible uso de antidepresivos y ansiolíticos.
Con relación a las terapias no farmacológicas, actualmente todavía existen pocos estudios de calidad que evalúen la eficacia de dichas intervenciones en los trastornos cognitivos asociados a la EP. Sin embargo, varias terapias se han mostrado prometedoras y existe evidencia creciente de su efecto positivo en la cognición de personas afectadas por la EP. Los datos actuales indican que el ejercicio físico (ver capítulo 12 sobre ejercicio físico en la enfermedad de Parkinson, pag. 307), especialmente el aeróbico, es un gran inductor de neuroplasticidad y tiene efectos beneficiosos en el funcionamiento cerebral y sobre la cognición127-132 (NE-I). Existen todavía pocos ensayos aleatorizados que demuestren una mejora de la cognición en personas con EP132 (NE-I). Un metaanálisis reciente ha mostrado que las intervenciones con ejercicio físico aeróbico tienen un efecto positivo en la función cognitiva de pacientes con demencia, independientemente del diagnóstico clínico y la frecuencia de la intervención127 (NE-I).

Respecto a las intervenciones mediante entrenamiento cognitivo basadas en la repetición de unas tareas estandarizadas133 (NE-I), un metaanálisis ha concluido que, aunque todavía hay pocos ensayos controlados y aleatorizados, el entrenamiento cognitivo es seguro y moderadamente efectivo para mejorar la cognición de pacientes con EP leve y moderada134 (NE-I).
Un estudio exploratorio reciente de baja calidad evaluó la capacidad cognitiva con rehabilitación para mejorar el deterioro cognitivo en pacientes con EP que recibieron entrenamiento cognitivo por ordenador. Se observaron algunos efectos significativos. Debido al carácter exploratorio del estudio y al pequeño tamaño de la muestra, no se pueden hacer recomendaciones a este respecto135 (NE-IV).
También recientemente se ha publicado un estudio con estimulación transcraneal de corriente directa (t-DCS) en la corteza prefrontal dorsolateral izquierda versus t-DCS simulada con el objetivo de evaluar el posible beneficio en el deterioro cognitivo leve en la EP en pacientes que reciben entrenamiento cognitivo por ordenador136,137 (NE-I). Aunque tuvo efectos positivos, al ser un estudio de baja calidad no se pueden obtener conclusiones para recomendaciones.

Bibliografía
35. Chacón Peña JR, García Moreno JM. Manifestaciones psiquiátricas y cognitivas. En: Escamilla Sevilla F, González Torres V, Moya Molina Miguel Ángel J (eds.). Recomendaciones de práctica clínica en la enfermedad de Parkinson. Grupo Andaluz de Trastornos de Movimiento (GATM). Sociedad Andaluza de Neurología (SAN). Barcelona: Editorial Glosa, S.L.; 2022. p. 139-153.
85. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf- 1837629189061
116. Emre M, Aarsland D, Brown R, et al. Clinical diagnostic criteria for dementia associated with Parkinson’s disease. Mov Disord. 2007;22(12):1689-707.
117. Dubois B, Burn D, Goetz C, et al. Diagnostic procedures for Parkinson’s disease dementia: recommendations from the movement disorder society task force. Mov Disord. 2007;22(16):2314-24.
118. Pagano G, Rengo G, Pasqualetti G, et al. Cholinesterase inhibitors for Parkinson’s disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry.2015;86(7):767-73.
119. Wang HF, Yu JT, Tang SW, et al. Efficacy and safety of cholinesterase inhibitors and memantine in cognitive impairment in Parkinson’s disease, Parkinson’s disease dementia, and dementia with Lewy bodies: systematic review with meta-analysis and trial sequential analysis. J Neurol Neurosurg Psychiatry. 2015;86(2):135-43.
120. Stubendorff K, Larsson V, Ballard C, et al. Treatment effect of memantine on survival in dementia with Lewy bodies and Parkinson’s disease with dementia: a prospective study. BMJ Open. 2014;4(7):e005158.
121. Wesnes KA, Aarsland D, Ballard C, et al. Memantine improves attention and episodic memory in Parkinson’s disease dementia and dementia with Lewy bodies. Int J Geriatr Psychiatry. 2015;30(1):46-54.
122. Ikeda M, Mori E, Kosaka K, et al.; Donepezil-DLB Study Investigators. Long-term safety and efficacy of donepezil in patients with dementia with Lewy bodies: results from a 52-week, open-label, multicenter extension study. Dement Geriatr Cogn Disord. 2013;36(3-4):229-41.
123. Litvan I, Goldman JG, Tröster AI, et al. Diagnostic criteria for mild cognitive impairment in Parkinson’s disease: Movement Disorder Society Task Force guidelines. Mov Disord. 2012;27(3):349-56.
124. Williams-Gray CH, Evans JR, Goris A, et al. The distinct cognitive syndromes of Parkinson’s disease: 5 year follow-up of the CamPaIGN cohort. Brain. 2009;132(Pt 11):2958-69.
125. Pigott K, Rick J, Xie SX, et al. Longitudinal study of normal cognition in Parkinson disease. Neurology. 2015;85(15):1276-82.
126. Frakey L, Friedman J. The effects of rasagiline on cognition in mild to moderate stage Parkinson’s disease, a double-blind placebo controlled study. Arch Clin Neuropsychol. 2014;6:514.
127. Mamikonyan E, Xie SX, Melvin E, et al. Rivastigmine for mild cognitive impairment in Parkinson disease: a placebo-controlled study. Mov Disord. 2015;30:912-8.
128. Groot C, Hooghiemstra AM, Raijmakers PG, et al. The effect of physical activity on cognitive function in patients with dementia: A meta-analysis of randomized control trials. Ageing Res Rev. 2016;25:13-23.
129. Szuhany KL, Bugatti M, Otto MW. A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor. J Psychiatr Res. 2015;60:56-64.
130. Wang C, Yu JT, Wang HF, et al. Non-pharmacological interventions for patients with mild cognitive impairment: a meta-analysis of randomized controlled trials of cognition-based and exercise interventions. J Alzheimers Dis. 2014;42(2):663-78.
131. Erickson KI, Leckie RL, Weinstein AM. Physical activity, fitness, and gray matter volume. Neurobiol Aging. 2014;35 Suppl 2:S20-8.
132. Kelly ME, Loughrey D, Lawlor BA, et al. The impact of exercise on the cognitive functioning of healthy older adults: a systematic review and meta-analysis. Ageing Res Rev. 2014;16:12-31.
133. Kalron A, Zeilig G. Efficacy of exercise intervention programs on cognition in people suffering from multiple sclerosis, stroke and Parkinson’s disease: A systematic review and meta-analysis of current evidence. NeuroRehabilitation. 2015;37(2):273-89.
134. Peña J, Ibarretxe-Bilbao N, García-Gorostiaga I, et al. Improving functional disability and cognition in Parkinson disease: randomized controlled trial. Neurology. 2014;83(23):2167-74.
135. Leung IH, Walton CC, Hallock H, et al. Cognitive training in Parkinson disease: A systematic review and meta-analysis. Neurology. 2015;85(21):1843-51.
136. Cerasa A, Gioia MC, Salsone M, et al. Neurofunctional correlates of attention rehabilitation in Parkinson’s disease: an explorative study. Neurological Sci 2014;35:1173-1180
137. Biundo R, Weis L, Fiorenzato E, et al. Double-blind randomized trial of tDCS versus sham in Parkinson patients with mild cognitive impairment receiving cognitive training. Brain Stim 2015;8:1223-1225.



