En la EP, los cambios observados en la RM cerebral están principalmente relacionados con la degeneración de las neuronas dopaminérgicas, localizadas a nivel de la sustancia negra (SN) del mesencéfalo y del incremento de depósito de hierro en estas regiones. La correcta visualización de estos cambios dependerá de la potencia de campo utilizado en la RM y las diferentes secuencias que, aunque cada vez su uso esté más extendido, no se disponen de protocolos estandarizados en la práctica clínica.
Resonancia magnética estructural
El papel de la RM estructural de 1,5 teslas (T) en pacientes con EP idiopática es controvertido, debido a la falta de signos específicos de la enfermedad y, de acuerdo con las guías del National Institute for Health and Care Excellence (NICE), no se debe utilizar para realizar el diagnóstico de la EP2 (NE-I). Sin embargo, en la práctica clínica, la imagen cerebral y en particular la RM suele realizarse al menos una vez durante el curso de la enfermedad, con el objetivo de detectar la presencia de lesiones estructurales que causen o contribuyan al parkinsonismo, poder identificar la magnitud y extensión de la enfermedad y ayudar a diferenciar la EP de otros parkinsonismos atípicos.
Los signos radiológicos que facilitan el diagnóstico de la EP y de los parkinsonismos atípicos son (Figuras 1-4):
-
En la EP, existen depósitos de hierro en la SN, visibles en secuencias T2 en la RM cerebral. Diferentes autores han publicado que este depósito de hierro puede incluso ayudarnos a diferenciar la PSP de la EP, ya que en la PSP existen depósitos de hierro mayores a nivel del tálamo, globo pálido y núcleo rojo. En cambio, en la AMS, a diferencia de la PSP y la EP, el depósito de hierro mayor está en el putamen3(NE-II).
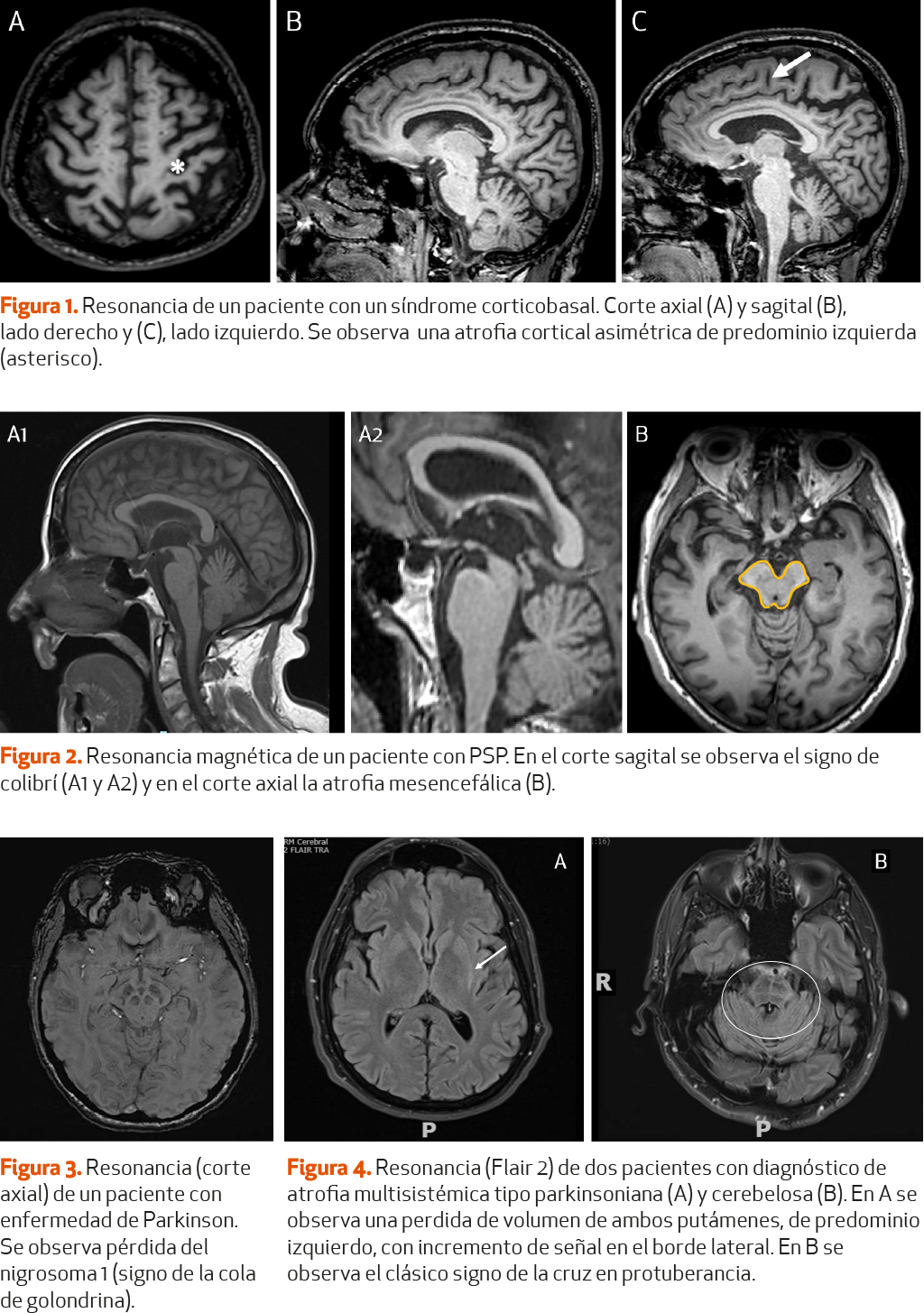
-
En la PSP existe una atrofia a nivel del mesencéfalo (tegmento y tubérculos cuadrigéminos superiores), junto con la conservación relativa de la morfología de la protuberancia, que permite observar en plano sagital el signo del colibrí (hummingbird sign) y en el plano axial, el signo de Mickey Mouse4. Determinados estudios han demostrado que estos hallazgos tienen una alta especificidad, del 99,5 y el 97,7% respectivamente para cada signo, pero una baja sensibilidad, del 51,6 y 38,6%5(NE-II) para el diagnóstico de PSP.
-
En la AMS-P, podemos encontrar una atrofia bilateral putaminal, con el signo del ribete o hiperintensidad en T2 del borde dorsolateral del putamen (putaminal rim sign) e hipointenso en T1. En la AMS-C destaca la atrofia del pedúnculo cerebeloso medio, cerebelo y puente del troncoencéfalo. En las formas cerebelosas de la AMS puede observarse el signo de la cruz (hot cross bun sign)4(NE-II) producido por una degeneración de las fibras pontocerebelosas que puede causar una hiperintensidad en el pedúnculo cerebral medio y protuberancia6,7(NE-II).
Estas anomalías en la neuroimagen son altamente específicas, pero su sensibilidad es relativamente baja, limitando su uso como biomarcador diferencial de parkinsonismos.
Como ya se ha explicado previamente, en la EP existen cambios degenerativos a nivel de la SN. Esta puede dividirse en la pars reticularis (SNpr) y la pars compacta (SNpc); esta última es la que alberga la mayoría de las neuronas dopaminérgicas. Aunque la composición estructural de estos elementos es sumamente compleja, se han identificado subregiones adicionales dentro de la SNpc conocidas como nigrosomas. Estas áreas se caracterizan por una densidad especialmente alta de neuronas dopaminérgicas y una concentración de hierro proporcionalmente baja. De los cinco nigrosomas totales, el nigrosoma-1 es el más grande y se ubica en la sección dorsal de la SNpc. Con las nuevas técnicas de alto campo de RM de 3 T o superiores y con las secuencias de alta resolución sensibles al hierro, como las secuencias ponderadas en T2* o las secuencias ponderadas en susceptibilidad (SWI), es posible visualizar estas estructuras en la RM. El nigrosoma-1 se visualiza como una estructura hiperintensa y ovalada en el segmento dorsolateral de la SNpc en estas secuencias, un signo radiológico conocido como cola de golondrina. En la EP existe una disminución en la concentración de neuronas dopaminérgicas y un aumento en los depósitos del hierro, siendo el nigrosoma-1 el más afecto, produciéndose una pérdida de la hiperintensidad (ausencia de cola de golondrina). Este signo radiológico ha demostrado en diversos estudios de metaanálisis una alta sensibilidad y especificidad en el diagnóstico de EP en estadios iniciales8 (NE-I). Sin embargo, no es signo patognomónico de la EP y la falta de protocolos estandarizados limita su uso en la práctica clínica.
Resonancia magnética morfométrica
La RM por volumetría permite cuantificar la atrofia cerebral. Se realiza de una forma semicuantitativa, definiendo a priori regiones de interés (ROI). Para poder diferenciar los diferentes síndromes parkinsonianos se han creado diferentes ROI, y ello ha permitido calcular las ratios de protuberancia, mesencéfalo y pedúnculos cerebelosos medio/superior, originando los índices de parkinsonismo en la RM9 (NE-II), muy útiles para el diagnóstico de PSP. Otros autores han destacado una pérdida de volumen pontocerebelar en la AMS10 (NE-II). En cambio, los volúmenes regionales suelen estar respetados en la EP.
La atrofia cerebral puede ser también evaluada a nivel global. La morfometría basada en vóxeles (VBM) es una técnica totalmente automatizada, independiente del evaluador, que no precisa una delimitación a priori de ROI. Usando esta técnica (VBM), en la EP diferentes autores han descrito una atrofia cortical sobre todo en áreas asociativas temporales, límbica, paralímbica, frontal y parietal11 (NE-II). Recientes estudios de VBM han descrito los siguientes hallazgos: en la EP se identifica una clara atrofia a nivel de los ganglios basales12 (NE-II) (debido a la degeneración nigroestriatal y la disfunción del circuito tálamo-cortical de los ganglios basales), lóbulo frontal y, de manera no específica, en el hipocampo derecho, circunvoluciones cinguladas anteriores izquierdas y giros temporales superiores. En pacientes con EP con disfunción respiratoria, se ha descrito un adelgazamiento cortical en la formación parahipocampal izquierda, giro fusiforme derecho, corteza cerebelosa derecha, y giros poscentrales izquierdos en comparación con los pacientes con EP con funciones pulmonares normales13 (NE-II). Por otro lado, en sujetos con EP avanzada, se descrito que la atrofia de la sustancia gris a nivel de las estructuras subcorticales es más pronunciada con respecto a los sujetos en etapas tempranas de la EP14 (NE-III), sirviendo de marcador de progresión de la enfermedad.
En la AMS se ha descrito una pérdida de volumen putaminal en comparación con la EP, siendo capaz de diferenciar la AMS/AMS-P de la EP con alta especificidad (92%), pero con una sensibilidad bastante baja (44%)15 (NE-II). Con respecto al diagnóstico diferencial entre los subtipos de AMS, recientes estudios han observado que tanto los pacientes con AMS-P como los de AMS-C pueden mostrar atrofia putaminal e infratentorial con considerable superposición. Sin embargo, la atrofia putaminal/ supratentorial ha demostrado ser más predominante en el subtipo AMS-P, mientras que la atrofia infratentorial lo es en el subtipo AMS-C16 (NE-III).
En cambio, en la PSP han encontrado una reducción de la sustancia blanca en protuberancia, mesencéfalo y adyacente a los ganglios basales, y reducción de la sustancia gris en tálamo, mesencéfalo, ganglios basales, corteza frontal e insular. En la PSP, la atrofia predominante a nivel del mesencéfalo se ha incorporado como una característica de imagen de apoyo en los criterios diagnósticos de la MDS17. Los autores han encontrado que las relaciones entre el área de la protuberancia y del mesencéfalo (P/M) y entre el grosor del pedúnculo cerebeloso medio y el pedúnculo cerebeloso superior (MCP/SCP) son mayores en la PSP que en la EP, AMS-P y controles. Utilizando estas relaciones, se calculó un índice como [(P/M) × (MCP/SCP)], denominado índice de parkinsonismo de RM, que demostró ser altamente sensible y específico para distinguir la PSP de la EP, AMS-P y los controles18 (NE-II). Se ha propuesto una versión revisada que incorpora el ancho del tercer ventrículo [índice de parkinsonismo de RM × (ancho del tercer ventrículo) / (ancho de los cuernos frontales)], que mostró una mayor sensibilidad (100%) y especificidad (94,3%) en la diferenciación de pacientes con parkinsonismo por PSP con lentitud de sacadas verticales de los de EP19 (NE-II).
Resonancia por difusión (diffusion weighted imaging [DWI])
La RM por difusión supone una técnica novedosa que permite valorar la integridad del cerebro a nivel microestructural, al medir el movimiento de las moléculas de agua, lo que posibilita medir la indemnidad de las fibras de la sustancia blanca. En general, en las enfermedades neurodegenerativas se produce un daño axonal y pérdida de neuronas asociado a un incremento en el movimiento de moléculas y por tanto el coeficiente de difusión. La imagen del tensor de difusión proporciona además información sobre la difusión media en un vóxel y la dirección de difusión (anisotropía fraccional). En general, la RM por difusión, a diferencia de la RM estructural, puede objetivar cambios más precoces estructurales que no son observados en la RM estructural normal.
Diferentes estudios han objetivado que la topografía del coeficiente de difusión, la difusión media y los cambios de anisotropía fraccional en los parkinsonismos atípicos muestran una alta correlación con los hallazgos histopatológicos. En este sentido, se ha observado un aumento regional de coeficiente de difusión en el pedúnculo cerebral medio que diferencia la AMS de la EP con una sensibilidad y especificidad del 84-100%20 (NE-III). Los pacientes con AMS-P presentan un aumento medio de la difusión en el putamen comparado con los pacientes con EP y PSP21 (NE-III). En cambio, los pacientes con PSP presentan una elevación del coeficiente de difusión regional en el mesencéfalo y globo pálido a diferencia de los pacientes con EP y AMS, y un aumento del coeficiente de difusión en el pedúnculo cerebeloso superior y núcleo caudado comparado con los pacientes con AMS22,23 (NE-III).
Resonancia magnética de susceptibilidad magnética (SWI)
La secuencia de susceptibilidad magnética (SWI, susceptibility weighted imaging) se basa en una secuencia T2-3D con alta resolución espacial, que utiliza el artefacto de susceptibilidad de la sangre en los vasos como si fuera contraste intrínseco. Esto va a
permitir diferenciar y detectar sustancias ferromagnéticas, diamagnéticas, como las calcificaciones y los depósitos de minerales, y las sustancias paramagnéticas, que son los productos de degradación de la sangre, hemosiderina y desoxihemoglobina24 (NE-I).
Esta secuencia tiene especial interés en el estudio de pacientes con EP por el estudio de los depósitos anómalos de hierro a nivel cerebral, principalmente en la SN. En personas sanas, el mayor porcentaje de depósito de hierro se encuentra a nivel del putamen, el globo pálido y el núcleo caudado y, en menor proporción, a nivel de la SN y el locus coeruleus. Sin embargo, la presencia de depósitos anómalos del hierro generalmente se encuentra en enfermedades neurodegenerativas, como la enfermedad de Alzheimer y la EP. Existen diferentes estudios publicados que comparan la concentración de depósitos de hierro a nivel de la SN entre sujetos sanos y pacientes con EP, las diferencias son estadísticamente significativas desde estadios iniciales de la enfermedad, haciendo posible el diagnóstico25 (NE-III). Existe una nueva técnica de RM conocida con mapeo cuantitativo de susceptibilidad (siglas en inglés QSM), con una resolución mayor, pero su uso no está extendido en la práctica clínica habitual26 (NE-III).
Recientes estudios27 (NE-III) abogan por el uso de forma conjunta de la secuencia SWI, QSM y secuencias específicas de neuromelanina en RM de 3T, con el objetivo de estudiar de forma cualitativa y cuantitativa los depósitos anómalos de hierro, principalmente a nivel de la SN. Este estudio multiparamétrico permitiría el diagnóstico de EP en estadios precoces, pero también evaluar el grado de progresión de la enfermedad.
Resonancia magnética con espectroscopia
La espectroscopia protónica por RM permite la valoración de ciertas moléculas implicadas en la bioenergía cerebral y en integridad neuronal. Particularmente, la ratio de N-acetil aspartato (NAA), como un marcador de integridad neuronal, y la creatina (Cr), como un marcador de metabolismo energético, son los pilares donde se han centrado diferentes estudios realizados en síndromes parkinsonianos. Concretamente en pacientes con EP y deterioro cognitivo, se ha descrito una disminución regional de NAA/Cr28,29 (NE-III). No obstante, el principal factor limitante es que los hallazgos pueden ser equívocos en estadios iniciales de la EP.
Transferencia magnética por imagen
Esta técnica de RM evalúa la energía transferida entre protones que se unen fuertemente a estructuras como la mielina con protones con alta movilidad en el agua. Por tanto, la magnitud de ratio de transferencia de la magnetización es altamente dependiente de la mielinización axonal. Esta técnica puede observar alteraciones que se producen en la desmielinización en enfermedades neurodegenerativas. En este sentido, se ha observado reducción de la ratio de transferencia de la magnetización en el núcleo caudado, putamen, tálamo y en la sustancia blanca periventricular, frontal y parietal en los síndromes parkinsonianos, pero todavía no se tiene la suficiente experiencia como para poder diferenciar los diferentes síndromes parkinsonianos.
Nuevas técnicas en desarrollo: RM de 7 teslas
La RM de 7 teslas (RM 7T) permite visualizar la anatomía de la SN. Usando esta técnica se ha observado una hiperintensidad en secuencias T2 de la SN en sujetos normales, y su ausencia en pacientes con EP debido a una pérdida de neuronas con melanina (nigrosomas) en la parte reticulada de la SN, y mayor depósito de hierro. La precisión diagnóstica de la RM 7 T para visualizar los nigrosomas tiene una sensibilidad del 100%, una especificidad del 87-100%, un valor predictivo positivo del 91-100% y un valor predictivo negativo del 100%, con un acuerdo intra e interevaluador alto. No obstante, las principales limitaciones que tiene todavía son la transmisión de campos no homogéneos, altos artefactos por movilidad y la alta intensidad de la señal depositada30 (NE-IV).
Resonancia magnética y neuromelanina
La neuromelanina (NM) es un pigmento que se produce durante la oxidación de la dopamina, y se encuentra principalmente a nivel de la SN y el locus coeruleus. Desde la introducción de secuencias de RM sensibles a la NM31, esta técnica ha adquirido una gran importancia en estudios de investigación con el objetivo de realizar un diagnóstico precoz de la EP y la diferenciación entre la EP, el temblor esencial (ET) y los parkinsonismos atípicos. Numerosos estudios han demostrado la existencia de niveles disminuidos de NM a nivel de la SN en fases precoces de la EP32 (NE-III). Actualmente esta técnica se utiliza en el campo de la investigación.


Bibliografía
1. Beach TG, Adler CH. Importance of low diagnostic accuracy for early Parkinson’s disease. Mov Disord. 2018;33(10):1551-1554.
2. Parkinson’s disease in adults: diagnosis and management. NICE guideline [NG71]. En: National Institute for Health and Care Excellence (NICE) [Internet]. Disponible en: https://www.nice.org.uk/guidance/ng71/resources/parkinsons-disease-in-adults-pdf 1837629189061
3. Han YH, Lee JH, Kang BM, et al. Topographical differences of brain iron deposition between progressive supranuclear palsy and parkinsonian variant multiple system atrophy. J Neurol Sci. 2013;325(1-2):29-35.
4. Saeed U, Compagnone J, Aviv RI, et al. Imaging biomarkers in Parkinson’s disease and Parkinsonian syndromes. Current and emerging concepts. Transl Neurodegener. 2017;6:8.
5. Mueller C, Hussl A, Krismer F, et al. The diagnostic accuracy of the hummingbird and morning glory sign in patients with neurodegenerative parkinsonism. Parkinsonism Relat Disord. 2018;54:90-94
6. Wenning GK, Colosimo C, Geser F, et al. Multiple system atrophy. Lancet Neurol. 2004;3(2):93-103. 7. Schwarz J, Weis S, Kraft E, et al. Signal changes on MRI and increases in reactive microgliosis, astrogliosis, and iron in the putamen of two patients with multiple system atrophy. J Neurol Neurosurg Psychiatry. 1996;60(1):98-101.
7. Schwarz J, Weis S, Kraft E, et al. Signal changes on MRI and increases in reactive microgliosis, astrogliosis, and iron in the putamen of two patients with multiple system atrophy. J Neurol Neurosurg Psychiatry. 1996;60(1):98-101.
8. Mahlknecht P, Krismer F, Poewe W, et al. Meta-analysis of dorsolateral nigral hyperintensity on magnetic resonance imaging as a marker for Parkinson’s disease. Mov Disord. 2017;32(4):619-623.
9. Quattrone A, Nicoletti G, Messina D, et al. MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology. 2008;246(1):214-21.
10. Paviour DC, Price SL, Jahanshahi M, et al. Regional brain volumes distinguish PSP, MSA-P, and PD: MRI-based clinico-radiological correlations. Mov Disord. 2006;21(7):989-96.
11. Pereira JB, Ibarretxe-Bilbao N, Marti MJ, et al. Assessment of cortical degeneration in patients with Parkinson’s disease by voxel-based morphometry, cortical folding, and cortical thickness. Hum Brain Mapp. 2012;33(11):2521-34.
12. Xu X, Han Q, Lin J, et al. Grey matter abnormalities in Parkinson’s disease: a voxel-wise meta-analysis. Eur J Neurol. 2019; 27:653-9.
13. Lee SY, Chen MH, Chiang PL, et al. Reduced gray matter volume and respiratory dysfunction in Parkinson’s disease: a voxel-based morphometry study. BMC Neurol. 2018;18:73.
14. Blair JC, Barrett MJ, Patrie J, et al. Brain MRI reveals ascending atrophy in Parkinson’s disease across severity. Front Neurol. 2019;10:1329.
15. Massey LA, Micallef C, Paviour DC, et al. Conventional magnetic resonance imaging in confirmed progressive supranuclear palsy and multiple system atrophy. Mov Disord. 2012;27:1754-62.
16. Krismer F, Seppi K, Göbel G, et al. Morphometric MRI profiles of multiple system atrophy variants and implications for differential diagnosis. Mov Disord 2019;34:1041-8.
17. Höglinger GU, Respondek G, Stamelou M, et al. Clinical diagnosis of progressive supranuclear palsy: the movement disorder society criteria. Mov Disord. 2017;32:853-64.
18. Quattrone A, Nicoletti G, Messina D, et al. MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology. 2008;246:214-21.
19. Lee W. Conventional Magnetic Resonance Imaging in the Diagnosis of Parkinsonian Disorders: A Meta-Analysis. Mov Disord Clin Pract. 2020;8(2):217-223.
20. Nicoletti G, Lodi R, Condino F, et al. Apparent diffusion coefficient measurements of the middle cerebellar peduncle differentiate the Parkinson variant of MSA from Parkinson’s disease and progressive supranuclear palsy. Brain. 2006;129(Pt 10):2679-87.
21. Baudrexel S, Seifried C, Penndorf B, et al. The value of putaminal diffusion imaging versus 18-fluorodeoxyglucose positron emission tomography for the differential diagnosis of the Parkinson variant of multiple system atrophy. Mov Disord. 2014;29(3):380-7.
22. Tsukamoto K, Matsusue E, Kanasaki Y, et al. Significance of apparent diffusion coefficient measurement for the differential diagnosis of multiple system atrophy, progressive supranuclear palsy, and Parkinson’s disease: evaluation by 3.0-T MR imaging. Neuroradiology. 2012;54(9):947-55.
23. Erbetta A, Mandelli ML, Savoiardo M, et al. Diffusion tensor imaging shows different topographic involvement of the thalamus in progressive supranuclear palsy and corticobasal degeneration. AJNR. 2009;30(8):1482-7.
24. Bajaj S, Krismer F, Palma JA, et al. Diffusion-weighted MRI distinguishes Parkinson disease from the parkinsonian variant of multiple system atrophy: A systematic review and meta-analysis. PLoS One. 2017;12(12):e0189897.
25. Martín-Bastida A, Lao-Kaim NP, Loane C, et al. Motor associations of iron accumulation in deep grey matter nuclei in Parkinson’s disease. A crosssectional study of iron-related magnetic resonance imaging susceptibility. Eur J Neurol. 2017;24:357-365.
26. Langkammer C, Pirpamer L, Seiler S, et al. Quantitative Susceptibility Mapping in Parkinson’s Disease. PLoS One. 2016; 11(9):e0162460.
27. Cao Q, Huang J, Tang D, et al. Application value of multiparametric MRI for evaluating iron deposition in the substantia nigra in Parkinson’s disease. Front Neurol. 2023;13:1096966.
28. Wang Y, Butros SR, Shuai X, et al. Different iron-deposition patterns of multiple system atrophy with predominant parkinsonism and idiopathetic Parkinson diseases demonstrated by phase-corrected susceptibility-weighted imaging. AJNR. 2012;33(2): 266-73.
29. Lewis SJ, Shine JM, Duffy S, et al. Anterior cingulate integrity: executive and neuropsychiatric features in Parkinson’s disease. Mov Disord. 2012;27(10):1262-7.
30. Lehericy S, Bardinet E, Poupon C, et al. 7 Tesla magnetic resonance imaging: a closer look at substantia nigra anatomy in Parkinson’s disease. Mov Disord. 2014;29(13):1574-81.
31. Sasaki M, Shibata E, Tohyama K, et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson’s disease. Neuroreport. 2006;17:1215-1218.
32. Jin L, Wang J, Wang C, et al. Combined visualization of nigrosome-1 and neuromelanin in the substantia nigra using 3T MRI for the differential diagnosis of essential tremor and de novo Parkinson’s disease. Front Neurol. 2019;10:100



