Introducción y aspectos técnicos
La neurosonografía es una técnica no invasiva, de bajo coste y de ejecución rápida y cómoda para el sujeto de estudio, lo que ha facilitado que el volumen de sujetos estudiados sea elevado, favoreciendo la calidad y cantidad de la evidencia científica acumulada33 (NE-III).
La sonografía transcraneal (STC) del parénquima o mesencefálica debe ser realizada por exploradores experimentados de acuerdo con una sistemática estandarizada (Tabla I). Se trata de una ecografía en modo dúplex, que se realiza con el paciente en decúbito supino, con el cabecero elevado unos 30 grados. La sonda se coloca sobre la escama temporal, en la línea orbitomeatal en ambos lados, con una inclinación variable en los planos de observación mesencefálico (SN, rafe y núcleo rojo) y diencefálico (ventrículos laterales, tercer ventrículo, ganglios basales) (Figura 5).

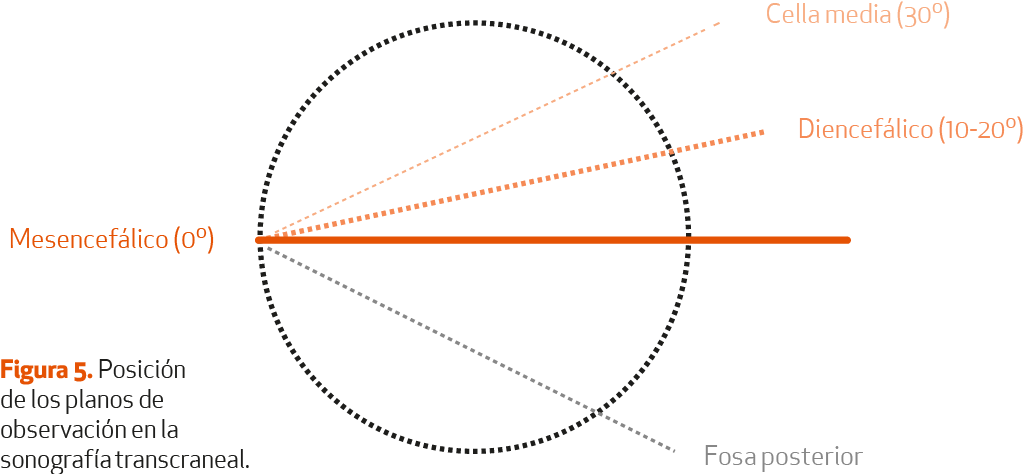
La ausencia de una ventana temporal suficiente puede limitar su aplicación en un 5-15% de los sujetos, en especial mujeres de edad avanzada y sujetos asiáticos (15-60%). Se requiere un entrenamiento específico, asistido por expertos, y experiencia documentada suficiente34 (NE-IV). Bajo estas condiciones, la reproducibilidad y la concordancia intra e interobservador son elevadas.
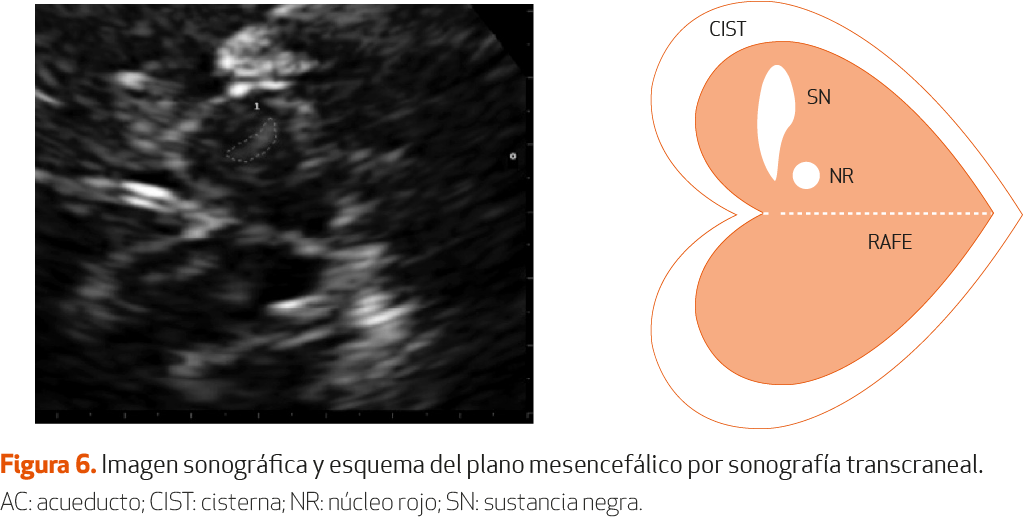
En el plano axial mesencefálico (Figura 6) se visualiza el mesencéfalo en forma de mariposa delimitada por la hiperecogenicidad de las cisternas basales. En la región anterior ipsilateral se observan unas señales hiperecogénicas confluentes: corresponden a la SN mesencefálica, el principal biomarcador detectado por STC. El área de ecogenicidad de la SN sigue una distribución normal en la población, considerándose la SN hiperecogénica (hiperecogenicidad marcada, SN+) cuando su área supera el percentil 90 (P90) de una muestra de sujetos control. No se han observado variaciones significativas en la ecogenicidad de la SN según la raza, aunque sí entre ecógrafos de distintos fabricantes. Para los equipos de última generación el punto de corte de hiperecogenicidad marcada está en torno a 0,25-0,30 cm2, mientras que está en torno a 0,20 cm2 para los más antiguos34 (NE-IV).
Ecografía transcraneal en el diagnóstico de la enfermedad de Parkinson
La hiperecogenicidad de la SN en pacientes con EP fue descrita por primera vez en el año 199533. A día de hoy, el mecanismo exacto por el que se produce este fenómeno no es del todo conocido, pero sí se sabe que intervienen diferentes procesos, como son la alteración en el depósito de hierro a nivel del mesencéfalo (principalmente debido a la alteración en el metabolismo del hierro)35 y los procesos de neuroinflamación que incluyen la activación de la microglía y la presencia de gliosis36 (NE-II). Por otra parte, hay que saber que estos cambios también han sido descritos en pacientes con parkinsonismos atípicos, como PSP y AMS, pero la incidencia en la EP es mayor. En recientes metaanálisis se estima una prevalencia de hiperecogeneidad en EP idiopática en torno al 84%37, con una sensibilidad en torno al 80-95% y una especificidad que varía entre el 60 y el 96%37 (NE-I). La hiperecogenicidad de la SN en pacientes con EPI suele ser unilateral o bilateral asimétrica, sin correlacionarse con la gravedad o duración de la enfermedad39 (NE-IV). Además, se ha observado una mayor hiperecogeneidad en EP de subtipo no tremórico y su ausencia en sujetos con EP podría predecir una peor respuesta al tratamiento dopaminérgico40 (NE-IV).
¿Cómo interpretar la hiperecogenicidad de la SN en sujetos control? La mayoría de estos individuos (en torno al 80%) no desarrollará nunca una EPI, pero su riesgo relativo es de 17,37 veces el de la población con SN normal, y de hasta 48,39 si se combina con anosmia o signos motores sutiles41 (NE-IV). Diversos autores han comunicado la conversión clínica a EPI de sujetos controles con hiperecogenicidad de la SN. La frecuencia de hiperecogenicidad de la SN es mayor del 10% en sujetos control con factores de riesgo para EPI, como el sexo masculino, la edad avanzada y los antecedentes familiares de EP, y mayor aún en presencia de hiposmia, trastorno del sueño REM y depresión.
La hiperecogenicidad de la SN se encuentra presente también en pacientes con EP monogénicas (PARK-SCNA, PARK-parkin, PARK-PINK1, PARK-DJ1, PARK-LRRK2)42
(NE-IV), con la excepción de la enfermedad de Kufor-Rakeb (PARK-ATP13A2). La hiperecogenicidad también está presente en la EP asociada a mutaciones en el gen de la glucocerebrosidasa (PARK-GBA o enfermedad de Gaucher) y en portadores asintomáticos de mutaciones en este gen43 (NE-IV). La hiperecogenicidad bilateral simétrica es más frecuente en pacientes con deterioro cognitivo asociado a EP. Varios autores han observado áreas de ecogenicidad mayores en el lado contralateral al hemicuerpo más afecto. La hipoecogenicidad del rafe se ha asociado a depresión y disfunción urinaria, la dilatación de ventrículos laterales con el deterioro cognitivo, y la hiperecogenicidad del caudado con psicosis dopaminérgica44 (NE-IV).
Ecografía transcraneal en el diagnóstico diferencial de la enfermedad de Parkinson
Diversos estudios han demostrado que la STC es útil para el diagnóstico diferencial de la EPI con el temblor esencial, en el que la SN es normal por definición. No obstante, la frecuencia de SN+ puede ser algo superior a la población normal, probablemente a expensas de aquellos pacientes en los que el temblor esencial es prodrómico de una EPI45 (NE-I). Recientes estudios de metaanálisis describen una sensibilidad entre el 69-85% (IC 95) y una especificidad entre el 77-91% (IC 95) en el diagnóstico diferencial entre EPI y temblor esencial con el uso de ecografía de la SN37 (NE-I). También se ha observado que pacientes con temblor esencial e hiperecogeneidad en la SN tienen un riesgo mayor de desarrollar EP en los próximos 5 años, que es mayor si además asocian alteraciones en la fase REM del sueño46 (NE-II).
En el caso de la entidad conocida como escáner sin evidencia de degeneración dopaminérgica (scans without evidence of dopaminergic deficiency [SWEDD]) y el parkinsonismo vascular, la proporción de SN+ es similar a la población control46 (NE-IV).
Respecto al parkinsonismo inducido por fármacos con SN+, lo que probablemente ocurra es que el uso de fármacos ha desenmascarado la EP47 (NE-IV). Estudios prospectivos recientes indican que la ecogenicidad normal de la SN se asocia con una alta probabilidad de reversibilidad de los síntomas en estos pacientes, con elevado valor predictivo negativo para descartar EPI subyacente desenmascarada (96%)48 (NE-I).
En el caso de los parkinsonismos atípicos AMS, PSP, DCB y DCL, la STC tiene especial interés, ya que no solo la frecuencia de SN+ es menor que en la EPI (AMS 20% y PSP 30-39%), sino que hay otras alteraciones sonográficas más específicas que apoyan el diagnóstico de forma positiva (Figura 7). En este sentido, destacan la hiperecogenicidad del núcleo lenticular (LN+), la ampliación del tercer ventrículo (IIIV+) y la simetría en la hiperecogenicidad de la SN49 (NE-III). La combinación de SN normal y LN+ tiene una buena rentabilidad diagnóstica para discriminar parkinsonismo atípico frente a EPI (especificidad y valor predictivo positivo cercano al 100%, sensibilidad del 59%), mientras que la de SN+ y lenticular normal diagnostica EPI frente a parkinsonismo atípico con valores predictivos sobre el 90% (positivo 91%, negativo 96%)50,51 (NE-I).

Recientes estudios de metaanálisis37,38 concluyen que la ecografía de la SN permite el diagnóstico diferencial entre EP y otros parkinsonismos (AMS-P, PSP y DCB principalmente), observándose una sensibilidad del 65-93% (IC 95) y una especificidad del 70% (IC 95) entre EPI y AMS (NE-I); una sensibilidad del 83% (IC 95) y especificidad del 71% (IC 95) entre la EPI y PSP (NE-I). En el caso del diagnóstico diferencial entre PSP y DCB (NE-II), es importante valorar de forma conjunta SN, ecogenicidad lenticular y tamaño del tercer ventrículo. Estudios más recientes de práctica clínica real muestran una utilidad diagnóstica más baja si únicamente se considera la hiperecogenicidad de la SN como variable ultrasonográfica (Tabla II)40 (NE-IV).


Bibliografía
33. Becker G, Seufert J, Bogdahn U, et al. Degeneration of substantia nigra in chronic Parkinson’s disease visualized by transcranial color-coded real-time sonography. Neurology. 1995;45(1):182-4.
34. Walter U. How to measure substantia nigra hyperechogenicity in Parkinson disease:detailed guide with video. J Ultrasound Med. 2013;32(10):1837-43.
35. Behnke S, Berg D, Naumann M, et al. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry.2005;76(3):423-5.
36. Berg D, Godau J, Riederer P, et al. Microglia activation is related to substantia nigraechogenicity. J Neural Transm (Vienna). 2010;117(11):1287-92.
37. Shafieesabet A, Fereshtehnejad SM, Shafieesabet A, et al. Hyperechogenicity of substantia nigra for differential diagnosis of Parkinson’s disease: A meta-analysis. Parkinsonism Relat Disord. 2017;42:1-11.
38. Mei YL, Yang J, Wu ZR, et al. Transcranial Sonography of the Substantia Nigra for the Differential Diagnosis of Parkinson’s Disease and Other Movement Disorders: A Meta-Analysis. Parkinsons Dis. 2021;2021:8891874.
39. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain. 2007;130(Pt 7):1799-807.
40. Fernández Moreno C, Arjona Padillo A. Neuroimagen estructural: tomografía axial computarizada, resonancia magnética y ecografía craneal. En: Escamilla Sevilla F, González
41. Berg D, Seppi K, Liepelt I, et al. Enlarged hyperechogenic substantia nigra is related to motor performance and olfaction in the elderly. Mov Disord. 2010;25(10):1464-9.
42. Brockmann K, Groger A, Di Santo A, et al. Clinical and brain imaging characteristics in leucine-rich repeat kinase 2-associated PD and asymptomatic mutation carriers. Mov Disord. 2011; 26(13): 2335-42.
43. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS [corrected] recommendations for the diagnosis of Parkinson’s disease. Eur J Neurol. 2013 Jan;20(1): 16-34. Erratum in: Eur J Neurol. 2013 Feb;20(2):406.
44. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson’s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain. 2007;130(Pt 7):1799-807.
45. Lauckaite K, Rastenyte D, Surkiene D, et al. Ultrasonographic (TCS) and clinical findings in overlapping phenotype of essential tremor and Parkinson’s disease (ET-PD). BMC Neurol. 2014;14(54):54.
46. Heim B, Peball M, Hammermeister J, et al. Differentiating Parkinson’s Disease from Essential Tremor Using Transcranial Sonography: A Systematic Review and Meta-Analysis. J Parkinsons Dis. 2022;12(4):1115-1123.
47. Skidmore F, Anderson K, Fram D, Weiner W. Psychogenic camptocormia. Mov Disord. 2007;22(13):1974-5.
48. López-Sendón Moreno JL, Alonso-Cánovas A, Buisán Catevilla J, et al. Substantia nigra echogenicity predicts response to drug withdrawal in suspected drug-induced parkinsonism. Mov Disord Clin Pract. 2016;3:268-74.
49. Behnke S, Berg D, Naumann M, et al. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry. 2005;76(3):423-5.
50. Alonso-Canovas A, Tembl Ferrairó JI, Martínez-Torres I, et al. Transcranial sonography in atypical parkinsonism: How reliable is it in real clinical practice? A multicentre comprehensive study. Parkinsonism Relat Disord. 2019 Nov;68:40-45.
51. Tao A, Chen G, Deng Y, et al. Accuracy of Transcranial Sonography of the Substantia Nigra for Detection of Parkinson’s Disease: A Systematic Review and Meta-analysis. Ultrasound Med Biol. 2019 Mar;45(3):628-641.



