En la práctica clínica habitual, el empleo del estudio genético con fines diagnósticos está limitado por la reducida proporción de casos de EP en los que se puede encontrar una mutación genética causal (menos del 10-30%, según las poblaciones). Desde una perspectiva clínica, la ausencia de terapias modificadoras de la enfermedad y la penetrancia variable de la mayoría de las variantes conocidas limitan la utilidad de las pruebas de diagnóstico genético para la EP.
En la actualidad, estos estudios se realizan clínicamente en entornos concretos, seleccionando caso a caso. Desde una perspectiva de investigación, el estudio genético se realiza para ayudar en la tipificación, y ofrecer la oportunidad de participar en ensayos clínicos basados en su estatus genético. En este sentido, es probable que en los próximos años vean la luz los primeros fármacos diseñados para formas monogénicas (LRRK2) o variantes de riesgo (GBA), con un potencial beneficio tanto para las formas genéticas como esporádicas de EP.
Las pruebas genéticas pueden proporcionar información útil para los pacientes y sus cuidadores sobre la propia enfermedad, ayudando en la incertidumbre del pronóstico y, en algunos casos, para abordar una planificación reproductiva. Cuando se analiza la opinión de los pacientes, los que han tenido una enfermedad de inicio temprano están de acuerdo en realizarse el estudio genético, como una forma de entender mejor su enfermedad y de tomar decisiones para su futuro4 (NE-IV).
Al propio médico conocer el estatus genético del paciente le puede ofrecer una información adicional que posibilita una mejor orientación terapéutica, derivada de la seguridad del diagnóstico, y valorar la utilidad o no de algunas opciones de tratamiento, como se ha planteado en la cirugía mediante estimulación cerebral profunda en pacientes con variantes en el gen GBA, donde los resultados esperables son peores6.
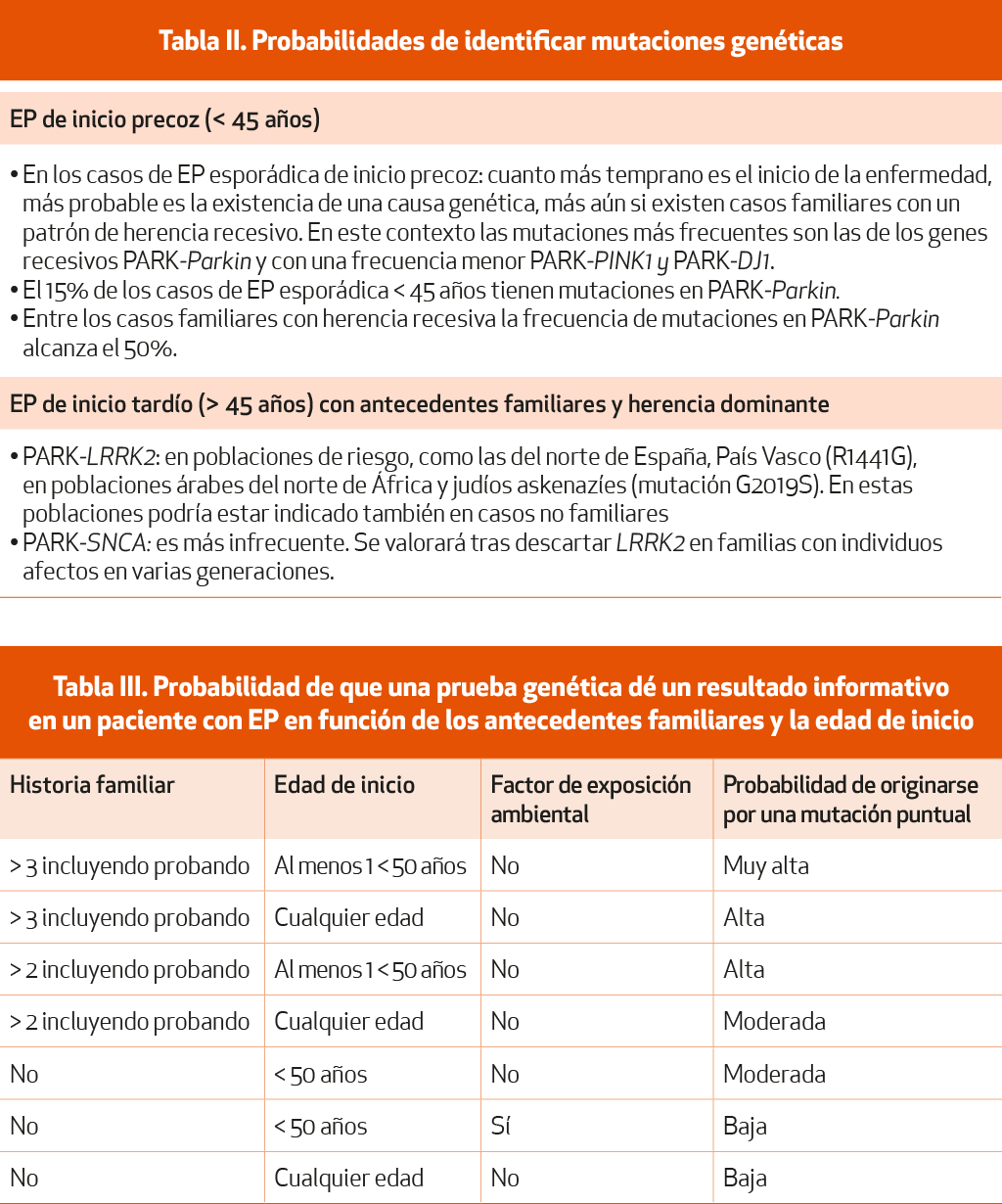
Sin considerar los posibles fármacos específicos actualmente en fase de ensayo, con una perspectiva de coste-eficacia y en el ámbito puramente asistencial, las pruebas genéticas podrían quedar restringidas a aquellas poblaciones en las que es más probable identificar pacientes con EP asociada a una determinada mutación, teniendo en cuenta consideraciones como la edad, el patrón de herencia o los factores raciales (Tablas II y III)7 (NE-III). No obstante, conviene recordar que un estudio negativo no excluye una causa genética, en tanto en cuanto muchas mutaciones genéticas aún se desconocen o solo se han realizado en los genotipos más frecuentes8 (NE-IV).
Tanto en un ámbito asistencial como de investigación, el estudio genético se debe realizar en centros especializados. Se debe informar al paciente y sus familiares con detalle, obtener un consentimiento informado firmado y realizar un asesoramiento genético antes de realizar la prueba y tras el resultado de la misma. La confidencialidad del resultado debe garantizarse, y en todo caso siempre debemos ponderar detenidamente el beneficio que la prueba pueda proporcionar al paciente, más allá de satisfacer la curiosidad del médico que lo trata.
Las probabilidades de identificar mutaciones genéticas causales en pacientes con EP aumentan en dos circunstancias:
-
EP de inicio precoz (menores de 45 años) y cuando existen antecedentes familiares de la enfermedad8 (NE-IV). En los casos esporádicos de inicio precoz, cuanto más temprano es este inicio, más probable es la existencia de una causa genética, más aún si existen casos familiares con un patrón de herencia recesivo. En este contexto las mutaciones más frecuentes son las de los genes recesivos PARK-Parkin y, con una frecuencia menor, PARK-PINK1 y PARK-DJ1. El 15% de los casos de EP menores de 45 años tienen mutaciones en PARK-Parkin. Entre los casos familiares con herencia recesiva la frecuencia de mutaciones en PARK-Parkin alcanza el 50%.
-
EP de inicio tardío (mayores de 45 años). En estos casos estará indicada la realización de una prueba genética solo cuando exista una historia familiar de EP con un patrón de herencia autosómica dominante. En estos casos estaría indicado estudiar las mutaciones causales del gen LRRK2, particularmente la G2019S. En determinadas poblaciones en las que se conoce la existencia de una elevada frecuencia de mutaciones en el gen LRRK2, como sucede en el norte de España, y especialmente en el País Vasco (mutación R1441G), en poblaciones árabes del norte de África y en judíos askenazíes (mutación G2019S). En las formas de inicio tardío con individuos afectos en múltiples generaciones, una vez descartadas mutaciones en LRRK2, procede estudiar el gen SNCA, aunque sus mutaciones son muy poco frecuentes incluso en este contexto. A la hora de efectuar el consejo genético en los portadores de mutaciones en LRRK2 debe tenerse en cuenta la penetrancia incompleta de algunas de las mutaciones, así como la patogenicidad dudosa de algunas variantes9 (NE-IV).
Con respecto al tipo de estudio, el tamaño de los paneles multigénicos de laboratorios comerciales es muy variable, con paneles que incluyen desde 5 hasta más de 50 genes. Existe, por lo tanto, también la necesidad de consensuar qué genes deben incluirse en un panel multigénico de laboratorio comercial para el estudio genético de EP10 (NE-IV), aunque la tendencia actual se dirige cada vez más a realizar estudios de secuenciación masiva.
Bibliografía
4. Pal G, Cook L, Schulze J, et al. Genetic Testing in Parkinson’s Disease. Mov Disord. 2023 Aug;38(8):1384-1396.
6. Pal G, Mangone G, Hill EJ, et al. Parkinson disease and subthalamic nucleus deep brain stimulation: cognitive effects in GBA mutation carriers. Ann Neurol. 2022;91(3):424-435.
7. Berardelli A, Wenning GK, Antonini A, et al. EFNS/MDS-ES/ENS recommendations for the diagnosis of Parkinson’s disease. Eur J Neurol. 2013;20:16-34.
8. Jacobs H, Latza U, Vieregge A, et al. Attitudes of young patients with Parkinson’s disease towards possible presymptomatic and prenatal genetic testing. Genet Couns. 2001;12:55-67.
9. Klein C, Schlossmacher MG. The genetics of Parkinson disease: Implications for neurological care. Nat Clin Pract Neurol. 2006;2:136-46.
10. Cook L, Schulze J, Verbrugge J, et al.; ClinGen Parkinson’s Disease Gene Curation Expert Panel and the MDS Task Force for Recommendations for Genetic Testing in Parkinson’s Disease; Clinical Genome Resource (ClinGen) Parkinson’s Disease Gene Curation Expert Panel Authors; Movement Society Disorder (MDS) Task Force on Recommendations for Clinical Genetic Testing in Parkinson’s Disease Authors. The commercial genetic testing landscape for Parkinson’s disease. Parkinsonism Relat Disord. 2021 Nov;92:107-111.



